Способ лечения инфекционного перитонита в эксперименте
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной хирургии, и может быть использовано для лечения инфекционного перитонита в эксперименте. Для этого крысам внутривенно вводят суспензию аллогенных мезенхимальных стволовых клеток из расчета 1,5×106 на 100 г массы животного в 2 мл физиологического раствора. Летальность животных в основной группе составила 27%, а в контрольной - 94%. Предложенный способ лечения инфекционного перитонита в эксперименте открывает новые возможности использования клеточных технологий для снижения летальности пациентов при перитоните. 11 ил., 1 пр.
Реферат
Изобретение относится к медицине, в частности к экспериментальной хирургии и клеточным технологиям.
Сегодня летальность при перитоните по данным многих авторов находится на уровне от 19 до 70%, что несильно отличается от данных 40 летней давности. Анализ мировой статистики показал, что вклад антибактериальной терапии в снижении летальности больных с перитонитом почти за 100 лет (с 1900 г. - 1980 г.) не превышает 20% [1]. Следует отметить, что атрибутивная значимость интенсивной терапии в улучшении результатов лечения перитонита около 15%; 15-20% - антибактериальная терапия. Остальные 70% - оптимизация хирургической тактики [2]. Но в последнее время все чаще приходится сталкиваться с резистентностью микрофлоры к антибактериальным препаратам, особенно при нозокомиальной инфекции.
Одним из компонентов современного комплексного лечения перитонита, который не входит в стандарты лечения, является иммунокоррекция. Сегодня для иммунотерапии используют препараты, в состав которых входит комплекс иммуноглобулинов основных классов (IgAMG). Но существующие работы на эту тему свидетельствуют, что данные препараты необходимо применять с патогенетической точки зрения, своевременно, на фазе первых проявлений симптомов перитонита и поражения органов, и их позднее применение в качестве «терапии отчаяния» является патогенетически и экономически необоснованным и неэффективным мероприятием [3].
В последнее время в зарубежной периодической литературе появились работы, которые открывают новые возможности клеточных технологий, а именно свойства мультипотентных мезенхимальных стволовых клеток (МСК). В частности, стало известно, что они способны уменьшать системное воспаление, снижать органную дисфункцию, обладают иммуномодулирующими свойствами; обнаружено прямое клеточное воздействие с иммунными клетками; могут прямо или косвенно моделировать способность фагоцитов хозяина снижать бактериальную нагрузку организма. Для того чтобы обосновать применение аллогенных мезенхимальных стволовых клеток при перитоните, следует рассмотреть данные исследований о применении МСК при септических состояниях и сепсисе. Следует также отметить, что в научной литературе результаты экспериментальных исследований о применении клеточных технологий при перитоните представлены недостаточно широко.
Стоит подчеркнуть, что приоритет в открытии МСК принадлежит советскому ученому А.Я. Фриденштейну, чья статья "Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues" [4], датированная 1968 годом, до настоящего времени является одной из наиболее цитируемых. Фриденштейн первым в мире установил, что в костном мозге наряду с гемопоэтическими клетками существует популяция стволовых клеток, способных дифференцироваться в клетки мезенхимального ростка - фибробласты, остеоциты, хондроциты, адипоциты, что спустя несколько лет было подтверждено многими исследованиями, выполненными в зарубежных странах. Особенностью МСК является не только потенциальная возможность их трансформации в гетерогенные клетки разных органов, получившая название пластичности, но и способность самостоятельно или опосредованно индуцировать продукцию ряда активных медиаторов разнообразных процессов - воспаления, фиброза, регенерации - цитокинов, факторов роста и их ингибиторов, ферментов и др. (паракринная активность) [5]. Процессы ускоренного апоптоза, нарушения микроциркуляции, эндотелиальная травма, повреждение миокарда, угнетение иммунного ответа - это те патогенетические механизмы сепсиса, которые теоретически могут быть компенсированы паракринными и пластическими эффектами МСК.
В 2007 г. JXuetal. сообщили, что МСК, будучи введенными мышам вместе с бактериальным липополисахаридом, предотвращают не только острое повреждение легких, но и системный воспалительный ответ, достоверно снижая сывороточные уровни провоспалительных цитокинов IFN-γ, IL-1β, IL-6, MIP-1α и IL-8 [6]. Другое экспериментальное исследование, доказавшее эффективность МСК в модели сепсиса у мышей, вызванной перевязкой и пункцией толстой кишки, было выполнено Shirley Н.J. Mei с коллегами [7]. В этой работе установлено не только снижение уровня маркеров системного воспаления под влиянием МСК, но и уменьшение бактериальной обсемененности селезенки и признаков полиорганной недостаточности. В еще одном исследовании на модели сепсиса у крыс доказано снижение функциональной депрессии миокарда и подавление тканевой экспрессии ИЛ-1β и ИЛ-6 у животных, получивших лечение МСК [8]. В дальнейшем те же авторы установили, что данные эффекты более выражены у МСК, донорами которых были самки [9].
Важным, недавно установленным свойством МСК, объясняющим их эффективность при инфекционных процессах, является самостоятельная продукция антимикробного пептида - кателицидина hCAP-18/LL-37, подавляющего рост грамм-отрицательных микроорганизмов. Поскольку при ингибировании данного протеина противоинфекционная активность МСК снижалась почти в 2 раза, авторы сделали вывод, что прямой антибактериальный эффект МСК при легочной инфекции сопоставим по значимости с традиционно упоминаемыми пластичностью и паракринной активностью [10].
Кроме приведенной литературы в патентном бюро США имеется заявка на изобретение - «Uses of mesenchymal stem cells» (использование мезенхимальных стволовых клеток) №20120027730 от 02.2012, в которой авторы описывают возможность применения МСК при системной воспалительной реакции и сепсисе [11].
Необходимо заметить, что и в нашей стране идут исследования по использованию МСК при сепсисе, их использование при септических состояниях не ставится авторами под сомнение. Это исследование в большей степени направлено на выявление путей уменьшения степени апоптоза трансплантируемых клеток [12].
Данные, которые приведены выше, получены зарубежными авторами в эксперименте при системном воспалении и сепсисе. Мы исследовали противовоспалительный и иммуномодулирующий эффекты МСК на модели инфекционного перитонита. В зарубежной литературе существуют данные, приведенные Hosoon Choi, Ryang Hwa Lee с соавторами, которые свидетельствуют, что МСК активизируются воспалительными сигналами для выделения противовоспалительного белка (TSG-6), стимулируемого TNF-α (ФНО-α), и тем самым создается отрицательно обратная связь, которая уменьшает воспаление в зимозан (суспензия полисахаридов из культуры дрожжей) индуцированном стерильном перитоните [13].
Задачей изобретения является способ лечения инфекционного перитонита в эксперименте.
Поставленная задача решается способом лечения инфекционного перитонита в эксперименте, заключающимся в том, что внутривенно вводят суспензию аллогенных мезенхимальных стволовых клеток из расчета 1,5×106 на 100 г массы животного.
Пример конкретного выполнения.
Исследования проводились в условиях операционного блока экспериментальной лаборатории Первого Московского государственного медицинского университета имени И.М. Сеченова. Все манипуляции выполнялись с соблюдением требований к гуманному обращению с животными (г. Страсбург, Франция, 1986) и руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ (г. Москва, 2000 г.). Фармакологическое обездвиживание и обезболивание животных осуществлялось путем ингаляции эфирным наркозом.
Работа по выделению клеток и их культивированию проводилась в соответствии с общими принципами осуществления культуральных исследований [4].
Мононуклеарную фракцию клеток получали из аспирата костного мозга животных. Для этого под эфирным наркозом из костномозгового канала большеберцовых и бедренных костей получали клетки костного мозга путем аспирации шприцем с иглой 18G, содержащим среду для забора (0,5 мл фосфатно-буферного раствора, содержащий 50 ЕД/мл гепарина и 0,25 мг/л гентамицина). Суспензию клеток КМ центрифугировали при 1500 об/мин (350g) 5 минут, осадок клеток ресуспендировали в растворе для лизиса эритроцитов (114 мМ NH4Cl, 7,5 мМ КНСО3, 100 мкМ EDTA) в течение 3 мин и повторно центрифугировали. Гемолизированный супернатант удаляли отсасыванием, а клеточный осадок ресуспендировали в среде DMEM (Пан Эко, Россия), содержащей 10% телячью эмбриональную сыворотку («Hy Clonegold», USA), инсулин 0,4 мкМ, 0,25 мг/л гентамицина.
Эти клетки представляли собой первичную культуру, преимущественно мононуклеарных клеток КМ, которые затем высевали в количестве 2,0-2,5 млн. кл/мл в культуральных флаконах. Затем культуральные флаконы помещали в CO2-инкубатор с концентрацией CO2 5%, атмосферного воздуха 95% и с повышенной влажностью. Через 2 суток после выделения первичной культуры неприкрепившуюся клеточную взвесь удаляли, а оставшиеся клетки продолжали культивировать. Замену культуральной среды на свежую осуществляли каждые 3-4 суток. После образования субконфлюэнтного монослоя клетки однократно отмывали раствором Версена, затем снимали раствором Версена с 0,25% трипсина, ресуспендировали в ростовой среде и разливали в новую культуральную посуду.
За 23-24 часа до введения каловой взвеси в брюшную полость, под эфирным наркозом, животным выполняли ампутацию дистальной 1/3-1/5 хвоста, с целью создания гиперреактивного фона и стресса в организме крысы [14]. Путем передозировки эфирного наркоза проводилось умерщвление нескольких интактных крыс. Содержимое слепой кишки изымалось, взвешивалось, готовилась 20% смесь на изотоническом растворе хлорида натрия. Затем смесь фильтровалась через двойной слой марли. После этого в течение 15 минут после приготовления каловой взвеси ее вводили из одного вкола (в центре белой линии живота) в правое и левое подреберья, в правую и левую подвздошную области, из расчета 0,7-0,9 миллилитра на 100 граммов массы животного, 25-ти половозрелым крысам линии Wistar. После введения взвеси животные были помещены на стандартный пищевой и водный режим. Спустя 7-8 часов после введения каловой взвеси, экспериментальные животные были разделены, случайным образом, на 2 группы. 1-я группа основная (15 шт.), которой производилась операция трансплантации аллогенных мезенхимальных стволовых клеток в дозе 1,5×106 на 100 г массы животного в 2 мл физиологического раствора внутривенно. 2-я группа - контрольная (10 шт.), которой производилась имитация введения стволовых клеток, путем введения в хвостовую вену 2 мл физиологического раствора. Ежедневно оценивалось общее состояние крыс, степень адинамии, отношение к воде и еде, состояние шерсти, а также уровень летальности на 3-и сутки эксперимента.
Различия в основной и контрольной группах начали наблюдаться непосредственно после операции трансплантации мезенхимальных стволовых клеток. Крысы в группе №1 вели себя более бодро, активнее передвигались по клетке, проявляли интерес к пище и воде, в отличие от крыс контрольной группы №2, в течение 1-х суток и всего времени проведения эксперимента. В течение всего времени проведения эксперимента крысы контрольной группы были более адинамичны по сравнению с основной, локализовались преимущественно в одном углу клетки, находясь одной группой, шерсть была взъерошена, интерес к пище отсутствовал, проявляли умеренный интерес к воде.
Летальность на 3-й сутки в основной группе составила 27%, а в контрольной 94%. Оставшиеся в живых животные были выведены из эксперимента путем передозировки эфирного наркоза на 10-е сутки эксперимента. При ревизии у всех особей в брюшной полости обнаруживалась мутная жидкость, петли кишечника вздуты, гиперемированы, отечны, сосуды брыжейки расширены. Передняя брюшная стенка, селезенка, печень, почки, часть большого сальника изымались для гистологического исследования с последующим изготовлением парафиновых срезов и их окраской гематоксилин-эозином, изучением под световым микроскопом.
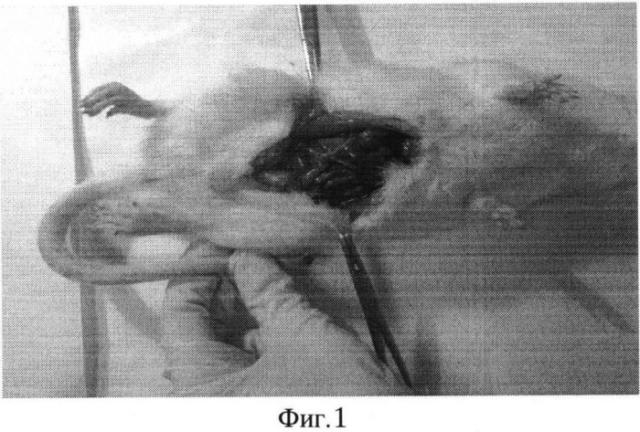
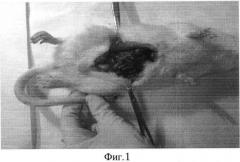
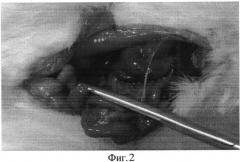
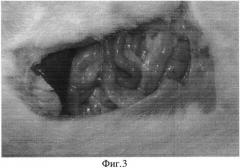
При макроскопическом сравнении воспалительного процесса в брюшной полости крыс, умерших на 3-и сутки эксперимента, следует обратить внимание на то, что у крыс в основной группе выраженность воспалительного процесса, количество перитонеального экссудата, наложения фибрина на париетальной, степень вздутия кишок и висцеральной брюшине было меньше, чем у крыс из контрольной группы (Фиг. 1-3).
При изучении окрашенных гистологических срезов оказалось, что у всех умерших животных от острого перитонита выраженность воспалительного процесса была разной в сравниваемых группах. В контрольной группе гистологическая картина характеризовалась: в печени гепатоциты в состоянии белковой дистрофии, с полнокровием центральных вен (Фиг. 4), брюшина отечна с диффузной нейтрофильной инфильтрацией (Фиг. 5), в почках наблюдалась ишемия клубочков, полнокровие, острый канальцевый некроз (Фиг. 7), а в селезенке картина септической селезенки с диффузной инфильтрацией нейтрофилов (Фиг. 6). Все это доказывало картину острого фибринозно-гнойного перитонита. В основной же группе у погибших животных гистологическая картина характеризовалась не такой яркой картиной воспалительного процесса брюшной полости, как в контрольной. Мы наблюдали разрешающийся перитонит (Фиг. 8-11).
При изучении гистологического материала животных, которые были выведены из эксперимента на 10-е сутки, оказалось, что выраженность воспалительного процесса у крыс в основной группе была меньше, а также наблюдалась картина разрешающегося перитонита. Тем временем у крыс в контрольной группе наблюдалась макроскопическая и гистологическая картина продолжающегося острого перитонита.
Таким образом, результаты предложенного способа лечения инфекционного перитонита в эксперименте открывают новые пути решения этой серьезной и тяжелой проблемы в хирургии.
Изобретение поясняется рисунками.
На фиг. 1 изображен общий вид вскрытого животного из контрольной группы с распространенным фибринозно-гнойным перитонитом (Группа №2).
На фиг. 2 изображено скопление гнойного экссудата в латеральном канале, а также наложения фибрина на петлях кишечника (Группа №2).
На фиг. 3 изображен воспалительный процесс в брюшной полости крыс из основной группы, который значительно отличается от контрольной группы (Группа №1).
На фиг. 4 изображена микрофотография печени крысы из контрольной группы: гепатоциты в состоянии белковой дистрофии, резкое полнокровие центральных вен, нейтрофильные сладжи в венах, центролобулярные некрозы, в пространствах Диссе эритроциты, эпителий желчных протоков частично слущен в просвет. Окраска Г+Э, увеличение ×200.
На фиг. 5 изображена микрофотография париетальной брюшины крысы из контрольной группы: отек, диффузная нейтрофильная инфильтрация. Окраска Г+Э, увеличение ×200.
На фиг. 6 изображена микрофотография селезенки крысы из контрольной группы: отмечаются некрозы, диффузная нейтрофильная инфильтрация. Окраска Г+Э, увеличение ×200.
На фиг. 7 изображена микрофотография почки крысы из контрольной группы: в почках ишемия клубочков, полнокровие, острый канальцевый некроз. Окраска Г+Э, увеличение ×200.
На фиг. 8 изображена микрофотография печени крысы из основной группы: гепатоциты в состоянии белковой дистрофии, полнокровие центральных вен, отсутствуют центролобулярные некрозы, эпителий желчных протоков в просвете, а также отсутствуют эритроциты в пространстве Диссе. Окраска Г+Э, увеличение ×200.
На фиг. 9 изображена микрофотография париетальной брюшины крысы из основной группы: отек, диффузная лимфоплазмоцитарная инфильтрация с единичными нейтрофилами. Окраска Г+Э, увеличение ×200.
На фиг. 10 изображена микрофотография селезенки крысы из основной группы: гипоплазия лимфоидных фолликулов, отмечаются множественные гигантские многоядерные клетки типа мегакариоцитов в красной пульпе. Окраска Г+Э, увеличение ×100.
На фиг. 11 изображена микрофотография почки крысы из основной группы: ишемия клубочков, полнокровие, дистрофические изменения эпителия проксимальных извитых канальцев. Окраска Г+Э, увеличение ×100.
Литература
1. Wittmann D.H. Intraabdominal infections // Pathophysiology anoireannent. 1991. P. 84.
2. Савельев B.C., Гельфанд Б.Р. Абдоминальная хирургическая инфекция // Российские национальные рекомендации. 2011.
3. Брискин Б.С. Иммунные нарушения и иммунокоррекция при интраабдоминальной инфекции / Б.С. Брискин, Н.Н. Хачатрян, 3. И. Савченко // Хирургия. - 2004. - №2. - С. 24-27.
4. Friedenstein AJ, Petrakova KV, Kurolesova AI, Frolova GP. Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues. Transplantation. 1968; 6(2): 230-247.
5. Garcia-Gomez I, Elvira G, Zapata AG et al Mesenchymal stem cells: biological properties and clinical applications. ExpertOpinBiolTher. 2010 Oct; 10(10): 1453-68.
6. Xu J, Woods CR, Mora AL, et al. Prevention of endotoxin-induced systemic response by bone marrow-derived mesenchymal stem cells in mice. Am.J. Physiol. LungCellMol. Physiol. 2007;. 293: L131-41.
7. Mei SH, Haitsma JJ, Dos Santos CC, et al. Mesenchymal Stem Cells Reduce Inflammation while Enhancing Bacterial Clearance and Improving Survival in Sepsis Am J RespirCrit Care Med. 2010 182 (8) 1047-57.
8. Weil BR, Manukyan MC, Herrmann JL, et al. Mesenchymal stem cells attenuate myocardial functional depression and reduce systemic and myocardial inflammation during endotoxemia Surgery. 2010; 148(2): 444-52.
9. Manukyan MC, Weil BR, Wang Y, et al. Female stem cells are superiortomalesmpreseivingmyocardialfunctionfollowingendotoxemiaAmJPhysiolRegulIntegrCompPhysiolJune 2011 300:(6) R1506-R1514.
10. Krasnodembskaya A, Song Y, Fang X et al, Antibacterial Effect of Human Mesenchymal Stem Cells Is Mediated in Part from Secretion of the Antimicrobial Peptide LL-37 Stem Cells 2010; 28:2229-2238.
11. Delgado; Mario; et al. Uses of mesenchymal stem cells. United States Patent Application. №20120027730, February 2, 2012.
12. Аверьянов А.В., Коноплянников А.Г. и др. Эффекты комбинированного лечения аллогенными мезенхимальными стволовыми клетками костного мозга и эритропоэтином в экспериментальной модели сепсиса // Инфекции в хирургии 2012. - №4. - 43-48.
13. Hosoon Choi, RyangHwa Lee, Nikolay Bazhanov, JooYoun Oh and Darwin J. Prockop // Anti-inflammatory protein TSG-6 secreted by activated MSCs attenuates zymosan-induced mouse peritonitis by decreasing TLR2/NF-B signaling in resident macrophages. Blood. 2011 118: 330-338.
14. Симонян K.C. Перитонит // M.: Медицина. 1971. - 216 c.
Способ лечения инфекционного перитонита в эксперименте, заключающийся в том, что крысам внутривенно вводят суспензию аллогенных мезенхимальных стволовых клеток из расчета 1,5×106 на 100 г массы животного.