Тест-система для определения активности интерферона человека
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована в лабораторной диагностике как тест-система и способ определения антивирусной активности интерферона альфа (ИФН-α) в сыворотке крови человека. Тест-система для определения уровня активности ИФН-α в сыворотке крови человека, включает диплоидные клетки, вируссодержащую жидкость и стандартный интерферон-α (ИФН-α) человека. В качестве диплоидных клеток тест-система включает клетки охарактеризованной линии диплоидных клеток - фибробластов человека М-20 на уровне 20-33 пассажей, культивированные в среде с добавлением 10% фибринолитически активной плазмы (ФАП). А в качестве вируса - адаптированный к клеткам линии М-20 вирус везикулярного стоматита (ВВС), штамм Индиана, при этом тест-система дополнительно включает витальный краситель на основе двух флуорохромов - трипафлавина и родамина С. Группа изобретений включает также способ определения уровня активности ИФН-α в сыворотке крови человека с использованием разработанной системы. Использование данных изобретений позволяет количественно, с хорошей воспроизводимостью, определить активность ИФН-α в образцах исследуемой сыворотки крови с помощью люминесцентной микроскопии препаратов, окрашенных витальным красителем на основе флуорохромов. 2 н. и 1 з.п. ф-лы, 4 ил., 1 табл., 4 пр.
Реферат
Изобретение относится к иммунологии, вирусологии, лабораторной диагностике, в частности к тест-системам и способам определения антивирусной активности интерферона-альфа (ИФН-α) в сыворотке крови человека.
Оценка уровня ИФН в сыворотке крови является важнейшим показателем состояния сопротивляемости организма к инфекциям различной этиологии. Исследование ИФН-статуса у пациента позволяет выявлять индивидуальную чувствительность к тому или иному лекарственному препарату (индуктору интерферона, иммуномодулятору). Стресс и острые вирусные инфекции, аллергические состояния характеризуются повышением уровня сывороточного интерферона и снижением уровня индуцируемой продукции ИФН-α-γ. Хронические вирусные инфекции (герпес, гепатит, рассеянный склероз) сопровождаются глубоким подавлением всех показателей интерферонового статуса. Аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит) характеризуются подавлением индуцируемой продукции ИНФ-α. Острый лимфолейкоз, злокачественные образования, проказа сопровождаются подавлением индуцируемой продукции ИФН-γ. При бронхиальной астме, крапивнице уровень сывороточного интерферона коррелирует с тяжестью заболевания. Снижение продукции α- и γ- интерферонов свидетельствует о дефектности систем интерферонов (врожденной или приобретенной) и являются показанием для ИФН-стимулирующей терапии [Сачек М.Г. Иммунологические аспекты хирургической инфекции. - Витебск, 1994, с.99-103; Новиков Д.К. Оценка иммунного статуса. - Москва-Витебск: Медицина, 1996, с.49-62; Григорян С.С. Оценка интерферонового статуса людей по пробам крови. Вопросы вирусологии, 1988, т.3, N 4, с.433-436]. Существует патент РФ 2159936, опубликованный 11.27.2000, посвященный способу выбора типа иммуномодулирующей терапии и определения прогноза исхода заболевания на основе анализа интерферонового статуса больного. В настоящее время в медицинской практике широко применяют следующие препараты: рекомбинантные: Беталейкин (ИЛ-1), Ронколейкин (ИЛ-2); природные: человеческий лейкоцитарный ИФН, вэллферон, лейкинферон; генно-инженерные рекомбинантные ИФН: реаферон, интрек, виферон; индукторы ИФН: циклоферон, арбидол [Иммунотропные лекарственные средства в детской кардиологии и кардиохирургии. Методические рекомендации №29. - Москва, 2005, с.16-21]. Для определения антивирусной активности интерферонов человека и ИФН статуса пациентов используют различные культуры клеток СПЭВ, Таурус-1, М-19.
Прототип. Патент РФ №1440029 от 22.03.93 г. «Штамм диплоидных клеток кожи и мышц эмбриона человека, используемый в качестве тест-системы для определения антивирусной активности интерферонов человека и размножения вирусов». Этот штамм ЛДКЧ обозначен М-21, однако культура фибробластов М-21 обладала недостаточной пролиферативной активностью, что снижало время формирования монослоя и повышало расход клеток и материалов и, в конечном итоге, привело к полному истощению ее запасов. Оценку антивирусной активности ИФН человека авторы проводили с использованием иммуноферментного анализа (ИФА). Этот метод имел высокую вариабильность и не позволял определять активность сывороточного ИФН даже в случае заражения организма высокопатогенным вирусом (клещевой энцефалит) или при лечении противовирусными препаратами, обладающими стимулирующим выработку ИФН действием. Особо отметим, что воспроизводимость результатов исследования ИФН зависит от качества используемых наборов для ИФА. Кроме того, исследовать уровень ИФН позволяет метод обратно-транскриптазной полимеразной цепной реакции (ОТ-ПЦР) в режиме реального времени. Однако метод ОТ-ПЦР, как и ИФА, требует специального оборудования и наборов, дороговизна которых ограничивает применение метода для проведения массового обследования больных и пострадавших.
В результате возникла необходимость в новой тест-системе, пригодной для определения антивирусной активности интерферона-альфа (ИФН-α) человека, более экономически выгодной, с использованием клеточной линии, отличающейся высокой пролиферативной активностью, имеющей банки посевных и рабочих клеток.
Таким образом, объектом изобретения является тест-система для определения уровня активности ИФН-α в сыворотке крови человека, включающая: диплоидные клетки - фибробласты человека охарактеризованной линии М-20 (96-ти луночный планшет с монослоем клеток), стандартный человеческий ИФН-α (коммерческий человеческий ИФН-α определенной активности) и жидкость, содержащую вирус везикулярного стоматита (ВВС). Для оценки ИФН-статуса выбран ВВС /штамм Индиана/, адаптированный к клеткам линии М-20 и позволяющий определять количество общего сывороточного ИФН-α. Тест-система также включает витальный краситель. Объектом изобретения является также способ определения уровня активности ИФН-α в сыворотке крови человека с использованием вышеуказанной тест-системы.
Определение уровня сывороточного ИФН-α человека основано на подавлении репродукции вируса везикулярного стоматита в клетках линии М-20 в присутствии исследуемой сыворотки крови, проявляющемся в различной степени деструкции монослоя фибробластов, в зависимости от концентрации ИФН в исследуемой сыворотке. Активность ИФН-α определяют посредством оценки деструкции монослоя клеток на препаратах, окрашенных витальным красителем, регистрируемой с помощью люминесцентного микроскопа. Результаты количественной оценки активности ИФН-α хорошо воспроизводимы в интервале гибели клеток (деструкции монослоя клеток) 50-80%.
В предлагаемой тест-системе используются диплоидные клетки - фибробласты человека охарактеризованной линии М-20, банки посевных и рабочих клеток которых на уровнях 7 и 16 пассажей хранятся в ИПВЭ им. М.П.Чумакова РАМН и позволяют обеспечить как производственные процессы, так и научные исследования.
Паспорт линии диплоидных клеток человека М-2.
Наименование линии: М-20; видовая принадлежность: человек; линия установлена в 1986 году в ГУ ИПВЭ им. М.П.Чумакова РАМН.
Культуральные свойства:
1. Тип роста: фибробластоподобный.
2. Количество пассажей: 50±2.
3. Фазы роста: 1-1-3 пассажи, II - 4-40, III - 41-(50±2).
4. Способ культивирования: стационарный, перевивки 2 раза в неделю.
5. Условия культивирования: среда ДМЕМ с α-глутамином с добавлением 10% ФАЛ при температуре 37°С и 5% CO2 в атмосфере.
6. Метод отделения клеток от поверхности роста: смесью 0,25% раствора трипсина и 0,02% раствора Версена в отношении (1:1).
Условия хранения: при температуре минус 196°С (в жидком азоте);
а) Состав криозащитной среды: среда ДМЕМ - 50%, криопротектор ДМСО - 10%, сыворотка эмбрионов коров - 40%.
б) Режим замораживания: стартовая температура 20°С, снижение температуры до +4°С со скоростью 1 град./мин.; выдержка 10 минут, снижение температуры до - 30 град./мин со скоростью 1 град./мин; выдержка 10 минут; снижение температуры до - 150°С со скоростью 10 град./мин. Перенос замороженных образцов в жидкий азот.
Восстановление и жизнеспособность клеток после криохранения: на водяной бане при температуре 37°С. Жизнеспособность: не менее 75±5% клеток. Среда для культивирования та же.
Изоэнзимная характеристика: Количество полос изоэнзимов Г-6ФДГ и ЛДГ и их электрофоретическая подвижность совпадают с таковыми для эритроцитов человека. Г-6ФДГ медленного типа.
Кариологическая характеристика: Кариотип человека 2n=46,ХУ. Диплоидных клеток 93,3-96,9%. Полиплоидных клеток не более 1,6%. Штамм обладает высокой генетической стабильностью.
Контроль контаминации: бактерий, грибов, микоплазм, при посеве на селективные питательные среды, заражении куриных эмбрионов и при электронно-микроскопическом исследовании не выявлено, вирусов не обнаружено в исследованиях на животных, в клеточных культурах, в куриных эмбрионах, методами электронной микроскопии.
Онкогенная безопасность: in vivo - при исследовании с использованием линейных мышей СВА опухоли не образовывались; in vitro - контроль на обратную транскриптазу отрицательный.
Биохимические, генетические маркеры: а) HLA-маркеры: А*02, 03; В*07, 40; С*03, 07; DRB1*15, 16; DQB1*05, 06; б) Клетки линии М-20 на уровне 20 пассажа продуцируют мРНК α-интерферона (ИФН-α) и интерлейкинов: ИЛ1β, 2,4,6,8.10,18.
Таким образом, линия диплоидных клеток человека М-20, охарактеризованная на безопасность в соответствии с методическими рекомендациями РД-42-28-10-89. МЗ СССР. М., 1989, обладает высокой пролиферативной активностью за счет использования при культивировании клеток ФАП. Клетки линии М-20 на уровне 20 пассажа продуцируют мРНК интерферона-α (ИФН-α) и интерлейкинов: ИЛ1β, 2,4,6,8.10,18.
Для изготовления тест-системы для определения уровня активности ИФН-α в сыворотке крови человека клетки линии М-20 16 пассажа восстанавливают из рабочего банка. Для этого криопробирку с клетками извлекают из жидкого азота и помещают в водяную баню при температуре 38°С и после оттаивания содержимое переносят в культуральный сосуд с питательной средой ДМЕМ, содержащей 10% ФАП (с содержанием тромбоцитарного фактора роста [PDGF] от 155 до 342 пг/мл), добавляют антибиотик гентамицин из расчета 1 мл 4% раствора на 1 л питательной среды. Для формирования монослоя клетки культивируют в течение 4-5 суток при 37°С и содержании СО2 в атмосфере 5%. После формирования монослоя клеток проводят 3 последовательных пассажа, необходимых для репарации ДНК после криоконсервирования. Затем проводят тиражирование клеток с 20 по 33 пассаж. Клетки этих пассажей предназначены для медико-биологических целей.
Схема изготовления тест-системы для определения активности ИФН-α в сыворотке крови человека:
I. Приготовление лабораторного стандарта вируса везикулярного стоматита:
1. Накопление ВВС при заражении фибробластов человека линии М-20.
2. Титрование полученной вируссодержащей жидкости.
II. Получение монослойной культуры фибробластов человека линии М-20 в двух 96-луночных планшетах.
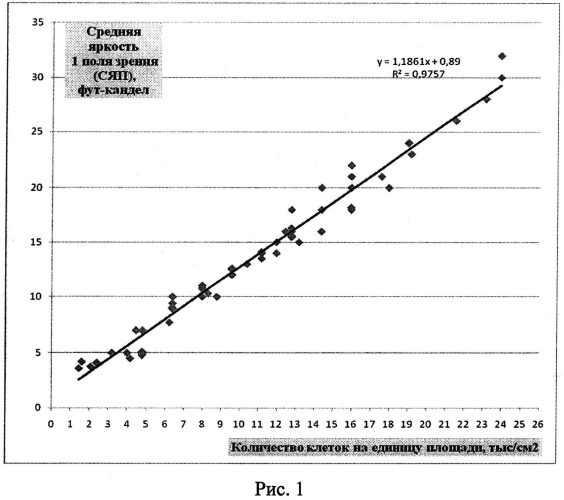
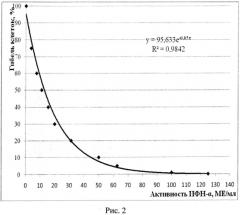
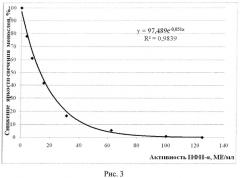
Одна планшета используется регулярно для определения активности ИФН-α в сыворотке крови человека посредством оценки степени деструкции монослоя клеток на препаратах, окрашенных витальным красителем, регистрируемой с помощью люминесцентного микроскопа, другая планшета - для построения калибровочных кривых: калибровочная кривая (рисунок 1) зависимости средней яркости поля зрения микроскопа (СЯПЗМ) от количества прикрепленных клеток (КПК) линии М-20 (тыс/см2); калибровочная кривая (рисунок 2) зависимости гибели клеток (%) от активности ИФН-α (МЕ/мл); калибровочная кривая (рисунок 3) зависимости изменения яркости свечения монослоя клеток (%) от активности ИФН-α (МЕ/мл). Вторая планшета используется не регулярно, в частности, при отработке метода исследования ИФН-α, проверке новых серий коммерческого препарата ИФН-α, при получении новых серий фибробластов человека линии М-20, используемых для научных и диагностических целей.
Готовая к использованию двойная тест-система содержит:
- 96-луночный планшет с монослоем клеток диплоидных клеток человека охарактеризованной линии М-20,
- стандартный человеческий ИФН-α (коммерческий человеческий ИФН-α определенной активности),
- жидкость, содержащую вирус везикулярного стоматита (ВВС) штамм Индиана, адаптированный к клеткам линии М-20,
- витальный краситель.
Схема определения активности ИФН-α в сыворотке крови человека:
1. Приготовление разведений:
а. Исследуемой сыворотки крови,
б. Коммерческого человеческого ИФН-α,
в. Вируссодержащей жидкости.
2. Инкубация монослойной культуры фибробластов человека линии М-20 в 96-луночном планшете с ИФН-α содержащими пробами.
Внесение в лунки одного 96-луночного планшета с монослоем клеток линии М-20 различных разведений исследуемой сыворотки крови человека; внесение в лунки другого 96-луночного планшета с монослоем клеток линии М-20 различных разведений коммерческого человеческого ИФН-α известной активности. Инкубация клеток с образцами, содержащими ИФН при 37°С и 5% CO2 в течение 24 часов.
3. Инкубация монослойной культуры фибробластов человека линии М-20 в 96-луночном планшете с разведениями индикаторного ВВС.
Внесение в лунки двух 96-луночных планшетов с монослоем клеток линии М-20 различных разведений вируссодержащей жидкости и инкубация планшета при 37°С и 5% CO2 в течение двух суток.
4. Учет результатов определения уровня активности интерферона в сыворотке крови человека.
После инкубации с ВВС из лунок планшета удаляют вируссодержащую жидкость и в каждую лунку планшета вносят витальный краситель, приготовленный на основе 2-х флуорохромов. Оценку окрашенных культур клеток в 96-луночных планшетах проводят с помощью флуоресцентного микроскопа в полуавтоматическом режиме. Для оценки яркости свечения 1 поля зрения используют программу Adobe Photoshop.Сравнивают яркость свечения монослоя клеток в лунках с коммерческим препаратом человеческого ИФН-α с яркостью свечения монослоя клеток в лунках с исследуемым образцом сыворотки крови человека. Чем ярче свечение анализируемого препарата, тем больше количество прикрепленных клеток (меньше деструкция монослоя). Следовательно, чем выше активность ИФН, тем меньше цитопатическое действие вируса, оказываемое на клетки. Для построения калибровочной кривой используют лунки второго планшета, в которых раститрован в международных единицах (ME) коммерческий препарат человеческого ИФН-α (рисунок 1). За титр интерферона принимают величину, обратную значению наибольшего разведения препарата, которое обеспечивает защиту от вируса 50% клеточного монослоя. Яркость свечения окрашенных клеток на препаратах обратно пропорциональна степени развития цитопатического действия вируса и прямо пропорциональна содержанию ИФН-α в исследуемых пробах.
Подробное описание изготовления тест-системы и осуществления способа определения активности ИФН-α человека
1-й этап. Приготовление лабораторного стандарта вируса везикулярного стоматита.
1. Накопление ВВС. Из культурального сосуда с монослоем клеток линии М-20, 19 пассажа удаляют культуральную жидкость, клетки промывают свежей средой ДМЕМ без сыворотки, вносят ВВС /штамм Индиана/, в конечной концентрации 10 цитопатических доз (ЦПД). Клетки с вирусом инкубируют в течение 1 часа, после чего заливают поддерживающей средой ДМЕМ с глутамином, рН 7,2 с 2% сыворотки эмбрионов коров, инкубируют в течение 2 суток при 37°С и содержанием CO2 5% до деструкции 70% монослоя клеток. Клетки разрушают 3-кратным замораживанием-оттаиванием.
2. Титрование полученной вируссодержащей жидкости. Для определения активности используемого вируса-индикатора - ВВС, в пенициллиновых флаконах делают 6 последовательных 10-кратных разведений вируса в среде ДМЕМ. Эту же среду используют при титровании ИФН. Соответствующие разведения вируса вносят по 0,1 мл (100 мкл) в лунку с монослоем клеток линии М-20 из расчета по 4 лунки для каждого разведения. Планшет инкубируют в термостате в течение 2 суток и определяют титр вируса, который должен составлять 104 ЦПД/мл. Полученную вируссодержащую жидкость разливают по пробиркам и хранят при - 70°С.
II-ой этап. Получение монослойной культуры фибробластов человека линии М-20 в двух 96-луночных планшетах.
Получение монослойной культуры фибробластов человека линии М-20 в двух 96-луночных планшетах. Клетки линии М-20 хранятся в жидком азоте.
Предварительно диплоидные клетки охарактеризованной линии М-20 масштабируют из ампулы банка посевных клеток 7 пассажа и получают банк рабочих клеток 16 пассажа (как описано выше). Эти клетки прикрепляются к поверхности культурального сосуда, обычно площадью 75 см2. В дальнейшем эти клетки отделяют от поверхности роста в культуральном сосуде посредством добавления 10 мл смеси растворов 0,25%-ного трипсина и 0,02%-ного версена в равных объемах, подогретой до температуры 37°С. После округления клеток жидкость удаляют и клетки переводят в суспензию встряхиванием с 20 мл питательной среды ДМЕМ с добавлением 10% ФАЛ. После подсчета клеток в камере Фукс-Розенталя суспензию разводят до концентрации 120×103 клеток/мл и высевают в два 96-луночных планшета по 0,2 мл/лунку (200 мкл/лунку). Планшеты с клетками инкубируют в термостате с 5% CO2 при 37°С в течение 1 суток до формирования плотного монослоя. В дальнейшем этот пул клеток от 20 до 33 пассажа можно использовать в работе, получая высоко воспроизводимые результаты.
Осуществление способа определения активности ИФН-α в сыворотке крови человека.
1. Приготовление разведений исследуемой сыворотки.
Последовательные двукратные разведения исследуемой сыворотки 1:10, 1:20, 1:40, 1:80 готовят во вспомогательных планшетах. В первую лунку вносят сыворотку крови, разведенной в 10 раз, а затем путем двойного разведения в последующих лунках получают разведение 1:20, 1:40, 1:80, как описано выше.
2. Приготовление разведений коммерческого человеческого интерферона-α.
Делают 5 последовательных двукратных разведений коммерческого интерферона-α от 25 до 0,7 МЕ/мл.
3. Приготовление разведений лабораторного стандарта вируса везикулярного стоматита
Пробирку с лабораторным стандартом ВВС с титром 104 ЦПД/мл размораживают и готовят рабочее разведение вируса, содержащего 100 ЦПД/мл. Рабочее разведение получают в результате двух последовательных 10-кратных разведений. Для контроля дозы вируса испытывают три последовательных 10-кратных разведения.
4. Инкубация монослойной культуры фибробластов человека линии М-20 в двух 96-луночных планшах с ИФН-содержащими пробами.
В лунки планшета с монослоем клеток линии М-20 вносят различные разведения исследуемой сыворотки крови человека. В контрольные лунки - разведения коммерческого препарата человеческого ИФН-α. Перед этим среду роста удаляют из лунок планшета, культуру промывают свежей питательной средой ДМЕМ, удаляют ее и снова вносят свежую среду по 0,1 мл (100 мкл) на лунку. Испытуемый образец сыворотки крови вносят в 1 первую лунку платы в объеме 0,1 мл (100 мкл) и делают последовательные двукратные разведения с помощью автоматической микропипетки. Для этого содержимое первой лунки пипетируют 3-4 раза и 0,1 мл (100 мкл) смеси переносят во 2 лунку, содержимое второй лунки пипетируют 3-4 раза и 0,1 мл (100 мкл) смеси переносят в 3 лунку и так далее до конечного разведения. Планшеты инкубируют в течение 24 часов.
5. Инкубация монослойной культуры фибробластов человека линии М-20 в двух 96-луночном планшете с разведениями индикаторного ВВС.
После инкубации клеток с разведениями исследуемой сыворотки (в первом планшете) и стандартного препарата ИФН-α (во втором планшете) в лунки планшета вносят по 0,1 мл (100 мкл) рабочего разведения вируса ВВС. Для контроля культуры оставляют 4 лунки с клетками, содержащими только питательную среду. Планшет инкубируют в течение 2 суток в термостате с 5% СО2 при 37°С.
6. Учет результатов уровня активности интерферона в сыворотке крови человека.
После инкубации клеток линии М-20 с ВВС из планшетов удаляют вируссодержащую жидкость и в каждую лунку планшета вносят витальный краситель, приготовленный на основе 2-х флуорохромов. Оценку окрашенных культур клеток в 96-луночных планшетах проводят с помощью флуоресцентного микроскопа в полуавтоматическом режиме. Витальный краситель готовят на основе 2-х флуорохромов - трипафлавина и родамина С - следующим образом. На первом этапе готовят концентрированные растворы трипафлавина (раствор А) и родамина С (Раствор Б) на 0,15М фосфатном буфере: Раствор А - трипафлавин, разводят 0,15М фосфатным буфером в соотношении 1:2000-1:5000. Необходимо добиться полного растворения кристаллов трипафлавина. Раствор Б - родамин С, разводят 0,15М фосфатным буфером в соотношении 1:1500-3000. Рабочий раствор витального красителя готовят смешиванием растворов А и Б в равных объемах и разводят в 10 раз 0,9% раствором NaCl. Для окраски 1 см2 монослоя с клетками требуется 2-5 мкл рабочего раствора красителя.
Оценку витально окрашенных культур клеток в 96-луночных планшетах проводят с помощью флуоресцентного микроскопа (объектив ×4, числовая апертура 1.25) в полуавтоматическом режиме. Для получения флуоресцентного изображения используют зеленый светофильтр (k-возбуждения 510-560 нм, λ-эмиссии от 590 нм). С помощью фотокамеры при экспозиции 1-4 сек получают цифровые изображения клеток и переносят в компьютер. Исследуют 27 стандартных полей зрения микроскопа. Единицей анализа является 1 поле зрения микроскопа, которое составляет 5 мм2 площади культуры клеток. Для оценки яркости свечения 1 поля зрения используют программу Adobe Photoshop. Между количеством клеток и интенсивностью их свечения (в фут-канделах) выявлена тесная корреляционная связь, описываемая уравнением у=1,1861x+0,89, где по оси абсцисс - количество клеток на единицу площади, тыс/см2, по оси ординат - средняя яркость одного поля зрения, фут-кандел (Рис.1. Калибровочная кривая зависимости средней яркости поля зрения микроскопа (СЯПЗМ) от количества прикрепленных клеток (КПК) линии М-20 (тыс/см2)). Установлено, что при интесивности С-ЯПЗ более 20 фут-кандел исследуемый монослой является максимально насыщенным, при 15,0-19,9 фут-кандел - монослой 60-80% конфлюентности, при менее чем 15 фут-кандел - монослой не сформирован.
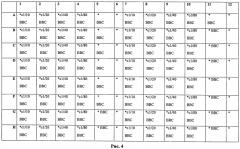
Ход определения отражен на рисунке 4. Тест-система для определения активности ИФН-α в 96-луночном планшете, где использованы следующие обозначения:
(*) - 96-луночный культуральной планшет содержит суточный монослой клеток линии М-20 (из расчета 18000 кл/см2) и рассчитан на обследование 4 образцов сыворотки для определения активности ИФН-α человека;
(ВВС) - вирус везикулярного стоматита, штамм Индиана;
(c1/10, c1/20, c1/40, c1/80) - исследуемые образцы сыворотки крови в разведениях: 1:10, 1:20, 1:40 и 1:80;
(*ВВС) - лунки столбцов №5 и №11 в планшете являются положительным контролем. Все 16 лунок с монослоем клеток линии М-20 инфицированы ВВС (10 ЦПД /100 мкл в лунке), количество прикрепленных клеток в положительном контроле составляло КПК - 10 кл/см2 100% гибели клеток.
(*) - лунки столбцов №6 и №12 в планшете являются отрицательным контролем или контролем культуры клеток. Все 16 лунок с монослоем клеток линии М-20 не содержат ВВС. Количество прикрепленных клеток в каждой лунке 18000 кл/см2, что эквивалентно средней яркости 1 поля зрения микроскопа, равной 20 фут-кандел.
(*с/ВВС) - 64 лунки опыта с монослоем клеток линии М-20, которые для оценки активности ИФН-α инкубировали с разными разведениями 4-х исследуемых сывороток крови человека (1:10, 1:20, 1:40 и 1:80) в течение 24 часов и затем инфицировали ВВС (10 ЦПД/100 мкл в лунке) с последующей инкубацией в течение 48 часов.
В лунках (A-D; 1-4) - образец сыворотки крови человека №1;
В лунках (A-D; 7-10) - образец сыворотки крови человека №2;
В лунках (Е-Н; 1-4) - образец сыворотки крови человека №3;
В лунках (Е-Н; 7-10)- образец сыворотки крови человека №4;
Результаты учитывали через 48 часов, оценивая степень деструкции монослоя по уменьшению количества прикрепленных клеток (КПК) и, соответственно, степени снижения средней яркости поля зрения микроскопа (СЯПЗМ) и выражали в %. При снижении этих параметров на 50%-80% от отрицательного контроля проводили расчет активности ИФН-α (в МЕ/мл) по калибровочным кривым (Рис.2. Калибровочная кривая зависимости гибели клеток (%) от активности ИНФ-α (МЕ/мл); Рис.3. Калибровочная кривая зависимости изменения яркости свечения монослоя клеток (%) от активности ИНФ-α (МЕ/мл)), с учетом разведения сывороток крови.
ПРИМЕРЫ применения предложенной тест-системы для определения и расчетов активности ИФН-α человека в сыворотке крови (таблица 1).
Пример 1. Исследование образца сыворотки №1
Содержание клеток в монослое было следующим:
А-5, В-5, С-5, D-5 - положительный контроль, монослой клеток линии М-20 инфицирован ВВС (10 ЦПД/100 мкл в лунке) - количество прикрепленных клеток (КПК) - 10 кл/см2, т.е. 100% клеток погибли.
А-6, В-6, С-6, D-6 - отрицательный контроль. СЯПЗМ=20 фут-кандел, что эквивалентно КПК=18000 кл/см2 (рассчитано по данным калибровочной кривой, рис.1). Заключение - нет деструкции монослоя.
А-1, В-1, С-1, D-1 - разведение сыворотки 1:10. СЯПЗМ=15 фут-кандел, что эквивалентно КПК=13000 кл/см2 (рассчитано по данным калибровочной кривой, рис.1). Заключение - деструкция монослоя в результате гибели клеток составляет 25-28%. Расчет активности ИФН-α не проводился, так как деструкция монослоя была менее 50%.
Расчет степени деструкции монослоя фибробластов (в %) осуществляют по формуле:
(СЯПЗМопыт-СЯПЗМотриц.контр): СЯПЗМотриц.контр=(15-20):20=0.25, что соответствует 25% деструкции монослоя.
Расчет количества погибших клеток (в %) осуществляют на основании параметра КПК по формуле:
(КПКопыт-КПКотриц.контр):КПКотриц.контр=(13000-18000):18000=28%. А-2, В-2, С-2, D-2 - разведение сыворотки 1:20. СЯПЗМ=13,4 фут-кандел, что эквивалентно КПК=12500 кл/см2 (рассчитано по данным калибровочной кривой, рис.1).
Заключение - деструкция монослоя в результате гибели клеток составляет 30,5%-33,0%. Расчет активности ИФН-α не проводился, так как деструкция монослоя была менее 50%.
Расчет степени деструкции монослоя фибробластов (в %) осуществляют по формуле:
(СЯПЗопыт-СЯПЗМотриц.контр):СЯПЗМотриц.контр=(13,4-20):20, что соответствует 33% деструкции монослоя.
Расчет количества погибших клеток (в %) осуществляют на основании параметра КПК по формуле:
(КПКопыт-КПКотриц.контр):КПКотриц.контр=(12500-18000):18000=30,5%
А-3, В-3, С-3, D-3 - разведение сыворотки 1:40. СЯПЗМ=9,1 фут-кандел, что эквивалентно КПК=8200 кл/см2 (рассчитано по данным калибровочной кривой, рис.1). Заключение - деструкция монослоя в результате гибели клеток составляет 54,4-54,5%.
Расчет степени деструкции монослоя фибробластов (в %) осуществляют по формуле:
(СЯПЗМопыт-СЯПЗМотриц.контр):СЯПЗМотриц.контр=(9,1-20):20, что соответствует 54,5% деструкции монослоя.
Расчет количества погибших клеток (в %) осуществляют на основании параметра КПК по формуле:
(КПКопыт-КПКотриц.контр):КПКотриц.контр=(8200-18000):18000=54,4%. Активность ИФН-α в образцах А-3, В-3, С-3, D-3 при гибели клеток 54% варьирует от 9,0 до 11,0 МЕ/мл и с учетом разведения сыворотки составляет 360-440 МЕ/мл (в среднем 400 МЕ/мл).
А-4, В-4, С-4, D-4 - разведение сыворотки 1:80. СЯПЗМ=4,5 фут-кандел, что эквивалентно КПК=3500 кл/см2 (рассчитано по данным калибровочной кривой, рис.1).
Заключение - деструкция монослоя в результате гибели клеток составляет 77,5-80,%).
Расчет степени деструкции монослоя фибробластов (в %) осуществляют по формуле:
(СЯПЗМопыт-СЯПЗМотриц.контр):СЯПЗМотриц.контр=(4,5-20):20, что соответствует 77,5% деструкции монослоя.
Расчет количества погибших клеток (в %) осуществляют на основании параметра КПК по формуле:
(КПКопыт-КПКотриц.контр):КПКотриц.контр=(3500-18000):18000=80,0)%.
Активность ИФН-α в образцах А-4, В-4, С-4, D-4 при гибели клеток 80% варьирует от 4,0 до 5,0 МЕ/мл и с учетом разведения сыворотки составляет 320-400 МЕ/мл (в среднем 360 МЕ/мл).
Заключение: в образце сыворотки крови №1 активность ИФН-α варьирует от 320 до 440 МЕ/мл, составляя в среднем 380 МЕ/мл.
Примеры 2-4. Аналогичным путем с помощью предложенной тест-системы определяли и рассчитывали активность ИФН-α человека в сыворотке крови №2, №3, №4). Активность ИФН-α в сыворотке крови №3 значительно снижена (120 МЕ/мл) по сравнению с физиологической нормой (640-1280 МЕ/мл). В сыворотке №2 активность ИФН-α составила 880 МЕ/мл, что соответствует норме. При исследовании активности ИФН-α в сыворотке №4 при ее стандартных разведениях (1:10, 1:20, 1:40, 1:80) рассчитать активность ИФН-α не удалось: потребовалось дополнительное разведение сыворотки 1:160. Степень деструкции монослоя фибробластов и количество погибших клеток составили 60%, что позволило определить активность ИФН-α, которая составила 1600 МЕ/мл, что выше нормы.
| Таблица 1 | |||||
| Оценка активности ИФН-α в 4 образцах сыворотки крови человека | |||||
| Параметры | Разведение сыворотки | Отрицательный контроль | |||
| 1:10 | 1:20 | 1:40 | 1:80 | ||
| Пример 1. Сыворотка №1 | |||||
| СЯПЗМ (фут-кандел) | 15 | 13,4 | 9,1 | 4,5 | 20 |
| Гибель клеток (%) | 28 | 35 | 54 | 80 | 0 |
| Степень деструкции монослоя (%) | 25 | 33 | 54 | 78 | 0 |
| *Активность ИФН-α (МЕ/мл) | - | - | 10 | 4,5 | 0 |
| *Активность ИФН-α в образце сыворотки крови №1 с учетом ее разведения | 380 МЕ/мл | ||||
| Пример 2. Сыворотка №2 | |||||
| СЯПЗМ (фут-кандел) | 17,6 | 16,2 | 13,3 | 9,2 | 20 |
| Гибель клеток (%) | 2 | 15 | 32 | 52 | 0 |
| Степень деструкции монослоя (%) | 1 | 18 | 34 | 54 | 0 |
| *Активность ИФН-α (МЕ/мл) | - | - | - | 11 | 0 |
| *Активность ИФН-α в образце сыворотки крови №2 с ее учетом разведения | - | 880 МЕ/мл |
| Пример 3. Сыворотка №3 | |||||
| СЯПЗМ (фут-каидел) | 9,8 | 6,4 | 4,8 | 2 | 20 |
| Гибель клеток (%) | 50 | 67 | 75 | 90 | 0 |
| Степень деструкции монослоя (%) | 51 | 69 | 78 | 91 | 0 |
| *Активность ИФН-α (МЕ/мл) | 12 | 6 | 3 | - | 0 |
| Активность ИФН-α в образце сыворотки крови №3 с учетом ее разведения | 120 МЕ/мл | - | |||
| Пример 4. ***Сыворотка №4 | |||||
| СЯПЗМ (фут-кандел) | 20 | 18 | 16 | 11 | 20 |
| Гибель клеток (%) | 0 | 11 | 21 | 44 | 0 |
| Степень деструкции монослоя(%) | 0 | 10 | 20 | 45 | 0 |
| *Активность ИФН-α (МЕ/мл) | - | - | - | - | 0 |
| *** Оценить активность ИФН-α в сыворотке №4 не удалось, так как при стандартных разведениях сыворотки гибель клеток (по сравнению с отрицательным контролем) была менее 50%. В этой связи потребовалось дополнительное разведение сыворотки №4 до 1:160. При этом гибель клеток составила 60%. В этом случае активность ИФН-α варьирует от 9,0 до 11,0 МЕ/мл, и с учетом разведения сыворотки составила в среднем 1600 МЕ/мл. |
Таким образом, предложена многокомпонентная тест-система для определения уровня активности ИФН-α в сыворотке крови человека, которая, за счет использования клеток охарактеризованной линии диплоидных клеток человека М-20, лабораторного стандарта ВВС, адаптированного к клеткам линии М-20, стандартного препарата ИФН-α человека и флюорохромных красителей, позволяет количественно определить активность ИФН-α (МЕ/мл) в исследуемых образцах сыворотки крови.
Способ определения уровня активности ИФН-α в сыворотке крови человека с использованием такой системы позволяет количественно, с хорошей воспроизводимостью, определить активность ИФН-α в образцах исследуемой сыворотки крови с помощью люминесцентной микроскопии препаратов, окрашенных витальным красителем на основе флюорохромов. При этом расчет активности интерферона-альфа, выраженной в международных единицах (ME) на миллилитр исследуемой сыворотки, проводят по калибровочной кривой, с учетом разведения исследуемой сыворотки крови.
1. Тест-система для определения уровня активности ИФН-α в сыворотке крови человека, включающая диплоидные клетки, вируссодержащую жидкость и стандартный интерферон-α (ИФН-α) человека, отличающаяся тем, что в качестве диплоидных клеток тест-система включает клетки охарактеризованной линии диплоидных клеток - фибробластов человека М-20 на уровне 20-33 пассажей, культивированные в среде с добавлением 10% фибринолитически активной плазмы (ФАП), а в качестве вируса - адаптированный к клеткам линии М-20 вирус везикулярного стоматита (ВВС), штамм Индиана, при этом тест-система дополнительно включает витальный краситель на основе двух флуорохромов - трипафлавина и родамина С.
2. Способ определения уровня активности ИФН-α в сыворотке крови человека, включающий использование тест-системы, содержащей диплоидные клетки, вируссодержащую жидкость и стандартный интерферон-α (ИФН-α) человека, отличающийся тем, что используют тест-систему по п.1, с помощью которой определяют подавление репродукции вируса везикулярного стоматита в клетках линии М-20 в присутствии исследуемой сыворотки крови, проявляющееся в различной степени деструкции монослоя фибробластов линии М-20 в лунках планшета в зависимости от уровня ИФН-α в исследуемой сыворотке, при этом активность ИФН-α определяют посредством оценки деструкции монослоя клеток на препаратах, окрашенных витальным красителем, с помощью люминесцентной микроскопии, и по калибровочной кривой, построенной с использованием стандартного ИФН-α, проводят расчет активности интерферона-альфа, выраженной в международных единицах (ME) на миллилитр исследуемой сыворотки.
3. Способ по п.2, в котором расчет активности ИФН-α проводят при степени деструкции монослоя клеток 50-80%.