Способ получения и очистки жирных кислот
Иллюстрации
Показать всеИзобретение относится к способу очистки жирной кислоты, содержащей от 1 до 6 центров неконъюгированной ненасыщенности, включающему: (a) введение в реакцию жирной кислоты, содержащей от 1 до 6 центров неконъюгированной ненасыщенности, с солью лития в первом растворе и в условиях, позволяющих образование осадка литиевой соли жирной кислоты; (b) выделение осадка; (c) растворение осадка во втором растворе, который способен давать два несмешивающихся слоя при растворении осадка, причем указанные два несмешивающихся слоя представляют собой органический слой и водный кислотный слой; (d) разделение двух несмешивающихся слоев, образовавшихся при растворении осадка; и (e) выпаривание органического слоя для выделения очищенной жирной кислоты, где способ очистки не включает разделения жирных кислот между собой. Изобретение также относится к способу получения жирной кислоты, содержащей от 1 до 6 центров неконъюгированной ненасыщенности, и к способу увеличения длины жирной кислоты. 3 н. и 10 з.п. ф-лы, 2 пр.
Реферат
Предшествующий уровень техники
Настоящее изобретение касается получения и очистки жирных кислот. Жирные кислоты - это алифатические монокарбоновые кислоты, имеющие, как правило, животное или растительное происхождение. Помимо того, что они являются источником энергии, жирные кислоты играют множество других ключевых ролей в организме. Они могут принимать участие в регуляции нормального уровня липидов, а также участвуют в воспалительной реакции. Кроме того, они играют важную роль в крови, регулируя процесс свертывания и кровяное давление.
Многие жирные кислоты могут быть синтезированы организмом in vivo. Однако некоторые из них, так называемые «незаменимые жирные кислоты», не синтезируются организмом. Незаменимые жирные кислоты включают короткоцепочечные полиненасыщенные жирные кислоты (SC-PUFAs): линолевую кислоту и α-линоленовую кислоту, а также длинноцепочечные полиненасыщенные жирные кислоты (LC-PUFAs), которые можно получить из этих SC-PUFAs. Эти две группы, как правило, далее подразделяют еще на две группы, ω-3 (или "Омега 3") жирные кислоты и ω-6 (или "Омега 6") жирные кислоты. Представителями LC-PUFAs ω-3 жирных кислот являются эйкозапентаеновая кислота (ЕРА) и докозагексаеновая кислота (DHA), а представителями ω-6 жирных кислот - гамма-линоленовая кислота (GLA), дигомо-гамма-линоленовая кислота (DGLA) и арахидоновая кислота (АА).
Поскольку незаменимые жирные кислоты не могут быть синтезированы организмом in vivo, они должны поступать с пищей. Поэтому существует необходимость в разработке и улучшении способов и методик выделения и очистки этих незаменимых жирных кислот. Существует также необходимость в разработке и улучшении способов превращения незаменимых жирных кислот в другие жирные кислоты, с тем чтобы обеспечить широкий спектр соединений и пищевых добавок, необходимых для удовлетворения индивидуальных потребностей. Кроме того, некоторые продукты PUFA необходимо получать в чистом виде, в связи с тем, что они обладают фармацевтической активностью.
Были найдены новые способы очистки жирных кислот, которые позволяют упростить получение, и/или повысить степень чистоты, и/или облегчить масштабирование процесса. Эти новые способы очистки можно применять для выделения полученной жирной кислоты или внедрять в более сложные способы получения указанной жирной кислоты. Эти способы позволяют удалить некислотные примеси из жирных кислот.
Сущность изобретения
Настоящее изобретение предлагает применение соли лития для очистки жирной кислоты.
Кроме того, настоящее изобретение предлагает способ очистки жирной кислоты, включающий:
(a) введение жирной кислоты в реакцию с солью лития в первом растворе в условиях, обеспечивающих образование осадка литиевой соли жирной кислоты;
(b) выделение осадка;
(c) растворение осадка во втором растворе, способном образовывать два несмешивающихся слоя при растворении данного осадка, представляющие собой органический слой и водный кислотный слой;
(d) разделение двух несмешивающихся слоев, образованных при растворении осадка; и
(e) выпаривание органического слоя для выделения очищенной жирной кислоты.
Предлагается также способ получения жирной кислоты, включающий:
(a) декарбоксилирование производного малоновой кислоты формулы R-CH2CH(CO2H)2, в которой R представляет собой остаток жирной кислоты, с получением жирной кислоты формулы RCH2CH2CO2H;
(b) обработка жирной кислоты, полученной таким путем, согласно способу очистки жирной кислоты, описанному выше.
Кроме того, предлагается способ увеличения длины жирной кислоты, включающий:
(a) восстановление жирной кислоты формулы R-CO2H или эфира жирной кислоты формулы R-CO2R1, в которых R представляет собой остаток жирной кислоты, а R1 представляет собой C1-6-алкильную группу, до спирта формулы R-CH2OH;
(b) сульфонирование спирта с образованием сульфоната формулы R-CH2OSO2R2, в которой R2 представляет собой C1-6-алкильную или С6-10-арильную группу;
(c) введение сульфоната в реакцию с производным малонового эфира и гидролиз полученного продукта с образованием производного малоновой кислоты формулы R-CH2CH(CO2H)2;
(d) декарбоксилирование производного малоновой кислоты с образованием жирной кислоты формулы R-CH2CH2CO2H; и
(e) обработку жирной кислоты, полученной таким путем, согласно способу очистки жирной кислоты, описанному выше.
Подробное описание изобретения
Используемый в данном тексте термин «C1-6-алкильная группа» обозначает линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, например C1-4-алкильную группу, содержащую от 1 до 4 атомов углерода. Примеры C1-4-алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Во избежание разночтений в тех случаях, когда присутствуют две алкильные группы, они могут быть одинаковыми или различными.
Используемый в данном тексте термин «С2-С4-алкенильная группа» представляет собой линейную или разветвленную алкенильную группу, содержащую по меньшей мере одну двойную связь, имеющую цис- либо транс-конфигурации, в тех случаях, когда это применимо, и содержащую от 2 до 4 атомов углерода, например -СН=СН2 или -СН2-CH=СН2, -СН2-СН2-CH=СН2, -СН2-СН=СН-СН3, -СН=С(СН3)-СН3 и -СН2-С(СН3)=СН2, предпочтительно С2-алкенильную группу, содержащую 2 атома углерода. Во избежание разночтений, в тех случаях когда в соединении по настоящему изобретению присутствуют две алкенильные группы, они могут быть одинаковыми или различными.
Используемый в данном тексте термин «атом галогена» обозначает, как правило, хлор, фтор, бром или йод.
Используемый в данном тексте термин «С1-С4-алкокси-группа» или «С2-С4-алкенилокси-группа» обозначает, как правило, указанную С1-С4-алкильную группу или указанную С2-С4-алкенильную группу, соответственно, которая присоединена к атому кислорода.
Галоалкил-, галоалкенил-, галоалкокси- или галоалкенилокси-группа, как правило, представляет собой указанную алкил-, алкенил-, алкокси- или алкенилокси-группу, соответственно, которая замещена одним или более атомов галогена. Как правило, она замещена одним, двумя или тремя указанными атомами галогена. Предпочтительные галоалкил- и галоалкокси-группы включают пергалоалкил- и пергалоалкокси-группы, такие как -СХ3 и -ОСХ3, в которых Х представляет собой указанный атом галогена, например хлор и фтор.
В данном тексте С1-С4-алкилтио или С2-С4-алкенилтио- группа обычно представляет собой С1-С4-алкильную группу или С2-С4-алкенильную группу, соответственно, которая присоединена к атому серы, например -S-СН3.
В данном тексте C1-C4 гидроксиалкильная группа представляет собой С1-С4-алкильную группу, замещенную одной или более гидрокси-групп. Как правило, она замещена одной, двумя или тремя гидрокси-группами. Предпочтительно она замещена единственной гидрокси-группой.
В данном тексте С6-10-арильная группа представляет собой фенил или нафтил. Во избежание разночтений в тех случаях, когда присутствуют две арильные группы, они могут быть одинаковыми или различными.
Если не указано иное, С6-10-арильные группы могут быть незамещенными или содержать 1, 2, 3 или 4 заместителя, одинаковых или различных, которые выбирают из атомов галогена и C1-4-алкильной, С2-4-алкенильной, C1-4-алкокси-, С2-4-алкенилокси-, C1-4-галоалкильной, С2-4-галоалкенильной, C1-4-галоалкокси-, С2-4-галоалкенилокси-, гидрокси-, меркапто-, циано-, нитро-, C1-4-гидроксиалкильной, С2-4-гидроксиалкенильной, С1-4-алкилтио-, С2-4-алкенилтио- и -NR'R" - групп, в которых R' и R" одинаковы или различны и каждый из них представляет собой водород или C1-4-алкил. В тех случаях, когда заместитель арильной группы выбирают из следующих: фенил, карбоциклил, гетероциклил, гетероарил, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB и -SO2NRARB, предпочтительно, чтобы присутствовал только один такой заместитель. Предпочтительно С6-10-арильные группы незамещены или содержат от 1 до 2 заместителей, предпочтительно 1 незамещенный заместитель. Предпочтительные заместители включают C1-4-алкильную, C1-4-алкокси-, С1-4-алкилтио- и гидрокси-группы. Более предпочтительные заместители включают атомы галогенов, а также C1-4-алкильные, C1-2-алкокси- и гидрокси-группы. Более предпочтительны незамещенные арильные группы.
В данном тексте термин С3-7-карбоциклическая группа представляет собой неароматическое насыщенное углеводородное кольцо, содержащее от 3 до 7 атомов углерода. Предпочтительно, чтобы это было насыщенное или мононенасыщенное углеводородное кольцо (т.е. циклоалкильная группа или циклоалкенильная группа), содержащее от 3 до 7 атомов углерода, более предпочтительно, содержащее от 3 до 6 атомов углерода. Примерами являются циклопропил, циклобутил, циклопентил и циклогексил и их моно-ненасыщенные варианты, в частности циклопентил и циклогексил. С3-7-карбоциклическая группа или функциональная группа включает также С3-7-карбоциклические группы или функциональные группы, описанные выше, но в которых один или более атомов углерода в кольце замещены группой -С(O)-. Предпочтительно, чтобы карбоциклические группы не содержали атомов углерода в кольце, замещенных группой -С(O)-.
В данном тексте термин 5- или 6-членная гетероциклическая группа представляет собой неароматическое, ненасыщенное или насыщенное Cs-e-карбоциклическое кольцо, в котором один или более, например 1,2,3 или 4, атомов углерода замещены группой, выбранной из N, О, S, S(O) и S(O)2, и в которой один или более из оставшихся атомов углерода может быть замещен группой -С(O)- или -C(S)-. В тех случаях, когда один или более из оставшихся атомов углерода замещен группой -С(O)- или -C(S)-, предпочтительно, чтобы только один или два (более предпочтительно - два) таких атомов углерода были замещены. Подходящие гетероциклические группы включают пирролидинил, пирролинил, пирролил, тетрагидрофуранил, дигидрофуранил, фуранил, тетрагидротиофенил, дигидротиофенил, тиофенил, имидазолидинил, пиразолидинил, имидазолил, имидазолинил, пиразолил, пиразолинил, оксазолидинил, изоксазолидинил, оксазолил, оксазолинил, изоксазолил, изоксазолинил, тиазолидинил, изотиазолидинил, тиазолил, тиазолинил, изотиазолил, изотиазолинил, диоксоланил, оксатиоланил, дитиоланил и тиофенил.
Используемый в данном тексте термин "соль" включает соли, образованные добавлением основания, кислоты, а также четвертичные соли. Примеры солей включают соли, образованные основаниями, такими как гидроксиды щелочных металлов, например гидроксиды лития, натрия и калия; гидроксиды щелочноземельных металлов, например гидроксиды кальция, бария и магния; с органическими основаниями, такими как Н-метил-О-глюкамин, холин трис(гидроксиметил)амино-метан, L-аргинин, L-лизин, Н-этил пиперидин, дибензиламин и т.п.
Если не указано иное, используемый в данном тексте термин "жирная кислота" обозначает С4-26-алифатическую монокарбоновую кислоту, более предпочтительно С10-24-алифатическую монокарбоновую кислоту, более предпочтительно С14-24-алифатическую монокарбоновую кислоту. Жирные кислоты, которые являются продуктами, полученными упомянутыми в данном описании способами, предпочтительно содержат от 16 до 24 атомов углерода. Жирные кислоты имеют множество источников получения или содержания. Например, их можно получить из животных или растительных жиров, масел или восков или же они могут содержаться в этих источниках в форме эфиров. Они также могут быть получены из других, более короткоцепочечных жирных кислот согласно одному из способов по настоящему изобретению.
Жирные кислоты, которые применяются в настоящем изобретении, имеют линейные или разветвленные углеводородные цепи. Предпочтительны линейные углеводородные цепи. Углеводородные цепи также могут содержать внутри себя С3-7-карбоциклическое или от 3- до 7-членного гетероциклическое кольцо. Однако предпочтительно, чтобы углеводородные цепи не содержали карбоциклические или гетероциклические кольца. Углеводородные цепи могут также включать в свой углеродный скелет один или более, предпочтительно один, атом кислорода. Тем не менее, предпочтительно, чтобы углеводородные цепи не содержали атомы кислорода.
Используемый в данном тексте термин "эфир жирной кислоты" представляет собой эфир жирной кислоты, описанной выше. Предпочтительно эфир жирной кислоты является алкильным эфиром, содержащим алкильную группу, которая представляет собой C1-6-алкильную группу. Предпочтительные эфиры жирной кислоты, таким образом, включают эфиры формулы R-CO2R1, в которых R представляет собой остаток жирной кислоты, a R1 представляет собой C1-6-алкильную группу. Предпочтительно, чтобы R1 была незамещенной. Предпочтительно R1 представляет собой C1-4-алкильную группу, более предпочтительно метил или этил, наиболее предпочтительно - этил.
Используемый в данном тексте термин "остаток жирной кислоты" относится к углеводородному «хвосту» жирной кислоты, описанной выше. Конкретнее, остаток жирной кислоты соответствует жирной кислоте, не включающей концевую карбоксильную кислотную группу. Соответственно, жирная кислота формулы R-CO2H содержит остаток жирной кислоты R. В нижеследующем обсуждении остаток жирной кислоты будет описан со ссылкой на жирную кислоту, от которой он образован. Во избежание противоречий, указанный остаток жирной кислоты может быть также образован от эфира жирной кислоты формулы R-CO2R1, в которой R1 является алкильной группой эфира.
Предпочтительно R представляет собой остаток жирной кислоты, образованный от жирной кислоты, содержащей от 14 до 22 атомов углерода, более предпочтительно от 16 до 22 атомов углерода, наиболее предпочтительно от 18 до 20 атомов углерода.
Предпочтительно R представляет собой остаток жирной кислоты, образованный от жирной кислоты, которая полностью насыщена или содержит от 1 до 6 центров неконъюгированной ненасыщенности. Центры неконъюгированной ненасыщенности представляют собой олефиновые (-СН=СН-) и/или ацетиленовые (-С≡С-) группы, которые расположены таким образом, что их делокализованные электроны не конъюгированы с другим центром ненасыщенности. Предпочтительная жирная кислота содержит 2, 3, 4, 5 или 6, более предпочтительно 2, 3, 4 или 5, более предпочтительно 2, 3 или 4, наиболее предпочтительно 3 или 4 центров неконъюгированной ненасыщенности. Центры неконъюгированной ненасыщенности предпочтительно являются олефиновыми группами. Следует понимать, что для гидрокарбильной цепи заданной длины может существовать множество вариантов расположения неконъюгированной ненасыщенности вдоль цепи. Например, жирные кислоты, обозначаемые как ω-3 (или "Омега 3") жирные кислоты, содержат концевую углерод-углеродную двойную связь в n-3 положении, т.е. третья связь от метильного конца жирной кислоты представляет собой углерод-углеродную двойную связь. Жирные кислоты, обозначаемые как ω-6 (или "Омега 6") жирные кислоты, содержат концевую углерод-углеродную двойную связь в n-6 положении, т.е. шестая связь от метильного конца жирной кислоты представляет собой углерод-углеродную двойную связь. Предпочтительно R представляет собой остаток жирной кислоты, образованный от ω-3 или ω-6 жирной кислоты, также обозначаемый как остаток ω-3 жирных кислот или остаток ω-6 жирных кислот.
Наиболее предпочтительными группами R являются те, которые происходят от ω-3 или ω-6 жирных кислот, содержащих от 16 до 22 атомов углерода, более предпочтительно от 18 до 20 атомов углерода, и содержащих от 2 до 5, более предпочтительно от 2 до 4, наиболее предпочтительно 3 или 4, неконъюгированных олефиновых групп. Примеры остатков жирных кислот включают C17H29-остаток гамма-линоленовой кислоты, C19H29-остаток эйкозапентаеновой кислоты, C17H27-остаток стеаридоновой кислоты, C17H31-остаток линолевой кислоты и C17H29-остаток альфа-линоленовой кислоты. Предпочтительными остатками жирных кислот являются С17Н29-остаток гамма-линоленовой кислоты, С19Н29-остаток эйкозапентаеновой кислоты и С17Н27-остаток стеаридоновой кислоты. Наиболее предпочтительными остатками жирных кислот являются С17Н29-остаток гамма-линоленовой кислоты и С19Н29-остаток эйкозапентаеновой кислоты. Во избежание противоречий, структуры гамма-линоленовой кислоты, эйкозапентаеновой кислоты и стеаридоновой кислоты таковы, как показано ниже:
Жирные кислоты, которые очищают в соответствии со способом по настоящему изобретению, предпочтительно представляют собой С16-24-жирные кислоты. Их предпочтительно получают в ходе процесса наращивания цепи (например, в ходе наращивания цепи малоната) жирных кислот формулы R-CO2H, в которой R представляет собой остаток жирной кислоты, описанной выше. Соответственно, жирные кислоты, которые очищают в соответствии с настоящим изобретением, предпочтительно являются кислотами формулы R-CH2-CH2-CO2H, полученными путем наращивания цепи жирных кислот формулы R-CO2H. Предпочтительная группа R у жирных кислот формулы R-СН2-СН2-CO2H такова, как описано выше.
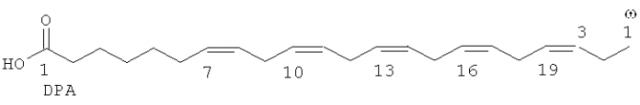
Такие жирные кислоты, которые подвергают очистке в соответствии со способом очистки по настоящему изобретению, предпочтительно представляют собой ω-3 или ω-6 жирные кислоты, содержащие от 16 до 24 атомов углерода, более предпочтительно от 20 до 22 атомов углерода, и содержащие 2, 3, 4, 5 или 6, более предпочтительно 2, 3, 4 или 5, более предпочтительно 2, 3 или 4, наиболее предпочтительно 3 или 4, неконъюгированных олефиновых групп. Примеры жирных кислот включают ω-6 жирные кислоты: дигомо-гамма-линоленовую кислоту (DGLA) и эйкозадиеновую кислоту, а также ω-3 жирные кислоты: докозапентаеновую кислоту (DPA, иногда обозначаемую как DEPA), эйкозатетраеновую кислоту (ЕТА) и эйкозатриеновую кислоту. Предпочтительной ω-6 жирной кислотой является дигомо-гамма-линоленовая кислота (DGLA). Предпочтительными ω-3 жирными кислотами являются докозапентаеновая кислота (DPA) и эйкозатетраеновая кислота (ЕТА), более предпочтительно докозапентаеновая кислота (DPA). Во избежание противоречий структуры DGLA (ω-6), DPA (ω-3) и ЕТА (ω-3) таковы, как показано ниже, причем нумерация атомов углерода включена для пояснения:
Как было описано ранее, настоящее изобретение предлагает применение соли лития для очистки жирной кислоты.
Как правило, указанная соль лития представляет собой вещество, отличное от алюмогидрида лития. Предпочтительная соль лития не является источником гидрида.
Обычно указанная жирная кислота представляет собой единственную жирную кислоту, согласно приведенному выше определению, т.е. эта жирная кислота не является смесью жирных кислот. Поэтому обычно соль лития добавляют к смеси единственной жирной кислоты и примесей не-кислотной природы. Эти примеси не-кислотной природы обычно образуются при осуществлении синтеза жирной кислоты, например такого, как раскрытый в настоящем описании. Таким образом, настоящее изобретение, как правило, не включает разделение жирных кислот между собой.
Обычно соль лития представляет собой бикарбонат лития, карбонат лития или гидроксид лития. Предпочтительно, чтобы соль лития представляла собой гидроксид лития, более предпочтительно - гидрат гидроксида лития.
Обычно указанная жирная кислота содержит от 1 до 6 центров неконъюгированной ненасыщенности, определенных в данном описании. Предпочтительная жирная кислота представляет собой ω-3 или ω-6 жирную кислоту.
Предпочтительно процесс очистки осуществляют по окончании последней из четырех стадий синтеза:
Стадия 1:
Соль лития и неочищенную жирную кислоту объединяют в первом растворе и выдерживают при условиях, позволяющих образование осадка литиевой соли жирной кислоты. Подходящие соли лития включают бикарбонат лития, карбонат лития и гидроксид лития. Предпочтительная соль лития представляет собой гидроксид лития. Соль лития может быть предоставлена в форме гидрата, например гидрата гидроксида лития. Ее можно добавлять к первому раствору в ее гидратной форме, но предпочтительно, чтобы ее сначала растворяли в подходящем растворителе, например в воде. Предпочтительно, чтобы первый раствор содержал кетон, более предпочтительно ацетон. Предпочтительная температура реакции находится в интервале от -30 до примерно 30°С.
Стадия 2:
Затем осажденную соль лития выделяют. Можно применять любой подходящий способ для выделения твердого осадка, например фильтрование. Осадок, возможно, промывают еще одним растворителем (например тем же растворителем, который используют на Стадии 1, предпочтительно ацетоном), и в любом случае растворитель выпаривают.
Стадия 3:
Выделенный осадок затем растворяют во втором растворе. Второй раствор выбирают таким образом, чтобы при растворении осадка образовывались два несмешивающихся слоя. Два несмешивающихся слоя представляют собой полярный слой, который представляет собой водный кислотный слой, и неполярный органический слой. Водный кислотный слой предпочтительно представляет собой водный раствор сильной минеральной кислоты, например хлороводородной кислоты. Подходящим неполярным органическим слоем является простой эфир. Подходящим простым эфиром для неполярного слоя является трет-бутил-метиловый эфир.
Стадия 4:
На этой стадии разделают два несмешивающихся слоя, образовавшихся при растворении осадка. Можно применять обычные методики разделения, например использовать обычную делительную воронку. После разделения двух несмешивающихся слоев получаемый органический слой можно, по желанию, промыть водой и высушить (например, с помощью Na2SO4 с последующей фильтрацией).
Стадия 5:
Растворитель удаляют из органического слоя выпариванием для того, чтобы выделить очищенную жирную кислоту. Такая очищенная жирная кислота имеет более высокую степень чистоты, по сравнению с неочищенным продуктом. Например, степень чистоты можно повысить примерно на 1% или больше, предпочтительно примерно на 2% или больше, более предпочтительно примерно на 5% или больше. Продукт, получаемый на этой стадии может быть бесцветным или окрашенным. Например, может быть получено светло-желтое масло. Этот продукт, возможно, далее обесцвечивают, применяя надлежащим образом хроматографический силикагель в подходящем растворителе. Например, обесцвечивание можно достичь путем перемешивания с 10-20% по массе хроматографического силикагеля в гексане.
Неочищенная жирная кислота, которую используют в вышеописанном процессе очистки, может иметь множество источников происхождения. Один из подходящих способов получения жирной кислоты осуществляют посредством декарбоксилирования производного малоновой кислоты. Например производное малоновой кислоты формулы RCH2CH(CO2H)2 можно декарбоксилировать с получением жирной кислоты формулы RCH2CH2CO2H. Полученную жирную кислоту формулы RCH2CH2CO2H можно затем очищать с помощью способа очистки, описанного выше.
Производное малоновой кислоты, описанное выше, может иметь несколько источников происхождения. Например, оно может быть предоставлено в кристаллической форме, выделенной и, возможно, очищенной после предыдущей стадии. Тем не менее, предпочтительно его предоставляют в виде неочищенного продукта реакции, не подвергавшегося процедуре очистки. Например, его можно получить в результате реакции сульфоната с получением производного малонового эфира, соответственно, через интермедиат эфира малоновой кислоты и последующий гидролиз.
Настоящее изобретение также предлагает способ увеличения длины жирной кислоты. В частности, этот способ можно применять для удлинения жирной кислоты на два атома углерода. Эти два атома углерода можно с хорошей эффективностью внедрить между остатком жирной кислоты R и карбоксильной кислотной группой. Данный способ наращивания включает четыре отдельных стадии:
Стадия I
Исходят из жирной кислоты формулы R-CO2H. Или же можно использовать соответствующий эфир жирной кислоты формулы R-CO2R1, в которой R представляет собой остаток жирной кислоты, а R1 представляет собой C1-6-алкильную группу. Предпочтительными группами R1 являются C1-4-алкильные группы, более предпочтительными - метил или этил, наиболее предпочтительной - этил.
Указанную жирную кислоту или эфир жирной кислоты восстанавливают с получением соответствующего спирта жирного ряда формулы R-CH2OH. Подходящие методики восстановления хорошо известны, и специалист в данной области техники легко сможет подобрать подходящие восстанавливающие агенты и условия реакции. Восстанавливающие агенты включают Red-AI (бис(2-метоксиэтокси)алюмогидрид натрия), DIBAL (гидрид диизобутилалюминия) и алюмогидрид лития. Восстанавливающие агенты применяют совместно с подходящим растворителем, причем подходящие инертные растворители включают простые эфиры и ароматические углеводороды, а также их производные. Предпочтительные растворители включают диэтиловый эфир, тетрагидрофуран и толуол. Температуру реакции можно варьировать, при этом подходящий температурный диапазон составляет от 0 до 35°С. Если исходным веществом является жирная кислота, то в процессе реакции восстановления выделяется водород. Водород следует тщательно и осторожно удалять. Использование эфира жирной кислоты в качестве исходного вещества снижает количество выделяемого водорода, поскольку образование водорода происходит только за счет разложения избытка восстанавливающего агента.
Предпочтительным восстанавливающим агентом является алюмогидрид лития. Его можно добавлять в реакцию в различных формах, например в виде твердого вещества или в растворе. Внесение в форме твердого вещества может подойти для мелкомасштабного производства. Для крупномасштабных процессов предпочтительно вводить алюмогидрид лития в растворе, что обеспечивает более удобное и безопасное обращение.
Стадия II
Спирт, полученный на стадии I, далее сульфонируют с получением сульфоната жирной кислоты формулы R-CH2OSO2R2, в которой R2 представляет собой C1-6-алкил или С6-10-арильную группу. Предпочтительно R2 представляет собой C1-6-алкил, более предпочтительно C1-4 алкил, наиболее предпочтительно метил. Если R2 представляет собой С6-10-арильную группу, данная арильная группа предпочтительно представляет собой фенил. Данные арильные группы могут быть незамещенными или замещенными, как описано ранее. Наиболее предпочтительным заместителем является метил. Подходящие сульфонирующие агенты выбирают надлежащим образом, например метансульфонил хлорид, фенилсульфонил хлорид и 4-метилфенилсульфонил хлориды являются предпочтительными сульфонирующими агентами, при этом особенно предпочтителен метансульфонил хлорид. Предпочтительно реакция протекает в присутствии четвертичного основания, такого как пиридин, 2,4,6-триметилпиридин или триэтиламин. Предпочтительная температура реакции находится примерно между 0 и 40°С.
Реакцию, возможно, проводят в подходящем растворителе. Обычно в реакциях сульфонирования такого типа используют хлорированные растворители (например, дихлорметан). Тем не менее, предпочтительно минимизировать или избегать применения хлорированных растворителей. Одним из путей, которые позволяют снизить или избежать применения хлорированного растворителя, является использование пиридина в качестве основания.
Стадия III
Сульфонат жирной кислоты, полученный в Стадии II, далее вводят в реакцию с производным малонового эфира, и ее продукт гидролизуют с получением производного малоновой кислоты формулы R-CH2CH(CO2H)2. Исходную реакцию предпочтительно проводят в безводном спирте, например в абсолютном этаноле. Предпочтительная температура реакции составляет примерно 60-90°С. Гидролиз можно проводить в любых подходящих для гидролиза условиях, например в водном спирте в присутствии гидроксидов металлов I группы. Предпочтительная температура реакции составляет примерно 15-50°С.
Подходящими производными малонового эфира являются металло-малонаты I группы, включая диалкилмалонаты натрия, NaCH(CO2R3)2, где R3 представляет собой C1-6-алкильную группу. Предпочтительно R3 представляет собой C1-4-алкильную группу, более предпочтительно - этил. Продуктом этой реакции сначала является сложный эфир формулы R-CH2CH(CO2R3)2, который далее гидролизуют с получением производного малоновой кислоты формулы R-СН2СН(CO2H)2. Реагенты и условия для гидролиза хорошо известны. Например, указанное производное малоновой кислоты может давать реакция с подходящим гидроксидом (например, гидроксидом натрия или калия).
Данное производное малоновой кислоты формулы R-СН2СН(CO2H)2, в зависимости от природы R, можно выделять и кристаллизовать. Однако некоторые производные малоновой кислоты с трудом поддаются кристаллизации или не кристаллизуются совсем. Например, производное малоновой кислоты, образованное от ЕРА или ее сложного эфира (т.е. R представляет собой Н3С-(СН2-СН=СН)5-(СН2)3-) не является легко кристаллизуемым. При таких обстоятельствах, когда процесс очистки нельзя легко осуществить с некристаллизуемым продуктом, способ очистки с применением соли лития, описанный выше, предлагает удобный способ повышения чистоты конечной жирной кислоты. Данный способ очистки с применением соли лития позволяет избежать необходимости кристаллизовать и очищать производное малоновой кислоты формулы R-CH2CH(CO2H)2, а вместо этого позволяет осуществлять очистку конечного продукта жирной кислоты. Соответственно, способ увеличения длины жирной кислоты, описанный ранее, предпочтительно задействует неочищенный продукт, получаемый на Стадии III, который используется в качестве исходного вещества для Стадии IV, без предварительной очистки продукта Стадии III.
Стадия IV
Производное малоновой кислоты, полученной на Стадии III, далее декарбоксилируют с получением жирной кислоты формулы R-CH2CH2CO2H. Можно использовать стандартные методики декарбоксилирования, с удалением выделяемого диоксида углерода (например с помощью вакуума) в ходе реакции. Например, декарбоксилирование можно осуществить простым нагреванием. Подходящие температуры нагревания могут варьироваться, но, как правило, они попадают в интервал 120-180°С, например 130-170°С, предпочтительно 140-160°С. Данную температуру следует поддерживать до тех пор, пока реакция не будет полностью завершена, что можно наблюдать по уменьшению и, в конечном счете, прекращению выделения диоксида углерода. Можно применять также вакуум, например подходящим является вакуум менее чем примерно 30 мбар.
Стадия V
Жирную кислоту, полученную на Стадии IV, далее очищают, применяя способ очистки жирной кислоты, описанный выше. Очищением с помощью этого способа удаляют не-кислотные примеси из жирной кислоты. Конечный продукт жирной кислоты имеет более высокую степень чистоты, по сравнению с жирной кислотой, полученной на Стадии IV. Степень чистоты конечной жирной кислоты может быть такой же, как у исходной жирной кислоты, используемой на Стадии I, т.е. жирной кислоты формулы R-СО2Н. Если исходная жирная кислота содержала не-кислотные примеси, то степень чистоты конечной жирной кислоты будет выше.
Примеры
Пример 1: Получение и очистка DGLA (эйкоза-8(Z), 11(Z), 14(Z)-триеновой кислоты)
Пример 1а: получение GL-спирта (октадека-6(Z), 9(Z), 12(Z)-триенол)
Для осушения свежего тетрагидрофурана (12000 частей, об.) в атмосфере азота добавляют алюмогидрид лития в тетрагидрофуране (2.4 М, 1620 частей, об.). Смесь охлаждают до 0-5°С и добавляют GLA (гамма-линоленовую кислоту, 95-98%, 1112 частей, вес.) в сухом тетрагидрофуране (2000 частей, об.) в течение 30-40 мин, поддерживая температуру около 3-7°С, при перемешивании и в токе азота. Затем смесь перемешивают при 8-12°С в течение 1 ч и при 12-18°С в течение 2 ч в атмосфере азота. После охлаждения до 3-5°С добавляют раствор воды (152 частей, об.) в тетрагидрофуране (500 частей, об.) под сильным током азота в течение 15-20 мин. Затем добавляют водный раствор гидроксида натрия (2 М, 456 частей, об.) в течение 10-15 мин. Смесь перемешивают при 10-15°С в укупоренном сосуде в атмосфере азота в течение ночи и затем добавляют безводный сульфат натрия (500 частей, вес.) и смесь перемешивают еще в течение 30 мин. После фильтрации неорганические твердые вещества промывают с помощью тетрагидрофурана (2000 частей, об.). Конечный раствор THF выпаривают под вакуумом. Малейшие примеси воды в продукте удаляют путем выпаривания совместно с 2×2000 частями (об.) толуола. Получают GL-спирт (1029 частей, вес., 97,4%) в виде светло-желтого масла.
Пример 1b: получение метан сульфоната GL-спирта (октадека-6(Z), 9(Z), 12(Z)-триенил метан сульфонат)
К перемешанной смеси GL-спирта (1000 частей, вес.) и метансульфонил хлорида (456 частей, вес.) в атмосфере азота, при 8-12°С добавляют сухой пиридин (307 частей, вес.) в течение 30-40 мин, поддерживая температуру не выше 15°С. Смесь перемешивают при этой температуре в течение 3-5 ч и затем дают нагреться до комнатной температуры и перемешивают в течение 24-48 ч. В смеси происходит осаждение гидрохлорида пиридина. Реакционную смесь затем разводят в гексане (4000 частей, об.), добавляют безводный сульфат натрия (200 частей, вес.) и полученную смесь перемешивают в течение 1 ч. Осажденные твердые вещества отфильтровывают и промывают гексаном. Гексан удаляют из фильтрата в вакууме с образованием неочищенного метан сульфоната (~1300 частей, вес.), который можно использовать для следующей стадии.
Альтернативный способ очистки (дающий более чистый продукт и менее окрашенный конечный продукт на последующих стадиях) описан далее. Реакционную смесь разводят в трет-бутил-метиловом эфире (4000 частей, об.) и охлаждают до 5-10°С. Добавляют воду (2000 частей, об.) при перемешивании, в атмосфере азота, и pH водного слоя доводят до 1-2 с помощью концентрированной хлороводородной кислоты. Через 15 мин слои разделяют, водный слой экстрагируют трет-бутил-метиловым эфиром (500 частей, об.). Объединенные органические слои затем промывают с помощью 1М хлороводородной кислоты (1000 частей, об.) и воды (4×500 частей, об.). Органический слой сушат (безводный сульфат натрия, 300 частей, вес.), фильтруют и выпаривают в вакууме с образованием более чистого метан сульфоната для использования на следующей стадии.
Пример 1с: получение 2-карбокси DGLA (2-карбокси-изокса-8(Z), 11(Z), 14(Z)-триеновой кислоты)
К абсолютному этанолу (10000 частей, об.) добавляют метоксид натрия 30% вес/об, в метаноле (1370 частей, об.). Добавляют диэтилмалонат (1520 частей, вес.) при комнатной температуре в атмосфере азота, в сильном токе, в течение 10-15 мин, и смесь перемешивают еще в течение 10-15 мин. Добавляют неочищенный метан сульфонат GL-спирта (1300 частей) в сильном токе в течение 10-15 мин и смесь перемешивают и нагревают с помощью обратного холодильника в течение 3,5-4,0 ч в атмосфере азота. После охлаждения до комнатной температуры добавляют в атмосфере азота раствор, приготовленный путем растворения гидроксида калия 85% (1900 частей, вес.) в воде (1000 частей, об.) и последующего добавления 95% этанола (13000 частей, об.). Происходит выделение тепла, температура реакции достигает 30-40°С. Смесь перемешивают при комнатной температуре в течение 4-5 ч в атмосфере азота. Суммарную ре