Пара синтетических олигонуклеотидных праймеров для выявления вируса иммунодефицита кошек и способ диагностики вирусного иммунодефицита кошек
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к паре синтетических олигонуклеотидных праймеров, применяемых для выделения ДНК провируса и РНК вируса иммунодефицита кошек, и к способу диагностики вирусного иммунодефицита кошек с использованием данных праймеров. Пара праймеров имеет следующую структуру - PF: 5′-TGGAGAAGGGAATTTCAGATGGG-3′ и PR: 5′-TTTGGGTCAAGTGCTACATATTGTGG-3′. Способ включает проведение ПЦР с детекцией полученных результатов методом горизонтального электрофореза в 1,5%-ном агарозном геле. Амплификацию проводят в следующем режиме: тотальная денатурация при 95°С в течение 5 мин, цикл денатурация при 95°С в течение 20 или 60 сек, отжиг при 56°С в течение 20 или 60 сек, элонгация при 72°С в течение 40 или 60 сек. Цикл денатурация - отжиг - элонгация повторяется 35 раз. Проводят заключительную элонгацию при 72°С в течение 5 мин. В случае наличия амплифицируемого фрагмента нуклеотидной последовательности длиной 366 п.н. судят о наличии FIV в организме кошки. Предложенное изобретение позволяет провести диагностику вирусного иммунодефицита кошек с высокой эффективностью. 2 н.п. ф-лы, 6 ил., 3 табл., 3 пр.
Реферат
Изобретение относится к области биотехнологии, молекулярной биологии, молекулярно-генетической диагностики вирусных болезней животных и может быть использовано в научных исследованиях для обнаружения рибонуклеиновой кислоты (РНК) вируса и дезоксирибонуклеиновой кислоты (ДНК) провируса иммунодефицита кошек методом полимеразной цепной реакции (ПЦР) в пробах слюны и крови животных.
Известен способ определения антител к FIV (feline immunodeficiency virus) в крови животных с применением хроматографических стрипов, основанный на специфическом взаимодействии антиген-антитело и выявлении образовавшегося комплекса с помощью окрашивания его наночастицами (J Feline Med Surg. 2013 Dec; 15(12):1063-9. doi: 10.1177/1098612X13488384. Epub 2013 May 10.Prevalence and risk factor analysis of feline haemoplasma infection in New Zealand domestic cats using a real-time PCR assay. Jenkins KS, Dittmer KE, Marshall JC, Tasker S).
Недостатком метода является низкая чувствительность, так как при незначительной виремии и угнетении иммунной системы титр антител ниже диагностического.
Известен способ определения антител к FIV в крови кошек методом ИФА (иммуноферментный анализ), основанный на обнаружении специфического комплекса антиген-антитело с помощью цветной реакции вследствие ферментирования субстрата энзимом, связанным с конъюгатом (JFelineMedSurg. 2013 Aug; 15(8):725-9. doi: 10.1177/1098612X13475465. Epub 2013 Jan 29. Preliminary evaluation of a quantitative polymerase chain reaction assay for diagnosis of feline immunodeficiency virus infection. Ammersbach M, Little S, Bienzle D).
Недостатком метода является невысокая информативность в случае обследования вакцинированного животного (ложноположительные результаты) и на ранних этапах заражения, когда в крови недостаточно высокий уровень антител (ложноотрицательные результаты).
Известен способ обнаружения антигена FIV в биологическом материале от кошек методом Real-Time PCR (полимеразная цепная реакция с детекцией в режиме реального времени), основанный на многократном копировании (амплификации) специфического участка генома вируса с последующей детекцией продуктов амплификации с помощью зондов, меченных флюорохромом (JFelineMedSurg. 2013 Dec; 15(12):1070-8. doi: 10.1177/1098612X13491959. Epub 2013 Jun 5. Adoor-to-doorprevalencestudy of feline immunodeficiency virus in an Australian suburb. Chang-Fung-Martel L Gummow B, Burgess G, Fenton E, Squires R).
Недостатком метода является высокая стоимость анализа и невозможность проведения его в рядовой ветеринарной лаборатории.
Наиболее близким к заявленному изобретению являются праймеры; способ их применения в полимеразной цепной реакции, описанные в патенте RU №2317329 от 04.05.2005, опубликованном 20.12.2008 г.: «Пара синтетических олигонуклеотидов - праймеров, используемых для выявления ДНК провируса лейкоза кошек эндогенного и экзогенного типа и условия полимеразной цепной реакции с их использованием», в котором с помощью компьютерных программ путем анализа структуры вируса, выбора консервативного участка вирусного генома подбирают оптимальную пару праймеров, у которых отсутствуют самокоплементарные участки внутри каждого праймера и между прямым и обратным, а затем используют эти праймеры для проведения ПЦР в объеме 25 мкл на одну пробу с детекцией полученных результатов методом горизонтального электрофореза в 1,5%-ном агарозном геле.
К недостаткам следует отнести невозможность выявления вируса иммунодефицита кошек с использованием описанных в патенте пары праймеров из-за неспецифичности их структуры для FIV, а условия полимеразной цепной реакции и состав реакционной смеси не могут быть использованы для обнаружения вируса иммунодефицита кошек.
Технической задачей является разработка эффективного и недорогого способа обнаружения ДНК провируса и РЖ вируса иммунодефицита кошек методом ПЦР путем конструирования двух специфических олигонуклеотидных праймеров и подбора условий для проведения ПЦР с ними.
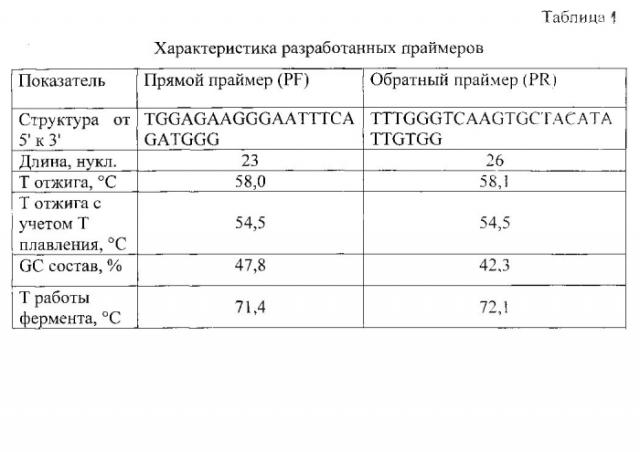
Решение технической задачи достигается подбором пары синтетических олигонуклеотидных праймеров, применяемых для выделения ДНК провируса и РНК вируса иммунодефицита кошек, которые получены с помощью компьютерных программ путем анализа структуры вируса, выбора консервативного участка вирусного генома, подбора оптимальной пары праймеров, у которых отсутствуют самокоплементарные участки внутри каждого праймера и между прямым и обратным. Подобранная пара праймеров имеет температуру отжига 56°С для обоих олигонуклеотидов, GC состав 47,8% для PF и 42,3% для PR и следующую структуру - PF: 5′-TGGAGAAGGGAATTTCAGATGGG-3′ и PR: 5′-TTTGGGTCAAGTGCTACATATTGTGG-3′.
Способ диагностики вирусного иммунодефицита кошек заключается в проведении ПЦР в объеме 25 мкл на одну пробу с использованием пары подобранных синтетических олигонуклеотидных праймеров и детекции полученных результатов методом горизонтального электрофореза в 1,5%-ном агарозном геле. Реакционная смесь готовится путем смешения буфера 10-кратного для ПЦР - 2,5 мкл, дНТФ (25 мМ) - 0,2 мкл, праймера PF (10 пмоль/мкл) - 1 мкл, праймера PR (10 пмоль/мкл) - 1 мкл, Taq полимеразы (5 ед./мкл) - 0,2 мкл, MgCl2 (50 мМ) - 1 мкл, бидистиллированной воды - 14,1 мкл и пробы ДНК - 5 мкл. При этом амплификацию проводят в следующем режиме: тотальная денатурация 95°С - 5 мин, цикл денатурация (95°С - 20 или 60 сек) - отжиг (56°С - 20 или 60 сек) - элонгация (72°С - 40 или 60 сек), причем цикл денатурация - отжиг - элонгация повторяется 35 раз, заключительная элонгация 72°С - 5 мин и хранение 4°С - 10 мин. По наличию или отсутствию амплифицируемого фрагмента нуклеотидной последовательности длиной 366 п.н. судят о наличии или отсутствии FIV в организме кошки.
На фигуре 1 представлены генетические модификации вируса иммунодефицита кошек, где видны наиболее вариабельные и консервативные участки генома.
На фигуре 2 представлена структура референтного штамма Feline immunodeficiency virus, с указанием размера генома и его основных фрагментов, размещенная на web-ресурсе Национального центра биотехнологической информации - NCBI (https://www.ncbi.nlm.nih.gov/genome/?term=FIV).
На фигуре 3 представлена электрофореграмма результатов исследования крови FIV - позитивных кошек методом ГЩР с использованием разработанных праймеров для определении размера амплифицируемого фрагмента. Пробы 1 и 2 являются положительными, так как содержат ампликоны, электрофоретическая подвижность которых соответствует длине фрагмента 366 п.н. В треке K- (отрицательный контроль) подобный фрагмент отсутствует.
На фигуре 4 представлена электрофореграмма результатов определения чувствительности разработанных праймеров. При исследовании крови чувствительность метода составила 10-4, при исследовании слюны - 10-3, о чем свидетельствуют полосы на уровне K+ (положительный контроль) в треках, при отсутствии подобной полосы в K-.
На фигуре 5 представлена электрофореграмма результатов определения специфичности разработанных праймеров. Положительный результат в ПЦР получали только с образцами ДНК, содержащими FIV, при отсутствии продукта амплификации с другими пробами, о чем свидетельствуют полосы на уровне K+ (положительный контроль) в треке FIV, при отсутствии подобных полос в треках FeLV, BLV, BIV и K-.
На фигуре 6 представлена электрофореграмма результатов исследования различного биологического материала от кошек с применением разработанных праймеров. Пробы 3, 4, 5, 17, 18 - положительные, так как содержат полосы в треках уровне K+ при отсутствии подобной полосы в K-.
Вирусный иммунодефицит кошек - заразная, хронически протекающая, неизлечимая болезнь, приводящая к нарушению функции иммунной системы, развитию синдрома приобретенного иммунодефицита (СПИДа) и заканчивающаяся летально.
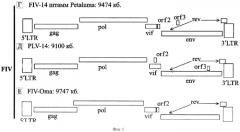
Возбудитель болезни - Feline immunodeficiency virus относят к семейству Retroviridae, подсемейству Orthoretrovirinae, роду Lent/virus, группе Feline lentivirus. Внутри группы различают 5 генотипов вида Feline immunodeficiency virus: А, В, С, D и Е. [Olmsted R.A.et all, 1989]. Наиболее часто встречается подтип Е, а также А и В. Кроме того, в природных популяциях выявлены несколько интер-подтипов FIV-рекомбинантов: А/В, А/С и B/D. Разделение на подтипы осуществляется на основании анализа модификаций структуры гена env [Martins AN et all, 2008] (Фиг. 1).
FIV имеет три основных структурных гена, кодирующих вирусные протеины в следующем порядке: 5′-gag-pol-env-3′: gag (group specificanti gen. - кодируют белки сердцевины), pol (кодируют обратную транскрип тазу - polymerase) и env (кодируют белки оболочки - envelope). Вирусный геном содержит донорный сайт вблизи гена gag и акцепторный перед геном env. FIV несут два добавочных гена: ген dUТРазы, расположенный в пределах гена pol (ответственен за предотвращение ошибочного включения урацила в молекулу РНК-вируса во время его репликации и, соответственно, его аттенуации). Вторая открытая рамка считывания, обозначенная как orf-A или orf-2, кодирует протеин, состоящий из 77 аминокислот, который является критическим на ранней стадии инфицирования клетки и при формировании вирусной частицы. Нарушение функции белка Orf-A ведет к снижению способности вируса к репликации и уменьшению его патогенности [В. Филдс. Вирусология. Т. 1. М.: Мир, 1989. - 492 с.].
Схема жизненного цикла вируса включает: связывание вириона с рецептором клетки хозяина, вход в клетку, обратное транскрибирование с образованием кДНК интеграцию в геном хозяина (формирование провируса). [Супотницкий М.В. Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. - Москва: Вузовская книга, 2009. - 400 с.].
Вирус является лимфо-нейротропным, инфицирование приводит глубокой к иммуносупрессии, проявляющейся в развитии вторичных инфекций и опухолевых процессов. Животное всю жизнь находится на поддерживающей терапии.
Полимеразная цепная реакция, которая является прямым высокочувствительным и высокоспецифичным молекулярно-биологическим методом, способна идентифицировать фрагменты провирусной ДНК и вирусной РНК (после проведения обратной транскрипции) FIV в лимфоцитах периферической крови и в слюне кошек и заключается в многократном увеличении копий специфичного участка ДНК выявляемого вируса с помощью фермента ДНК-полимеразы. Праймеры фланкируют искомый участок, присоединяясь по принципу комплементарности на денатурированную ДНК, и ориентированы таким образом (прямой и обратный), что элонгация новой цепи ДНК проходит только между ними. Основными параметрами эффективного прохождения реакции амплификации, обеспечивающими специфичность и чувствительность, являются правильный выбор области генома идентифицируемого агента, структура и температурный режим отжига олигонуклеотидных праймеров.
Конструирование пары синтетических олигонуклеотидных праймеров, применяемых для выделения ДНК провируса и РНК вируса иммунодефицита кошек, и разработка способа диагностики вирусного иммунодефицита кошек с их использованием осуществлялись в семь этапов:
- анализ структуры генома FIV;
- конструирование праймеров;
- подбор оптимальной пары праймеров;
- моделирование состава реакционной смеси способа диагностики вирусного иммунодефицита кошек с использованием разработанной пары праймеров;
- отработка условий способа диагностики вирусного иммунодефицита кошек с использованием разработанной пары праймеров;
- определение чувствительности способа диагностики вирусного иммунодефицита кошек с использованием разработанной пары праймеров;
- определение специфичности способа диагностики вирусного иммунодефицита кошек с использованием разработанной пары праймеров.
1. Анализ структуры генома FIV. С помощью компьютерной программы Vector NTI 11 (Invitrogen, США) проводит анализ структуры генома референтного штамма Feline immunodeficiency virus (фиг. 2) и фрагментов генома FIV, размещенных на web-ресурсе NCBI, с целью выявления наиболее консервативного участка.
2. Конструирование праймеров. С помощью компьютерной программы GENERUNR, геном вируса в формате FASTA применяли для подбора праймеров на участке гена gag (с 628 по 1980 п.н.), который является наиболее консервативным для всех вариантов FIV (фиг. 1).
3. Подбор оптимальной пары праймеров. Проверку качества и термодинамический анализ выбранных праймеров выполняли с помощью программы OLIGO DNA/RNA primer analysis software, v.5.0. При дизайне праймеров основными требованиями были: степень гомологии (комплементарность) с выбранным участком гена; отсутствие самокоплементарных участков внутри праймеров и комплементарности друг другу, чтобы не допускать возникновения устойчивых вторичных структур (димеров); близость значений температуры отжига и плавления праймеров.
На основании проведенного компьютерного анализа была подобрана пара праймеров, характеристика которых приведена в таблице 1.
Подобранная пара олигонуклеотидных праймеров имеет оптимальные размер (23-26 п.н.), структуру (отсутствие само- и взаимокомплементарности) и GC состав (42-47%), среднюю температуру отжига для обоих праймеров 56°С, температуру работы фермента 72°С.
Синтез разработанных олигонуклеотидных праймеров заказывают в коммерческой организации.
4. Моделирование состава реакционной смеси способа диагностики вирусного иммунодефицита кошек с использованием разработанной пары праймеров. Нуклеиновые кислоты (НК) из биологического материала от кошек выделяли методом нуклеосорбции на силикогеле с использованием наборов «ДНК-сорб-В» и «РИБО-сорб» (ИнтерЛабСервис, Россия). Получение кДНК на матрице РНК, выделенной из слюны животных, осуществляли с применением набора реагентов «РЕВЕРТА-L» (ИнтрЛабСервис). ПЦР проводили в объеме реакционной смеси - 25 мкл на 1 пробу. Состав реакционной смеси представлен в таблице 2.
Состав реакционной смеси подбирали таким образом, чтобы концентрация ионов MgCl2 была в пределах 1,5-4 мМ, что обеспечивает оптимальную скорость и точность работы фермента Taq-полимеразы, концентрация дНТФ - не более 0,4 мМ, концентрация праймеров - 10 пмоль/мкл и объем пробы - 5 мкл, что способствует повышению специфичности реакции. При использовании амплификатора с крышкой без нагрева на смесь наслаивают 20 мкл минерального масла для ПЦР. При использовании амплификатора с нагревающейся крышкой минеральное масло не используется.
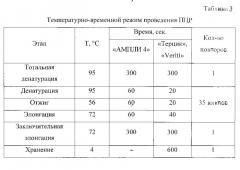
5. Отработка условий способа диагностики вирусного иммунодефицита кошек с использованием разработанной пары праймеров. Отработку условий ПЦР с использованием разработанных праймеров осуществляли па амплификаторах «АМПЛИ 4» и «Терцик», «Veriti» (США). Температурно-временной режим проведения реакции для амплификаторов представлен в таблице 3.
Для амплификаторов с активным регулированием температуры по раствору в пробирке («Терцик», «Veriti») время прохождения всех этапов амплификации (денатурация - отжиг - элонгация) короче, чем для амплификатора с матричным регулированием температуры («АМПЛИ 4)»).
Учет осуществляли методом горизонтального гельэлектрофореза в 1,5% агарозном геле с добавлением бромистого этидия в качестве интерколирующего красителя для ДНК. Результат учитывали на оборудовании фирмы BioRad (США). Для определения размера ампликонов после проведения ПЦР с разработанными праймерами, использовали маркер молекулярных масс "1 kb DNA ladder" («Stratagene», США) (фиг. 3). В электрофоретической дорожке проб 1 и 2 присутствует светящаяся полоса. Ее электрофоретическая подвижность соответствует длине ампликона 366 п.н. В электрофоретической дорожке, соответствующей отрицательному контролю (K-), такая полоса отсутствует.
6. Определение чувствительности способа диагностики вирусного, иммунодефицита кошек с использованием разработанной пары праймеров. Положительные пробы биоматериала использовали в качестве позитивного контроля при определении чувствительности метода. Из очищенных проб (кровь, слюна) готовили десятикратные разведения, которые исследовали методом ПЦР с применением разработанных специфических олигонуклеотидных праймеров. Последним разведением, в котором обнаруживалась специфическая полоса на электрофореграмме при исследовании крови, считалось разведение 10-4, при исследовании слюны - 10-3 (фиг. 4).
7. Определение специфичности способа диагностики вирусного иммунодефицита кошек с использованием разработанной пары праймеров. Специфичность проверяли на образцах провирусной ДНК FIV, FeLV (вирус лейкемии кошек), BIV (вирус иммунодефицита КРС), BLV (вирус энзоотического лейкоза КРС), являющихся близкородственными ретровирусами, а также образцах от интактных и серонегативных кошек. Положительный результат в ПЦР получали только с образцами ДНК, содержащими FIV, при отсутствии продукта амплификации с другими пробами (Фиг. 5).
Пример 1. Применение реакции амплификации для выявления ДНК провируса иммунодефицита кошек с использованием разработанных специфических олигонуклеотидных праймеров при исследовании периферической крови животных. Для анализа методом ПНР были взяты пробы периферической крови от кошек, серопозитивных при исследовании на антитела к FIV методом ИХА, показавших присутствие вируса при исследовании методом Real-Time PCR и имеющих клинические проявления СПИДа. В процессе ПЦР были получены продукты амплификации на матрице ДНК провируса иммунодефицита кошек длиной 366 п.н. Это свидетельствует о воспроизводимости результатов проведенных опытов.
Пример 2. Применение реакции амплификации для выявления РНК вируса иммунодефицита кошек с использованием разработанных специфических олигонуклеотидных праймеров при исследовании слюны животных. Для анализа методом ПНР были взяты пробы слюны от кошек, показавших наличие ДНК провируса иммунодефицита кошек в периферической крови методом ПЦР. В процессе ПЦР были получены продукты амплификации на матрице кДНК вируса иммунодефицита кошек длиной 366 п.н. Это свидетельствует о воспроизводимости результатов проведенных опытов.
Пример 3. Применение реакции амплификации для выявления провирусной ДНК и вирусной РНК возбудителя вирусного иммунодефицита кошек с использованием разработанных специфических олигонуклеотидных праймеров при исследовании биологического материала от кошек. Для анализа методом ПЦР были взяты пробы слюны и периферической крови от разных кошек, принадлежащих частным владельцам и обратившимся за ветеринарной помощью в УНИЦ «Ветеринарный госпиталь» ФГБОУ ВПО «Саратовский ГАУ». В процессе ПЦР были получены продукты амплификации длиной 366 п.н. (фиг. 6). Это свидетельствует о воспроизводимости результатов проведенных опытов.
Предложенный способ позволяет детектировать на ранних стадиях высококонсервативную область гена gag вируса иммунодефицита кошек. Выбор высококонсервативной области гена gag, общей для всех генетических вариантов FIV, позволяет повысить чувствительность способа диагностики иммунодефицита кошек, выявлять животных, инфицированных любым типом вируса. Проведение обратной транскрипции позволяет выявлять вирусную РНК возбудителя ВИК в слюне животных. Использование предлагаемой модификации ПЦР позволяет значительно снизить себестоимость анализа, что важно для владельцев животных, и делает его доступным для рядовой ветеринарной лаборатории.
Техническим результатом, на достижение которого направлено данное изобретение, является доступный по стоимости, достоверный, высокочувствительный и высокоспецифичный способ выявления фрагмента провирусной ДНК и РНК вируса иммунодефицита кошек в биологическом материале в короткие сроки.
Предложенный способ апробирован с положительными результатами и регулярной воспроизводимостью этих результатов в 2014 году на 17 пробах ДНК и 17 пробах РНК, полученных из крови и слюны кошек, принадлежащих частным владельцам и обращавшимся в УНИЦ «Ветеринарный госпиталь» ФГБОУ ВПО «Саратовский ГАУ». Работу проводили на базе межкафедральной учебно-научно-исследовательской лаборатории «Геном» ФГБОУ ВПО «Саратовский ГАУ» и ФКУЗ РосНИПЧИ «Микроб» (г. Саратов).
1. Пара синтетических олигонуклеотидных праймеров, применяемых для выделения ДНК провируса и РНК вируса иммунодефицита кошек, полученных с помощью компьютерных программ, анализа структуры вируса, выбора консервативного участка вирусного генома, подбора оптимальной пары праймеров, у которых отсутствуют самокоплементарные участки внутри каждого праймера и между прямым и обратным, которые отличаются тем, что имеют температуру отжига - 56°C для обоих олигонуклеотидов, GС состав - 47,8% для РF и 42,3% для PR и следующую структуру - и .
2. Способ диагностики вирусного иммунодефицита кошек с использованием пары синтетических олигонуклеотидных праймеров, заключающийся в проведении ПЦР в объеме 25 мкл на одну пробу с детекцией полученных результатов методом горизонтального электрофореза в 1,5%-ном агарозном геле, отличающийся тем, что реакционная смесь готовится путем смешения буфера 10-кратного для ПЦР - 2,5 мкл, дНТФ (25 мМ) - 0,2 мкл, праймера PF (10 пмоль/мкл) - 1 мкл, праймера PR (10 пмоль/мкл) - 1 мкл, Taq полимеразы (5 ед./мкл) - 0,2 мкл, MgCl2 (50 мМ) - 1 мкл, бидистиллированной воды - 14,1 мкл и пробы ДНК - 5 мкл, при этом амплификацию проводят в следующем режиме: тотальная денатурация 95°C - 5 мин, цикл денатурация (95°C - 20 или 60 сек) - отжиг (56°C - 20 или 60 сек) - элонгация (72°C - 40 или 60 сек), причем цикл денатурация - отжиг - элонгация повторяется 35 раз, заключительная элонгация 72°C - 5 мин, хранение 4°C - 10 мин, а по наличию или отсутствию амплифицируемого фрагмента нуклеотидной последовательности длиной 366 п.н. судят о наличии или отсутствии FIV в организме кошки.