Способ получения популяции клеток, экспрессирующих маркеры плюрипотентности и маркеры, характерные для линии сформированной эндодермы
Иллюстрации
Показать всеНастоящее изобретение касается способа получения популяции клеток, экспрессирующих маркеры плюрипотентности и маркеры, характерные для линии сформированной эндодермы. Представленный способ предусматривает следующие стадии (а) получение популяции клеток, экспрессирующих маркеры HNF-3β, GATA-4, Mixl1, CXCR4, и SOX-17, характерные для линии сформированной эндодермы, и (b) культивирование популяции клеток в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся перед культивированием предварительной обработке белком или экстраклеточным матриксом, в среде с добавлением активина А и лиганда Wnt и IGF-1 или инсулина, трансферрина и селена, где культивируемые клетки экспрессируют маркеры линии сформированной эндодермы и маркеры плюрипотентности. Охарактеризованное изобретение позволяет получать клетки, способные культивироваться в условиях гипоксии, не требующие линий питающих клеток, покрытий из сложных белков матрикса и сохраняющие потенциал дифференцировки. 15 з.п. ф-лы, 39 ил., 9 табл., 32 пр.
Реферат
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к плюрипотентным стволовым клеткам, которые легко выращиваются в культуре в полистироловой посуде для культивирования тканей и не требуют линии питающих клеток. В настоящем изобретении также предлагаются способы производства линии плюрипотентных стволовых клеток из эмбриональных стволовых клеток человека.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Достижения в области клеточной заместительной терапии сахарного диабета 1-го типа и нехватка трансплантируемых островков Лангерганса заставили обратить внимание на разработку источников инсулинпродуцирующих клеток, или β-клеток, подходящих для трансплантации. Одним из подходов является формирование функциональных β-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных, плюрипотентные стволовые клетки дают начало группе клеток, формирующих три зародышевых листка (эктодерму, мезодерму и эндодерму) в ходе процесса, именуемого гаструляцией. Ткани, из которых состоят, например, щитовидная железа, тимус, поджелудочная железа, кишечник и печень, будут развиваться из эндодермы через промежуточную стадию. Промежуточной стадией данного процесса является образование сформированной эндодермы. Клетки сформированной эндодермы экспрессируют ряд маркеров, таких как HNF-3 beta, GATA-4, Mixl1, CXCR4 и SOX-17.
Формирование поджелудочной железы происходит при дифференцировке сформированной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют ген панкреатическо-дуоденального гомеобокса, PDX-1. При отсутствии PDX-1 развитие поджелудочной железы не идет дальше формирования вентрального и дорзального зачатков. Следовательно, экспрессия PDX-1 является важным этапом органогенеза поджелудочной железы. Зрелая поджелудочная железа содержит, среди других типов клеток, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани образуются при дифференцировке панкреатической эндодермы.
Клетки, обладающие свойствами островковых клеток, как сообщалось, были получены из эмбриональных клеток мыши. Например, в публикации Lumelsky et al. (Science 292:1389, 2001) сообщается о дифференцировке мышиных эмбриональных стволовых клеток в инсулин-секретирующие структуры, сходные с островками поджелудочной железы. Soria et al. (Diabetes 49:157, 2000) сообщают, что инсулин-секретирующие клетки, полученные из мышиных эмбриональных стволовых клеток, нормализовали гликемию у мышей с диабетом, вызванным стрептозотоцином.
В одном примере, в публикации Hori et al. (PNAS 99: 16105, 2002) описывается, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид 3-киназы (LY294002) приводила к образованию клеток, сходных с β-клетками.
В другом примере, Blyszczuk et al. (PNAS 100:998, 2003) сообщается о получении инсулин-продуцирующих клеток из мышиных эмбриональных стволовых клеток с конститутивной экспрессией Pax4.
Micallef et al. сообщают, что ретиноевая кислота может регулировать способность эмбриональных стволовых клеток формировать PDX-1-положительную панкреатическую эндодерму. Ретиноевая кислота с наибольшей эффективностью индуцирует экспрессию PDX-1 при добавлении в культуру на 4 день дифференцировки эмбриональных стволовых клеток в течение периода, соответствующего концу гаструляции эмбриона (Diabetes 54:301, 2005).
В публикации Miyazaki et al. сообщается о линии мышиных эмбриональных стволовых клеток со сверхэкспрессией PDX-1. Эти результаты показывают, что экспрессия экзогенного PDX-1, очевидно, повышает экспрессию генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, P48, Pax6 и HNF6 в образующихся дифференцированных клетках (Diabetes 53: 1030, 2004).
В публикации Skoudy et al. сообщается, что активин-A (входящий в суперсемейство TGFβ) повышает экспрессию экзокринных панкреатических генов (p48 и амилаза) и эндокринных генов (PDX-1, инсулин и глюкагон) в эмбриональных стволовых клетках мыши. Максимальный эффект наблюдался при использовании активина-A в концентрации 1 нМ. Также эти авторы наблюдали, что на уровень экспрессии мРНК инсулина и PDX-1 не влияла ретиноевая кислота; однако обработка раствором FGF-7 с концентрацией 3 нМ приводила к повышению уровня транскрипта PDX-1 (Biochem. J. 379: 749, 2004).
В работе Shiraki et al. изучались эффекты ростовых факторов, специфически ускоряющих дифференцировку эмбриональных стволовых клеток в PDX-1-положительные клетки. Эти авторы наблюдали, что TGFβ2 приводил к воспроизводимому увеличению доли PDX-1-положительных клеток (Genes Cells. 2005 Jun; 10(6): 503-16.).
В публикации Gordon et al. продемонстрирована индукция образования эндодермальных клеток brachyury+/HNF-3 beta+ из эмбриональных стволовых клеток мыши в отсутствии сыворотки и в присутствии активина в сочетании с ингибитором сигнального пути Wnt (US2006/0003446A1).
В публикации Gordon et al. (PNAS, Vol 103, page 16806, 2006) говорится: “Для образования передней первичной полоски требовались, одновременно, сигнальные пути Wnt и TGF-beta/nodal/активин”.
Однако модель развития эмбриональных стволовых клеток на мышах может не имитировать в точности программу развития у высших млекопитающих, как, например, у человека.
Thomson et al. выделяли эмбриональные стволовые клетки из человеческих бластоцист (Science 282:114, 1998). Параллельно, Gearhart и соавторы получили клеточные линии человеческих эмбриональных зародышевых клеток (чЭЗ) из ткани половых желез эмбриона (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от эмбриональных стволовых клеток мыши, воспрепятствовать дифференцировке которых можно путем простого культивирования с фактором торможения лейкемии (Leukemia Inhibitory Factor, LIF), человеческие эмбриональные стволовые клетки должны культивироваться в очень специфических условиях (США, патенты № 6200806; WO 99/20741; WO 01/51616).
D'Amour et al. описывают производство обогащенных культур сформированной эндодермы, производной от человеческих эмбриональных стволовых клеток, в присутствии высокой концентрации активина и низкой концентрации сыворотки (D'Amour KA et al. 2005). Трансплантация этих клеток под почечную капсулу мышей приводит к их дифференцировке в более зрелые клетки, обладающие характерными особенностями некоторых эндодермальных органов. Клетки сформированной эндодермы, производные от человеческих эмбриональных стволовых клеток, могут подвергаться дальнейшей дифференцировке в PDX-1-положительные клетки после добавления FGF-10 (US 2005/0266554A1).
В публикации D'Amour et al. (Nature Biotechnology - 24, 1392-1401 (2006)) говорится: “Мы разработали процесс дифференцировки, преобразующий человеческие эмбриональные стволовые клетки (чЭС) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы, инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Данный процесс имитирует органогенез поджелудочной железы in vivo, проводя клетки через фазы, напоминающие образование сформированной эндодермы, эндодермы кишечной трубки, панкреатической эндодермы и превращение предшественников эндокринных клеток в клетки, экспрессирующие эндокринные гормоны”.
В другом примере, Fisk et al. сообщают о системе для производства островковых клеток поджелудочной железы из человеческих эмбриональных стволовых клеток (заявка на патент US2006/0040387A1). В данном случае процесс дифференцировки был разделен на три стадии. Сначала человеческие эмбриональные стволовые клетки были дифференцированы до эндодермы с помощью сочетания н-бутирата и активина-А. Далее клетки культивировались с антагонистами TGFß, такими как Noggin, в сочетании с EGF или бетацеллюлином с получением PDX-1-положительных клеток. Окончательная дифференцировка запускалась никотинамидом.
В одном примере, Benvenistry et al. сообщают: “Мы сделали вывод, что сверхэкспрессия PDX-1 увеличивала экспрессию панкреатических обогащенных генов, а для индукции экспрессии инсулина могут потребоваться дополнительные сигналы, присутствующие только in vivo” (Benvenistry et al, Stem Cells 2006; 24:1923-1930).
Имеющиеся способы культивирования человеческих эмбриональных стволовых клеток требуют применения или белков экстраклеточного матрикса, или слоя питающих фибробластов, или добавления экзогенных ростовых факторов, таких как, например, bFGF.
В одном примере Cheon et al (BioReprod DOI:10.1095/biolreprod.105.046870, October 19, 2005) описывают не содержащую питающих клеток и сыворотки культуральную систему, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной, заменяющей сыворотку среде (SR), обогащенной различными факторами роста, способными запустить самообновление эмбриональных стволовых клеток.
В другом примере, Levenstein et al (Stem Cells 24: 568-574, 2006) описывают способы длительного культивирования человеческих эмбриональных стволовых клеток в отсутствие фибробластов или кондиционированной среды, с применением среды, обогащенной основным фактором роста фибробластов (bFGF).
В другом примере, в заявке на патент US 2005 0148070, описывается способ культивирования человеческих эмбриональных стволовых клеток в среде с определенным составом без сыворотки и без питающих клеток-фибробластов, где данный способ включает: культивирование стволовых клеток в культуральной среде, содержащей альбумин, аминокислоты, витамины, минеральные вещества, по меньшей мере один трансферрин или заменитель трансферрина, по меньшей мере один инсулин или заместитель инсулина, культуральную среду, в основном, не включающую эмбриональную сыворотку млекопитающих и содержащую по меньшей мере около 100 нг/мл фактора роста фибробластов, способного активировать сигнальный рецептор фактора роста фибробластов, причем фактор роста происходит из источника, иного, чем просто слой питающих клеток-фибробластов, среду, поддерживающую пролиферацию стволовых клеток в недифференцированном состоянии без слоя питающих клеток или кондиционированной среды.
В другом примере, в заявке на патент US20050233446, описывается среда с определенным составом, которая может быть использована при культивировании стволовых клеток, включая недифференцированные зародышевые стволовые клетки приматов. В растворе среда является существенно изотонической относительно культивируемых стволовых клеток. В данной культуре указанная среда содержит основную среду и количество bFGF, инсулина и аскорбиновой кислоты, достаточное для поддержки роста зародышевых стволовых клеток без существенной дифференцировки.
В другом примере, в заявке на патент US6800480, отмечается: “В одном варианте осуществления предлагается культуральная среда для выращивания зародышевых стволовых клеток приматов в существенно недифференцированном состоянии, включающая основную среду с низким содержанием эндотоксина и низким осмотическим давлением, которая эффективно поддерживает рост зародышевых стволовых клеток приматов. Основная среда объединяется с питательной сывороткой, способной поддерживать рост зародышевых стволовых клеток приматов, и субстратом, выбираемым из группы, включающей питающие клетки и экстраклеточный матрикс, полученный из питающих клеток. Упомянутая среда также включает в себя заменимые аминокислоты, антиоксидант и первый фактор роста, выбираемый из группы, включающей в себя нуклеозиды и соль-пируват.”
В другом примере, в заявке на патент US20050244962, говорится: “В одном аспекте, в изобретении предлагается способ культивирования эмбриональных стволовых клеток приматов. Стволовые клетки культивируются в культуре, существенно свободной от эмбриональной сыворотки млекопитающих (предпочтительно также существенно свободной от сыворотки любых животных) и в присутствии фактора роста фибробластов, полученного из источника, иного, чем просто слой питающих фибробластов. В предпочтительной форме, слой питающих фибробластов, ранее необходимый для поддержания культуры стволовых клеток, становится необязательным вследствие добавления достаточного количества фактора роста фибробластов”.
В другом примере, в заявке на патент WO2005065354, описывается изотоническая культуральная среда определенного состава, в основном не содержащая питающих клеток и сыворотки, включающая: a. базальную среду; b. количество bFGF, достаточное для поддержки роста главным образом недифференцированных стволовых клеток млекопитающих; c. количество инсулина, достаточное для поддержки роста главным образом недифференцированных стволовых клеток млекопитающих; и d. количество аскорбиновой кислоты, достаточное для поддержки роста главным образом недифференцированных стволовых клеток млекопитающих.
В другом примере, в заявке на патент WO2005086845, описан способ поддержания недифференцированных стволовых клеток, причем упомянутый способ включает в себя воздействие на стволовые клетки одним из членов семейства белков трансформирующего ростовой фактор-бета (TGFβ), одним из членов семейства белков фактора роста фибробластов (FGF) или никотинамидом (NIC) в количестве, достаточном для поддержания клеток в недифференцированном состоянии в течение периода времени, достаточного для получения желаемого результата.
Кроме того, для формирования панкреатических эндокринных клеток, клеток, экспрессирующих гормоны поджелудочной железы, или клеток, секретирующих гормоны поджелудочной железы из эмбриональных стволовых клеток человека, может потребоваться проведение генетических манипуляций с человеческими эмбриональными стволовыми клетками. Трансфицирование человеческих эмбриональных стволовых клеток с применением традиционных технологий, таких как, например, липофектамин или электропорация, не дает нужного эффекта.
В публикации WO2007027157 описывается способ, включающий в себя: (a) получение эмбриональной стволовой (ES) клетки; и (b) формирование линии клеток-предшественников из этой эмбриональной стволовой клетки; причем линия клеток-предшественников отбирается на основе способности к самообновлению. Предпочтительно, по данному способу проводится отделение от соматических клеток, на основе их неспособности к самообновлению. Предпочтительно, линия клеток-предшественников формируется или определяется в отсутствие со-культуры, предпочтительно, в отсутствие питающих клеток, которые, предпочтительно, отделяются от эмбриональных стволовых клеток. При необходимости, способ также включает (d) получение дифференцированной клетки из линии клеток-предшественников.
Следовательно, насущной потребностью по-прежнему остается разработка условий для создания стабильных линий плюрипотентных стволовых клеток, способных расти для решения текущих клинических задач и сохраняющих потенциал дифференцировки в панкреатические эндокринные клетки, в клетки, экспрессирующие гормоны поджелудочной железы, или в клетки, секретирующие гормоны поджелудочной железы.
КРАТКОЕ ОПИСАНИЕ
В настоящем изобретении предлагается популяция клеток, обладающих характеристиками человеческих эмбриональных стволовых клеток, способных легко расти в культуре при низком содержании сыворотки, не требующих линии питающих клеток или покрытия из сложных белков матрикса, способных пересеваться в виде суспензии одиночных клеток, трансфицироваться с очень высокой эффективностью и культивироваться в условиях гипоксии. Такое сочетание уникальных свойств отличает описанные клетки, составляющие предмет настоящего изобретения, от прототипа.
В одном из вариантов осуществления настоящего изобретения предлагается способ получения популяции, состоящей из клеток, экспрессирующих маркеры плюрипотентности, включающий следующие этапы:
а. получение клеток; и
b. культивирование клеток в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся перед культивированием предварительной обработке белком или экстраклеточным матриксом.
Клетки могут представлять собой человеческие эмбриональные стволовые клетки или клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы. Человеческие эмбриональные стволовые клетки перед культивированием этих клеток на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным матриксом, могут культивироваться в среде с нормальным содержанием кислорода. В качестве альтернативы человеческие эмбриональные стволовые клетки могут культивироваться в условиях гипоксии.
Человеческие эмбриональные стволовые клетки перед культивированием этих клеток на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным матриксом, могут культивироваться в среде с нормальным содержанием кислорода и обрабатываться ингибитором Rho-киназы. В качестве альтернативы человеческие эмбриональные стволовые клетки могут культивироваться в условиях гипоксии и обрабатываться ингибитором Rho-киназы.
Клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, перед культивированием этих клеток на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным матриксом, могут культивироваться в среде с нормальным содержанием кислорода. В качестве альтернативы клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, могут культивироваться в условиях гипоксии.
В одном из вариантов осуществления настоящего изобретения предлагается способ получения популяции клеток, состоящей из клеток, экспрессирующих маркеры плюрипотентности, включающий следующие этапы:
а. культивирование человеческих эмбриональных стволовых клеток,
b. дифференцировка человеческих эмбриональных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, и
c. извлечение клеток с последующим их культивированием в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся перед культивированием предварительной обработке белком или экстраклеточным мактриксом.
Клетки могут культивироваться в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом, в среде, содержащей сыворотку, активин-А и Wnt-лиганд. В качестве альтернативы клетки могут культивироваться в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом, в среде, содержащей сыворотку, активин-А, Wnt-лиганд и IGF-1.
Клетки могут культивироваться в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом, в среде, содержащей сыворотку, ингибитор Rho-киназы, активин-А и Wnt-лиганд. В качестве альтернативы клетки могут культивироваться в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом, в среде, содержащей сыворотку, ингибитор Rho-киназы, активин-А, Wnt-лиганд и IGF-1.
В одном из вариантов осуществления настоящего изобретения предлагается способ получения популяции, состоящей из клеток, экспрессирующих маркеры плюрипотентности, включающий следующие этапы:
а. культивирование человеческих эмбриональных стволовых клеток, и
b. извлечение клеток с последующим их культивированием в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом.
Клетки могут культивироваться в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом, в среде, содержащей сыворотку, активин-А и Wnt-лиганд. В качестве альтернативы клетки могут культивироваться в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом, в среде, содержащей сыворотку, активин-А, Wnt-лиганд и IGF-1.
Клетки могут культивироваться в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом, в среде, содержащей сыворотку, ингибитор Rho-киназы, активин-А и Wnt-лиганд. В качестве альтернативы клетки могут культивироваться в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом, в среде, содержащей сыворотку, ингибитор Rho-киназы, активин-А, Wnt-лиганд и IGF-1.
Клетки, экспрессирующие маркеры плюрипотентности, полученные способами, составляющими предмет настоящего изобретения, способны расти в культуре в условиях гипоксии, на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом.
В одном из вариантов осуществления настоящего изобретения предлагается способ выращивания клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, включающий этапы культивирования клеток в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся обработке белком или экстраклеточным матриксом. В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, получают из плюрипотентных клеток, формируемых способами, составляющими предмет настоящего изобретения.
Клетки могут культивироваться в условиях гипоксии на субстрате тканевой культуры, не подвергавшемся предварительной обработке белком или экстраклеточным мактриксом, в среде, содержащей сыворотку, активин-А, Wnt-лиганд и ингибитор GSK-3B.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
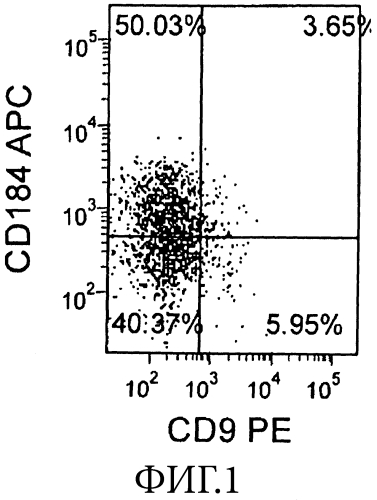
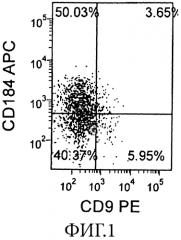
На Фиг. 1 показана экспрессия CXCR4 (CD 184, ось Y) и CD9 (ось X) в человеческих эмбриональных стволовых клетках линии H9, пассаж 54, которые были дифференцированы в сформированную эндодерму после обработки средой с низким содержанием сыворотки + Activin-A + WNT-3A в течение 4 дней.
На Фиг. 2 показан анализ способом ПЦР в реальном времени человеческих эмбриональных стволовых клеток линии H9, пассаж 54, на 4 и 6 день протокола дифференцировки в сформированную эндодерму, описанного в Примере 5. На панели a) показана экспрессия AFP, Bry, CXCR4, GSC и SOX-7. На панели b) показана экспрессия SOX-17, GATA-4 и HNF-3 beta.
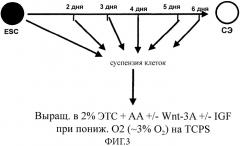
На Фиг. 3 показан протокол выделения, использованный для получения клеток EXPRES из эмбриональных стволовых клеток в соответствии со способами, составляющими предмет настоящего изобретения.
На Фиг. 4 показана морфология выращенных клеток EXPRES на стадии P0, день 11, культивированных в 2% ЭТС + DMEM-F12 + 100 нг/мл активина-A (панель a) или 2% ЭТС + DMEM-F12 + 100 нг/мл активина-A + 20 нг/мл WNT-3A (панель b). На панели c показана морфология клеток EXPRES, пассаж 3.
На Фиг. 5 показан анализ способом ПЦР в реальном времени выращенных клеток EXPRES, культивируемых в 2-5% ЭТС + DMEM-F12 + 100 нг/мл активина-A + 20 нг/мл WNT-3A на протяжении трех пассажей. На панели a) показана экспрессия AFP, Bry, CXCR4, GSC и SOX-7. На панели b) показана экспрессия SOX-17, GATA-4 и HNF-3 beta.
На Фиг. 6 показано влияние добавления Wnt-3A на экспрессию генов в клетках EXPRES. На панели a) показаны данные ПЦР в реальном времени для экспрессии SOX-17, GATA-4 и HNF-3 beta. На панели b) показаны данные ПЦР в реальном времени для экспрессии AFP, Bry, CXCR4, GSC и SOX-7.
На Фиг. 7 показано влияние IGF-1, Wnt-3A и активина-A на экспрессию генов в клетках EXPRES. На панели a) показаны данные ПЦР в реальном времени для экспрессии SOX-17, GATA-4, HNF-3 beta, Bry, CXCR4 и GSC. На панели b) показаны данные ПЦР в реальном времени для экспрессии SOX-7 и AFP. На панели c) показаны данные ПЦР в реальном времени для экспрессии OCT-4.
На Фиг. 8 показана морфология выращенных клеток EXPRES, полученных из линии человеческих эмбриональных стволовых клеток H9, пассаж 54, культивированных в a) 2% ЭТС + DMEM-F12 + 100 нг/мл AA + 20 нг/мл WNT-3A, b) 2% ЭТС + DMEMF12 + 100 нг/мл AA, c) 2% ЭТС + DMEM-F12 + 50 нг/мл IGF-I.
На Фиг. 9 показан потенциал роста клеток EXPRES 01 и 02, культивируемых на полистироле для тканевой культуры в условиях гипоксии. Клетки EXPRES 01 культивировались в 2% ЭТС + DM-F12 + 100 нг/мл AA + 20 нг/мл WNT-3A + 50 нг/мл IGF-I, при этом клетки EXPRES 02 культивировались в 2% ЭТС + DM-F12 + 100 нг/мл AA + 20 нг/мл WNT-3A.
На Фиг. 10 показана морфология клеток EXPRES, полученных из одиночно-клеточной суспензии недифференцированных эмбриональных стволовых клеток на TCPS (полистирол для тканевой культуры) в среде DM-F12 + 2% ЭТС + 100 нг/мл AA + 20 нг/мл WNT3A + 50 нг/мл IGF-I.
На Фиг. 11 показана экспрессия белков, определяемая способом сортировки клеток с возбуждением флуоресценции (FACS) в клетках EXPRES 01, пассаж 24. На панели a) показаны уровни экспрессии E-кадгерина, на панели b) показаны уровни экспрессии CXCR4, на панели c) показаны уровни экспрессии CD9, на панели d) показаны уровни экспрессии CD117, на панели e) показаны уровни экспрессии CD30, на панели f) показаны уровни экспрессии LIF-рецептора, на панели g) показаны уровни экспрессии TRA 1-60, на панели h) показаны уровни экспрессии TRA 1-81, на панели i) показаны уровни экспрессии SSEA-1, на панели j) показаны уровни экспрессии SSEA-3, на панели k) показаны уровни экспрессии SSEA-4 и на панели l) показаны уровни экспрессии CD56.
На Фиг. 12 показана экспрессия белков, определяемая способом сортировки клеток с возбуждением флуоресценции (FACS) в клетках EXPRES 02, пассаж 21. На панели a) показаны уровни экспрессии E-кадгерина, на панели b) показаны уровни экспрессии CXCR4, на панели c) показаны уровни экспрессии CD9, на панели d) показаны уровни экспрессии CD117, на панели e) показаны уровни экспрессии CD30, на панели f) показаны уровни экспрессии LIF-рецептора, на панели g) показаны уровни экспрессии TRA 1-60, на панели h) показаны уровни экспрессии TRA 1-81, на панели i) показаны уровни экспрессии SSEA-1, на панели j) показаны уровни экспрессии SSEA-3, на панели k) показаны уровни экспрессии SSEA-4 и на панели l) показаны уровни экспрессии CD56.
На Фиг. 13 показаны иммунофлуоресцентные изображения клеток EXPRES 01, пассаж 10, культивируемых в 2% ЭТС + DMEM-F12 + 100 нг/мл AA + 20 нг/мл WNT-3A + 50 нг/мл IGF-I. Панель a) изображение с окраской DAPI, соответствующее панели b, панель b) Nanog, панель c) совместное окрашивание DAPI (синий) и Oct-4 (зеленый), панель d) изображение с окраской DAPI, соответствующее панели e, панель e) SOX-2 и панель f) совместное окрашивание DAPI (синий) и HNF-3 beta (зеленый).
На Фиг. 14 показаны иммунофлуоресцентные изображения клеток EXPRES 02, пассаж 9, культивируемых в 2% ЭТС + DMEM-F12 + 100 нг/мл AA + 20 нг/мл WNT-3A. Панель a) изображение с окраской DAPI, соответствующее панели b, панель b) HNf3B, панель c) изображение с окраской DAPI, соответствующее панели d, панель d) OCT-4, панель e) изображение с окраской DAPI, соответствующее панели f, панель f) SOX-2, панель g) изображение с окраской DAPI, соответствующее панели h, панель h) NANOG.
На Фиг. 15 показана экспрессия генов, определенная способом ПЦР в реальном времени для клеток EXPRES 01, EXPRES 02, клеток EB, полученных из клеток H9, клеток SA002, культивированных на MATRIGEL в MEF-CM, и для недифференцированных клеток H9, культивированных на MATRIGEL в MEFCM. Все уровни экспрессии нормализованы к недифференцированным клеткам H9. На панели a) показана экспрессия SOX-1, на панели b) показана экспрессия FOXD3, MYOD1, POU5F1 и ZFP42, на панели c) показана экспрессия ABCG2, коннексина 43, коннексина 45 и цитокератина 15, на панели d) показана экспрессия нестина, SOX-2, UTF1 и виментина, на панели e) показана экспрессия GATA-2, Brachyury, TERT и тубулина-бета III, на панели f) показана экспрессия CFC1 и GATA-4, на панели g) показана экспрессия AFP и FOXA2 и на панели h) показана экспрессия IPF1A и MSX1.
На Фиг. 16 показана измеренная способом FACS экспрессия CXCR4 (ось Y) и CD9 (ось x) в a) клетках EXPRES 01, пассаж 5, культивированных на полистироле для тканевой культуры в среде для культивации, а затем в среде DMEM-F12 + 0,5% ЭТС + 100 нг/мл активина-A и 20 нг/мл WNT3A в течение 2 дней, затем еще 2 дней в DMEM-F12 + 2% ЭТС + 100 нг/мл активина-A, b) клетках EXPRES 02, пассаж 4, культивированных на полистироле для тканевой культуры в среде для культивации, а затем в среде DMEM-F12 + 0,5% ЭТС + 100 нг/мл активина-A и 20 нг/мл WNT3A в течение 2 дней, затем еще 2 дней в DMEM-F12 + 2% ЭТС + 100 нг/мл активина-A.
На Фиг. 17 показана измеренная способом ПЦР в реальном времени экспрессия генов a) в клетках EXPRES 01 и b) в клетках EXPRES 02, обработанных средой с низким содержанием сыворотки, плюс AA + WNT-3a.
На Фиг. 18 показаны иммунофлуоресцентные изображения клеток EXPRES 01, пассаж 5, культивированных в 2% ЭТС + DMEM-F12 + 100 нг/мл AA + 20 нг/мл WNT-3A + 50 нг/мл IGF-I, затем в среде DMEM-F12 + 0,5% ЭТС + 100 нг/мл активина-A и 20 нг/мл WNT3A в течение 2 дней, затем еще 2 дней в DMEM-F12 + 2% ЭТС + 100 нг/мл активина-A. Панель a) изображение с окраской DAPI, соответствующее панели b, панель b) GATA-4, панель c) изображение с окраской DAPI, соответствующее панели d, панель d) SOX-17, панель e) изображение с окраской DAPI, соответствующее панели f, панель f) HNF-3 beta, панель g) изображение с окраской DAPI, соответствующее панели h, панель h) OCT-4.
На Фиг. 19 показаны иммунофлуоресцентные изображения клеток EXPRES 02, пассаж 4, культивированных в 2% ЭТС + DMEM-F12 + 100 нг/мл AA + 20 нг/мл WNT-3A, затем в среде DMEM-F12 + 0,5% ЭТС + 100 нг/мл активина-A и 20 нг/мл WNT3A в течение 2 дней, затем еще 2 дней в DMEM-F12 + 2% ЭТС + 100 нг/мл активина-A. Панель a) изображение с окраской DAPI, соответствующее панели b, панель b) GATA-4, панель c) изображение с окраской DAPI, соответствующее панели d, панель d) SOX-17, панель e) изображение с окраской DAPI, соответствующее панели f, панель f) HNF-3 beta, панель g) изображение с окраской DAPI, соответствующее панели h, панель h) OCT-4.
На Фиг. 20 показана измеренная способом FACS экспрессия CXCR4 (ось Y) и CD9 (ось x) в a) клетках EXPRES 01, пассаж 19, и b) клетках EXPRES 02, пассаж 14, культивированных на полистироле для тканевой культуры в среде для культивации, затем в среде DMEM-F12 + 0,5% ЭТС + 100 нг/мл активина-A + 100 нМ GSK-3B-ингибитора IX и 20 нг/мл WNT3A в течение 4 дней.
На Фиг. 21 показаны иммунофлуоресцентные изображения клеток EXPRES 01, пассаж 19, культивированных в 2% ЭТС + DMEM-F12 + 100 нг/мл AA + 20 нг/мл WNT-3A + 50 нг/мл IGF-I, и клеток EXPRES 02, пассаж 14, культивированных в 2% ЭТС + DMEM-F12 + 100 нг/мл AA + 20 нг/мл WNT-3A, затем в среде DMEM-F12 + 0,5% ЭТС + 100 нг/мл активина-A + 100 нМ GSK-3B-ингибитора IX и 20 нг/мл WNT-3A в течение 5 дней. Панель a) изображение с окраской DAPI, соответствующее панели b, панель b) HNF-3 beta, панель c) изображение с окраской DAPI, соответствующее панели d, панель d) GATA-4, панель e) изображение с окраской DAPI, соответствующее панели f, панель f) SOX-17, панель g) изображение с окраской DAPI, соответствующее панели h, панель h) HNF-3 beta, панель i) изображение с окраской DAPI, соответствующее панели j, панель j) GATA-4, панель k) изображение с окраской DAPI, соответствующее панели l, панель l) SOX-17.
На Фиг. 22 показана измеренная способом ПЦР в реальном времени экспрессия генов a) в клетках EXPRES 01 и в клетках EXPRES 02, обработанных средой с низким содержанием сыворотки, плюс AA + WNT3a + GSK-3B-ингибитор IX в течение 5 дней. На панели a показана экспрессия AFP, Brachyury, CDX2, Mox1, OCT3/4, SOX-7 и ZIC1, на панели b показаны уровни экспрессии CXCR4, GATA-4, Goosecoid, HNf3B и SOX-17.
На Фиг. 23 показана экспрессия генов, измеренная способом ПЦР в реальном времени для клеток EXPRES 01, посеянных с плотностью 5000-40000 клеток/см2 на полистирол для культивирования ткани в культивационной среде, затем культивировавшихся в DMEM-F12 + 0,5% ЭТС + 100 нг/мл AA + 20 нг/мл WNT-3A + 100 нМ GSK-3B-ингибитора IX в течение четырех дней в условиях гипоксии. На панели а) показаны уровни экспрессии AFP, Brachyury, SOX-7 и OTX2. На панели b) показаны уровни экспрессии CXCR4, HNF-3 beta, GATA-4, SOX-17, Cerb и GSC.
На Фиг. 24 показаны результаты анализа длины теломеров в клетках с пониженным контролем теломеров (полоса 1), клетках EXPRES 01, пассаж 24 (полоса 2), клетках EXPRES 02, пассаж 17 (полоса 3), недифференцированных человеческих эмбриональных стволовых клетках H1, пассаж 40 (полоса 4) и в клетках с повышенным контролем теломеров (полоса 5).
На Фиг. 25 показана экспрессия генов, измеренная способом ПЦР в реальном времени для клеток EXPRES 01, пассаж 21, дифференцированных в клетки эндодермы передней кишки (S3), клетки панкреатической эндодермы (S4) и панкреатические эндокринные клетки (S5).
На Фиг. 26 приведены иммунофлуоресцентные изображения клеток EXPRES 01, пассаж 35, культивированные по Примеру 18. Панель а) изображение с окраской DAPI, соответствующее панели b), панель b) анти-1 трипсин, панель c) HNF-3 beta (зеленый), альбумин (красный), панель d) альбумин (красный) и DAPI (синий), панель e) изображение с окраской DAPI, соответствующее панели f, панель f) PDX-1, панель g) изображение с окраской DAPI, соответствующее панели h, панель h) SOX-17, панель i) изображение с окраской DAPI, соответствующее панели j, панель j) CDX-2.
На Фиг. 27 показаны диаграммы рассеяния данных с биочипов, где сравниваются, панель a) клетки EXPRES 01 (ось y) с недифференцированными человеческими эмбриональными стволовыми клетками линии H9 (ось x), панель b) клетки EXPRES 02 (ось y) с недифференцированными человеческими эмбриональными стволовыми клетками линии H9 (ось x), панель c) клетки EXPRES 01 (ось y) с клетками EXPRES 02 (ось x), панель d) клетки EXPRES 01 (ось y) с человеческими эмбриональными стволовыми клетками линии H9, дифференцированными в сформированную эндодерму (ось x), панель e) клетки EXPRES 02 (ось y) с человеческими эмбриональными стволовыми клетками линии H9, дифференцированными в сформированную эндодерму (ось x), панель f) недифференцированные человеческие эмбриональные стволовые клетки линии H9 (ось y) с человеческими эмбриональными стволовыми клетками линии H9, дифференцированными в сформированную эндодерму (ось x).
На Фиг. 28 показана морфология телец EB, образованных клетками EXPRES 01.
На Фиг. 29 показана экспрессия генов, измеренная способом ПЦР в реальном времени, для клеток линии EXPRES 01, клеток линии EXPRES 02 и человеческих эмбриональных стволовых клеток линии H9, пассаж 43, через пять недель после трансплантации под почечную капсулу мышей NOD-SCID. На панелях a-e показаны маркеры мезодермы. На панелях f & g показаны маркеры эктодермы. На панелях h и i показаны маркеры эндодермы. На панели j показаны дополнительные маркеры эмбриональной эндодермы. На панелях k-m показаны маркеры плюрипотентности.
На Фиг. 30 показана пролиферация и состояние клеточного цикла клеток EXPRES 03, измеренная по включению бромдезоксиуридина (BRDU). Клетки EXPRES 03 культивировались в 2% ЭТС/DMEM/F12, с добавлением: панель a) активина-A (100 нг/мл) и wnt3a (20 нг/мл), панель b) активина-A (100 нг/мл) и wnt3a (20 нг/мл) и IGF (50 нг/мл). Показаны также другие клетки, панель c) чЭС клетки (H9p43), панель d) клетки амниотической жидкости (AFDX002) и панель e) клетки МЭФ (мышиные эмбриональные фибробласты), обработанные митомицином. На панели f) для разных изученных популяций клеток показана встречаемость клеток, находящихся в фазе S, G1 и G2/M клеточного цикла.
На Фиг. 31 показана эффективность трансфекции и экспрессия EGFP в клетках EXPRES 01 и в человеческих эмбриональных стволовых клетках, которые сеялись либо в виде одиночно-клеточных дисперсий, либо клеточных кластеров. Клетки были проанализированы через 24 часа при помощи флуоресцентной микроскопии и проточной цитометрии. На панели A) показаны данные, полученные на клетках EXPRES 01. На панели B) показаны данные, полученные на одиночно-клеточной суспензии человеческих эмбриональных стволовых клеток, на панели C) показаны данные, полученные на кластерах человеческих эмбриональных стволовых клеток.
На Фиг. 32 показаны, как функция количества клеток, усредненные данные по оптической плотности (OD), измеренные с помощью MTS-теста и отражающие активность фермента дегидрогеназы для a) клеток EXPRES 01, культивированных в атмосфере кислорода воздуха (около 21%), b) клеток EXPRES 01, культивированных в 3% O2, c) клеток EXPRES 02 культивированных в атмосфере кислорода воздуха (около 21%), d) клеток EXPRES 02, культивированных в 3% O2.
На Фиг. 33 показана экспрессия генов, измеренная способом ПЦР в реальном времени для клеток EXPRES 01 P27, посеянных с плотностью 10000 клеток/см2 на полистирол для культивирования ткани в среде DMEMF12 + 0,5% ЭТС + 100 нг/мл AA + 20 нг/мл WNT3A + 100 нМ GSK-3B-ингибитора IX. На панели a показаны уровни экспрессии AFP, Brachyury, SOX-7 и OTX2. На панели b показаны уровни экспрессии CXCR4, HNF-3 beta, GATA-4, SOX-17, Cer1 и GSC.
На Фиг. 34 показана измеренная способом FACS экспрессия CXCR4 (ось Y) и CD9 (ось x) в клетках EXPRES 01 P27, культивированных на полистироле для культивирования ткани в среде DMEM-F12 + 0,5% ЭТС + 100 нг/мл AA + 20 нг/мл WNT-3A + 100 нМ GSK-3B-ингибитора-IX для трех пассажей.
На Фиг. 35 показано влияние трансфекции малых интерферирующих РНК (миРНК) на экспрессию GSK-3B и бета-катенина. Клетки EXPRES были проанализированы путем флуоресцентной микроскопии и количественными способами ОТ-ПЦР. A) Флуоресцентная микроскопия клеток, трансфицированных i) миРНК, меченными с помощью CY3 и ii) миРНК, меченными флуоресцином. B) Нокдаун целевого гена, выраженный в процентной доле оставшейся активности, в клетках, трансфицированных олигонуклеотидными последовательностями миРНК для i) GSK3b и ii) бета-катенина.
На Фиг. 36 показан кариотип двух клеточных линий, полученных в соответствии со способами, представляющими предмет настоящего изобретения. Панель a: клеточн