Способы улучшения множественных свойств белка
Иллюстрации
Показать всеНастоящее изобретение относится к способу предоставления вариантов протеазы или амилазы со значением эффективности, по меньшей мере, в одном интересующем тесте, превышающим показатель эффективности для указанного фермента дикого типа. Тестируют множество вариантов фермента, охватывающее определённый диапазон суммарного поверхностного заряда или электрокинетического потенциала, по меньшей мере, в одном интересующем тесте. Такой тест включает измерение: эффективности стирки, связывания субстрата, ингибирования фермента, уровней экспрессии, стабильности в детергенте, тепловой стабильности, скорости реакции, степени завершенности реакции и/или тепловой активности. Идентифицируют значение поверхностного заряда или электрокинетического потенциала, при котором эффективность в тесте составляет по меньшей мере 50% от максимальной. Создают новое множество (библиотеку) вариантов фермента, обогащенное членами, обладающими значением по меньшей мере 50% от максимального значения, в указанном, по меньшей мере, одном интересующем тесте в пределах указанного значения заряда или потенциала. Тестируют указанное множество вариантов фермента и, по меньшей мере, один фермент дикого типа в указанном, по меньшей мере, одном интересующем тесте. Если значение показателя эффективности превышает показатель для фермента дикого типа, то идентифицируют варианты фермента, показывающие улучшенный результат. Использование изобретения обеспечивает новый способ получения вариантов ферментов с улучшенной активностью. 18 з.п. ф-лы, 32 ил., 14 табл., 15 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СВЯЗАННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет временных патентных заявок США №№ 60/933307, 60/933331 и 60/933312, поданных 6 июня 2007 года, включенных, таким образом, в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к эффективным способам получения белка с одним или несколькими полезными характеристиками в промышленном, потребительском или фармацевтическом применениях. В некоторых предпочтительных вариантах осуществления настоящее изобретение относится к способам производства превосходных ферментов для заданного применения посредством скрининга сокращенного набора испытываемых ферментов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Свойства белков, функционирующих за пределами их естественного окружения, часто являются субоптимальными. Например, ферменты (например, протеазы, липазы, амилазы, целлюлазы и т.д.) часто используются для очистки материи от красителей в детергентах для стирки, которые типично состоят из сложных сочетаний активных ингредиентов. Фактически, большинство чистящих продуктов содержит систему поверхностно-активных веществ, отбеливатели, моющие компоненты, гасители мыльной пены, грязесуспендирующие компоненты, грязеотталкивающие компоненты, оптические отбеливатели, смягчители, дисперсанты, соединения, подавляющие перенос красителя, абразивы, бактерициды и отдушки, а также ферменты для очистки. Таким образом, несмотря на сложность современных детергентов, существует много красок, которые сложно удалить полностью отчасти из-за субоптимальной эффективности фермента. Несмотря на многие исследования в разработке ферментов, в данной области сохраняется потребность в способах для создания белков для конкретных применений и условий. Фактически, в данной области сохраняется потребность в способах быстрой и систематичной адаптации электростатических свойств других для оптимизации их эффективности в коммерческих приложениях. В частности, в данной области сохраняется потребность в способах создания в промышленном отношении применимых ферментов, включая, в качестве неограничивающих примеров, липазы, амилазы, кутиназы, маннаназы, оксидоредуктазы, целлюлазы, пектиназы, протеазы и другие ферменты, для того, чтобы обеспечить увеличенную активность, стабильность и растворимость в очищающих растворах. Кроме того, в данной области сохраняется потребность в способах создания рекомбинантных ферментов, которые могут быть экспрессированы при высоких уровнях из трансформированных клеток-хозяев.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к эффективным способам получения белка с одной или несколькими полезными характеристиками в промышленном, потребительском или фармацевтическом применениях. В некоторых предпочтительных вариантах осуществления настоящее изобретение относится к способам производства превосходных ферментов для заданного применения через скрининг сокращенного набора испытываемых ферментов.
Настоящее изобретение относится к способам предоставления библиотеки вариантов белков, содержащим: тестирование множества вариантов белков, охватывающих диапазон интересующего свойства (например, физического свойства) в интересующем тесте; идентификацию оптимального значения в диапазоне интересующего свойства, которое связано с благоприятным результатом в интересующем тесте; и предоставление множества вариантов белков в пределах оптимального значения диапазона интересующего свойства, посредством этого предоставляя библиотеку вариантов белков, обогащенную членами, имеющими благоприятный результат в интересующем тесте. В некоторых предпочтительных вариантах осуществления благоприятный результат соответствует значению более приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 95% от максимального значения, наблюдаемого в интересующем тесте. В дополнительных вариантах осуществления способы дополнительно содержат стадию тестирования множества вариантов белков и белка дикого типа в интересующем тесте. В других дополнительных вариантах осуществления способы содержат стадию идентификации вариантов белков, обладающих улучшенным результатом, где белок дикого типа достигает значения, равного 1,0, в интересующем тесте, и варианты белков обладают улучшенным результатом, достигая значения, превышающего 1,0. В некоторых предпочтительных вариантах осуществления показатель эффективности = эффективность теста/эффективность дикого типа. В некоторых особенно предпочтительных вариантах осуществления белок представляет собой фермент. В некоторых дополнительных предпочтительных вариантах осуществления фермент представляет собой протеазу, амилазу, целлюлазу, полиэстеразу, эстеразу, липазу, кутиназу, пектиназу или оксидазу. В некоторых дополнительных вариантах осуществления белок представляет собой антитело или гормон или цитокин (например, фактор роста). В некоторых предпочтительных вариантах осуществления протеаза представляет собой нейтральную металлопротеазу. В некоторых особенно предпочтительных вариантах осуществления родительская протеаза представляет собой зрелую форму дикого типа нейтральной металлопротеазы. В других дополнительных предпочтительных вариантах осуществления вариант получают из нейтральной металлопротеазы семейства Bacillaceae. В других вариантах осуществления вариант получен из нейтральной металлопротеазы рода Bacillus. В некоторых других вариантах осуществления протеаза представляет собой сериновую протеазу. В некоторых особенно предпочтительных вариантах осуществления родительская протеаза представляет собой зрелую форму дикого типа сериновой протеазы. В других дополнительных предпочтительных вариантах осуществления вариант получен из сериновой протеазы подотряда Micrococcineae. В дополнительных вариантах осуществления вариант получен из сериновой протеазы рода Cellulomonas. Еще в дополнительных вариантах осуществления интересующее свойство представляет собой заряд относительно фермента дикого типа. В некоторых особенно предпочтительных вариантах осуществления интересующее свойство представляет собой электрокинетический потенциал. В некоторых дополнительных предпочтительных вариантах осуществления интересующий тест содержит эффективность стирки. В некоторых особенно предпочтительных вариантах осуществления эффективность стирки содержит эффективность удаления крови-молока-чернил (КМЧ) в детергенте. В некоторых вариантах осуществления эффективность стирки тестируют в моющем составе, образованном в виде порошкообразного или жидкого детергента, который имеет pH от 5 до 12,0. Еще в дополнительных вариантах осуществления эффективность стирки тестируют в холодной воде с жидким детергентом, который имеет щелочной pH. В некоторых альтернативных вариантах осуществления интересующий тест содержит измерение связывания субстрата и/или измерение ингибирования фермента, и/или измерение уровней экспрессии, и/или измерение стабильности в детергенте, и/или измерение тепловой стабильности, и/или измерение скорости реакции, и/или измерение степени завершенности реакции, и/или измерение тепловой активности.
Настоящее изобретение также относится к способам производства улучшенного варианта укладки тестируемого белка, включающим: анализ множества вариантов укладки зондового белка, охватывающего диапазон интересующего свойства в интересующем тесте; идентификацию оптимального значения в диапазоне интересующего свойства, которое связано с благоприятным результатом в интересующем анализе; анализ белка, который является родительским для укладки тестируемого белка в интересующем анализе; и производство улучшенного варианта укладки тестируемого белка посредством введения замены аминокислоты в родительский белок из условия, чтобы улучшенный вариант находился в пределах оптимального значения диапазона интересующего свойства. В некоторых вариантах осуществления укладка тестируемого белка и укладка зондового белка различны. В некоторых дополнительных вариантах осуществления укладка тестируемого белка представляет собой сериновую протеазу и укладка зондового белка представляет собой нейтральную металлопротеазу.
Настоящее изобретение также относится к способам производства варианта фермента, специфичного к краске-субстрату, содержащим: определение электрокинетического потенциала краски-субстрата в эталонном буфере; определение электрокинетического потенциала родительского фермента в эталонном буфере; и производство варианта фермента, специфичного к краске-субстрату посредством введения замены аминокислоты в родительский фермент из условия, чтобы электрокинетический потенциал варианта фермента был ближе к электрокинетическому потенциалу краски-субстрата, чем к электрокинетическому потенциалу родительского фермента.
Настоящее изобретение дополнительно относится к способам производства композиции для очистки множества красок, содержащим: определение электрокинетического потенциала каждой из множества красок в эталонном буфере; выбор очищающего фермента, обладающего электрокинетическим потенциалом в эталонном буфере, в основном равным электрокинетическому потенциалу одной краске из множества, где выбор продолжается до тех пор, пока не будет образована пара каждой краски из множества, по меньшей мере, с одним очищающим ферментом; и изготовление композиции для очистки множества красок посредством включения очищающих ферментов из стадии b в моющий раствор с pH и удельной электропроводностью, в основном равной таковой эталонного буфера.
Настоящее изобретение относится к способам предоставления библиотеки вариантов белков, включающим: a) тестирование множества вариантов белков, охватывающего диапазон, по меньшей мере, одного интересующего свойства, по меньшей мере, в одном интересующем тесте; b) идентификацию оптимального значения в диапазоне интересующего свойства, которое связано с благоприятным результатом, по меньшей мере, в одном интересующем тесте; и c) предоставление множества вариантов белков в пределах оптимального значения диапазона интересующего свойства из условия, чтобы была предоставлена библиотека вариантов белков, обогащенная членами, обладающими благоприятным результатом, по меньшей мере, в одном интересующем тесте. В некоторых вариантах осуществления интересующее свойство представляет собой физическое свойство. В некоторых дополнительных вариантах осуществления благоприятный результат соответствует значению, большему чем, по меньшей мере, приблизительно, 50% от максимального значения, наблюдаемого в интересующем тесте. В некоторых дополнительных вариантах осуществления благоприятный результат соответствует значению, большему чем, по меньшей мере, приблизительно, 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 95% от максимального значения, наблюдаемого в интересующем тесте. В некоторых дополнительных вариантах осуществления способы дополнительно содержат стадию: d) тестирование множества вариантов белков и, по меньшей мере, одного белка дикого типа, по меньшей мере, в одном интересующем тесте. В некоторых дополнительных вариантах осуществления способы дополнительно содержат стадию идентификации вариантов белков, которые обладают улучшенным результатом, где белок дикого типа достигает величины показателя эффективности 1,0, по меньшей мере, в одном интересующем тесте и варианты белков, обладающие улучшенным результатом, достигают величины, превышающей 1,0. В некоторых вариантах осуществления белок представляет собой антитело, гормон или цитокин. В некоторых предпочтительных вариантах осуществления белок представляет собой фермент. В некоторых особенно предпочтительных вариантах осуществления фермент представляет собой протеазу, амилазу, целлюлазу, полиэстеразу, эстеразу, липазу, кутиназу, пектиназу, оксидазу или трансферазу. В некоторых особенных более предпочтительных вариантах осуществления протеаза представляет собой нейтральную металлопротеазу или сериновую протеазу. В некоторых дополнительных предпочтительных вариантах осуществления сериновая протеаза представляет собой субтилизин. В некоторых альтернативных предпочтительных вариантах осуществления нейтральная металлопротеаза получена из члена семейства Bacillaceae. Еще в некоторых дополнительных вариантах осуществления сериновая протеаза получена из члена рода Cellulomonas. В некоторых дополнительных вариантах осуществления фермент представляет собой целлюлазу, тогда как в других вариантах осуществления фермент представляет собой амилазу. В некоторых дополнительных вариантах осуществления интересующее свойство представляет собой заряд. В некоторых дополнительных вариантах осуществления заряд вариантов белков и фермента дикого типа определяют и сравнивают. В некоторых дополнительных вариантах осуществления интересующее свойство представляет собой электрокинетический потенциал. Еще в некоторых дополнительных вариантах осуществления электрокинетический потенциал вариантов белков и фермента дикого типа определяют и сравнивают. В некоторых предпочтительных вариантах осуществления электрокинетический потенциал варианта белка находится между приблизительно -40 мВ и приблизительно +40 мВ, тогда как в других вариантах осуществления электрокинетический потенциал варианта белка находится между приблизительно -20 мВ и приблизительно +20 мВ, и в других дополнительных вариантах осуществления электрокинетический потенциал варианта белка находится между приблизительно -10 мВ и приблизительно +10 мВ. В некоторых дополнительных вариантах осуществления интересующий тест включает эффективность стирки. В некоторых предпочтительных вариантах осуществления эффективность стирки включает эффективность очистки от крови-молока-чернил. В некоторых дополнительных вариантах осуществления варианты белков и белок дикого типа тестируют в моющем составе. В некоторых предпочтительных вариантах осуществления моющий состав выполнен в виде порошкообразного или жидкого детергента, обладающего pH между приблизительно 5 и приблизительно 12,0. В некоторых дополнительных предпочтительных вариантах осуществления эффективность стирки тестируют в холодной воде с жидким детергентом, обладающим основным pH. В некоторых альтернативных вариантах осуществления эффективность стирки тестируют в горячей воде с детергентом. В некоторых предпочтительных вариантах осуществления, по меньшей мере, один интересующий тест включает измерение связывания субстрата, ингибирование фермента, уровни экспрессии, стабильность в детергенте, тепловую стабильность, скорость реакции, степень завершенности реакции, тепловую активность, разжижение крахмала, разложение биомассы и/или осахаривание.
Настоящее изобретение также относится к способам производства, по меньшей мере, одного улучшенного варианта укладки тестируемого белка, включающим: a) тестирование множества вариантов укладки зондового белка, охватывающего диапазон, по меньшей мере, одного интересующего свойства, по меньшей мере, в одном интересующем анализе; b) идентификацию оптимального значения в диапазоне, по меньшей мере, одного интересующего свойства, которое связано с благоприятным результатом, по меньшей мере, в одном интересующем анализе; c) тестирование белка, который является родительским для укладки тестируемого белка, по меньшей мере, в одном интересующем анализе; и d) производство, по меньшей мере, одного улучшенного варианта укладки тестируемого белка посредством введения аминокислотной модификации в родительский белок из условия, чтобы, по меньшей мере, один улучшенный вариант находился в пределах оптимального значения диапазона, по меньшей мере, одного интересующего свойства. В некоторых дополнительных вариантах осуществления модификация содержит, по меньшей мере, одну замену аминокислоты. Еще в некоторых дополнительных вариантах осуществления укладка тестируемого белка и укладка зондового белка различаются. В некоторых вариантах осуществления интересующее свойство представляет собой электрокинетический потенциал. В некоторых других дополнительных вариантах осуществления укладка тестируемого белка содержит, по меньшей мере, одну сериновую протеазу, и укладка зондового белка содержит, по меньшей мере, одну нейтральную металлопротеазу.
Настоящее изобретение также относится к способам производства варианта фермента, специфичного к краске-субстрату, включающим: a) определение электрокинетического потенциала краски-субстрата в эталонном буфере; b) определение электрокинетического потенциала родительского фермента в эталонном буфере; и c) производство варианта фермента, специфичного к краске-субстрату посредством введения, по меньшей мере, одной аминокислотной модификации в родительский фермент из условия, чтобы электрокинетический потенциал варианта фермента, специфичного к краске-субстрату, был ближе к электрокинетическому потенциалу краски-субстрата, чем к электрокинетическому потенциалу родительского фермента. В некоторых вариантах осуществления модификация включает, по меньшей мере, одну замену аминокислоты, делецию и/или вставку. В некоторых альтернативных вариантах осуществления модификация включает химическую модификацию родительского фермента. В некоторых дополнительных вариантах осуществления вариант фермента, специфичный к краске-субстрату, положительно заряжен и является эндотермическим, и краска-субстрат отрицательно заряжена. В некоторых альтернативных вариантах осуществления вариант фермента, специфичного к краске, отрицательно заряжен и является экзотермическим, и краска-субстрат отрицательно заряжена. В некоторых дополнительных вариантах осуществления вариант фермента, специфичного к краске, положительно заряжен и является экзотермическим, и краска-субстрат положительно заряжена. В других дополнительных вариантах осуществления вариант фермента, специфичного к краске, отрицательно заряжен и является эндотермическим, и краска-субстрат положительно заряжена.
Настоящее изобретение также относится к способам производства композиции для очистки множества красок, включающим: a) определение электрокинетического потенциала каждой краски из множества в эталонном буфере; b) отбор очищающего фермента, обладающего электрокинетическим потенциалом в эталонном буфере, который в основном равен электрокинетическому потенциалу, по меньшей мере, одной краски из множества; и c) производство композиции для очистки множества красок, где композиция содержит, по меньшей мере, один очищающий фермент, выбранный на стадии b). В некоторых дополнительных вариантах осуществления композиция содержит моющий раствор с pH и удельной электропроводностью, которые в основном равны таковым эталонного буфера. В некоторых дополнительных вариантах осуществления стадия отбора устанавливает более чем один очищающий фермент. В некоторых других дополнительных вариантах осуществления композиция содержит, по меньшей мере, два очищающих фермента и где, по меньшей мере, два очищающих фермента обладают электрокинетическими потенциалами, которые соответствуют электрокинетическим потенциалам, по меньшей мере, двух красок из множества.
Настоящее изобретение также относится к композициям для очистки множества красок, произведенным с использованием способов, изложенных в настоящем документе. В некоторых предпочтительных вариантах осуществления композиции содержат, по меньшей мере, один очищающий фермент. В некоторых альтернативных вариантах осуществления, по меньшей мере, один очищающий фермент представляет собой вариант белка. В некоторых дополнительных вариантах осуществления вариант белка более отрицательно заряжен, чем белок-предшественник дикого типа, используемый для производства варианта белка, тогда как в некоторых альтернативных вариантах осуществления вариант белка более положительно заряжен, чем белок-предшественник дикого типа, используемый для производства варианта белка. В некоторых дополнительных вариантах осуществления вариант белка более отрицательно заряжен, чем белок-предшественник дикого типа, используемый для производства варианта белка для увеличения стабильности в детергентах, содержащих анионные поверхностно-активные вещества.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
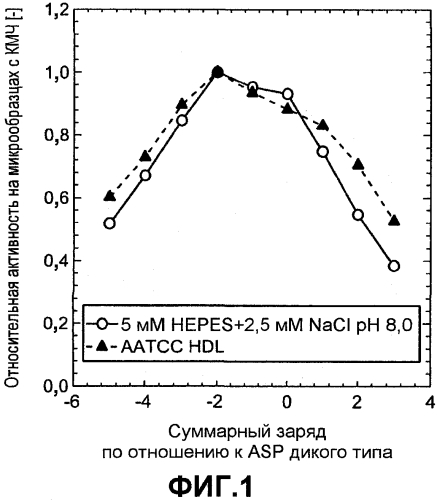
Фиг.1 показывает относительную активность на микрообразцах с кровью-молоком-чернилами (КМЧ) (нормализована по отношению к образецу с лучшей эффективностью) для вариантов ASP как функцию от изменения суммарного заряда по отношению к ASP дикого типа, которую измеряли в жидком детергенте AATCC (залитые треугольники) и буфере (незалитые круги) с совпадающим pH и удельной электропроводностью (5 мМ HEPES pH 8,0, 2,5 мМ NaCl).
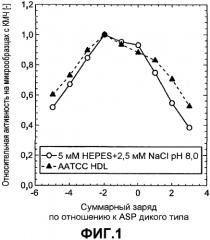
Фиг.2 показывает относительную активность кровь-молоко-чернила (КМЧ) на микрообразцах (нормализована по отношению к образцу с оптимальной эффективностью) для комбинаторной библиотеки заряда ASP как функцию изменения суммарного заряда по отношению к ASP дикого типа, которую измеряли в жидком детергенте AATCC (залитые треугольники).
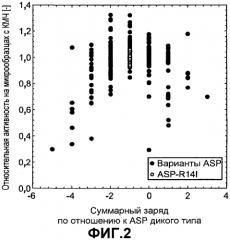
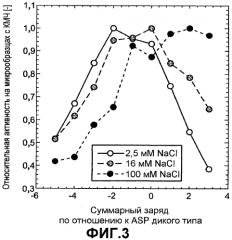
Фиг.3 показывает относительную активность КМЧ на микрообразцах (нормализована по отношению к образцу с оптимальной эффективностью) для вариантов ASP как функцию изменения заряда по отношению к ASP дикого типа, которую измеряли в 5 мМ HEPES pH 8,0 с переменной концентрацией NaCl: 2,5 мМ (незалитые круги), 16 мМ (серые круги) и 100 мМ (черные круги).
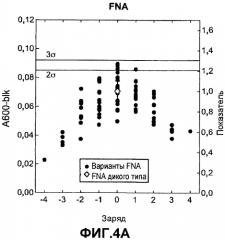
Фиг.4 показывает относительную активность кровь-молоко-чернила (КМЧ) на микрообразцах (нормализована по отношению к родительской молекуле) для вариантов из комбинаторной зарядовой библиотеки FNA (график A) и GG36 (график B) (залитые значки) как функцию изменения суммарного заряда по отношению к родительской FNA или GG36 дикого типа (незалитые значки), которую измеряли в североамериканских условиях для жидкостей для стирки.
Фиг.5 показывает относительную активность кровь-молоко-чернила (КМЧ) на микрообразцах (нормализованную по отношению к родительской молекуле) для вариантов комбинаторной зарядовой библиотеки FNA (график A) и GG36 (график B) (залитые значки) как функцию изменения суммарного заряда по отношению к родительской FNA или GG36 дикого типа (незалитые значки), которую измеряли в западноевропейских условиях для жидкостей для стирки.
Фиг.6 показывает относительную активность кровь-молоко-чернила (КМЧ) на микрообразцах (нормализованную по отношению к родительской молекуле) для вариантов комбинаторной зарядовой библиотеки FNA (график A) и GG36 (график B) (залитые значки) как функцию изменения суммарного заряда по отношению к родительской FNA или GG36 дикого типа (незалитые значки), которую измеряли в японских условиях для порошков для стирки.
Фиг.7 показывает относительную активность к печеным яйцам на микрообразцах (нормализованную по отношению к родительской молекуле) для вариантов комбинаторной зарядовой библиотеки FNA (график A) и GG36 (график B) (залитые значки) как функцию изменения суммарного заряда по отношению к родительской FNA или GG36 дикого типа (незалитые значки), которую измеряли в западноевропейских условиях для автоматической мойки посуды.
Фиг.8 показывает активность на микрообразцах с рисовым крахмалом (нормализованную по отношению к родителю) для вариантов комбинаторной зарядовой библиотеки S242Q (незалитые значки) как функцию изменения суммарного заряда по отношению к родителю (залитые значки), которую измеряли в североамериканских условиях стирки.
Фиг.9 показывает активность к рисовому крахмалу на микрообразцах (нормализованную по отношению к родителю) для вариантов комбинаторной зарядовой библиотеки TS23t (незалитые значки) как функцию изменения суммарного заряда по отношению к родителю (залитые значки), которую измеряли в западноевропейских условиях стирки.
Фиг.10 показывает относительную специфическую активность гидролиза BODIPY крахмала (нормализованную по отношению к родителю) для вариантов комбинаторной зарядовой библиотеки S242Q (незалитые значки) как функцию изменения суммарного заряда по отношению к родителю (залитые значки).
Фиг.11 показывает конечную вязкость AmyS в рамках первой шкалы зарядов как функцию изменения суммарного заряда по отношению к AmyS дикого типа.
Фиг.12 по первой оси показывает активность КМЧ на микрообразцах для вариантов ASP как функцию электрокинетического потенциала, которую измеряли в буфере (5 мМ HEPES pH 8,0, 2,5 мМ NaCl). Вторая ось отображает активность КМЧ на микрообразцах для вариантов ASP (нормализованную к пиковому значению аппроксимации нормального распределения, сплошная линия) как функцию z-оценки. Электрокинетический потенциал краски-субстрата равен -8,97 мВ.
Фиг.13 показывает активность КМЧ на микрообразцах для вариантов ASP как функцию доли связанной ASP, которую измеряли в 5 мМ HEPES pH 8,0 с переменной концентрацией NaCl: 2,5 мМ NaCl (незалитые), 16 мМ NaCl (серые) и 100 мМ NaCl (черные).
Фиг.14 показывает долю связанной ASP как функцию изменения суммарного заряда по отношению к ASP дикого типа, которую измеряли в детергенте AATCC HDL (треугольники) или в 5 мМ HEPES pH 8,0 с переменной концентрацией NaCl: 2,5 мМ NaCl (незалитые круги), 16 мМ NaCl (серые круги) и 100 мМ NaCl (черные круги).
Фиг.15 показывает частичное связывание зарядовых комбинаторных вариантов ASP (незалитые значки) как функцию изменения суммарного заряда по отношению к родителю ASP-R14I (залитые значки), которое измеряли в 5 мМ HEPES pH 8,0 с 2,5 мМ NaCl.
Фиг.16 показывает частичное связывание ASP как функцию электрокинетического потенциала, измеренного в 5 мМ HEPES pH 8,0 с 2,5 мМ NaCl.
Фиг.17 показывает уровни экспрессии вариантов ASP в Bacillus subtilis как функцию изменения суммарного заряда по отношению к ASP дикого типа.
Фиг.18 показывает на первой оси уровни экспрессии вариантов ASP (залитые круги) и NprE (незалитые круги) в Bacillus subtilis как функцию электрокинетического потенциала, измеренного в эталонном буфере 5 мМ HEPES pH 8,0 с 2,5 мМ NaCl. Вторая ось обозначает уровни экспрессии вариантов ASP (нормализованные к пиковому значению аппроксимации нормального распределения, сплошная линия) как функция z-оценки.
Фиг.19 показывает стабильность вариантов ASP в присутствии LAS как функцию изменения суммарного заряда по отношению к ASP дикого типа.
Фиг.20 показывает стабильность вариантов FNA в присутствии LAS/ЭДТА как функцию изменения суммарного заряда по отношению к родительскому FNA.
Фиг.21 показывает стабильность вариантов TS23t в присутствии LAS/ЭДТА как функцию изменения суммарного заряда по отношению к родительскому TS23t-7mut.
Фиг.22 показывает термостабильность вариантов ASP как функцию изменения суммарного заряда по отношению к ASP дикого типа.
Фиг.23 показывает тепловую стабильность AmyS в рамках первой шкалы зарядов как функцию изменения заряда по отношению к AmyS дикого типа.
Фиг.24 показывает тепловую активность ASP (график A) и NprE (график B) как функцию изменения суммарного заряда по отношению к ASP и NprE дикого типа соответственно при различных температурах, 40°C, 50°C и 60°C. Тепловая активность показана как коэффициент для активности при 30°C (активность при повышенной температуре, деленная на активность при 30°C).
Фиг.25 показывает тепловую активность ASP (график A) и NprE (график B) как функцию электрокинетического потенциала при различных температурах, 40°C, 50°C и 60°C. Тепловая активность показана как коэффициент для активности при 30°C (активность при повышенной температуре, деленная на активность при 30°C).
Фиг.26 показывает тепловую стабильность вариантов ASP со шкалой зарядов при 30°C (незалитые круги) и 40°C (залитые круги) в 5 мМ HEPES pH 8,0 с 2,5 мМ NaCl.
На фиг.27 предоставлена матрица изменения заряда, показывающая изменение заряда для замен аминокислотных остатков при pH 8,6. С помощью этой матрицы можно легко определить изменение суммарного заряда варианта фермента по сравнению с родительским ферментом.
На фиг.28 предоставлена матрица изменения способности образовывать водородные связи, показывающая изменение способности образовывать водородные связи для замен аминокислотных остатков. С помощью этой матрицы можно легко определить изменение способности образовывать водородные связи варианта фермента по сравнению с родительским ферментом.
На фиг.29 предоставлена матрица изменения гидрофобности Кайта-Дулиттла, показывающая изменение гидрофобности для замен аминокислотных остатков. С помощью этой матрицы можно легко определить суммарное изменение гидрофобности варианта фермента по сравнению с родительским ферментом.
На фиг.30 предоставлена матрица изменения гидрофобности Эйзенберга, показывающая изменение гидрофобности для замен аминокислотных остатков. С помощью этой матрицы легко определить изменение суммарной гидрофобности варианта фермента по сравнению с родительским ферментом.
На фиг.31 предоставлена активность очистки от рисового крахмала AmyS в рамках первой шкалы зарядов как функция pH. pH 3,0-4,25 представляет собой 200 мМ формиат натрия +0,01% Tween-80. pH 4,25-5,5 представляет собой 200 мМ ацетат натрия +0,01% Tween-80. Данные совпадают с кривыми титрования, каждая с одним значением pKa.
На фиг.32 предоставлены значения pKa, определенные на фиг.31, построенной в зависимости от изменения заряда по отношению к AmyS дикого типа.
ОБЩЕЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к эффективным способам получения белка с одним или несколькими полезными характеристиками в промышленном, потребительском или фармацевтическом применениях. В некоторых предпочтительных вариантах осуществления, настоящее изобретение относится к способам производства превосходных ферментов для заданного применения посредством скрининга сокращенного набора испытываемых ферментов.
Протеаза субтилизин является основным ферментом, используемым в детергентах для стирки и возможно наиболее широко используемым ферментом в мире. Почти двадцать лет назад было отмечено, что поверхностные электростатические эффекты могут модулировать каталитическую активность субтилизина (смотрите, например, Russell and Fersht, Nature 328:496-500 [1987]). Позже было замечено, что мутации, которые касаются изменения суммарного заряда субтилизина, обладают сильным действием на эффективность стирки в детергентах (смотрите, например, EP патент № 0479870 B1, включенный в настоящий документ в качестве ссылки). Предполагалось, что положительное воздействие является результатом сдвига pI (изоэлектрическая точка) субтилизина в сторону pH моющего раствора. Однако последняя работа показала, что это заключение не всегда применимо (смотрите, например, патент США № 6673590 B1, включенный в настоящий документ в качестве ссылки). Как показано в этом патенте, действие зарядовых мутаций на субтилизин существенно зависит от концентрации детергента, причем мутации, снижающие pI родительского субтилизина, предоставляют фермент, который более эффективен при низкой концентрации детергента, и мутации, повышающие pI, предоставляют фермент, который более эффективен при высокой концентрации детергента. Это очень полезно, потому что концентрация детергента в моющих растворах значительно меняется в мировом масштабе. Таким образом, специалистам в данной области стало очевидно, что существует оптимальная pI для эффективности стирки субтилизина, которая зависит от pH и концентрации детергента в моющем растворе. Были описаны дальнейшие попытки к улучшению активности субтилизина в детергентах для стирки (смотрите патентную заявку США № 2005/0221461, включенную в настоящий документ в качестве ссылки). К удивлению, было обнаружено, что варианты субтилизина, обладающие таким же суммарным электростатическим зарядом, как у родительского субтилизина, обладают увеличенной эффективностью стирки как в условиях мытья с низкой, так и с высокой концентрацией детергента. Таким образом, электростатические свойства белков (например, ферментов) обладают значительным действием на их функции.
Ранее попытки разработать превосходные белки были сосредоточены на минимизации связывания фермента с поверхностями. Например, некоторые способы касались изменения последовательности субтилизина для получения вариантов фермента со сниженной адсорбцией на нерастворимых основах (смотрите, например, WO 95/07991). В другом подходе pI субтилизина изменяли для того, чтобы получить варианты фермента с суммарным зарядом, равным нулю при определенном pH (смотрите, например, WO 91/00345). Однако в процессе разработки по настоящему изобретению было определено, что эти подходы не всегда успешны. Как описано в настоящем документе, поверхностные свойства ферментов, включая связывающие свойства, как правило, вместо непрерывного изменения обладают оптимумами как функцией заряда в поверхностном заряде или гидрофобности. Даже для ферментов, которые обычно достаточно активны, поверхностные свойства могут приводить к тому, что реакция в целом будет проходить значительно ниже при некоторых условиях и с некоторыми субстратами, чем при других условиях и/или с другими субстратами. В некоторых вариантах осуществления настоящего изобретения поверхностные свойства фермента модифицированы посредством изменения свойства одной или нескольких аминокислот на поверхности фермента. Когда эти изменения выполнены в сайтах на поверхности, которые не взаимодействуют с любыми другими аминокислотами и не необходимы для функции фермента, свойства белка предсказывают с использованием способов по настоящему изобретению, исходя из свойств аминокислот, замененных в этих позициях. В некоторых вариантах осуществления эти сайты легко определяют исходя из структурных данных, тогда как в других вариантах осуществления применение находят выравнивания гомологичных последовательностей, данные библиотеки оценки сайтов и/или любое их сочетание. В дополнительных вариантах осуществления матрицы замен аминокислот находят применение для направления замены аминокислоты(-кислот) и для установления тех физических свойств белка, которые коррелируют со свойствами незамененных аминокислот.
Настоящее изобретение относится к эффективным способам получения белка с одной или несколькими полезным характеристиками для промышленного, потребительского или фармацевтического применения. В частности, настоящее изобретение относится к способам производства превосходных ферментов для заданного применения посредством скрининга сокращенного набора испытываемых ферментов. Несмотря на то что в настоящем документе дано описание в отношении образцовой сериновой протеазы (например, ASP) и образцовой металлопротеазы (например, NprE), композиции и способы по настоящему изобретению не ограничены протеазами. Фактически, настоящее изобретение находит применение для повышения эффективности различных классов ферментов, а также протеаз (например, амилаз, целлюлаз, оксидаз, оксидоредуктаз, кутиназ, маннаназ, пектиназ, амилаз, липаз и т.п.). Фактически, не планируется, что настоящее изобретение ограничено любым конкретным ферментом или классом ферментов. Кроме того, настоящее изобретение находит применение при оптимизации свойств неферментативных белков и производстве требуемых превосходных белков.
Если не указано иначе, осуществление настоящего изобретения на практике касается общепринятых способов, общеупотребимых в молекулярной биологии, микробиологии и рекомбинации ДНК, которые известны специалистам в данной области. Такие способы известны специалистам в данной области и описаны во многих руководствах и справочных изданиях, хорошо известных специалистам в данной области. Все патенты, патентные заявки, статьи и публикации, отмеченные в настоящем документе как выше, так и ниже, настоящим явно включены в настоящий документ в качестве ссылки.
Пока в настоящем документе не установлено обратное все технические и научные термины, используемые в настоящем документе, имеют такое же значение, которое обычно подразумевается специалистом в той области, к которой принадлежит это изобретение. Хотя любые способы и материалы, сходные или эквивалентные материалам и способам, описываемым в настоящем документе, находят применение при осуществлении настоящего изобретения на практике, некоторые из п