Средства на основе медь (ii) содержащего комплексного соединения дигидрокверцетина, обладающее противовирусной активностью
Иллюстрации
Показать всеИзобретение относится к области химико-фармацевтической промышленности и медицины. Изобретение представляет применение комплексного соединения ионов Cu2+ с депротонированным (+)-дигидрокверцетином (2,3-дигидро-3,5,7-тригидрокси-2-(3,4-дигидроксифенил)-4Н-1-бензопиран-4-он) с общей формулой ML(Н2О)n, где Μ - медь(II), L - депротонированный (+)-дигидрокверцетин, а именно, комплексного соединения состава CuLH2O, в качестве средств с противовирусной активностью в отношении вирусов гриппа штаммов A/Aichi/2/68 (H3N2) и A/Duck/Potsdam (H5N2). Изобретение обеспечивает выраженные новые свойства комплексного соединения меди с (+)-дигидрокверцетином, обладающего непосредственной активностью в отношении вирусов гриппа А/Аichi/2/68 (H3N2) и прямой вирулицидной активностью по отношению к вирусу А/Duck/Potsdam (H5N2). 1 ил., 5 табл., 4 пр.
Реферат
Изобретение относится к области химико-фармацевтической промышленности и медицины и касается средств, обладающих противовирусной активностью в отношении вирусов гриппа штаммов A/Aichi/2/68 (H3N2) и A/Duck/Potsdam (H5N2).
Проблема гриппа и гриппоподобных инфекций не теряет своей актуальности из-за уникальной способности вирусов гриппа к изменчивости путем мутаций, рекомбинаций и реассортации генов, что сопровождается модификацией биологических свойств возбудителя и является причиной неконтролируемого распространения инфекции. Несмотря на успехи в создании вакцин, средств химиопрофилактики и терапии, ежегодно эпидемии гриппа охватывают страны и континенты. Иммунитет, формируемый у населения в результате вакцинопрофилактики, приводит к появлению новых дрейф-вариантов, ускользающих от вируснейтрализующего действия специфических антител.
Известны противовоспалительные, противовирусные, противоотечные, иммуностимулирующие препараты для лечения гриппа, направленные на различные специфические мишени в патогенезе гриппозной инфекции.
Противовирусные препараты для лечения гриппа по механизмам действия можно классифицировать на ингибиторы разных этапов вирусной репродукции, внутри которых можно выделить ингибиторы адсорбции и слияния вирусной и клеточной мембран - арбидол, камостат, препараты группы полиоксиметаллатов и полиоксиполимеров, ингибиторы декапсидации вируса - производные амантадина - ремантадин и амантадин, ингибиторы репликации вируса - рибаверин и амиксин, препараты - ингибиторы транскрипции вируса - соединения класса диоксибутанов и пирролидинов, группу препаратов ингибиторов высвобождения вируса из клетки, такие как озелтамивир и занамивир. Практически каждый из этих препаратов имеет недостатки - ограниченную активность, высокую токсичность и различные другие побочные эффекты.
В связи с этим важной задачей являются поиск новых, активных в отношении разнообразных штаммов вируса гриппа, средств, действие которых направлено против самого вируса и на снижение реактивных процессов в организме.
Вирусы гриппа вызывают в организме окислительный стресс, а генерирование биорадикалов О2 ·-, ClO-, OONO-, NO· и др. является фактором, поддерживающим вирусную репродукцию [Suliman Η.В., Ryan L.K., Bishop L., Folz R.J. Prevention of in influenza-induced lung injury in mice overexpressing extracellular superoxide dismutase. Am. J. Physiol. Lung. Cell. Mol. Physiol. 2001, Vol.280, p.L69-L78; Kumar N., Zhong-tao Xin, Yuhong Liang, et al. NF-кВ Signaling Differentially Regulates Influenza Virus RNA Synthesis. J. Virol. 2008, Vol.82, p.9880-9889; Nencioni L., Sgarbanti R., De Chiava G., et al. Influenza virus and redox mediated cell signaling: a complex network of virus/host interaction. New Microbiol., 2007, Vol.30, p.367-375]. Происходит это путем активации различных сигнальных каскадов, один из которых связан через подавление активных форм кислорода с ингибированием активности транскрипционного фактора Nf-kB, который, как известно, осуществляет избирательную репродукцию РНК вируса гриппа. Было показано, что некоторые антиоксидантные флавоноиды, в частности кверцетин, являются прямыми ингибиторами Nf-kB, что и обеспечивает их ингибирующее действие на гриппозную инфекцию [Cho S.Y., Park Sang-Joon, Kwon Myung-Ja, et al. Quercetin suppresses proinflammatory cytokines production through MAP kinases and NF-kappaB pathway in lipopolysaccharide-stimulated macrophage. Mol. Cell. Biochem. 2003, Vol.243, p.153-601.
Также известно, что флавоноиды оказывают превентивное антиоксидантное действие путем индукции синтеза специализированных антиоксидантных ферментов супероксиддисмутазы (СОД) и каталазы [Кольтовер В.К. Антиоксидантная биомедицина: от химии свободных радикалов к системно-биологическим механизмам // Известия академии наук. Серия химическая. 2010. С.37]. Флавоноиды кверцетин и дигидрокверцетин в качестве антиоксидантных препаратов используются для коррекции и лечения многих патологических состояний и болезней человека [Havsteen В.H. The biochemistry and medical significance of the flavonoids. Pharmacology & Therapeutics. 2002. Vol.96, p.367]. Эти соединения рекомендованы в качестве монопрепаратов для снижения окислительного потенциала клеток и предупреждения перекисного окисления липидов при таких хронических заболеваниях, как атеросклероз, диабет и аутоиммунные заболевания, гриппозные инфекции [Киселев О.И. Химиопрепараты и химиотерапия гриппа. Санкт-Петербург: Издательство «Росток». 2012, 272 с.]. Недостатками кверцетина и дигидрокверцетина являются ограниченное во времени антиоксидантное действие, выраженная зависимость от условий метаболизма и уровня генерирования активных радикалов кислорода.
В качестве прототипа заявляемых средств можно рассматривать кальциевую соль дигидрокверцетина, обладающую противовирусной активностью [Киселев О.И., Бабкин В.А., Зарубаев В.В., Остроухова Л.А. Средство для профилактики и лечения гриппа А и В. Патент RU 2380100 от 27.08.2008]. В этом патенте показано, что среди дигидрокверцетина, его кальциевой соли и смеси дигидрокверцетина с глюконатом кальция в опытах по профилактике и лечению гриппозной инфекции лучшие результаты защиты проявляет соль дигидрокверцетина, меньшую активность - смесь веществ. Защитным действием, но в меньшей степени, чем его кальциевая соль, обладает и сам дигидрокверцетин. Авторы обосновывают проявление этой активности образованием хелатированной формы флавоноида, обладающего более выраженной антиоксидантной активностью по сравнению со свободным ДКВ.
Таким образом, хелатированные комплексные соединения некоторых двухвалентных ионов биогенных металлов с флавоноидом дигидрокверцетином способны проявлять синергизм свойств флавоноида и металлсодержащего соединения, обеспечивая тем самым противовирусную, противовоспалительную и антиоксидантную активность.
Задача изобретения - расширение арсенала средств, обладающих противовирусной активностью в отношении различных штаммов вируса гриппа А.
Задача решена путем применения индивидуального хелатного комплексного соединения на основе ионов меди(II) и (+)-дигидрокверцетина, обладающего противовирусной и вирулицидной активностью по отношению к вирусам гриппа штаммов A/Aichi/2/68 (H3N2) и A/Duck/Potsdam (H5N2), соответственно.
Известно, что медь(II) является кофактором активного центра фермента супероксиддисмутазы, которая, в свою очередь, также участвует в реакциях антиоксидантной защиты организма.
Новое назначение медьсодержащего комплексного соединения на основе (+)-дигидрокверцетина, заявляемого в качестве средства, обладающего противовирусной и вирулицидной активностью по отношению к вирусам гриппа штаммов A/Aichi/2/68 (H3N2) и H5N2, не вытекает с очевидностью из его известных свойств и обнаружены авторами впервые.
Комплекс ионов Cu2+ с (+)-дигидрокверцетином (2,3-дигидро-3,5,7-тригидрокси-2-(3,4-дигидроксифенил)-4Н-1-бензопиран-4-он) с общей формулой ML(Н2О)n, где Μ - ионы меди2+, L - депротонированный (+)-дигидрокверцетин, получают в результате осуществления способа получения комплексных соединений [Трофимова Н.Н., Бабкин В.А., Вакульская Т.И., Чупарина Е.В. Синтез и установление строения комплексов и солей дигидрокверцетина с цинком, медью (II) и кальцием в водных растворах // Химия растительного сырья. 2012. №2. С. 51-62]. Там же приведены физико-химические характеристики, доказывающие индивидуальность и химическую структуру синтезированного комплексного соединения.
Медный комплекс дигидрокверцетина: C15H13O8Cu, Μ 385, т.пл. 248-249°C. CuLH2O, 2,3-дигидро-3,5,7-тригидрокси-2-(3,4-дигидроксифенил)-4Н-1-бензопиран-4-оно)-аквамедь(II).
Технический результат, обеспечиваемый изобретением, заключается в выраженных новых свойствах комплексного соединения меди с (+)-дигидрокверцетином, обладающего непосредственной активностью в отношении вирусов гриппа А/Аichi/2/68 (H3N2) и прямой вирулицидной активности по отношению к вирусу /Duck/Potsdam (H5N2). Благодаря показанной противовирусной активности данного производного дигидрокверцетина, это соединение возможно использовать в разработке оригинальных эффективных препаратов для лечения и профилактики гриппа и ОРВИ.
Заявляемое средство нетоксично. Дигидрокверцетин, на основе которого осуществляется синтез комплексных соединений ионов биогенных металлов, природный флавоноид - является продуктом промышленной переработки древесины лиственницы и отходов лесопиления и лесопереработки, т.е. его источником служит естественно возобновляемое сырье. Технология его производства экологически чистая. Все эти преимущества открывают возможность для производства заявляемого средства и их применения для лечения и профилактики гриппа и ОРВИ.
Эксперименты выполнялись в соответствии с нормами гуманного обращения с животными согласно «Правилам проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. №755).
Пример 1. Исследование токсичности комплексного соединения CuLH2O
Исследование острой токсичность при пероральном введении проводили в опытах на аутбредных белых крысах-самках массой 176,25±23,46 г., применяя ориентировочное определение показателей LD50 по методу Deichmann W.B., Le Blanc T.I. [Токсикометрия химических веществ, загрязняющих окружающую среду / Под ред. А.А. Каспарова, И.В. Саноцкого. М.: Центр международных проектов ГКНТ, 1986. 428 с.; Deichmann W.B. Determination of the approximate lethal dose with about six animals / W.B. Deichmann, T.I. Le Blanc // J. Industr. Hyd. Toxicol. 1943. 25, 9. p. 415-417].
Животные в течение эксперимента находились на стандартном режиме питания. Каждая доза испытывалась на одном животном, при этом дозы последовательно увеличивали на 50%. Испытуемые образцы вводили один раз перорально в дозах (мг/кг): 2100, 3150, 4725 и 7087,5. Объем вводимого раствора составлял 2 мл взвеси на 100 г веса животного. Для приготовления взвеси использовали 0,5% раствор пищевого крахмала. Контрольным животным вводили крахмал в эквивалентных объемах взвеси. После введения образцов за состоянием животных наблюдали 20 дней.
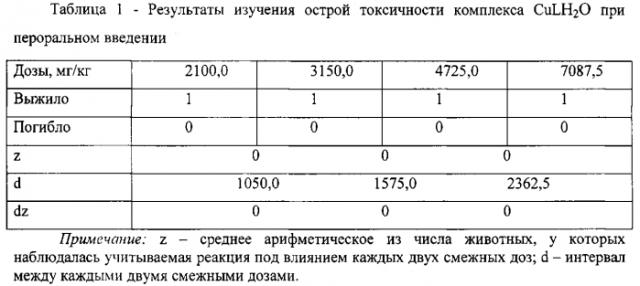
Вялость и низкая двигательная активность наблюдалась лишь в первые минуты после введения взвеси образцов. Пищу животные принимали спустя 1-1,5 ч после введения веществ. В течение всего срока наблюдения изменений во внешнем виде, поведении и состоянии животных не происходило. За время наблюдения гибели белых крыс не отмечено. При вскрытии выживших белых крыс через 20 дней после введения исследуемых образцов не обнаружено изменений в почках, печени, селезенке. Результаты определения острой токсичности образцов представлены в таблице 1.
По результатам испытаний острой токсичности исследованного комплексного соединения CuLH2O в опытах на белых крысах максимально возможная доза введения 7087,5 мг/кг не вызывала гибели животных, LD50>7087,5 мг/кг. Согласно квалификации токсических веществ образец отнесен к группе практически нетоксичных веществ.
Исследование токсичности комплексного соединения CuLH2O при внутрибрюшинном введении. Для исследуемого препарата были взяты три группы белых мышей по четыре мыши в каждой. Препарат вводили животным внутрибрюшинно в концентрации 1000, 500 или 250 мг/кг веса в объеме 0,2 мл один раз в день в течение трех суток. В течение этого времени вели наблюдение за животными, учитывали смертность в каждой группе. На основании полученных данных рассчитывали величину 50% летальной дозы (LD50).
При исследовании токсичности соединений смертность в каждой группе, при введении препарата, оказалась равной нулю. Отсюда можно сделать вывод, что вещество является малотоксичными, LD50>1000 мг/кг веса.
Пример 2. Изучение действия комплексного соединения CuLH2O на стандартной модели летальной гриппозной инфекции мышей, вызванной штаммом вируса гриппа А/Аichi/2/68 (H3N2)
Материал.
Мыши - белые беспородные, массой 16-20 г, предоставлены питомником «Рапполово», Ленинградская область. Для заражения животных был использован гомогенат легочной ткани мышей, предварительно зараженных вирусом, на 3 сутки после инфицирования. Из него готовили серию 10-кратных разведений на физиологическом растворе, после чего инфекционную активность вируса в заражающем материале определяли в отдельном эксперименте при помощи титрования по летальности на животных. Титр вируса рассчитывали по методу Рида и Менча [Am. J. Hyg., 1938, 27:493-497].
Вирус-штамм вируса гриппа А/Аichi/2/68 (Η3Ν2). Вирусы накоплены в течение 48 часов в аллантоисной полости 10-12-дневных куриных эмбрионов из коллекции вирусных штаммов НИИ гриппа РАМН.
Препарат - комплексное соединение CuLH2O, в качестве референс-препарата использовали Ремантадин (1-(1-адамантил)- аминэтилгидрохлорид).
Исследуемые препараты в необходимых концентрациях вводили животным перорально через желудочный зонд в объеме 0,2 мл по лечебной схеме (один раз в сутки в течение 5 дней начиная с 1-х суток после инфицирования животных) или внутрибрюшинно по лечебно-профилактической схеме за 24 ч, 1 ч до заражения и через 24, 48 и 72 ч после заражения. В качестве плацебо контрольной группе животных вводили физиологический фосфатный буфер.
Вирусы вводили животным интраназально под легким эфирным наркозом в дозе 1 или 10 LD50 в объеме 50 мкл/мышь. В каждую группу наблюдения брали по 30 мышей. На 3 день после заражения 10 животных из каждой группы выводили из эксперимента и изолировали легкие. Из этих 10 легких 5 использовали для выделения вируса (замораживали и хранили при -20°C до постановки соответствующих экспериментов), оставшиеся 5 фиксировали 10% формалином. Наблюдение за оставшимися животными осуществляли в течение 15 дней, т.е. срока, в течение которого при экспериментальном гриппе отмечается смертность животных. Ежедневно фиксировали вес и смертность животных в контрольных и опытных группах. На основании полученных показателей смертности в каждой группе рассчитывали процент смертности (М, отношение числа павших за 14 дней животных к общему числу зараженных животных в группе), индекс защиты (IP, отношение разницы процентов смертности в контрольной и опытной группах к проценту смертности в контрольной группе) и среднюю продолжительность жизни животных (MDD) из расчета 14 дней наблюдения в соответствии со следующими формулами:
MDD=(Σ N D)/Nt, где N - количество животных, проживших D дней, Nt - общее число животных в группе;
M=M/Nt, где Μ - число животных в группе, павших в течение 14 дней после заражения,
IP=((Мс-Ме)/Мс)×100%, где Мс и Me - смертность в процентах в контрольной и опытной группах, соответственно.
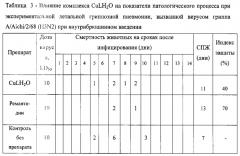
Данные защитного эффекта исследованного препарата представлены в таблицах 2 и 3. Установлено, что комплекс меди(II) с дигидрокверцетином на использованной модели летальной гриппозной пневмонии, вызванной вирусом гриппа A/Aichi/2/68 (H3N2) при пероральном введении при использованных дозах, проявил противогриппозную активность, увеличивая индекс защиты животных на 20% (табл. 2). Из данных, представленных в таблице 3? видно, что медный комплекс дигидрокверцетина при его внутрибрюшинном введении увеличивает продолжительность жизни мышей на 4 дня по сравнению с контрольной группой. Здесь индекс защиты составил уже 40% по сравнению с контролем.
Таким образом, комплекс меди(II) с дигидрокверцетином в экспериментах на стандартной модели летальной гриппозной инфекции мышей, вызванной штаммом вируса гриппа А/Аichi/2/68 (Η3Ν2) при пероральном введении, проявил протективную активность, увеличивая индекс защиты по сравнению с контролем на 20%. При внутрибрюшинном введении препарата CuLH2O индекс защиты составил 40%, что на 20% выше аналогичного показателя при пероральном введении.
Пример 3. Изучение влияния комплексного соединения CuLH2O на репликацию вируса гриппа in vivo
Методы исследования.
Для определения инфекционного титра вируса гриппа в легочной ткани животных легкие мышей, извлеченные на 3 сутки после инфицирования и введения исследуемых препаратов по схеме, указанной выше, гомогенизировали в десятикратном объеме стерильного физиологического фосфатного буфера и готовили из гомогенатов серию десятикратных разведений на том же буфере.
Монослойную культуру клеток MDCK инфицировали 10-кратными разведениями вируса и оставляли на сутки в термостате при температуре 37°C.
Через сутки из лунок отбирали по 100 мкл культуральной жидкости и вносили в планшет для иммунологических реакций, затем проводили реакцию гемагглютинации (РГА). По снижению инфекционного титра вируса по сравнению с положительным контролем судили о противовирусной активности соединений.
Титрование вируса в легочной ткани. Для определения инфекционного титра вируса гриппа в легочной ткани животных легкие мышей, извлеченные на 3 сутки после инфицирования, гомогенизировали в десятикратном объеме стерильного физиологического фосфатного буфера и готовили из гомогенатов серию десятикратных разведений на том же буфере. При определении титра вируса гриппа использовали культуру клеток MDCK, выращенных на 96 луночных панелях на среде MEM. Клетки заражали серийными десятикратными разведениями легочного гомогената от 10 до 10-6 и инкубировали в термостате в течение 48 ч. По окончании срока инкубации культуральную жидкость переносили в лунки планшета для иммунологических реакций, после чего добавляли равный объем 1% куриных эритроцитов в физиологическом растворе.
Уровень репродукции вируса в лунках панели оценивали по РГА эритроцитов. За титр вируса принимали величину, противоположную десятичному логарифму наибольшего разведения вируса, способного вызвать положительную реакцию гемагглютинации и выражали в логарифмах 50% экспериментальной инфекционной дозы вируса (lg ЭИД50).
Поскольку в предыдущем эксперименте комплексное соединение меди с дигидрокверцетином продемонстрировало более выраженную протективную активность, было изучено его влияние на репликацию вируса гриппа in vivo. Полученные данные представлены в таблице 4, из которых видно, что препарат в дозе вируса LD50 3 оказывает влияние на снижение титра вируса в легочной ткани, а проявляемый данным препаратом протективный эффект при гриппозной инфекции, вероятнее всего, осуществляется при помощи опосредованных механизмов защиты.
Пример 4. Изучение действия комплексного соединения меди (II) CuLH2O на вирус гриппа птиц A/Duck/Potsdam (H5N2)
Материал.
Вирус - штамм вируса гриппа вируса A/Duck/Potsdam (H5N2) (вирус гриппа птиц).
Препарат - комплексное соединение меди (II) CuLH2O.
Методы исследования.
Исходя из известного вирулицидного действия солей меди (CuCl2·2H2O) [Sagripant J.-L., Rouston L.B., Bonifacino А.С. et al. Mechanism of Copper-Madiated Inactivation of Herpes Simplex Virus. Antimicrob. Agents. Chemoter. 1997. Vol.41, p.812-817] комплексное соединение CuLH2O исследовалось на вирулицидную активность против вируса H5N2 (вирус гриппа птиц). Для эксперимента были приготовлены разведения препарата 5, 10, 20 мкМ для которых наблюдалось снижение титра вируса, Lg ИД50, соответственно (таблица 5). Снимки, полученные электронной микроскопией концентрата вируса A/Duck/Potsdam (H5N2) до и после обработки исследуемым препаратом, показали наличие прямого вирулицидного действия комплексного соединения CuLH2O на вирионы, заключающееся в лизисе оболочек вирионов (фиг.1). Представленные данные позволяют сделать вывод, что растворы комплекса меди (II) в широком диапазоне концентраций разрушают частицы вируса птичьего гриппа H5N2, что свидетельствует о прямом вирулицидном действии исследованного вещества.
Приложения
Краткое описание чертежей
Фиг.
Справа на фиг.: концентрат вируса группа птиц A/Duck/Potsdam (H5N2). Видны округлые вирионы, окруженные ясно выраженной «щеткой» поверхностных антигенов - рецепторов (HA, NA). Слева: Тот же вирусный концентрат, обработанный раствором комплекса CuLH2O в течение 10 мин. Видно полное разрушение вирионов. Негативное контрастирование раствором натриевой соли фосфорно-вольфрамовой кислоты, pH 7,0. Масштабные отрезки 100 нм.
1. Применение комплексного соединения ионов Cu2+ с депротонированным (+)-дигидрокверцетином (2,3-дигидро-3,5,7-тригидрокси-2-(3,4-дигидроксифенил)-4Н-1-бензопиран-4-он) с общей формулой ML(Н2О)n, где Μ - медь(II), L - депротонированный (+)-дигидрокверцетин, а именно комплексного соединения состава CuLH2O, в качестве средств с противовирусной активностью в отношении вирусов гриппа штаммов A/Aichi/2/68 (H3N2) и A/Duck/Potsdam (H5N2).
2. Применение комплексного соединения CuLH2O по п. 1 для обеспечения высокой вирулицидной активности в отношении патогенных частиц вируса птичьего гриппа A/Duck/Potsdam (H5N2).