Катод для электрохимического получения водорода и способ его изготовления
Иллюстрации
Показать всеИзобретение относится к области металлургии, а именно к катодным материалам на основе нанокристаллических частиц Fe-Ni. Катод для электрохимического получения водорода выполнен в виде стальной подложки с нанесенным на ее поверхность нанокомпозитным покрытием железо-никель. Покрытие железо-никель с содержанием Ni 3-10 мас.% выполнено толщиной 0,5-0,9 мм и со средним размером зерна, составляющим до 40 нм. Способ изготовления катода для электрохимического получения водорода характеризуетсяя тем, что подготавливают и послойно наносят на стальную подложку механоактивированную порошковую нанокомпозицию железо-никель с содержанием никеля 3-10 мас.% и проводят послойное лазерное спекание. Лазерное спекание осуществляют в вакууме оптоволоконным импульсным иттербиевым лазером при частоте генерации импульсов 20000-100000 Гц и времени действия импульса 100 нс. Полученный катод характеризуется пониженным перенапряжением водорода. 2 н.п. ф-лы, 2 табл., 1 пр.
Реферат
Изобретение относится к катодным материалам на основе нанокристаллических частиц Fe-Ni и к способу электролиза водных щелочных растворов для электрохимического получения водорода.
В промышленных электролизерах для получения водорода путем электролиза водных щелочных растворов используют в качестве материалов для катодов железо (нелегированную сталь) и/или никель [1, 2]. Известно использование железоникелевых сплавов разного состава [3, 4]. Данные по катодной активности железа и никеля в качестве материалов катодов обобщены в литературе [1, 2]. Железо, никель и их сплавы относятся к материалом со средним перенапряжением водорода, повышение активности железа в реакции катодного выделения водорода наблюдается при содержании никеля в сплаве более 20 мас.% Никель вдвое более активен, чем железо и сплавы Fe-Ni. Однако в промышленном электролизе водных растворов щелочей применяются чаще всего катоды из железа, хотя на них перенапряжение водорода выше, чем на никеле, в связи с тем, что никель более дорогой и дефицитный металл.
Наиболее низким перенапряжением водорода обладают металлы платиновой группы, особенно родий [5], однако при электролизе воды для получения водорода эти металлы практически не используются ввиду их дороговизны.
Известно [6], что лазерная обработка металлических материалов в определенных условиях приводит к синтезу на их поверхности нанокристаллических элементов, что изменяет их электрохимические, в частности коррозионные свойства.
Известен способ получения катода для электролиза водных растворов с целью получения водорода, который заключается в нанесении на металлическую подложку покрытия, содержащего оксид церия и один из металлов восьмой группы периодической системы, в частности никель. Покрытие получают посредством плазменного напыления интерметаллического соединения церия и никеля и нагревания промежуточного покрытия в неокисляющей атмосфере [7]. Данное изобретение выбрано в качестве прототипа. Недостатками катода по данному патенту являются многостадийность получения катодно активного покрытия и применение в качестве одного из компонентов редкого элемента - церия.
Была поставлена задача создания с помощью лазерных технологий материала катода на основе нанокомпозита железо-никель, т.е. материалов более доступных и дешевых по сравнению с церием и обладающихо пониженным перенапряжением водорода. Материал для катода был получен в результате лазерного спекания нанокомпозитных порошков Ni-Fe в специально подобранных условиях. Анализ изображений и электронограмм образцов методом просвечивающей электронной микроскопии показал, что полученный композит состоит из наноразмерных частиц Fe в несплошной никелевой оболочке.
Исходными материалами для получения порошка, содержащего нанокомпозитные частицы Fe-Ni, являлись карбонильное железо марки Р20 и карбонат никеля NiCO3·6H2O марки Х.Ч. Подготовка порошка включала следующие технологические стадии: механическое измельчение карбонильного железа в мельнице-активаторе планетарного типа АГО-2С в течение 10-15 минут, добавление в полученный порошок карбоната никеля в необходимом количестве для создания композиции, содержащей 3-10 мас.% Ni; совместный размол в течение 10-15 минут, отжиг образовавшегося порошкообразного композита в водороде при 400-450°C, заливка полученного композита гептаном для предотвращения контакта с воздухом и окисления.
Полученную порошковую смесь наносили на поверхность образца из стали-40 и подвергали лазерному спеканию. Путем поверхностного нанесения и спекания были получены слои Fe-Ni-композита толщиной 0,5-0,9 мм.
Лазерное спекание проводили с помощью иттербиевого оптоволоконного лазера LDesiner 1F, работающего в импульсном режиме генерации излучения, при частоте генерации импульсов от 20000 до 100000 Гц, времени действия импульса 100 нс, что соответствует скорости кристаллизации расплавленной части порошковой частицы от 0,5 м/с до 10 м/с. Обработку проводили в вакууме при остаточном давлении 5·10-1-10-2 мм ртутного столба, мощности излучения варьировали в пределах 9-20 Вт.
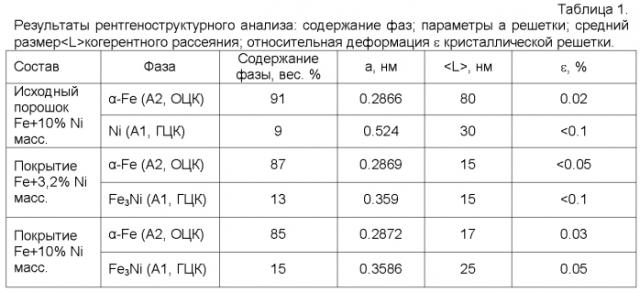
Исходный порошок Fe-Ni содержал от 3 до 10 мас.% Ni, остальное железо. Согласно данным рентгеноструктурного рентгенофазового анализа исходная смесь состояла из фаз α-Fe и Ni (при среднем размере частиц порошка от 15 до 80 нм).
Полученный на поверхности подложки из стали-40 композитный наноматериал имеет хорошее сцепление с подложкой, не отслаивается и не осыпается, в том числе и в ходе длительного электролиза, что дало основание изготовить из полученных образцов катоды для электролиза и осуществить электролиз модельного раствора щелочи (0,1 м NaOH) для измерения перенапряжения водорода.
В ходе экспериментов по изготовлению катодов на основе наноразмерного порошкообразного композита Fe-Ni было выяснено, что наиболее активные катоды получаются при содержании Ni в порошке 3-10 мас.%, что очень важно с точки зрения экономии никеля при изготовлении нанокомпозитов Fe-Ni. По этой причине исследовали образцы с содержанием Ni в указанном интервале.
Пример конкретного осуществления предлагаемого изобретения
Установлено, что в ходе совместного размола карбонильного железа и карбоната никеля последний разлагается до NiO, СО2 и Н2О. При последующем отжиге порошковой смеси в водороде NiO превращается в металлический никель. При данных условиях Ni практически не диффундирует вглубь частиц Fe и образуется нанокомпозит Fe-Ni с расчетным содержанием элементов композита.
Мехноактивированное получение исходного порошкообразного нанокомпозита приводили в шаровой планетарной мельнице из порошка карбонильного железа и шестиводного карбоната никеля путем размола в течение 10 минут. Соотношение Fe и NiCO3·6Н2О соответствовало созданию порошка с 3,2 или 10 мас.% Ni. Далее проводили отжиг полученного порошка Fe-NiO при 450-500°C в атмосфере водорода в течение 10 минут. В результате отжига была получена композиция порошков Fe и Ni с требуемым химическим составом.
Полученный порошковый материал наносили на подложку из стали-40 слоем до 0,08 мм и проводили лазерную обработку в режиме согласно методу лазерного спекания по патенту РФ №2443506, а именно с частотой генерации импульсов от 20000 до 100000 Гц и временем действия импульса 100 нс, при скоростях кристаллизации расплавленной части порошковой частицы от 0,5 м/с до 10 м/с. Далее наносили еще один слой порошка и отжигали лазером аналогично. В результате нанесения и отжига 10 слоев образовалась лазерно спеченное покрытие толщиной 0,8 мм.
Результаты рентгенографического исследования с помощью дифрактометра ДРОН-6 и Оже-электронных спектров, полученные на спектрометре Jump 10s, подтверждают сохранение нанокомпозитных структур поверхности со средним размером частиц 40 нм, табл. 1.
Для электрохимических исследований были отобраны образцы железа-армко (далее Fe), никель марки НО (далее Ni) и лазерно обработанные образцы с содержанием 3-10 мас.% Ni. Были проведены электрохимические поляризационные измерения в потенциодинамическом режиме на потенциостате IPC-Pro в электрохимической ячейке ЯСЭ-2 при комнатной температуре. В качестве электрода сравнения использовали насыщенный хлоридсеребрянный электрод, относительно которого и проведены электродные потенциалы. Подготовка поверхности образцов перед электрохимическими исследованиями заключалась в зачистке их влажной окисью алюминия, промывке дистиллированной водой и обезжиривании этанолом. Далее образцы помещали в электрохимическую ячейку с раствором 0,1 м NaOH. Одновременно включали поляризацию электродов со скоростью 1 мВ/с до потенциала -1500 мВ, т.е. катодного выделения водорода. Далее включали анодную поляризацию и доводили потенциал до 1100 мВ, т.е. до величины несколько отрицательнее равновесного водородного электрода (его величина в данных условиях -970 мВ). Далее включали катодную поляризацию и снимали обратный ход кривой до потенциала -1500 мВ.
При этом на всех исследованных образцах прямой и обратный ход кривых практически совпадают. Исследованные токи пересчитывали на видимую (геометрическую) поверхность электродов. При заданном катодном потенциале, т.е. при данном перенапряжении, измеренный ток является мерой скорости реакции катодного выделения водорода, т.е. характеризует электрокаталитическую активность электрода. В таблице 2 приведена величина плотности тока выделения водорода при перенапряжении 200 мВ для Fe, Ni, электрода с лазерно образованным нанокомпозитом Fe-Ni (3,2 и 10 мас.%).
Таким образом, в модельном щелочном растворе 0,1 м NaOH скорость выделения водорода на данном лазерно обработанном образце, имеющем на поверхности нанокомпозит Fe-10 мас. % Ni, в 8,5 раз выше, чем на Fe, и в 1,5 раза выше, чем на Ni.
Источники информации
1. Якименко Л.М. Электрохимические процессы в химической промышленности: производство водорода, кислорода, хлора и щелочей. М.: Химия, 1981, с. 52-60.
2. Шпильрайн Э.Э., Малышенко С.П., Кулешов Г.Г. Введение в водородную энергетику. М.: Энергоатомиздат, 1984, 4. - 264 с.
3. Федорова Н.С. О связи перенапряжения водорода на сплавах и межатомными расстояниями в них. Журнал физической химии. 1958, т. 32, с. 506-511.
4. Лавренко В.А., Ягупольская Л.Н., Тикун В.Л., Казаченко Е.В. Перенапряжение выделения водорода на сплавах системы железо-никель. Электрохимия, 1973, т. 9, №12, с. 1808-1811.
5. Козин Л.Ф., Волков С.В. Современная энергетика и экология: проблемы и перспективы. Киев. Наукова думка. 2006. - 775 с.
6. Харанжевский Е.В., Кривилев М.Д. Физика лазеров, лазерные технологии и методы математического моделирования лазерного воздействия на вещество. Учебное пособие. Ижевск. Издательство «Удмуртский университет», 2011. - 188 с.
7. Патент на изобретение РФ №2083724.
1. Катод для электрохимического получения водорода, выполненный в виде стальной подложки с нанесенным на ее поверхность нанокомпозитным покрытием железо-никель, отличающийся тем, что покрытие железо-никель с содержанием Ni 3-10 мас.% выполнено толщиной 0,5-0,9 мм и со средним размером зерна, составляющим до 40 нм.
2. Способ изготовления катода для электрохимического получения водорода по п.1, характеризующийся тем, что подготавливают и послойно наносят на стальную подложку механоактивированную порошковую нанокомпозицию железо-никель с содержанием никеля 3-10 мас.% и проводят послойное лазерное спекание, причем лазерное спекание осуществляют в вакууме оптоволоконным импульсным иттербиевым лазером при частоте генерации импульсов 20000-100000 Гц и времени действия импульса 100 нс.