Способ идентификации границ поражения ладонного апоневроза при контрактуре дюпюитрена
Иллюстрации
Показать всеИзобретение относится к медицине, травматологии и ортопедии, и может быть использовано для определения границ поражения ладонного апоневроза in vivo при контрактуре Дюпюитрена (КД). Границу поражения идентифицируют по данным геометрического анализа послойных магнитно-резонансных томограмм кисти в аксиальной и корональной проекциях на ядрах 1H в режиме измерения плотности протонов. В качестве критерия поражения ладонного апоневроза принимают его толщину более 1×10-3м. Способ обеспечивает неинвазивное дооперационное определение в течение не более 40 минут in vivo границ поражения при данном заболевании с возможностью построения 2D-изображения по данным МРТ с топографо-анатомической верификацией распространения поражения ладонного апоневроза. 5 ил., 3 пр.
Реферат
Изобретение относится к медицине, а именно к травматологии и ортопедии, и может быть использовано для определения границ поражения ладонного апоневроза in vivo при контрактуре Дюпюитрена (КД).
Цель изобретения: определение границ поражения ладонного апоневроза у пациента с болезнью Дюпюитрена неинвазивно, в условиях целостного организма. Методом магнитно-резонансной томографии в зоне интереса оперативного вмешательства ладонного апоневроза (aponeurosis palmaris, ЛА) кисти определяют геометрию измененного ЛА до операции.
Способ позволяет построить 2D-изображение пораженного ЛА непосредственно перед операцией и тем самым создает возможность подобрать необходимый хирургический доступ, осуществить всю полноту манипуляций, обеспечивающих тотальное иссечение пораженного aponeurosis palmaris.
Контрактура Дюпюитрена - хроническое прогрессирующее рубцовое перерождение ладонного апоневроза, сопровождающееся сгибательной контрактурой пальцев кисти. Является доброкачественной фибро-пролиферативной опухолью, по МКБ 10 - фасциальный фиброматоз неизвестной этиологии (М 720).
Главное биохимическое отклонение в aponeurosis palmaris (a. palmaris) при КД - это увеличение соотношения коллаген тип III / тип I [14], при этом в коллагене тип I повышение гидроксилирования идет не на пролине (как в норме), а на лизине [19]. Гистологическое исследование показывает рост числа фибробластов. В зоне скопления фибробластов («узелки») формируется дезорганизованный внеклеточный матрикс, бедный коллагеном I. Позднее волокна коллагена укладываются линейно, формируя характерные фиброзные тяжи, которые пальпируются подкожно. Пораженный a. palmaris образует отроги, проникающие к ладонной поверхности кисти, вызывающие деформацию кожных покровов ладони, фактически, КД является одновременно и кожной доброкачественной опухолью.
Лечение КД сводится к устранению сгибательной контрактуры пальцев и восстановлению функции кисти. Большинство отечественных и зарубежных специалистов для достижения цели отдают предпочтение оперативному методу лечения. Оперативный метод лечения КД является одновременно самым старым и предпочтительным, он был предложен Cooper в 1822 году.
Существующие методы оперативного лечения КД можно разделить на две основные группы: паллиативные - иссечение измененного тяжа ЛА через небольшие разрезы на ладони и пальцах (подкожное рассечение) и радикальные - от частичного до тотального иссечения патологически измененных тяжей ЛА.
При КД в послеоперационном периоде наблюдается крайне высокая частота операционных осложнений; интраоперационные (повреждение сосуда, нерва, сухожилия) до - 16% [5], общехирургические послеоперационные (гематома, некроз, нагноение, тугоподвижность и т.д.) до - 22,3% [10], поздние послеоперационные (рецидив, распространение, прогрессирование) до - 93,75% [4, 16]; последние, по мнению хирургов, зависят от степени (от частичного до тотального) и точности иссечения пораженного ладонного апоневроза (ЛА) [18].
Одной из проблем при выборе вида операции и технологии разреза является сложность определения границ распространения КД. Четкое знание границ поражения ЛА определяет выбор рациональной хирургической техники и радикальность оперативного вмешательства.
Известен способ идентификации границ КД, при котором визуально выявляют внешние изменения на кисти и пальцах, определяют амплитуду движений в суставах и измеряют углы сгибательной контрактуры пальцев по классификации А.П. Беюл (1926) [2]. При этом обращается внимание на рельеф кожи (кожные складки) или рельефные U-образные зоны компрессии кожи с дистальным плоским выходом - признак Hugh Johnson.
Недостатком способа является то, что он абсолютно субъективен, определение границ поражения возможно только при наличии явно визуализируемых признаков КД.
Известен способ определения линейных размеров деформации кожного покрова кисти [6], при котором на кожу наносят красящее вещество, к окрашенной поверхности прикладывают миллиметровую бумагу и вычисляют площадь деформации кожного покрова.
Недостатком способа является то, что регистрируется поверхностный дефект кожного покрова, площадь и геометрия которого не совпадают с таковыми пораженного ладонного апоневроза, расположенного на глубине от 2 до 4×10-3 метра от ладонной поверхности кисти.
Известен способ количественного определения морфологических параметров рельефа поверхности биологических объектов с помощью оптического стереомикроскопа и последующей компьютерной стереореконструкции [8]: высота, наклон, объем, извилистость, линейные размеры, ориентация элементов рельефа поверхности или структурных элементов, слагающих объемную микроструктуру исследуемого объекта, дифференциальное распределение приведенных параметров.
Недостатком способа является то, что полученное 3D-изображение рельефа кожного покрова не соотносится правильным образом с геометрией и топографо-анатомической локализацией структур, расположенных подкожно, каковым является участок поражения a. palmaris при КД.
Известен способ определения границ новообразования кожи [7], при котором производят световое облучение области новообразования и области, окружающей его и заведомо принадлежащей неизмененным тканям. Получают цифровое изображение неиндуцированной аутофлуоресценции в диапазоне длин волн, большем по отношению к световому облучению. На нем выделяют массивы из нормальных точек и опухолевых точек и определяют яркость для каждой точки двух массивов. Вычисляют частоту встречаемости точек с различной яркостью, записывают частоту встречаемости в одномерные массивы и формируют синтетический массив по предлагаемой авторами формуле. Затем определяют среднее значение функции синтетического распределения по формуле. Выделяют массив из n-точек, расположенных в окне с центром симметрии в точке с координатами (x, y), определяют яркость для каждой точки массива и вычисляют частоту встречаемости точек с различной яркостью. Записывают частоту встречаемости в двумерный массив и определяют среднюю встречаемость. Определяют вероятность прохождения границы опухоль - неизмененная ткань в точке с координатами (x, y) по приведенной формуле и по локальным максимумам, образованным точками со смежными координатами, определяют границы новообразования.
Недостатками способа являются: 1) исследуется только поверхность кожи; 2) вводится формулировка «заведомо неизмененные ткани» без объективной верификации состояния тканей; 3) трехэтапность физического анализа яркости точек и их математического анализа с введением понятия «окно» с центром симметрии в точке с координатами (x, y), средней встречаемостью и необходимостью поиска локальных максимумов. При этом границы определенного новообразования сохраняют статистически вероятностный характер.
Известен способ определения границ патологического состояния биологической ткани [11] путем измерения капиллярного кровотока кожи или слизистых оболочек с помощью аппарата "Лазерного анализатора скорости поверхностного капиллярного кровотока" (ЛАКК-01). Вначале фиксируют показатели датчика лазерного доплеровского флоуметра в заведомо непораженном участке кожи или слизистой оболочки. Затем датчик устанавливается на участок тела, расположенный рядом с патологическим процессом, имеющий показатели капиллярного кровотока, максимально близкие к нормальным. При продвижении датчика в сторону патологически измененной ткани фиксируются данные доплерограммы и при изменении показателей среднеарифметического параметра микроциркуляции относительно параметра непораженного участка на 0,3, а коэффициента асимметрии на 0,03 определяют границу патологического состояния ткани.
Недостатками способа являются: 1) apriori авторы в качестве критерия отправной точки измерения нормальные участки тканей выбирают по показателям капиллярного кровотока, максимально близкие к нормальным, что делает бессмысленным дальнейшие расчеты среднеарифметических параметров при определении параметра пораженнного участка, т.к. границей поражения является всякий участок, отличающийся от нормы по скорости капиллярного кровотока; 2) предлагаемое отклонение среднеарифметического параметра микроциркуляции, равное 0,3, и коэффициента асимметрии 0,03 не имеют значения 95% доверительного интервала, следовательно, сильно зависят от числа случаев выборки, а пределы их значений могут перекрываться с нормальными значениями регистрируемых данных 3) проекция нарушения капиллярного кровотока по своей геометрии может не совпадать с зоной патологического участка тканей, последний, обычно, превышает по размерам первый.
Известен способ определения размеров и глубины залегания анатомо-морфологических структур в живой биологической ткани [12], при котором получают оптико-когерентное томографическое (ОКТ) изображение обследуемой биологической ткани. Создают откалиброванный тест-объект путем набора стопкой, по меньшей мере, четырех полупрозрачных светорассеивающих полимерных пленок толщиной 10-50 мкм, таким образом, чтобы по меньшей мере один зазор был 50-500 мкм. Определяют размеры и глубину залегания зазора в ОКТ-изображении тест-объекта. Размеры и глубину залегания анатомо-морфологических образований в живой биологической ткани определяют по определенным формулам, включающим реальные размеры тест-объекта.
Недостатками способа являются: 1) необходимость построения фантомного объекта с заданными параметрами толщины и зазора; 2) дальнейшее исследование реального анатомо-морфологического образования требует применения определенных формул, включающих реальные размеры тест-объекта.
Известен способ идентификации границ пораженного апоневроза при КД интраоперационно [21].
Недостатками способа являются: 1) исходное произвольное нанесение разреза на ладонной поверхности кисти; 2) техника операционного доступа в ходе операции подлежит коррекции в соответствии с субъективным видением и ощупыванием пораженного a. palmaris хирургом.
Известен способ определения границы пораженного участка ткани при хирургическом вмешательстве [13], при котором рассеченную ткань в месте контакта с ножом охлаждают и измеряют переходное электросопротивление ткани, по достижении определенных значений которого периодически включают и затем выключают нагрев ножа, производят измерение времени охлаждения заведомо здоровых участков ткани и время охлаждения в каждом из циклов рассечения ткани, сравнивают полученные временные значения и при резком их изменении фиксируют место функционального состояния биологической ткани.
Недостатками данного способа являются: 1) неопределенность температурного режима нагрева ножа, и естественно, тканей, которых нож касается, что приводит к тому, что при различных температурах будет регистрироваться различное электросопротивление ткани; 2) технология подразумевает измерение времени охлаждения ткани, калькуляцию физических параметров и поиск зоны резкого их изменения. Фактически, при проведении операции хирургу предлагается отвлекаться от операции как таковой и совмещать работу оператора электроизмерительного прибора и, непосредственно, хирурга.
Известен способ повышения точности обнаружения новообразований (злокачественных) и определения границ их локализации [9], при котором измеряют интенсивности, спектры отражения и флуоресценции нормальных и подозреваемых участков на персональном компьютере. При обнаружении разницы в спектрах и при превышении интенсивности отраженного света от подозреваемого участка ткани по сравнению с нормальным более чем на 25% делают заключение о наличии злокачественного новообразования. Границы опухоли определяют визуально на экране монитора компьютера как линию, соединяющую точки изображения, в которых яркость нормальных участков изменяется более чем на 3%.
Недостатком способа является то, что вводится некое пороговое значение превышения интенсивности отраженного света на 25% и яркости на 3% по сравнению с нормальными участками тканей, что традиционно является слабым местом подобных технологий идентификации медицинского феномена, т.к. пороговое значение зависит от вида ткани или опухоли, числа выборки пациентов, расы пациента, возраста и многих других параметров, требующих нормировку.
Совокупность рассмотренных способов по идентификации границ поражения тканей, включая и новообразования делятся на 2 вида: 1) неинвазивные 2) инвазивные; характеризуются или чрезвычайной субъективностью или технической сложностью исполнения, при этом вводится понятие пороговое значение или статистически вероятностный результат в терминах дескриптивной статистики: среднее значение, коэффициент ассиметрии и т.д. Практика подобного подхода в медицине показала неэффективность его использования.
В целом, согласно приведенным способам до операции нет доступа к информации о состоянии тканей и правильная идентификация границ поражения тканей залегающих подкожно, практически невозможна.
Фактически, отсутствует пригодный к применению в практической хирургии КД надежный алгоритм визуализации распространения поражения ЛА у конкретного пациента на дооперационном этапе, in vivo.
Наиболее адекватным методом для решения данной задачи является метод MPT. В MP-томографии источником информации является не взаимодействие излучения с исследуемым веществом, а сигнал от органа или ткани, точнее, строгая зависимость локализации источника измеряемого сигнала - магнитного ядра биохимической субтанции - с его резонансной частотой и фазой, а в других методах, таких как микроскопия, ультразвуковое и рентгеновское исследования, только изменение амплитуды и фазы рассеянной волны под влиянием исследуемого объекта. Магнитное поле, радиочастотные импульсы и импульсный градиент магнитного поля необходимы лишь для возбуждения заданного ответа атомов организма, в нашем случае протонов организма.
Соответственно, времена релаксации ЯМР - 1H (T1, T2) отражают изменения содержания ионов металлов, диамагнетиков, высокомолекулярных соединений [15] и низкомолекулярных лигандов [1]. Показатели плотности протонов (PD), времена релаксации (T1, T2) определяются способностью молекул, составляющих ткани, образовывать гидратный слой и толщиной гидратированного слоя [17], что в свою очередь детерминируется конформацией и составом участков биохимических структур, экспонированных в водную фазу. Внедрение в клиническую практику МРТ существенно расширило возможности диагностики различных изменений лучезапястного сустава и кисти благодаря возможности получения контрастного изображения мягких тканей [3]. МРТ находит применение в исследовании кисти: хорошо визуализируются пястно-фаланговый сустав, гиалиновые оболочки, парасухожильные отеки, некроз, переломы костей [20].
В клинической практике часто говорят о T1-, Т2-изображениях и протонных изображениях. Однако в последнем случае правильно использовать термины «T1, T3 - взвешенное изображение» или «изображение, взвешенное по протонной плотности» (точнее - «промежуточно-взвешенное изображение»), потому что на самом деле это изображение зависит от всех трех факторов с преобладанием влияния какого-то одного.
Определение геометрии пораженного ладонного апоневроза методом МРТ согласно предлагаемому способу осуществляется следующим образом:
1. Используется MP-томограф с напряженностью магнитного поля не менее 1,5 T. Положение обследуемого пациента: лежа на животе головой вперед к MP-томографу, обследуемая кисть вытянута вперед, ладонью вниз. Кисть помещают в радиочастотную катушку. Для исключения искажения снимков кисть во время исследования фиксируют мягкими подушечками (силикон, размером 100×50×100×10(-3 м)), ориентируя по средней линии катушки. Используется импульсная последовательность и проекции, PD и axialis, coronalis.
2. Определяется геометрия пораженного ладонного апоневроза больного с контрактурой Дюпюитрена: обозначается исходная стартовая линия для снимков МРТ - carpi iuncturam, начало 3D-системы координат. Координата «X» (шкала-линейка) проходит вдоль кисти, координата «Y» (шкала-линейка) проходит поперек кисти, координата «Z» (шкала-линейка) перпендикулярна к осям X и Y. Уровень исследования: до metacarpophalangeal iuncturam, с шагом томограмм 3×10-3 м; регистрируются 20-25 томограмм в axialis и 18-20 томограмм в coronalis проекциях. Длительность исследования 20-30 мин.
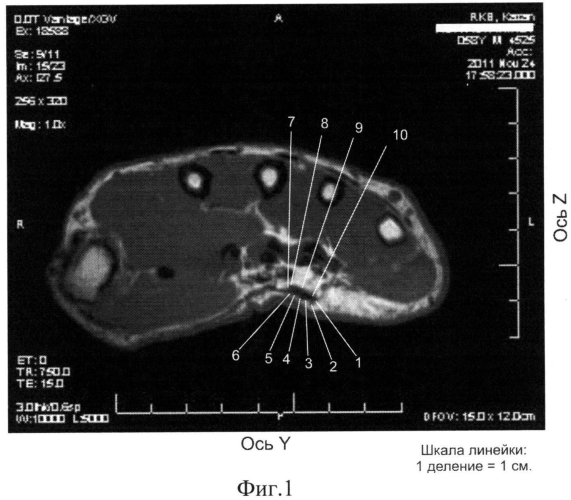
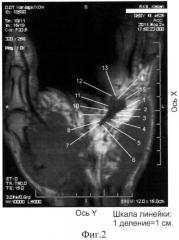
3. Определяются координаты точек конкретного сечения ЛА, соответствующих границе поражения ладонного апоневроза, в качестве критерия поражения ЛА принимается его утолщение более 1×10-3 м (фиг.1, 2).
4. По совокупности полученных данных координат геометрии пораженного участка ладонного апоневроза строится его 2D-изображение в течение 10 минут, которое переносится на изображение кисти пациента в масштабе 1:1.
Разработанный способ является неинвазивным и позволяет идентифицировать границы поражения ладонного апоневроза при контрактуре Дюпюитрена на дооперационном этапе, in vivo, в течение 40 минут.
Технический результат, на достижение которого направлено изобретение, заключается в построении 2D-изображения по данным МРТ-томографии в режиме PD, что приводит к топографо-анатомической верификации распространения поражения ладонного апоневроза на дооперационном этапе.
Способ поясняется иллюстрациями (чертежами). Краткое описание чертежей:
На фиг.1 показан томографический срез кисти, импульсная последовательность PD, проекция axialis. Общие топографо-анатомические черты aponeurosis palmaris (проекция axialis): ЛА занимает центральный отдел области ладони между thenar и hypothenar. Лучевой край ЛА проецируется на уровне лучевого края сухожилий сгибателей 2 пальца, локтевой край ЛА проецируется на уровне лучевого края сухожилий сгибателей 5 пальца. Своим лучевым краем ЛА не переходит в фасцию thenar, а в виде отрога распространяется к коже ладонной поверхности кисти по границе возвышения мышц thenar. Под ЛА расположены ветви поверхностной артериальной ладонной дуги, ветви срединного нерва, сухожилия сгибателей 2, 3, 4, 5 пальцев с червеобразными и ладонными межкостными мышцами. Детальное описание aponeurosis palmaris (проекция axialis): ЛА имеет линейную форму с четко очерченными контурами, толщина в проекции сухожилий сгибателей 2-3 пальцев составляет 0,5-1×10-3 м в проекции сухожилий сгибателей 4-5 пальцев значительное утолщение до 4×10-3 м на участке шириной 10×10-3 м, овальной формы с четкими контурами. Координаты точек данных сечений представлены на фиг.1: проекция axialis (№ точки, ее координаты y(10-2 м)/z(10-2 м);): 1. 1,4/3,4; 2. 1,5/3,6; 3. 1,7/3,5; 4. 1,9/3,4; 5. 2,1/3,3; 6. 2,3/3,3; 7. 2,4/3,2; 8. 2,3/2,9; 9. 1,9/3,0; 10. 1,5/3,2; участок пораженного ладонного апоневроза: искомые точки пораженного a. palmaris указаны стрелками №№1-10.
На фиг.2 представлена импульсная последовательность PD, проекция coronalis. Общие топографо-анатомические черты aponeurosis palmaris (проекция coronalis): ЛА занимает центральный отдел области ладони между thenar и hypothenar ближе к локтевому краю кисти в проекции сухожилий сгибателей 4-5 пальцев. По периферии ЛА окружен подкожной жировой клетчаткой. Детальное описание aponeurosis palmaris (проекция coronalis): ЛА имеет плоскостную линейную форму с четко очерченными контурами, простирается в дистальном направлении по ходу проекции сухожилий сгибателей 4-5 пальцев. Координаты точек данных сечений представлены на Фиг.2: проекция coronalis (№ точки. ее координаты x{10-2 м)/y{10-2 м);): 1. 6,8/0,4; 2. 6,6/0,6; 3. 6,3/1,1; 4. 6,1/1,4; 5. 5,8/1,6; 6. 5,5/1,7; 7. 5,5/1,8; 8. 5,8/1,8; 9. 6,3/1,6; 10. 6,6/1,5; 11. 6,9/1,6; 12. 7,5/1,4; 13. 7,6/1,1; 14. 7,3/0,9; 15. 7,2/0,5; участок пораженного ладонного апоневроза: искомые точки пораженного a. palmaris указаны стрелками №№1-15.
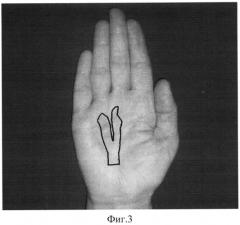
На фиг.3 приведен фотоснимок кисти пациентки Ф., КД I степень. Границы измененного ЛА, определенные методом МРТ, обведены маркером.
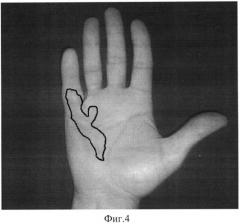
На фиг.4 - фотоснимок кисти пациента Я., КД II степень. Границы измененного ЛА, определенные методом МРТ, обведены маркером.
На фиг.5 - фотоснимок кисти пациента С., КД III степень. Границы измененного ЛА, определенные методом МРТ, обведены маркером.
Клинический результат достигается тем, что способ идентификации границ поражения ладонного апоневроза при контрактуре Дюпюитрена включает в себя геометрический анализ магнитно - резонансных томограмм на ядрах 1Н в режиме измерения плотности протонов в аксиальной и корональной проекциях. В качестве критерия поражения ладонного апоневроза принимается его утолщение больше чем 1×10-3 м. По совокупности полученных данных координат точек пораженного ладонного апоневроза строится 2D изображение на фотографии снимка кисти пациента (масштаб 1:1), и предоставляется для визуального анализа хирургу с целью выбора оптимальной техники операционного разреза и вида операции.
Клинические примеры использования предлагаемого способа у пациентов с контрактурой Дюпюитрена I, II и III степени.
Идентификация границ поражения ладонного апоневроза при контрактуре Дюпюитрена I степени.
1. Пациентка Ф., 64 года, обратилась с жалобами на уплотнение на правой ладони и периодические боли в нем. Пальпаторно определяется безболезненное уплотнение тканей площадью 1,9×10-2 м2 в средней - дистальной третях ладони в проекции сухожилий сгибателей 5 пальца, кожа над уплотнением с явлениями небольшого гиперкератоза по типу омозолелости, ограничения движений в суставах пальцев нет. Диагноз: Контрактура Дюпюитрена правая кисть, 1 степень, 3-4 пальцы.
Лабораторные анализы. Кровь: СОЭ - 7 мм/час (2-22 мм/час)* (* - в скобках показаны значения нормы), Л - 4,9·10% (4-8,8·109/л), гемоглобин - 123 г/л (115-159 г/л), палочкоядерные нейтрофилы - 4% (1-6%), сегментоядерные нейтрофилы - 57% (44-70%), эозинофилы - 4% (0-5%), моноциты 7% (2-9%), лимфоциты - 28% (18-40%). Моча: удельный вес - 1021, белок - отрицательный.
Обсуждение: выявленные данные анамнеза, физикального обследования, лабораторного анализа не позволяют однозначно идентифицировать границы поражения ЛА.
С целью верификации границ поражения ЛА проведено обследование методом МРТ PD, проекция axialis - 23 томограммы, проекция coronalis - 18 томограмм, по совокупности координат искомых точек в структуре пораженного a. palmaris установлены границы поражения ЛА (фиг.3).
Заключение: границы поражения ЛА расположены в пределах продольных тяжей ладонного апоневроза к 3-4 пальцам, от уровня основания ладони до пястно-фалангового сустава 3-4 пальцев. Площадь поражения составляет 4,8×10-2 м2 (фиг.3). Проведена операция по удалению пораженных участков ладонного апоневроза.
Идентификация границ поражения ладонного апоневроза при контрактуре Дюпюитрена II степени.
2. Пациент Я., 45 лет, обратился с жалобами на уплотнение на правой ладони и периодические боли в нем. Пальпаторно определяется безболезненное уплотнение тканей площадью 3,4×10-2 м2 в средней - дистальной третях ладони в проекции сухожилий сгибателей 5 пальца, кожа над уплотнением с явлениями небольшого гиперкератоза по типу омозолелости, имеется сгибательная контрактура в пястно-фаланговом суставе 5 пальца под углом 160 градусов, сгибание в суставах пальца от угла контрактуры не ограничено. Диагноз: Контрактура Дюпюитрена правая кисть, 2 степень, 5 палец.
Лабораторные анализы. Кровь: СОЭ - 5 мм/час (2-22 мм/час), Л - 5,2·109/л (4-8,8·109/л), гемоглобин - 131 г/л (115-159 г/л), палочкоядерные нейтрофилы - 3% (1-6%), сегментоядерные нейтрофилы - 59% (44-70%), эозинофилы - 2% (0-5%), моноциты 5% (2-9%), лимфоциты - 31% (18-40%). Моча: удельный вес - 1018, белок - отрицательный.
Обсуждение: выявленные данные анамнеза, физикального обследования, лабораторного анализа не позволяют однозначно определить границы поражения ЛА.
С целью верификации границ поражения ЛА проведено обследование методом МРТ PD, проекция axialis - 23 томограммы, проекция coronalis - 18 томограмм, по совокупности координат искомых точек в структуре пораженного a. palmaris установлены границы поражения ЛА (фиг.4).
Заключение: границы поражения ЛА расположены в пределах продольных тяжей ладонного апоневроза к 4-5 пальцам, от уровня основания ладони до пястно-фалангового сустава 4 пальца и до уровня проксимального межфалангового сустава 5 пальца. Площадь поражения составляет 7,4×10-2 м2 (фиг.4). Проведена операция по удалению пораженных участков ладонного апоневроза.
Идентификация границ поражения ладонного апоневроза при контрактуре Дюпюитрена III степени.
3. Пациент С., 72 года, обратился с жалобами на уплотнение на правой ладони и периодические боли в нем. Пальпаторно определяется безболезненное уплотнение тканей площадью 1,7×10-4м2 в средней - дистальной третях ладони в проекции сухожилий сгибателей 5 пальца, кожа над уплотнением с явлениями небольшого гиперкератоза по типу омозолелости, имеется сгибательная контрактура в пястно-фаланговом суставе под углом 130 градусов, в проксимальном межфаланговом суставе - под углом 110 градусов, сгибание в суставах пальца от угла контрактуры не ограничено. Диагноз: Контрактура Дюпюитрена левая кисть, 3 степень, 4 палец.
Лабораторные анализы. Кровь: СОЭ - 5 мм/час (2-22 мм/час), Л - 6,1·109/л (4-8,8·109/л), гемоглобин - 121 г/л (115-159 г/л), палочкоядерные нейтрофилы - 4% (1-6%), сегментоядерные нейтрофилы - 59% (44-70%), эозинофилы - 2% (0-5%), моноциты 5% (2-9%), лимфоциты - 30% (18-40%). Моча: удельный вес - 1021, белок - отрицательный.
Обсуждение: выявленные данные анамнеза, физикального обследования, лабораторного анализа не позволяют однозначно определить границы поражения ЛА.
С целью верификации границ поражения ЛА проведено обследование методом МРТ PD, проекция axialis - 23 томограммы, проекция coronalis - 18 томограмм, по совокупности координат искомых точек в структуре пораженного a. palmaris установлены границы поражения ЛА (фиг.5).
Заключение: границы поражения ЛА расположены в пределах продольных тяжей ладонного апоневроза к 3-4-5 пальцам, от уровня основания ладони до пястно-фалангового сустава 3 пальца, проксимального межфалангового сустава 4 пальца, головки 5 пястной кости. Площадь поражения составляет 4,5×10-2 м2 (фиг.5). Проведена операция по удалению пораженных участков ладонного апоневроза.
Источники информации
1. Аксенов С.Н. Влияние низкомолекулярных лигандов сыворотки крови на ЯМР параметры протонов воды растворов сывороточного альбумина: (тезисы) / С.Н. Аксенов, В.К. Боженко, О.Д. Калачихина // Материалы VII Всесоюзная конф., магнитный резонанс в биологии и медицине. - Черноголовка, 1989. - С.234-235.
2. Беюл А.П. Дюпюитреновская контрактура, ее патогенез / А.П. Беюл // Новая хирургия. - 1926. - Т.2, - №1. - С.83-102.
3. Васильев А.Ю. Комплексная лучевая диагностика ревматоидного артрита лучезапястного сустава и кисти на ранних стадиях заболевания / А.Ю. Васильев, И.Е. Обраменко, Н.В. Железинская // Мед. Визуализация. - 2007. - №2. - С.115-119.
4. Горидова Л.Д. Болезнь Дюпюитрена, хирургическое лечение и некоторые вопросы Этиопатогенеза: автореф. дис… канд. мед. наук / Л.Д. Горидова. - Харьков, 1979. - 15 с.
5. Губочкин Н.Г. Хирургическое лечение больных с контрактурой Дюпюитрена с позиции микрохирургии / Н.Г. Губочкин // Амбулаторная хирургия. - 2002. - №3 (7). - С.14-17.
6. Еникеев Д.А. Способ определения линейных размеров и площади поверхностной проекции атрофического рубца кожи / Д.А. Еникеев, Т.У. Гафаров // Бюллетень «Изобретения. Полезные модели». - 2012. - №6. - С.113.
7. Новиков И.А. Способ определения границ новообразований кожи и слизистых оболочек / И.А. Новиков, Е.А. Осипова // Бюллетень «Изобретения. Полезные модели». - 2010. - №27. - С.690.
8. Омельяненко Н.П. Способ определения морфологических количественных параметров рельефа поверхности биологических объектов: кожи, ногтей, волос, костей, хрящей, зубов и других / Н.П. Омельяненко, В.Н. Соколов, Д.И. Юрковец // Бюллетень «Изобретения. Полезные модели». - 2000. - №17. - С.299.
9. Селиванов С.П. Способ повышения точности обнаружения злокачественных новообразований и определения границ их локализации / С.П. Селиванов, В.Е. Прокопьев, Б.Н. Зырянов // Бюллетень «Изобретения. Полезные модели». - 2000. - №19. - С.387.
10. Сиваконь С.В. Комплексное хирургическое лечение контрактуры Дюпюитрена: дис… докт. мед. наук / С.В. Сиваконь. - Пенза, 2003. - С.25.
11. Способ определения границы патологического состояния биологической ткани / В.Т. Кривихин, В.М. Чекмарев, И.И. Буркин [и др.] // Бюллетень «Изобретения. Полезные модели». - 1999. - №30. - С.265.
12. Способ определения размеров и глубины залегания анатомо-морфологических структур в живой биологической ткани при ее обследовании с помощью оптико-когерентной томографии / Д.А. Рогаткин, В.И. Шумский, С.Г. Терещенко [и др.] // Бюллетень «Изобретения. Полезные модели». - 2010. - №36. - С.610.
13. Способ определения границы пораженного участка ткани при хирургическом вмешательстве / В.И. Голуб, А.П. Уточкин, В.Е. Шубин [и др.] // Бюллетень «Изобретения. Полезные модели». - 1994. - №5. - С.64.
14. Biochemistry and histology of the connective tissue of Dupuytren's disease lesions / S. Bazin, M. Le lous, V.C. Duance [et.al] // Eur. J. Clin. Invest. - 1980. - N.10. - P.9-16.
15. Gerasimova L.T. Dynamic behavior of NMR relaxation parameters in blood plasma of bums patients / L.T. Gerasimova, V.S. Veksler, I.I. Jurasov // Bruker minispec application note NMR / A 25. - 1990. - P.5.
16. Results of total aponeurectomy for Dupuytren's contracture in 61 patients: a retrospective clinical study / A. Hogemann, U. Wolfhard, D. Kendoff [et. al] // Arch Orthop Trauma Surg. - 2009. V. 129. - P.195-201.
17. Kimmich R. In vivo NMR field-cycling relaxation spectroscopy reveals 14N, 1H relaxations sinks in the backbones of proteins / R. Kimmich, W. Nugger, F. Winter // Phys. Med. Biol. - 1984. V. 29, №2. - P.593-596.
18. Leclercq C. Resultat a long terme des aponevrectomies pour maladie de Dupuytren / C. Leclercq, R. Tubiana // Chir. Med. Acad. - 1986. - V. 112 (3). - P.194-197.
19. Comperative study on the thermostability of collagen I of skin and bone: Influence of posttranslational hydroxylation of prolyl and lysyi residues / H. Notbohm, S. Mosler, M. Bodo [et. al] // J. Protein Chem. - 1992. - N. 11. - P.635-643.
20. Reimer P. Wrist joint / P. Reimer, P.M. Parizer, F.A. Stichnoth // Clinical MR Imaging. - 1999. - P. 196-198.
21. Tonkin M.A. Dupuytren's contracture: a comparative study of fasciectomy and dermofasciectomy in one hundred patients / M.A. Tonkin, F.D. Burke, J.P. Varian // J. Hand Surg. Br. - 1984. V. 9. - P.156-162.
Способ идентификации границ поражения ладонного апоневроза при контрактуре Дюпюитрена, отличающийся тем, что граница поражения ладонного апоневроза идентифицируется по данным геометрического анализа послойных магнитно-резонансных томограмм кисти в аксиальной и корональной проекциях на ядрах 1H в режиме измерения плотности протонов, в качестве критерия поражения ладонного апоневроза принимается его толщина более 1×10-3 м.