Устройство контроля участка инфузии, основанное на модели
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Устройство контроля доставки медикамента содержит пользовательский интерфейс, выполненный с возможностью приема входной информации. Входная информация содержит информацию о пациенте, и/или информацию о медикаменте, и/или информацию об устройстве сосудистого доступа. Датчик выполнен с возможностью измерения скорости изменения давления жидкости в канале доставки жидкости, через который посредством устройства сосудистого доступа доставляется медикамент к области места инфузии пациента. Процессор выполнен с возможностью определения модельного состояния области места инфузии на основе скорости изменения давления в канале доставки жидкости и входной информации. Выходное устройство предоставляет предупреждение, сигнал тревоги и/или графическую/цифровую индикацию состояния, когда установленное модельное состояние области места инфузии и скорость изменения давления жидкости в канале доставки жидкости к области места инфузии указывают на инфильтрацию. Раскрыты способ контроля доставки медикамента и считываемый компьютером носитель, содержащий команды для выполнения способа. Изобретения позволяют определить и предупредить о состоянии инфильтрации. 3 н. и 13 з.п. ф-лы, 6 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к управлению инфузией медикаментов, и в частности, к системе выявления нарушений хода инфузии медикаментов пациенту.
Описание области техники, к которой относится изобретение
Многие индивидуумы страдают хроническими заболеваниями, при лечении которых необходимо регулярное, и иногда длительное внутривенное введение медикаментов. Некоторые режимы лечения таких заболеваний, как диабет, астма, эпилепсия рак и даже аллергия, требуют регулярной и последовательной инфузии точных количеств внутривенных медикаментов для выживания пациента. Внутривенная инфузия медикаментов может принимать множество форм, в зависимости от пациента, режима лечения, и выбора врача и лечебного учреждения. Многие инфузии обеспечиваются через «центральные» линии в большие сосуды рядом с сердцем, такие как общая полая вена, или непосредственно в сердце, например, черед правое предсердие. Инфузии обычно осуществляют с помощью устройств сосудистого доступа (УСД), таких как катетеры, иглы или в/в канюли. Их можно помещать в сосуды, такие как в голове (например, в сосуды волосистой части головы), ноге (например, в тыльную вену стопы), тыльной стороне руки, запястье и внутренней стороне локтя, известной как антекубитальная область. «Инфильтрация» или «транссудация» возникает, когда медикамент случайно вводят в ткань, окружающую участок пункции УСД или выходное отверстие УСД. Может наблюдаться как значительное повреждение ткани, так и потеря медикамента, доставляемого к целевому органу. Гиперосмотическая, гипертоническая природа даже простых в/в жидкостей, используемых для инфузии, таких как физиологический раствор и декстроза, может вызывать локализованное повреждение, приводящее к травматизации нерва, некрозу ткани и инфицированию. Для центрально доставляемых катетеров пенетрация выходной частью УСД в грудину, в частности в околосердечную сумку, окружающую сердце, может угрожать жизни.
Раскрытие сущности изобретения
Имеется потребность в системе и/или способе определения того, имеется ли инфузия медикамента в область ткани, окружающую участок пункции УСД или вывод УСД. Соответственно, системы и способы, описанные здесь, предпочтительно обладают характеристикой, определяющей установленное состояние области около места инфузии (ОУИ), и обеспечивают предупреждение, сигнал тревоги и/или графическую/цифровую индикацию события, когда установленное состояние области около места инфузии и множество фактических параметров состояния жидкости канала доставки жидкости в области около места инфузии указывают на инфильтрацию. Установленное состояние области около места инфузии в некоторых вариантах осуществления определяют с помощью камерной модели области вокруг места инфузии, или с помощью непрерывной модели области вокруг места инфузии.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, обеспечивается устройство контроля доставки медикамента. Устройство включает в себя пользовательский интерфейс, выполненный с возможностью приема входящей информации, и датчик, выполненный с возможностью измерения множества параметров состояния жидкости в каналах для доставки жидкости, через которые медикамент доставляют посредством устройства сосудистого доступа (УСД) к области вокруг места инфузии у пациента. Устройство также содержит процессор, выполненный с возможностью определения состояния области вокруг места инфузии на основе множества измеряемых параметров состояния жидкости и входной информации, и выходное устройство, выполненное с возможностью обеспечения передачи информации, касающейся состояния области вокруг места инфузии.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, обеспечен способ контроля доставки медикамента. Способ включает в себя прием входящей информации и измерение множества параметров состояния жидкости в каналах доставки жидкости, в которые вводят медикамент посредством устройства сосудистого доступа (УСД) в области вокруг места инфузии у пациента. Способ также включает в себя определение состояния модели области вокруг места инфузии на основе множества измеренных параметров состояния жидкости и входной информации и обеспечение передачи информации о состоянии области вокруг места инфузии.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, обеспечивается машиночитаемый носитель, содержащий машиночитаемые команды, вызывающие выполнение процессором способа контроля доставки медикамента. Способ включает в себя прием входящей информации и измерение множества параметров состояния жидкости в каналах доставки жидкости, через которые доставляется медикамент посредством устройства сосудистой доставки (УСД), в области вокруг места инфузии у пациента. Способ также включает в себя определение модельного состояния области вокруг места инфузии на основе множества измеренных параметров состояния жидкости и входной информации и обеспечение передачи информации, касающейся состояния области вокруг места инфузии.
Сопроводительные чертежи, которые включены для обеспечения дополнительного разъяснения и являются частью настоящего описания, иллюстрируют раскрытые воплощения, и вместе с описанием служат для толкования принципов раскрытых воплощений. На чертежах:
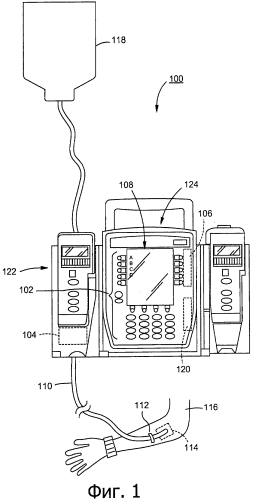
Фиг.1 иллюстрирует систему контроля доставки медикамента в соответствии с некоторыми воплощениями.
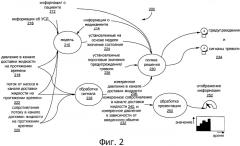
Фиг.2 является диаграммой состояний системы контроля доставки медикамента с Фиг.1.
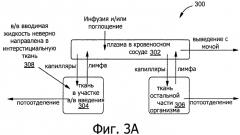
Фиг.3А является примерной трехкомпонентной моделью области вокруг места инфузии у пациента.
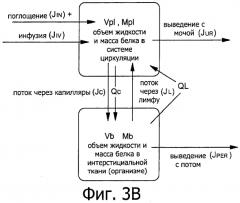
Фиг.3В является примерной двухкомпонентной моделью области вокруг места инфузии у пациента.
Фиг.3С является диаграммой, показывающей, как Уравнение 2.9 получают из Уравнения 2.8.
Фиг.3D является диаграммой инфильтрации в двухкомпонентной модели с Фиг.3В.
Фиг.3Е является моделированием инфильтрации.
Фиг.3F является примерной трехкомпонентной моделью области вокруг места инфузии у пациента.
Фиг.3G является диаграммой инфильтрации на трехкомпонентной модели с Фиг.3F.
Фиг.3Н является набором модельных уравнений для моделирования инфильтрации после в/в инфузии.
Фиг.3I является набором установленных параметров у здорового взрослого для применения с описанной камерной моделью.
Фиг.3J иллюстрирует модельный прогноз объема в ткани рядом с участком инфузии.
Фиг.3К иллюстрирует измерение давления в ткани рядом с участком инфильтрации с течением времени.
Фиг.3L иллюстрирует измерение давления сразу после в/в введения в участках ткани различного размера с течением времени.
Фиг.4А-4С иллюстрируют три положения устройства сосудистого доступа для примерной непрерывной модели в области рядом с участком инфузии у пациента.
Фиг.4В иллюстрирует решение в непрерывной модели для давления и размещения.
Фиг.4Е иллюстрирует прогнозируемое давление в области рядом с участком инфузии для трех различных скоростей введения.
Фиг.4F иллюстрирует прогнозируемое давление в области рядом с участком инфузии для определенной скорости введения.
Фиг.4G иллюстрирует давление, оцениваемое вдоль линии, проходящей через область вокруг места инфузии.
Фиг.4Н иллюстрирует осесимметричную модель на двумерной плоскости.
Фиг.4I иллюстрирует осесимметричную модель, отображенную из двумерной плоскости с Фиг.4Н в трехмерное положение.
Фиг.5 является примерным способом контроля доставки медикамента с применением системы контроля доставки медикамента с Фиг.1.
Фиг.6 является структурной схемой, иллюстрирующей примерную вычислительную систему, которая может выполнять некоторые аспекты настоящего изобретения в соответствии с одной конфигурацией настоящего изобретения.
Осуществление изобретения
При доставке жидкого медикамента в область вокруг места инфузии пациента имеется проблема повреждения, возникающего из-за введения медикамента в интерстициальное тканевое пространство (ИТП). Предшествующие попытки контроля безопасности таких инфузии были неточными или неэффективными, отчасти из-за неспособности использования информации, касающейся пациента, УСД, жидкости и предыстории. Имеются и другие проблемы, оцениваемые и решаемые, по меньшей мере частично, с помощью воплощений настоящего изобретения, которые включают устройство для контроля доставки медикамента. Устройство содержит пользовательский интерфейс, сконструированный для приема входящей информации, и датчик, сконструированный для измерения множества параметров состояния жидкости в каналах для доставки жидкости, через которые медикамент доставляют посредством устройства сосудистого доступа (УСД) к области вокруг места инфузии у пациента. Устройство также содержит процессор, сконструированный для определения состояния области вокруг места инфузии на основе множества измеряемых параметров состояния жидкости и входной информации, и выходное устройство, сконструированное для обеспечения передачи информации, касающейся состояния области вокруг места инфузии.
В следующем подробном описании многочисленные специфические детали установлены для обеспечения полного разъяснения настоящего описания. Однако рядовому специалисту в данной области техники необходимо понять, что воплощения настоящего изобретения могут быть осуществлены без некоторых из этих специфических деталей. В других случаях хорошо известные структуры и методики не показаны в подробностях, чтобы не затруднять описание.
Фиг.1 иллюстрирует систему контроля доставки медикамента 100 в соответствии с некоторыми воплощениями. Система 100 включает пользовательский интерфейс 102, выходной датчик давления 104, и процессор 106. Систему 100 применяют, например, с инфузионным насосом 122 (например, системной модульной инфузионной насосной линией CareFusion's Alaris®) или блоком контроля за пациентом 124 для контроля инфузии медикамента 118 из мешка для внутривенного (в/в) введения через канал доставки жидкости 110 в область вокруг места инфузии 114 пациента 116 посредством УСД. Как модуль инфузионных насосов 122, так и блок контроля за пациентом 124 (или «блок наблюдения за пациентом» или «БКП» или «контроллер») сопряженный с модулем 126, может содержать свой собственный пользовательский интерфейс, выводы (например, дисплеи), и процессор (например, для приема сигналов давления и контроля работы насосов). В некоторых воплощениях система 100 (например, для измерения сопротивления для модуляции потока)… Как применяется здесь, термины «область вокруг места инфузии», «ОУИ», «интерстициальное тканевое пространство», «ИТП», «участок в/в введения» и «ткань участка в/в введения», могут применяться взаимозаменяемо. Примерные УСД включают катетеры, имплантируемые порты, иглы и внутривенные канюли. В некоторых воплощениях процессор 106 применяют для выполнения обработки выбранной информации, в то время как микроконтроллер, встроенный в инфузионный насосный модуль 122, применяют для низкоуровневой (например, быстрой, в режиме реального времени) обработки, такой как модуляция скорости потока и процесс приема сигналов давления для подсчета гидравлического сопротивления.
Пользовательский интерфейс сконструирован для приема входящей информации (или «предоставленной информации») для системы 100, такой как информация о пациенте, информация о медикаменте, и/или информация о УСД, и вывода информации через выходное устройство 108. Информация о пациенте включает массу тела пациента, рост пациента, площадь поверхности тела пациента, возраст пациента и/или пол пациента. В некоторых воплощениях информация о пациенте включает диагноз пациента и лечение, которые могут влиять на такие факторы, как вероятность отека ткани в области рядом с участком инфузии. Информация о медикаменте включает химическую природу медикамента, концентрацию медикамента, скорость инфузии (например, мкг/кг/мин), и скорость потока (например, мл/час) медикамента, и природу по меньшей мере одного растворителя или вспомогательного вещества, относящихся к медикаменту. Информация об УСД включает тип УСД, размеры УСД, участок тела для УСД, величину податливости УСД, величину сопротивления УСД, и топологию инфузионной сети (например, через какие каналы проводится инфузия одним и тем же УСД). В некоторых воплощениях величины включают параметры, которые являются стационарной величиной, введенной через пользовательский интерфейс 102, хранящейся в блоке контроля за пациентом 124 и/или хранящейся в сети, подключенной к блоку контроля за пациентом 124, такой как сервер, подключенный с помощью беспроводного соединения к блоку контроля за пациентом 124. В некоторых воплощениях информация о УСД может быть доступной, и быть полученной с веб-сайта (например, с веб-сайта производителя УСД), с которым сообщается сервер. Входное устройство с проводным или беспроводным соединением можно применять для пользовательского интерфейса 102, такого как, без ограничения, клавиатура, сенсорная панель, мышь, микрофон, устройство для считывания данных с магнитных карт, датчик для считывания биометрических данных, бесконтактное считывающее устройство, радиочастотное (РЧ) идентифицирующее считывающее устройство, и устройство для считывания символов. В некоторых воплощениях сбор вышеупомянутых параметров осуществляется, по меньшей мере частично, через электронную передачу информации, такую как с применением оптического штрих-кода или радиочастотной идентификации (РЧИ) для связи между блоком контроля за пациентом или инфузионным насосом и системой 100, освобождая врача от необходимости ввода информации. В некоторых воплощениях сервер, соединенный с системой 100 (например, беспроводным или проводным способом), может принимать информацию от существующих источников, таких как система госпитализации, выписки и перевода пациента (ГВП), клинической лаборатории, автоматизированная система назначения лечения (АСНЛ), и/или аптека.
Выходной датчик давления 104 сконструирован для измерения множества параметров состояния жидкости в канале доставки жидкости 110. Параметры состояния жидкости включают, например, мгновенные изменения и скорость изменения давления в канале доставки жидкости, сопротивление в канале доставки жидкости, емкостное сопротивление в канале доставки жидкости, и гидравлическое сопротивление в канале доставки жидкости. В некоторых воплощениях давление измеряют на выходе канала доставки жидкости 110, таком как область вокруг места инфузии 114, где медикамент 118 покидает канал доставки жидкости 110.
В некоторых воплощениях гидравлическое сопротивление на входе в сеть инфузионных трубок 110 измеряют на основе модуляций мелкого масштаба, введенных процессором 106, в средней скорости инфузии медикамента 118. В некоторых воплощениях два основных подхода применяют для измерения гидравлического сопротивления на входе. Один подход применяют для скоростей выше 50 мл/ч. Другой, более сложный подход применяют для скоростей, равных или ниже 50 мл/ч. Подход при более высокой скорости, в принципе, динамически регулирует скорость потока на модели прямоугольных импульсов вокруг среднего программируемого значения и измеряет давление в ответ на эти модуляции. Итоговое давление при высокой скорости вычитают из итогового давления при низкой скорости, и эту разницу делят на разницу скоростей потока. Результат является «динамическим» входным сопротивлением пути жидкости. Полученное сопротивление фильтруют с помощью среднего значения и полученных способов усреднения для устранения шума, связанного с передвижением, и т.д. В способе с низкой скоростью потока достигается подобный результат, однако, модуляция и последующая обработка сигналов давления является несколько более сложной с целью устранения неуместной вариации потока, которая может быть нежелательной для некоторых медикаментов. Дополнительную информацию, касающуюся подходов к измерению гидравлического входного сопротивления, можно найти в патентах США №№5803917 и 6416291, включенных посредством ссылки во всей полноте. Мелкомасштабные модуляции связаны с вариациями итогового давления в канале доставки жидкости 110 для дальнейшего измерения емкостного сопротивления и полного сопротивления на входе в канал доставки жидкости 110. В некоторых воплощениях, включая те, где измеряют полное сопротивление жидкости, выходной датчик давления 104 сконструирован с высоким разрешением и высокой точностью.
Процессор 106 сконструирован для определения состояния в области вокруг места инфузии 114 на основе множества измеряемых параметров состояния жидкости и входной информации. В некоторых воплощениях процессор 106 сконструирован для регистрации по меньшей мере одного их мгновенных параметров состояния жидкости, фильтрованных параметров состояния жидкости, и долговременных тенденций параметров состояния жидкости. Процессор 106 дополнительно сконструирован для моделирования состояния жидкостей и белков (например, массы белка, пористости ткани) в области рядом с участком инфузии 114 на основе давления в канале доставки жидкости, сопротивления в канале доставки жидкости, и входной информации (например, информации о пациенте, информации о медикаменте, и/или информации об УСД). В некоторых воплощениях модель дополнительно основана на полном сопротивлении в канале доставки жидкости. Как обсуждается здесь, в некоторых воплощениях термин «полное сопротивление» включает три ортогональных параметра сопротивления, податливости и инерции. В некоторых воплощениях в модели применяется поток от насоса в канале доставки жидкости 118. В некоторых воплощениях в модели дополнительно применяется история измерения параметров состояния жидкости, такая как история инфузии медикамента 118 (например, объем вливаемого медикамента на протяжении времени). История измерения параметров состояния жидкости (например, объема вливаемого медикамента на протяжении времени), составлена для хранения в памяти 120.
В некоторых воплощениях модель является дискретной камерной моделью, непрерывной моделью или их комбинацией. Камерная модель описывает количество и давление жидкостей и белков (например, основного растворителя плазмы крови), и из этих значений получает ожидаемые объемы, деформации и давления в ткани, окружающей участок инфузии 114. Непрерывная модель описывает подобные параметры, но подсчитывает их с применением физической модели упругости и пористости ИТП с гораздо большим разрешением. Камерная модель концептуализирует и разделяет организм и его жидкости на небольшое число однородных областей, в то время как непрерывная модель описывает свойства организма и его жидкостей в трех физических измерениях на протяжении времени. В некоторых воплощениях непрерывную модель применяют в ходе уточнения структуры и параметров камерной модели, и при подходящей вычислительной мощности применяют непосредственно в системе с режимом реального времени.
Эти подходы дополняют друг друга, поскольку камерная модель имитирует поток между отдаленными областями, а непрерывная модель имитирует поток внутри области. Дополнительные подробности, касающиеся этих моделей, а также то, как их создать, описаны подробно ниже. На основе сравнения моделей для состояний без инфильтрации и при инфильтрации, выходное устройство 108 сконструировано для обеспечения передачи информации, касающейся состояния области вокруг места инфузии 114, чтобы указывать на инфильтрацию области вокруг места инфузии 114. Например, модель сконструирована для прогноза отсутствия в/в введенной жидкости в ИТП, что является нормальным состоянием, и для прогноза любого положительного значения в/в введенной жидкости как прогрессивно ухудшающегося состояния.
На основании знаний о в/в потоке, измеренного давления и сопротивления, и таких параметров, как податливость и пористость, коррелирующих с вводимыми оператором параметрами пациента, такими как возраст и расположение в/в УСД, модель прогнозирует состояние интерстициальной ткани, включая количество жидкости, добавленной в интерстициальное пространство, количество транспортируемого белка, и ожидаемое значение давления. Если параметры состояния жидкости, измеренные датчиком 104, выходят за пределы предварительно установленного диапазона соответствующих ожидаемых параметров состояния жидкости, то процессор 106 посылает сообщение выходному устройству 108. В некоторых воплощениях сообщениями на выходе являются предупреждение, сигнал тревоги и/или графическая/цифровая индикация состояния. Сообщение на выходе является, в некоторых воплощениях, событием, управляемым пороговым значением. В некоторых воплощениях сообщение на выходе представляет состояние интерстициальной ткани в виде непрерывной переменной с генерацией предупреждения/сигнала тревоги или без него. В некоторых воплощениях передача информации может осуществляться на основе других свойств, связанных с пациентом, таких как, без ограничения (1) объем жидкости, давление, податливость, и сопротивление пути инфузии, (2) объем жидкости, давление, масса белка, податливость, и пористость интерстициального тканевого матрикса, и (3) объем жидкости, давление, масса белка, податливость, и сопротивление периферического сосуда. Степень изменения этих значений, в некоторых воплощениях, является независимым параметром состояния. Например, определение податливости участка инфильтрованной ткани в области, окружающей сосуд, в некоторых воплощениях можно определить путем выявления тенденций в скорости изменения давления против нагнетаемого объема. По сравнению с сосудом, где податливость в целом является высокой, а давление в целом не изменяется сверх данного объема вливаемой жидкости, в инфильтрованном участке ткани давление может возрастать со временем, в зависимости от скорости потока насоса и его связи с лимфатическим оттоком по меньшей мере отчасти во время инфильтрации. Например, при 20 мл/ч ожидаемый лимфатический отток будет переполнен у ребенка с массой тела 10 кг, таким образом, если стенка сосуда повреждена канюлей, давление будет увеличиваться со временем. Раскрытая камерная модель прогнозирует, что давление возрастет, жидкость начнет диффундировать наружу более быстро, что в итоге приведет к относительно стационарному состоянию.
Как только выходное устройство 108, которое показано на Фиг.1 в виде дисплея, получает сообщение, выходное устройство 108 обеспечивает отображение сообщения, такого как значение, предупреждение или сигнал тревоги. Передаваемая информация может быть, например, видимым сообщением (например, экранным сообщением или графическим индикатором, таким как гистограмма или график), аудио сообщением (например, звуковым сигналом тревоги), различными типами сенсорных сообщений (например, вибрацией), или любыми их комбинациями. В некоторых воплощениях выходное устройство 108 сконструировано для отображения текущих и ожидаемых параметров состояния жидкости на протяжении времени инфузии медикамента 118 пациенту 116, независимо от того, укажут ли ожидаемые параметры состояния жидкости на инфильтрацию. Такое отображение является предпочтительным, поскольку обеспечивает для оператора возобновляемый статус области вокруг места инфузии 114 пациента 116. В некоторых воплощениях выходное устройство 108 сконструировано для отображения отклонения текущих параметров состояния жидкости от ожидаемых параметров состояния жидкости. Например, если ожидаемая в/в введенная жидкость в ИТП является нулевой, выходное устройство 108 будет отображать модель, предполагающую присутствие в/в вводимой жидкости в ИТП. В некоторых воплощениях передаваемое сообщение включает расчет с помощью описанной модели ключевого параметра состояния, например, предполагаемой внутривенно введенной жидкости в области вокруг места инфузии 114, которая должна при нормальных условиях быть нулевой. В некоторых воплощениях, как раскрыто выше, расчетный ключевой параметр состояния представляется выходным устройством так, чтобы позволить врачу решать, какое действие предпринимать. В некоторых воплощениях расчетный ключевой параметр состояния применяется в качестве порога срабатывания сигнализатора выходного устройства. В некоторых воплощениях порог может зависеть от размера области вокруг места инфузии 114 пациента (например, области вокруг места инфузии 114 для взрослого, ребенка или новорожденного), вероятной токсичности медикамента, например, для инфузионного средства с высоким раздражением порог должен быть ниже, чем для солевого инфузионного раствора для гидратации.
Выходное устройство 108 изображено в виде дисплея. Могут применяться другие типы выходных устройств, включая без ограничения принтер, звуковые индикаторы, такие как громкоговоритель, или другие визуальные индикаторы, такие как экран индикатора, включая дисплей в виде электронно-лучевой трубки (ЭЛТ), вакуумный люминесцентный дисплей (ВЛД), светоизлучающий диодный дисплей (СИД), дисплей с плазменной панелью (PDP), жидкокристаллический дисплей (ЖКД), органический светоизлучающий диод (ОСИД), или дисплей с люминофором на основе эффекта эмиссии электронов с поверхностной проводимостью (SED). Подобным образом, сообщение, передаваемое выходным устройством 108, может быть, например, визуальным сообщением (например, сообщением на экране), аудио сообщением (например, звуковым сигналом тревоги), различными типами сенсорных сообщений (например, вибрацией), или любыми их комбинациями. Выходное устройство 108 сконструировано для отображения или иного вывода информации, обеспеченной процессором 106, таким как сообщение о том, находятся ли измеренные параметры состояния жидкости в пределах предварительно установленного диапазона ожидаемых параметров состояния жидкости.
Фиг.2 является диаграммой 200 потока сигнала и обработки высокоуровневого состояния системы контроля доставки медикамента с Фиг.1. Модель 210, создаваемая процессором 106, основана на различной входной информации, включая, например, информацию о пациенте 212 (например, массу тела и другие неизменные свойства), поток от насоса в канале доставки жидкости 222 медикамента 118 на протяжении времени, давление 218 в канале доставки жидкости (например, в/в линии) на протяжении времени (например, с учетом истории зарегистрированных значений измеренного давления в канале доставки жидкости, хранящихся в памяти 120), сопротивление в канале доставки жидкости 220 на протяжении времени, и информацию об УСД 216. В некоторых воплощениях модель 210 также основана на вводимой информации, включающей информацию о медикаменте 214. Поток от насоса в канале доставки жидкости 222 медикамента 118 на протяжении времени, давление 218 в канале доставки жидкости на протяжении времени, сопротивление в канале доставки жидкости 220 на протяжении времени, и информация об УСД 216 также обеспечиваются для обработки сигнала 228, например, процессором 106. Выход модели 210, включая расчетные значения состояния 224 области вокруг места инфузии 114 пациента 116 (например то, сколько инфузионной жидкости инфильтровано в области вокруг места инфузии 114, или сколько белка, критического фактора транспорта жидкости между сосудами, лимфой и ИТП, находится в области вокруг места инфузии 114), обеспечивается для логики решений 230 (например, в процессоре 106) для обработки, например, с текущим измеренным давлением в канале доставки жидкости 238, текущим измеренным сопротивлением в канале доставки жидкости 240, и текущим измеренным давлением по отношению к вливаемому объему 232. Эти текущие измеренные значения 238, 240 и 232 обеспечиваются обработкой сигналов 228, и далее обеспечиваются для обработки с целью отображения 250, включая возможное масштабирование и сглаживание смещений динамического диапазона, для факультативного отображения на информационном дисплее 252, таком как выходное устройство 108. Например, ожидаемое давление и сопротивление 224 канала доставки жидкости 110 и текущее измеренное давление в канале доставки жидкости 238 и сопротивление 240 может отображаться для оператора, для контроля инфузии медикамента 118 пациенту 116. Возвращаясь к логике решений 230, если текущие измеренные значения 238, 240 и 232 и значения, определенные моделью 224, указывают на то, что область вокруг места инфузии 114 инфильтрована, на основании обеспеченного предупреждения и порога срабатывания тревожного сигнала 216, которые могут определяться информацией о пациенте 212 и информацией о медикаменте 224, то тревожное оповещение и/или сигнал тревоги 234 выдаются, например, выходным устройством 108, или в некоторых воплощениях, контроль 234 регулирует инфузию медикамента пациенту 116, например, насосом, связанным с устройством для контроля доставки медикамента 100.
Фиг.3А является примерной камерной моделью 300 области вокруг места инфузии 114 пациента 116. Как показано на Фиг.3А, обобщенном и существенно упрощенном примере, камерная модель разделяет жидкости организма на отдельные однородные камеры: плазму (внутри кровеносного сосуда) 302, участок в/в введения рядом с тканью 304 (в который может быть неверно направлена в/в введенная жидкость), и все другие ткани организма 306 (например, все участки вне области, непосредственно прилегающей к участку в/в введения). Модель рассчитывает объем жидкости и массу белка (первичное влияние на транспорт жидкости между камерами) внутри каждой из этих камер 302, 304 и 306 в ходе имитированной инфильтрации на основе контролируемого потока от насоса и измеренного давления, а также свойств ткани, рассчитываемых из данных, введенных пользователем, описывающих участок и возраст/массу тела пациента. Увеличение объема жидкости (например, сумма плазмы крови и в/в жидкости) внутри интерстициального пространства является первичным индикатором возрастающего осложнения, вероятно, из-за неправильного размещения устройства сосудистого доступа.
Выражения для транспорта жидкости и белка описаны шестью обыкновенными дифференциальными уравнениями, как подробно показано ниже. Давление в камере области ткани рядом с участком в/в введения рассчитывают из кривой давления-объема (податливости), определенной по массе тела пациента и описанию участка, поскольку масса тела и участок известны. Этот тип модели описывает транспорт жидкости и белка между каждой камерой с применением обыкновенных дифференциальных уравнений (ОДУ). Транспорт жидкости и белка является результатом действия системы микрососудистого обмена. Более сложная модель включает лимфатический дренаж и экзогенное, зависимое от времени поступление жидкости 308, которое может происходить при инфильтрации или развитии подкожной инфекции. Эта более усложненная модель обеспечивает расчет среднего давления и общего объема жидкости в каждой камере. Поскольку каждая камера предполагается однородной, эта модель не показывает перемещения жидкости внутри камеры. Однако камерные модели, описываемые ОДУ, являются более простыми, чем непрерывные модели, и таким образом, их проще определить и быстрее решить. Камерные модели с большим успехом применяют в области фармакокинетики.
Чтобы более подробно разъяснить, как камерная модель была разработана для данной заявки, далее подробно описаны два примерных, упрощенных воплощения камерной модели. Камерные модели (или модели из элементов с сосредоточенными параметрами) прогнозируют количества и скорости изменения (например, транспорта) вещества в различных камерах. Во-первых, описана двухкамерная модель, Фиг.3В, рассматривающая циркуляторную систему (плазму) и остальную ткань (интерстициальное тканевое пространство). Затем модель распространяется на трехкамерную систему, включающую локальную камеру, описывающую жидкость рядом с участком инфузии.
Вначале рассматривается упрощенная двухкамерная модель, разделяющая жидкости организма на две однородные камеры, плазму (PL) и интерстициальную ткань (тело) В), как показано на Фиг.3В. Эта модель устанавливает объем жидкости V и массу белка М в обеих камерах. Объем жидкости в плазме и тканях организма обозначается как VPL и VB, a масса белка в каждой камере как MPL и MB. В более полной модели, описанной после данной модели, источник экзогенной жидкости и белка добавляется к камере плазмы, имитируя нормально размещенной УСД, или к интерстициальной ткани, имитируя условия инфильтрации.
В упрощенной модели, показанной на Фиг.3В, транспорт жидкости, т.е. скорость изменения ее объема со временем dVB/dt, и белка dMB/dt, в интерстициальной ткани определяется как разница между транспортом через мембрану капилляров в ткань JC и QC, и транспортом лимфы из ткани в плазму JL и QL, а также потерей жидкости посредством выделения из циркуляторной системы Jper:
d V B / d t = J C − J L − J p e r , ( 2.1 ) и
d M B / d t = Q C − Q L . ( 2.2 )
Общий транспорт (т.е. временные изменения жидкости и белка) в плазму определяется разницей между потоком лимфы JL и капиллярным потоком JC, с дополнительным вводом жидкости с питьем Jin, и инфузией Jiv, и выведением с мочой Jur:
d V P L / d t = J L − J C + J i n + J i v − J u r ( 2.3 ) и
d M P L / d t = − d M B / d t = Q L − Q C ( 2.4 )
Обмен жидкости через мембраны капилляров (из сосуда (PL) к интерстициальной ткани (В)) моделируют в соответствии с законом мембранной фильтрации Старлинга:
J C = κ [ ( P P L − P B ) − σ ( I I P L − I I B ) ] ( 2.5 )
В соответствии с законом Старлинга, поток жидкости управляется двумя механизмами. Во-первых, закон Дарси устанавливает, что поток через пористую среду (здесь, мембрану капилляра, отделяющую артериальные и венозные кровеносные сосуды от окружающей интерстициальной ткани) пропорционален разнице гидростатического давления жидкости (ΔР=PPL-PB). Во-вторых, поток жидкости следует как осмотический градиент (ΔП=ПPL-ПB), обусловленный разницей концентраций белка по разные стороны мембраны капилляров, как описано Уравнениями 2.6 и 2.7.
Белки учитываются, поскольку они являются наиболее важными растворенными веществами, влияющими на транспорт жидкости между циркуляцией и тканью организма. Это обусловлено низкой диффузивностью белков по сравнению с растворенными веществами меньшего размера, такими как ионы. Любая разница в концентрации белка между камерами вызывает градиент коллоидного осмотического давления ΔП, который влияет на поток жидкости через мембрану капилляра в соответствии с законом Старлинга (см. Уравнение 2.5). Взаимоотношение между концентрацией белка С и коллоидным осмотическим давлением П в каждой камере составляет:
C P L = 1,522 ⋅ П P L ( 2.6 )