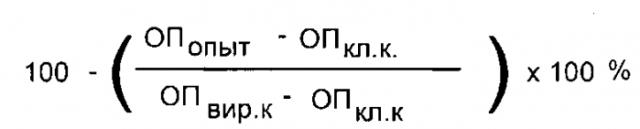Производное 1,3-адамантандиуксусной кислоты и его противовирусная активность
Иллюстрации
Показать всеИзобретение относится к области фармацевтической промышленности, конкретно к новому производному 1,3-адамантандиуксусной кислоты с аминокислотным остатком этилового эфира треонина указанной ниже формулы. Данное соединение обладает избирательной противовирусной активностью в отношении вируса гриппа А и действует на штаммы, резистентные к действию римантадина гидрохлорида. Оно может найти применение при создании новых противовирусных препаратов. 2 н.п. ф-лы, 3 ил., 3 пр.
Реферат
Изобретение относится к вирусологии и фармацевтической промышленности и касается создания нового биологически активного производного 1,3-адамантандиуксусной кислоты, которое может быть использовано для разработки противовирусных фармацевтических препаратов.
Проблема гриппа - одна из актуальнейших научных задач последнего столетия. Вирусы гриппа активно циркулируют в природе. Актуальность гриппа как медицинской проблемы обусловлена высокой заболеваемостью, наносящей огромный экономический вред. На долю гриппа и гриппоподобных заболеваний приходится до 90% всех инфекций.
В настоящее время известен ряд препаратов, направленных на подавление репликации вируса гриппа. Это ингибиторы нейраминидазы - озельтамивир (тамифлю) и занамивир (реленза), а также ингибиторы функций канала М2 - препараты ремантадин и амантадин.
В качестве специфической противовирусной терапии в настоящее время ВОЗ одобрила только один препарат - озельтамивир фосфат (тамифлю).
Соединения, содержащие субъединицы адамантана, уже давно применяют в вирусологии и фармакологии. Известны лекарственные противогриппозные препараты на основе производных адамантана - это 1-аминоадамантан (амантадин) и 1-(1-адамантил)этиламин (римантадина гидрохлорид). Кроме того, римантадин гидрохлорид, помимо вируса гриппа, ингибирует репродукцию вируса Синдбис, что может быть обусловлено тем, что он как липофильное слабое основание способен повышать pH эндосомального содержимого и тем самым препятствовать депротонизации вируса [1]. Другое соединение, содержащее субъединицы адамантана, 1-(адамант-1-ил)пропиламин (адапромин) также применяется как противовирусное средство, которое активно в отношении вирусов гриппа типа А и В, но он токсичнее римантадина гидрохлорида [2]. Известно противовирусное соединение 2-[2-(Диметиламино)этокси]-N-адамантил-1-ацетамид (тромантадин), которое применяется в виде мазей и активно в отношении вирусов простого герпеса 1-го и 2-го типов и вируса герпес Зостер [2].
В настоящее время известно, что биологическая активность римантадина гидрохлорида связана с угнетением функции белка М2 в белковой оболочке вируса гриппа А, который регулирует транспорт протонов через оболочку вируса внутрь вириона. Данные кристаллографических исследований показывают, что белок М2 содержит 4 одинаковые субъединицы, образующие тетрамер, расположенный в мембране вируса. Эти субъединицы частично спирализованы в левозакрученные α-спирали. Нормальное функционирование канала М2 во многом осуществляется за счет аминокислотных остатков трансмембранной области белка Val(27), Ala(30), Ser(31), Gly(34), His(37) и Trp(41). Эти аминокислотные остатки, структурно находясь внутри канала М2, обеспечивают ионный транспорт и его регуляцию [3]. По мнению этих исследователей присутствие объемного карбоцикла адамантана в поре мембраны вируса приводит к нарушению транспорта протонов за счет возникновения водородной связи между аминогруппой римантадина гидрохлорида и оксигруппой серина в положении 31 в трансмембранном домене.
Ремантадин используется с начала 80-х гг. прошлого века для лечения и профилактики гриппозной инфекции. Известны разработки по повышению эффективности адамантановых производных. Один из подходов - это создание комплексов с другими соединениями. В частности, комплексные соединения адамантана и полимерных матриц (поликарбоксилаты анионного типа на основе малеинового ангидрида и дивинилового спирта) способны ингибировать репродукцию вирусов гриппа А, а также вирусов простого герпеса. Данные соединения обладают токсичностью в 5-10 раз ниже, чем у римантадина гидрохлорида [4]. Другой подход - это композиция римантадина гидрохлорида с известными лекарственными препаратами или субстанциями. Например, комбинированный препарат «Анвимакс» (ООО АнвиЛаб) помимо римантадина гидрохлорида содержит парацетамол, аскорбиновую кислоту, кальций глюконат моногидрат, рутозид тригидрат, лоратадин и таким образом обладает не только противовирусным (противогриппозным), но и интерфероногенным, жаропонижающим, обезболивающим, антигистаминным и ангиопротекторным действием. [5]. Известны технические решения, основанные на пролонгации свойств римантадина гидрохлорида, например комплекс с альгинатом натрия [6] или с но-шпой [7]. Известна также композиция римантадина гидрохлорида с 3,6-диоксоциклогекса-1,4-диен-1,2,4,5-тетрасульфатом натрия, что позволяет снизить его токсичность [8]. Однако все эти комбинации не способны решить главную задачу - растущую резистентность вируса к препарату ремантадин. В результате широкого использования этого препарата для лечения гриппа в последние десятилетия он утратил свою исходную противогриппозную активность. В настоящее время выявлено большое количество штаммов, полностью резистентных к препарату ремантадин [9]. Количество резистентных форм гриппа увеличивается с каждым годом по причине спонтанных мутаций в геноме вируса. Это заставляет расширять исследования как по выявлению причин возникновения резистентности, так и по ее преодолению. Один из таких подходов - это создание новых противовирусных (эффективных против штаммов гриппа, резистентных препаратам адамантанового ряда) субстанций на базе карбоцикла адамантана.
Решение проблемы резистентности видится в синтезе нового противовирусного соединения на базе карбоцикла адамантана. Недавно проведенное изучение противовирусных свойств алкильных производных аминоадамантана на примере вируса гриппа A S-15 показало, что некоторые структуры на основе 1-аминоадамантана активно подавляют репликацию этого штамма гриппа [10]. Известно, что триазольные и тетразольные производные адамантанов обладают высоким уровнем противовирусной активности in vitro в отношении лабораторных и циркулирующих сезонных вирусов гриппа А и умеренной активностью в отношении пандемического штамма A(H1N1)pdm2009. Причем тетразольные производные адамантанов более активны, нежели их триазольные гомологи [11]. Недавний анализ последовательности гена М2 вирусов гриппа А из Вьетнама, Малайзии, Камбоджи и Таиланда показал, что Ser31Asn и Alal30Thr являются наиболее распространенными мутациями, связанными с устойчивостью к амантадину. В случае аминокислотной замены в 31 положении серина на аспарагин было исключено образование водородной связи с оксигруппой серина и адамантановый остов более не задерживался в поре канала М2, а, следовательно, был восстановлен нормальный транспорт протонов внутрь вириона [12].
Для преодоления резистентности вирусов гриппа к препаратам адамантанового ряда нами предложено внести в адамантановую молекулу дополнительные функциональные группы, которые были бы способны связаться с белками канала М2 вируса гриппа. Предположено, что увеличение числа функциональных групп в адамантановой конструкции повышает возможности химического соединения взаимодействовать с белками вируса гриппа А, т.к. восстановление противовирусной активности может зависеть как от свойств функциональной группы аминокислотного остатка, так и от расстояния ее от карбоцикла адамантана [13].
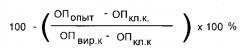
Сущность изобретения заключается в создании нового синтетического соединения, являющегося производным 1,3-адамантандиуксусной кислоты, а именно Ad-(CH2-Thr-OEt)2, которое высокоселективно подавляет репродукцию вируса гриппа А и эффективно против штаммов, резистентных к римантадину гидрохлориду. Предлагаемое производное 1,3-адамантандиуксусной кислоты с двумя остатками этилового эфира треонина, N,N-1,3-диациладамантил-диэтилтреонат (1,3-ди[N-ацил-2-амино-3-гидрокси-1-этилбутанат] адамантандиуксусной кислоты) малотоксично и имеет формулу:
Получить соединение Ad-(CH2-Thr-OEt) можно, например, методом смешанных ангидридов. Механизм противовирусного действия полученного соединения до конца не ясен. Основной предполагаемый механизм сходен с действием римантадина гидрохлорида.
Технический результат - синтезировано новое соединение, малотоксичное, обладающее избирательной противогриппозной активностью и действующее на штаммы вируса гриппа А, резистентные к действию препаратов римантадина гидрохлорида и амантадина.
Краткое описание чертежей. Для более ясного понимания сути заявленного изобретения, которое отражено в формуле изобретения, а также для демонстрации ее особенностей и преимуществ далее приводится подробное описание со ссылками на фигуры чертежей.
На фиг.1 представлена схема синтеза соединения Ad-(CH2-Thr-OEt)2 методом смешанных ангидридов.
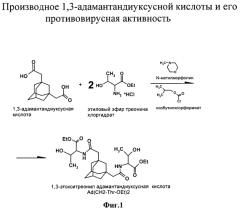
На фиг.2 представлены в виде диаграммы данные о цитотоксической активности предлагаемого соединения.
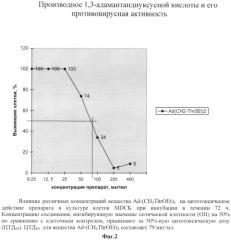
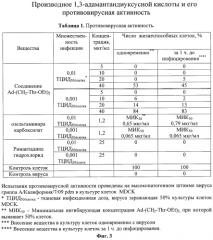
На фиг.3 представлены в виде таблицы данные влияния различных концентраций вещества Ad-(CH2ThrOEt)2 на репродукцию вируса гриппа А/Калифорния/7/09 pdm в культуре клеток Madin Darby Canine Kidney (MDCK) при добавлении вещества одномоментно с вирусом и за 1 ч до инфицирования. Испытания противовирусной активности соединения Ad-(CH2-Thr-OEt)2 проведены в сравнении с римантадина гидрохлоридом и озельтамивира карбоксилатом.
Для получения соединения Ad-(CH2-Thr-OEt)2 могут быть использованы различные подходы. Один из способов получения соединения Ad-(CH2-Thr-OEt) - метод смешанных ангидридов (фиг.1). Однако предложенный метод синтеза не должен рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
Образование пептидной связи между карбоциклом, содержащим карбоксильную группу, и эфиром аминокислоты треонина проводили в одну стадию в условиях реакции смешанных ангидридов. Метиловый эфир треонина брали в двухмолярном избытке по отношению к 1,3-адамантандиуксусной кислоте. В работе использовался метиловый эфир L-треонина, фирмы Nova Biochem. Все применяемые для конденсации растворители предварительно абсолютировали и перегоняли. Тонкослойную хроматографию (ТСХ) проводили на пластинах Silufol в системах: втор-бутанол - 3%-ный аммиак, 100:44 (А), метанол-хлороформ, 13:60 (В), бутанол-уксусная кислота-вода-пиридин, 30:3:12:10 (С). Молекулярный вес был установлен посредством масс-спектрометрии на MALDI-TOF-времяпролетном масс-спектрометре Bruker UltraFlex II с программным обеспечением для сбора и обработки масс-спектров flexControl 1.1. и flexAnalys 2.2. Удельное оптическое вращение полученного соединения определяли в стандартных условиях на автоматическом поляриметре А1-ЕПЛ (1%-ный раствор в этиловом спирте, длина кюветы 0,5 дм).
Настоящее изобретение проиллюстрировано нижеследующими примерами. Однако эти примеры не должны рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
Пример 1. Синтез Ad-(CH2-Thr-OEt)2 и его выделение.
К 0,91 г (3,61 ммоль) 1,3 адамантандиуксусной кислоты в 15,0 мл тетрагидрофурана прибавляют 0,79 мл (7,13 ммоль) N-метилморфолина (NMM). Охлаждают до (-)20-(-)25°C и при перемешивании в реакционную массу добавляют 0,94 мл (7,21 ммоль) изо-бутилхлорформиата. Перемешивают 10 мин. Затем добавляют заранее приготовленный и охлажденный до (-)20°C 0,95 г (7,13 ммоль) хлоргидрата этилового эфира L-треонина в смеси 15,0 мл тетрагидрофурана и 2,0 мл N,N-диметилформамида с 0,79 мл (7,13 ммоль) NMM. Перемешивают 30 мин, затем еще 1 ч при 0°C и 2 ч при 20°C.
Растворители удаляют в вакууме. Остаток растворяют в 35,0 мл этилацетата. Промывают последовательно Н2О (5,0 мл × 1), 0,5 н NaHCO3 (10,0 мл × 2), 10%-ной лимонной кислотой (4,0 мл × 1) и Н2О (5,0 мл × 1). Органический слой сушат безводным Na2SO4. Этилацетат удаляют в вакууме, получают маслянистый остаток. Продукт дополнительно сушат на капилляре форвакуумного насоса до прекращения вспенивания масла.
Выход: 1,35 г. (92%). Rf 0,76 (A); Rf 0,26 (B); Rf 0,75 (C), [ α ] 20 D = 8 ∘ .
Пример 2. Определение цитотоксического действия соединения.
Токсичность соединения изучена через 72 ч после внесения Ad-(CH2-Thr-OEt)2 на монослой культуры клеток MDCK в 96-луночных панелях и инкубации при 37°C. Для этого использовали соединение в концентрациях (6,25; 12,5; 25; 50; 100; 200 и 400 мкг/мл). Состояние клеточного монослоя проверяли под микроскопом. Оценку цитотоксичности проводили колориметрическим методом. После инкубации в течение 72 ч при 37°C монослой отмывали раствором фосфатного буфера (PBS). Количество жизнеспособных клеток определяли сравнением интенсивности окрашивания раствора в контрольных (без Ad-(CH2-Thr-OEt)2 и опытных лунках при добавлении нейтрального красного на автоматическом спектрофотометре при длине волны 450 нм. Концентрацию препарата, ингибирующую значение оптической плотности (ОП) на 50% по сравнению с клеточным контролем (без Ad-(CH2-Thr-OEt)2, принимают за 50%-ную цитотоксическую дозу (ЦТД50). ЦТД50 соединения Ad-(CH2-Thr-OEt)2 составила 79 мкг/мл. Данные представлены на фиг.2.
Пример 3. Исследование противовирусной активности соединения.
Испытания проводили в культуре клеток MDCK с пандемическим штаммом вируса гриппа A/Калифорния/7/09pdm, резистентным к действию римантадина гидрохлорида [14]. Изучение противовирусной активности соединения Ad-(CH2-Thr-OEt)2 проводили на 96-луночных панелях со сформировавшимся монослоем клеток. Одномоментно с инфицированием или за 1 ч до заражения в монослой клеток вносили предлагаемое соединение в концентрации 5,0; 10,0; 20,0 и 40,0 мкг/мл. Вирусным контролем служили лунки без Ad-(CH2-Thr-OEt)2. В качестве препаратов сравнения применяли римантадина гидрохлорид (25,0 мкг/мл) (Zhejiang Kangyu Pharmaceutical Со, Китай) и озельтавивира карбоксилат (Hoffmann-La Roche, Швейцария) (1,2 мкг/мл), которые добавляли по той же схеме, что и предлагаемое вещество. В лунки клеточного контроля наносили только среду и компоненты ИФА. Панели инкубировали 24 ч при 37°C, а затем останавливали реакцию фиксированием клеток 80%-ным ацетоном на PBS. Постановку метода клеточного иммуноферментного анализа (ИФА) проводили согласно методике, описанной ранее [15]. Процент ингибирования вирусной активности соединениями определяли по формуле:
где ОПопыт - оптическая плотность опытной лунки (с Ad-(CH2-Thr-OEt)2) при 492 н.м., ОПкл.к - ОП492 клеточного контроля, ОП вир.к. - ОП492 вирусного контроля.
Из данных таблицы 1 (фиг.3) видно, что синтезированное соединение Ad-(CH2-Thr-OEt)2 защищает клетки монослоя MDCK от цитопатического действия вируса. Соединение Ad-(CH2-Thr-OEt)2 показало значительный процент ингибирования (от 45 до 84%) репродукции штаммов вируса гриппа А, устойчивых к действию римантадина гидрохлорида как в опытах по одномоментному внесению препарата с вирусом, так и при внесении соединения за 1 ч до заражения в концентрации 40 мкг/мл. Вирус был чувствителен к Тамифлю (в опыте использовали метаболит - озельтамивира карбоксилат), который был эффективен в достаточно низкой концентрации. Отсутствие ингибирующего эффекта римантадина гидрохлорида косвенно свидетельствует о резистентности данного штамма к препаратам ремантадин и амантадин. Т.о. нужно отметить, что соединение Ad-(CH2-Thr-OEt)2 проявляет противовирусный эффект порядка 80% при концентрации 40 мкг/мл, обладает избирательной противовирусной активностью в отношении вируса гриппа А и действуют на штаммы, резистентные к действию римантадина гидрохлорида. При этом оно обладает достаточно низкой токсичностью для культуры клеток MDCK, цитотоксическая концентрация соединений Ad-(CH2-Thr-OEt)2 составила 79 мкг/мл. Более того, компоненты, из которых состоит соединение Ad-(CH2-Thr-OEt)2, сами по себе обладают низкой токсичностью и соответственно в результате ферментативного гидролиза в организме не будет образовываться опасных метаболитов. В настоящее время в единичных случаях уже обнаружена резистентность к препаратам ингибиторам нейраминидазы [16]. Аминокислотное производное 1,3-адамантандиуксусной кислоты использует в качестве предполагаемой мишени достаточно консервативный белок М2, что может значительно отсрочить появление к ним резистентности. Синтез Ad-(CH2-Thr-OEt)2 прост и относительно дешев, т.к. содержит экономически доступные соединения. Соединение Ad-(CH2-Thr-OEt)2 может быть предложено в качестве кандидатного средства для лечения и профилактики гриппа как самостоятельное лекарственное средство, так и в составе комбинированных препаратов.
Литература
1. Андронова В.Л. // Антибиотики и химиотерапия. 1996. т.41. №718. с.26-30.
2. Машковский М.Д. Лекарственные средства. В 2 частях. Ч.1. 12-е изд., перераб. и доп. М.: Медицина, 1993.
3. Cady S. D., Mishanina T.V., Hong, М.. Backbone structure of the amantadine-blocked trans-membrane domain M2 proton channel from Influenza A virus. // J. Mol. Biol. 2009. V. 385, 1127-1141.
4. Киселев О.И., Чижов Н.П., Ильенко В.И. Противовирусный препарат ПОЛИРЕМ // Патент RU 2071323.
5. Регистр лекарственных средств России (РЛС), 2013, с.142-143.
6. Киселев В.И., Киселев О.И., Юрьев М.З. Препарат для лечения и профилактики вирусных заболеваний // Патент RU 218522.
7. Ашмарин И.Л., Жилинская И.Н., Киселев О.И. Средство для лечения гриппа // Патент RU 2229877.
8. Еропкина Е.М., Киселев О.И., Еропкин М.Ю. Средство, обладающее антигипоксической и цитопротекторной активностями, используемое для снижения токсичности ремантадин гидрохлорида при лечении гриппозной инфекции // Патент RU 2302236.
9. Шляпникова О.В., Слепушкин А.Н., Бурцева Е.И. Чувствительность к ремантадину и арбидолу вирусов гриппа, вызвавших эпидемические подъемы заболеваемости в России в сезоне 2004-2005 гг // Вопр. Вирусол., 2007. 2. с.24-29.
10. Zarubaev V.V., Golod E.L., Anfimov P.M. Synthesis and anti-viral activity of azolo-adamantanes against influenza A virus. // Bioorg. Med. Chem. 2010. V.18(2), 839-848.
11. Красуцкий П.А., Семенова И.Г., Новикова М.И. Аминокислоты ряда адамантана. Синтез и противовирусная активность α-аминокислот ряда адамантана и их производных // Хим.-фарм. журн. 1985. 24(7), с.825-829.
12. N. Naffakh, S. van der Werf. // An outbreak of swine-origin influenza A(H1N1) virus with evidence for human-to human transmission. // Microb Infect. 2009.
13. Шибнев В.А., Гараев T.M., Финогенова М.П Некоторые пути преодоления резистентности вирусов гриппа А к препаратам адамантанового ряда. // Вопр. вирусол. 2011. 56(2), с.36-39.
14. Wang J, Ma С, Wang J. et. al. Discovery of novel dual inhibitors of the wild-type and the most prevalent drug-resistant mutant, S3 IN, of the M2 proton channel from influenza A virus. // J. Med. Chem. 2013. 56(7), 2804-2812.
15. Ленева И.А., Фадеева Н.И., Федякина И.Т. Применение иммуноферментной индикации вирусспецифических антигенов в изучении нового противогриппозного препарата арбидол // Хим.-фарм. журнал 1994. 28 (9), с.4-15.
16. Львов Д.К., Бурцева Е.И., Галегов Г.А. Чувствительность эпидемических и пандемических штаммов вирусов гриппа к занамивиру (Релензе™) в опытах in vitro // Вопр. вирусол., 2010. 55(6), с.10-14.
1. Производное 1,3-адамантандиуксусной кислоты с аминокислотным остатком этилового эфира треонина формулы: .
2. Соединение формулы ,обладающее избирательной противовирусной активностью в отношении вируса гриппа А и действующее на штаммы, резистентные к действию римантадина гидрохлорида.