Способ синтеза соединений диарилтиогидантоина и диарилгидантоина
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к способу получения соединения формулы (I-1), включающему (a) объединение соединения формулы D-1 с соединением формулы (F), диметилсульфоксидом (ДМСО) и изопропилацетатом с образованием смеси; и (b) нагревание указанной смеси с получением соединения диарилтиогидантоина формулы (I-1). Также изобретение относится к способу получения соединения формулы (M-I), включающему (a) объединение 4-бром-2-фторбензойной кислоты с 2-аминоизомасляной кислотой, диметилформамидом (ДМФА), водой, триэтиламином (TEA) и 2-ацетилциклогексаноном с образованием смеси; и (b) нагревание указанной смеси с получением 4-(2-карбоксипропан-2-иламино)-2-фторбензойной кислоты: (c) взаимодействие 4-(2-карбоксипропан-2-иламино)-2-фторбензойной кислоты с соединением формулы (F) с получением соединения диарилтиогидантоина формулы (M-1). Технический результат: разработаны новые способы получения производных диарилтиогидантоина, обладающих полезной биологической активностью. 2 н. и 1 з.п. ф-лы, 11 пр.
,,,
Реферат
Перекрестные ссылки на родственные заявки
По данной заявке испрашивается приоритет предварительной заявки на патент США №61/307796, поданной 24 февраля 2010. Полное описание этой заявки включено в настоящее описание посредством ссылки.
Заявление о федерально спонсированном исследовании или разработке не применяется.
Область техники, к которой относится изобретение
Изобретение относится к области терапии рака, а именно, к способам синтеза лекарственных средств для лечения рака предстательной железы.
Предпосылки создания изобретения
Согласно Американскому обществу по борьбе с раком, рак предстательной железы является наиболее часто диагностируемым типом рака среди мужчин в Соединенных Штатах, помимо рака кожи. По оценке Американского общества по борьбе с раком, было диагностировано приблизительно 186000 новых случаев рака предстательной железы, и приблизительно 29000 мужчин умерли от рака предстательной железы в одних только Соединенных Штатах в течение 2008. Таким образом, рак предстательной железы является второй основной причиной смерти от рака у мужчин в Соединенных Штатах после рака легких.
Метастатический рак предстательной железы представляет собой злокачественную опухоль, которая распространяется за пределы предстательной железы и окружающих тканей в отдаленные органы и ткани. Большинство мужчин, которые умирают от рака предстательной железы, умирают от последствий метастазирующей опухоли. Согласно Национальному институту рака, среднее выживание пациентов с раком предстательной железы, который метастазировал в отдаленные органы, обычно составляет один-три года, и большинство таких пациентов умирает от рака предстательной железы. Метастатический рак предстательной железы обычно разделяют на два состояния: гормоно-чувствительное состояние и кастрационно-резистентное состояние (также называемое гормоно-рефракторное состояние).
Тестостерон и другие мужские половые гормоны, известные собирательно как андрогены, могут питать рост клеток рака предстательной железы. Андрогены оказывают свой эффект на клетки рака предстательной железы, связываясь и активируя рецепторы андрогена, которые экспрессированы в клетках рака предстательной железы. В случае, когда они сначала метастазируют в отдаленные участки, большинство случаев рака предстательной железы зависит от андрогенов для роста. Эти случаи рака предстательной железы известны как "гормоно-чувствительные" злокачественные образования. Соответственно, в настоящее время ведущие методы терапии, используемые для лечения метастатического рака предстательной железы, сосредоточены на уменьшении или противодействии эффектам андрогенов на клетки рака предстательной железы. Один метод использует так называемые "антиандрогены", которые являются молекулами, которые блокируют взаимодействие андрогенов с антиандрогенными рецепторами. Другой метод должен уменьшать количество андрогенов, продуцированных в организме, главным образом, в яичках. Это может быть достигнуто хирургически, путем удалением обоих яичек (орхиэктомия) или путем применения лекарственных средств, известных как агонисты рилизинг-фактора лютеинизирующего гормона, или ЛГ-РГ, которые снижают естественную выработку тестостерона в яичках (иногда называемой "химическая кастрация").
Большинство метастатических опухолей предстательной железы первоначально чувствительно к гормону и, таким образом, отвечает на гормональные методы лечения. Однако согласно исследованию, опубликованному 7 октября 2004 в выпуске The New England Journal of Medicine, фактически во всех случаях гормоно-чувствительный метастатический рак предстательной железы претерпевает изменения, которые преобразуют его в кастрационно-резистентное состояние в течение 18-24 месяцев после начала гормональной терапии [Debes, J. et al. "Mechanisms of Androgen-Refractory Prostate Cancer." New. England. J. Med. (2004), 351:1488-1490]. Одним из важных механизмов, посредством которого гормоно-чувствительное состояние переходит в кастрационно-резистентное состояние, вероятно, является сверхэкспрессия андрогенных рецепторов. В экспериментах, сравнивающих экспрессию гена в клетках гормоно-чувствительного и кастрационно-резистентного рака предстательной железы, повышение экспрессии андрогенных рецепторов было единственным генетическим изменением, постоянно ассоциированым с кастрационно-резистентным раком [Chen, C. et al. "Molecular determinants of resistance to antiandrogen therapy." Nat. Med. (2004), 10(l):33-39]. Обычно, в этом состоянии раковые опухоли предстательной железы продолжают расти андроген-зависимым образом, несмотря на снижение выработки тестостерона до очень низких (то есть, посткастрационных) уровней. Рак предстательной железы в этом состоянии известен как "кастрационно-резистентный" рак предстательной железы или CRPC. Переход от гормоно-чувствительного к кастрационно-резистентному состоянию после начала гормональной терапии обычно определяется на основании или возрастающих уровней простатического специфического антигена, или PSA, или документально подтвержденного развития заболевания, что подтверждается тестами диагностической визуализации или клиническими симптомами. Метастатический рак предстательной железы, который стал кастрационно-резистентным, чрезвычайно агрессивен; средняя выживаемость таких пациентов составляет только 10-16 месяцев.
Основная причина того, что CRPC является столь смертельным, заключается в том, что он трудно поддается лечению. Поскольку методы лечения, в настоящее время используемые для лечения метастатического рака предстательной железы, работают путем уменьшения возможности андрогенов питать рост клеток раковой опухоли предстательной железы, они обычно эффективны только в отношении рака предстательной железы, который остается гормоно-чувствительным в зависимости от андрогенов для роста. CRPC больше не отвечает на гормональные методы лечения, которые эффективны при гормоно-чувствительном состоянии. Ситуацию дополнительно усложняют биологические изменения в раке предстательной железы, который перешел в кастрационно-резистентное состояние, и лекарственные средства, которые первоначально блокируют антиандрогенные рецепторы и подавляют рост гормоно-чувствительной раковой опухоли предстательной железы, могут иметь точно противоположный эффект и начать питать рост CRPC. Например, Casodex® (бикалутамид), продаваемый AstraZeneca PLC, непосредственно блокирует взаимодействие андрогенов с антиандрогенными рецепторами и является наиболее продаваемым антиандрогенным терапевтическим средством. Однако на in vitro модели кастрационно-резистентного состояния рака предстательной железы, в котором клеточные линии рака предстательной железы были генетически спроектированы для сверхэкспрессии андрогенных рецепторов (таким образом, переводя их из гормоно-чувствительного в кастрационно-резистентное состояние), Casodex® не осуществил эффективного ингибирования андрогенных рецепторов в этих клетках, а, в некоторых случаях, он стал стимулятором андрогенных рецепторов. В соответствии с этими результатами, которые согласуются с опубликованным клиническим исследованием Casodex при CRPC на человеке, Casodex® является неэффективным терапевтическим средством для кастрационно-резистентного состояния метастатического рака предстательной железы.
Соединения, которые связываются с андрогенным рецептором, с той же самой целью, с которой связывается Casodex® и другие имеющиеся в продаже лекарственные средства для лечения метастатического рака предстательной железы, были получены для использования при кастрационно-резистентном состоянии метастатического рака предстательной железы. Эти соединения связываются с андрогенными рецепторами способом, который делает их эффективными при лечении раковых образований, которые стали невосприимчивыми к применяемым в настоящее время лекарственным средствам. Например, некоторые соединения, описанные в публикации патентной заявки США № 2007/0004753, 2007/0254933 (вновь опубликованной как 2008/0139634) и 2009/0111864, являются новыми низкомолекулярными антагонистами андрогенных рецепторов, которые ингибируют функцию андрогенных рецепторов, блокируя транслокацию андрогенных рецепторов в ядро и связывание ДНК.
Способ синтеза соединений настоящего изобретения, как описано в вышеприведенных публикациях патентных заявок США, включает конденсацию изотиоцианата с изобутиронитрилом. Главные недостатки способа, как описано выше, включают только 25%-ный выход желаемого продукта, получаемого на конечной стадии, приводя к 15%-ому общему выходу из коммерчески доступных исходных веществ. Кроме того, каждое промежуточное соединение требует трудоемкой колоночной хроматографии для очистки, что приводит к увеличению общей продолжительности получения продукта, что, с точки зрения промышленного производства, является невыгодным. Для сравнения, настоящее изобретение, описанное в данном описании, обеспечивает 50%-ный общий выход, и любая необходимая очистка осуществляется простыми средствами осаждения или кристаллизации. Кроме того, настоящее изобретение исключает использование чрезвычайно токсичного реагента ацетонциангидрина. В результате, способ согласно настоящему изобретению представляет собой более безопасный процесс, в котором количество растворителя снижено, минимизируя производственные отходы и воздействие на окружающую среду, время цикла уменьшено, и пропускная способность и общий выход продукта в способе увеличены.
Краткое описание сущности изобретения
Настоящее изобретение включает высокоэффективный способ получения соединения формулы (I,2-I):
где:
X представляет собой S или O;
Y1 и Y2 независимо представляют собой метил или вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную группу с 4-5 атомами углерода;
R1 представляет собой L1-C(=O)-NR4R5 или L1-CN; где L1 представляет собой одинарную связь или C1-C8алкилен; и R4 и R5 независимо выбраны из H и C1-C8алкила; и
R2 представляет собой водород или фтор;
включающий взаимодействие соединения формулы A:
где LG представляет собой Br, I или другую удаляемую группу, с соединением формулы B:
с получением соединения формулы C:
;
взаимодействие соединения формулы C с соединением формулы R6-LG в условиях алкилирования или с соединением формулы R6-OH в условиях этерификации с образованием соединения формулы D:
D
где R6 представляет собой C1-C8алкил;
и взаимодействие соединения формулы D с соединением формулы (F,2-F):
F,2-F
где X представляет собой S или O,
с получением соединения диарилтиогидантоина или диарилгидантоина формулы (I,2-I):
.
В одном варианте осуществления изобретения в отношении соединения формулы A, LG представляет собой Br или I. В конкретном варианте осуществления LG представляет собой Br.
Другой аспект настоящего изобретения обеспечивает эффективный способ получения кислотного производного формулы (I,2-Ia):
где:
Y1 и Y2 независимо представляют собой метил или вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную группу с 4-5 атомами углерода;
R7 представляет собой L1-C(=O)-OH; где L1 представляет собой одинарную связь или C1-C8алкилен; и
R2 представляет собой водород или фтор;
включающий гидролиз соединения формулы I,2-I:
где
R1 представляет собой L1-C(=O)-NR4R5; где L1 представляет собой одинарную связь или C1-C8алкилен; и R4 и R5 независимо выбраны из H и C1-C8алкила.
В одном конкретном варианте осуществления в отношении соединения формулы I,2-Ia, L1 представляет собой одинарную связь; и R7 представляет собой -C(=O)-OH.
В одном конкретном варианте осуществления в отношении соединения формулы I,2-Ia, Y1 и Y2, оба представляют собой метил, R7 представляет собой -C(=O)-OH, и R2 представляет собой F.
В одном варианте осуществления изобретения описанный выше гидролиз осуществляют в присутствии концентрированной HCl.
В одном варианте осуществления изобретения описанный выше гидролиз проводят при температуре 80-140°C или при температуре около 80-140°C.
В одном конкретном варианте осуществления описанный выше гидролиз проводят при температуре 120°C или при температуре около 120°C.
В одном варианте осуществления изобретения описанный выше гидролиз проводят в течение 10-60 час или в течение от около 10 час до около 60 час.
В одном конкретном варианте осуществления описанный выше гидролиз проводят в течение 48 час или в течение около 48 час.
В одном конкретном варианте осуществления в отношении соединения формулы I,2-Ia, X представляет собой S.
В одном конкретном варианте осуществления в отношении соединения формулы I,2-Ia, X представляет собой O.
В одном конкретном варианте осуществления в отношении соединения формулы I,2-Ia, Y1 и Y2, оба представляют собой метил, R7 представляет собой -C(=O)-OH, R2 представляет собой F, и X представляет собой S.
В одном конкретном варианте осуществления в отношении соединения формулы I,2-Ia, Y1 и Y2, оба представляют собой метил, R7 представляет собой -C(=O)-OH, R2 представляет собой F, и X представляет собой O.
В одном конкретном варианте осуществления настоящее изобретение включает высокоэффективный способ получения соединения формулы (I):
где:
Y1 и Y2 независимо представляют собой метил или вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную группу с 4-5 атомами углерода;
R1 представляет собой L1-C(=O)-NR4R5 или L1-CN; где L1 представляет собой одинарную связь или C1-C8алкилен; и
R4 и R5 независимо выбраны из H и C1-C8алкила; и
R2 представляет собой водород или фтор;
включающий следующие стадии:
взаимодействие соединения формулы A:
где LG представляет собой Br, I или другую удаляемую группу, с соединением формулы B:
с образованием соединения формулы C:
;
взаимодействие соединения формулы C с соединением формулы R6-OH в условиях этерификации или, альтернативно, взаимодействие соединения формулы C с соединением формулы R6-LG, где R6 представляет собой C1-C8алкил, и LG представляет собой Br, I или другую удаляемую группу, с образованием соединения формулы D:
взаимодействие соединения формулы D с соединением формулы F, 4-изотиоцианато-2-(трифторметил)бензонитрилом:
с образованием соединения формулы (I):
.
В одном варианте осуществления изобретения в отношении соединения формулы A, LG представляет собой Br или I. В конкретном варианте осуществления LG представляет собой Br.
В одном конкретном варианте осуществления настоящее изобретение включает высокоэффективный способ получения соединения формулы (I):
где:
Y1 и Y2 независимо представляют собой метил или вместе с атомом углерода, к которому они присоединены, образуют циклоалкильную группу с 4-5 атомами углерода;
R1 представляет собой L1-C(=O)-NR4R5 или L1-CN; где L1 представляет собой одинарную связь или C1-C8алкилен; и R4 и R5 независимо выбраны из H и C1-C8алкила; и
R2 представляет собой водород или фтор;
включающий взаимодействие соединения формулы A:
с соединением формулы B:
с получением соединения формулы C:
;
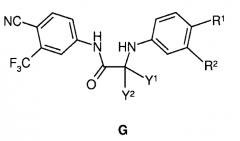
взаимодействие соединения формулы C с соединением формулы E:
с образованием соединения формулы G:
и взаимодействие соединения формулы G с тиофосгеном,
с получением диарилтиосоединения гидантоина формулы (I):
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, Y1 и Y2, оба представляют собой метил.
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, Y1 и Y2 вместе с атомом углерода, к которому они присоединены, объединены с образованием циклобутильного кольца.
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, Y1 и Y2 вместе с атомом углерода, к которому они присоединены, объединены с образованием циклопентильного кольца.
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, L1 представляет собой одинарную связь.
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, L1 представляет собой -CH2-, -CH2-CH2- или -CH2-CH2-CH2-.
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, L1 представляет собой одинарную связь; и R1 представляет собой -C(=O)-NHCH3.
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, L1 представляет собой одинарную связь; и R1 представляет собой -C(=O)-NH2.
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, R2 представляет собой F.
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, Y1 и Y2, оба представляют собой метил, R1 представляет собой -C(=O)-NHCH3, и R2 представляет собой F.
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, Y1 и Y2, оба представляют собой метил, R1 представляет собой -C(=O)-NH2, и R2 представляет собой F.
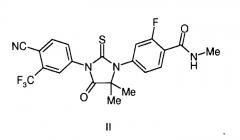
В одном конкретном варианте осуществления в отношении соединения формулы I или I,2-I, соединение соответствует формуле II:
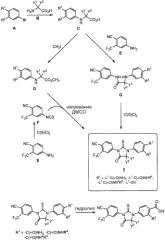
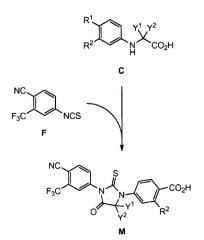
Общая схема для одного варианта осуществления взаимодействия, проиллюстрированная в порядке выполнения A→C→D→I ниже, представлена на схеме 1, ниже:
Схема 1
где проиллюстрирован a) необязательный синтез a) соединения F из 4-амино-2-(трифторметил)бензонитрила (соединение E) и тиофосгена, и b) необязательный гидролиз заместителя R1 соединения I до группы карбоновой кислоты, для синтеза, когда карбоновая кислота необходима в положении R1. При необязательном гидролизе заместителя R1 соединения I до группы карбоновой кислоты, R1 ограничивается -L1-(C=O)NH2, -L1-(C=O)NHR4 и -L1-(C=O)NR4R5, поскольку гидролиз R1, когда R1 представляет собой -L1-CN, будет приводить к гидролизу другой группы нитрила, присутствующей на другом бензольном кольце. При гидролизе, представленном на схеме 1, L1 обозначает отсутствие группы (то есть, одинарную связь), поскольку гидролиз указан как дающий группу -COOH, однако в других вариантах осуществления изобретения L1 также может быть C1-C8алкиленом.
В альтернативном способе соединение формулы C обрабатывают соединением E в условиях образования амидной связи, с получением соединения формулы G, с последующей обработкой реагентом, таким как тиофосген, с образованием соединения формулы I (то есть, в порядке C→G→I, указанном на схеме выше).
В одном варианте осуществления соединение формулы A смешивают с соединением формулы B в присутствии каталитического количества как катализатора на основе меди (I), так и бета-дион лиганда, такого как 2-ацетилциклогексанон, в полярном растворителе и при нагревании до температуры приблизительно 90-120°C, приблизительно 100-110°C или приблизительно 105°C. Катализатором на основе меди (I) может быть хлорид меди (I) или йодид меди (I). Катализатор меди (I), такой как CuCl, может присутствовать в количестве около 0,05-0,35 эквивалентов относительно соединения A, около 0,15-0,25 эквивалентов относительно соединения A или около 0,2 эквивалента относительно соединения A. Лиганд, такой как 2-ацетилциклогексанон, может присутствовать в количестве около 0,05-0,35 эквивалентов относительно соединения A, около 0,15-0,25 эквивалентов относительно соединения A или около 0,2 эквивалента относительно соединения A. В другом варианте осуществления лиганд, такой как 2-ацетилциклогексанон, присутствует в количестве приблизительно равном количеству используемого катализатора на основе меди (I), такого как хлорид меди (I). Соединение B может быть добавлено в количестве около 1-2 эквивалентов относительно соединения A, около 1,25-1,75 эквивалентов относительно соединения A или около 1,5 эквивалентов относительно соединения A. Выбор бета-дион лигандов известен специалистам в данной области, например, 2,4-пентандион, 2,4-гександион, 1-фенил-1,3-бутандион, 2-ацетилциклогексанон и тому подобное. Полярный растворитель может быть выбран из группы, состоящей из диметилсульфоксида (ДМСО), диметилформамида (ДМФА), N-метилпирролидона (NMP), диметилацетамида (DMA), изопропилацетата (IPAc), изопропилового спирта (IPA) и подобного; в другом варианте осуществления изобретения полярным растворителем является ДМФА, вода или смесь ДМФА и воды. В другом варианте осуществления изобретения после взаимодействия в течение около 6-24 час, около 8-20 час или около 12-14 час, или после того, как анализ показал расход соединения A приблизительно 90% или более, реакционную смесь затем охлаждают до температуры около 15-25°C, например, до около 25°C или до комнатной температуры. В другом варианте осуществления изобретения к охлажденной реакционной смеси добавляют воду с последующим промыванием органическим несмешивающимся с водой растворителем, таким как изопропилацетат; затем смесь разделяют на органический и водный слои. В другом варианте осуществления изобретения водный слой подкисляют для выделения соединения C осаждением, фильтрованием и сушкой.
В одном варианте осуществления изобретения соединение C подвергают взаимодействию с алкилирующим агентом формулы R6-LG, где R6 представляет собой C1-C8алкил, и LG представляет собой Br, I или другую удаляемую группу, с образованием соединения формулы D. Соединения формулы R6-LG включают соединения, такие как метилйодид. Взаимодействие может быть осуществлено в присутствии неорганического основания, такого как K2CO3, KHCO3, Na2CO3 или NaHCO3, в полярном растворителе, таком как ДМСО, ДМФА, NMP, DMA или IPAc, и каталитического количества воды. Каталитическое количество воды может составлять около 5-25%, 10-20% или 14% эквивалентов соединения C, или около 0,05-0,25%, 0,10-0,20% или 0,14% объема полярного растворителя. Реакционная смесь может быть нагрета до около 35-50°C или около 40-46°C, в течение около 5-60 мин, или до тех пор, пока анализ не показал более чем около 90% или около 95%, или около 99% преобразования соединения C в соединение D. После взаимодействия, смесь может быть охлаждена до температуры около 5-25°C или около 15-25°C. Реакционная смесь, содержащая соединение D, может быть объединена с водой для осаждения продукта D из раствора. Продукт D может быть выделен путем фильтрования и сушки. В одном варианте осуществления изобретения количество используемого неорганического основания, такого как K2CO3, составляет около 2 эквивалентов или менее чем около 2 эквивалентов относительно соединения C. В другом варианте осуществления изобретения количество используемого неорганического основания, такого как K2CO3, составляет около 1,5 эквивалентов или менее чем около 1,5 эквивалентов относительно соединения C. В другом варианте осуществления изобретения количество используемого неорганического основания, такого как K2CO3, составляет около 1,2 эквивалента или менее чем около 1,2 эквивалента относительно соединения C. В другом варианте осуществления изобретения количество используемого неорганического основания, такого как K2CO3, составляет около 1,1 эквивалента или менее чем около 1,1 эквивалента относительно соединения C. В другом варианте осуществления изобретения количество используемого неорганического основания, такого как K2CO3, составляет около 1,0 эквивалента или менее чем около 1,0 эквивалента относительно соединения C. В другом варианте осуществления изобретения количество используемого неорганического основания, такого как K2CO3, составляет около 0,9 эквивалента или менее чем около 0,9 эквивалента относительно соединения C. В другом варианте осуществления изобретения количество используемого неорганического основания, такого как K2CO3, составляет около 0,8 эквивалента или менее чем около 0,8 эквивалента относительно соединения C. В другом варианте осуществления изобретения количество используемого неорганического основания, такого как K2CO3, составляет около 0,7 эквивалента или менее чем около 0,7 эквивалента относительно соединения C. В другом варианте осуществления изобретения количество используемого неорганического основания, такого как K2CO3, составляет около 0,6 эквивалента или менее чем около 0,6 эквивалента относительно соединения C.
В другом варианте осуществления изобретения при использовании CH3I для образования соединения D (где R6=CH3), избыточное количество CH3I гасят уксусной кислотой. CH3I может быть использован в количестве около 1-1,5 эквивалента относительно соединения C, например, в количестве около 1,2 эквивалента относительно соединения C, и количество AcOH может быть добавлено в количестве около или немного больше, чем избыточное количество метилйодида (например, когда используют 1,2 эквивалента метилйодида, где метилйодид используют в избыточном на 0,2 эквивалента количестве, относительно соединения C, тогда может быть использовано около 0,21-0,25 эквивалента или около 0,23 эквивалента AcOH относительно соединения C) для гашения непрореагировавшего CH3I. Для этой стадии также могут быть использованы альтернативные метилирующие агенты, известные специалистам в данной области, такие как диметилсульфат.
В другом варианте осуществления изобретения стадия объединения реакционной смеси, содержащей соединение D, с водой выполнена постепенным добавлением воды к нагретой реакционной смеси в течение от около 0,5 часа до около 3,5 часов, от около 0,6 часа до 3,4 часов, от около 1 часа до 2 часов или в течение около 0,5, 0,6, 1, 2, 3, 3,4 или 3,5 часов, до тех пор, пока не будет добавлено 1-5 объемов воды или приблизительно 1-3 объема воды или приблизительно 2 объема воды для более медленного осаждения соединения D и уменьшения количества неорганического катиона и основания, такого как K+ и CO3 2-, из неорганического основания, такого как K2CO3, используемого в реакции. В одном варианте осуществления изобретения температура добавляемой воды составляет от около 50°C до около 80°C, от около 50°C до около 70°C, от около 55°C до около 75°C, от около 55°C до около 65°C, от около 57°C до около 63°C, от около 48°C до около 53°C или от около 68°C до около 71°C или от около 57°C или около 70°C. В другом варианте осуществления изобретения осажденное соединение D снова суспендируют или повторно образуют взвесь в воде, и затем воду удаляют фильтрованием для дополнительного уменьшения количества присутствующего неорганического катиона. В другом варианте осуществления объем воды для повторного суспендирования или повторного образования взвеси составляет приблизительно 5-15 объемов или приблизительно 10 объемов. В другом варианте осуществления повторное суспендирование или повторное образование взвеси в воде осуществляют в течение от около 0,5 часа до около 3 часов, от около 1,0 до около 2,0 часов, около 1,0 часа, около 1,5 часов или около 2 часов. В другом варианте осуществления температура воды для повторного суспендирования или повторного образования взвеси составляет от около 15°C до около 35°C, от около 20°C до около 30°C, от около 20°C до около 25°C или от около 20°C до около 23°C.
В одном варианте осуществления изобретения остаточное количество неорганического катиона, такого как ион калия, остающегося в соединении D, меньше чем или составляет приблизительно 1000 ч./млн. (частей на миллион). В другом варианте осуществления изобретения остаточное количество неорганического катиона, такого как ион калия, остающегося в соединении D, меньше чем или составляет приблизительно 500 частей на миллион. В другом варианте осуществления изобретения остаточное количество неорганического катиона, такого как ион калия, остающегося в соединении D, меньше чем или составляет приблизительно 300 ч./млн.
В одном варианте осуществления изобретения остаточное количество основания, такого как ион бикарбоната, ион карбоната или другого основания, остающегося в соединении D, меньше чем или равно около 1000 ч./млн. В другом варианте осуществления изобретения остаточное количество основания, остающегося в соединении D, меньше чем или равно около 500 ч./млн. В другом варианте осуществления изобретения остаточное количество основания, остающегося в соединении D, меньше чем или равно около 300 ч./млн.
В одном варианте осуществления изобретения соединение D может быть высушено продувкой или вытяжкой сухого воздуха, сухого азота или аргона или другого сухого инертного газа через соединение. В другом варианте осуществления изобретения соединение D может быть высушено путем помещения соединения в вакуум (например, при вакууме около 1 мм рт.ст. или ниже, при вакууме 0,5 мм рт.ст. или ниже или при вакууме 0,1 мм рт.ст. или ниже). В одном варианте осуществления изобретения остаточное количество воды, остающееся в соединении D, меньше чем или равно около 0,5%. В одном варианте осуществления изобретения остаточное количество воды, остающееся в соединении D, меньше чем или равно около 0,3%. В одном варианте осуществления изобретения остаточное количество воды, остающееся в соединении D, меньше чем или равно около 0,1%. В одном варианте осуществления изобретения остаточное количество воды, остающееся в соединении D, меньше чем или равно около 500 ч./млн. В одном варианте осуществления изобретения остаточное количество воды, остающееся в соединении D, меньше чем или равно около 300 ч./млн. В одном варианте осуществления изобретения остаточное количество воды, остающееся в соединении D, меньше чем или равно около 100 ч./млн.
Альтернативный способ получения соединения D из соединения C использует стандартные условия этерификации по Фишеру, включающие смешивание соединения C в метаноле и нагревание в течение около 1-16 час при около 40-100°C (или при кипячении с обратным холодильником) с каталитическим количеством кислоты, таким как одна-пять капель серной кислоты, хлористоводородной кислоты, азотной кислоты, фосфорной кислоты или другой неорганической кислоты, п-толуолсульфоновой кислоты или ионообменной смолы, содержащей сульфоновую кислоту; в одном варианте осуществления изобретения используют H2SO4. В некоторых вариантах осуществления воду можно удалить путем азеотропной отгонки (такой как ловушкой Дина-Старка). После завершения этерификации (завершение около 70%, около 80%, около 90%, около 95% или около 99%), выделение соединения D может быть осуществлено способом, описанным выше.
В другом варианте осуществления изобретения стадия образования соединения I включает смешивание соединения D с соединением F в полярном растворителе или в смеси первого полярного растворителя и второго полярного растворителя, и нагреванием до около 60-100°C, около 80-100°C или около 80-85°C, в течение около 1-48 часов или около 12-24 часов. В другом варианте осуществления изобретения после реакции процесс продолжается путем охлаждения реакционной смеси до около 15-30°C, до около 25°C или до комнатной температуры, и объединения с водой с последующим экстрагированием желаемого продукта полярным растворителем или смесью третьего полярного растворителя и четвертого полярного растворителя. Соединение F может быть добавлено в количестве около 1-3 эквивалентов относительно соединения D, или около 1,5-2,5 эквивалентов относительно соединения D, или около 1,5 эквивалентов или около 2 эквивалентов относительно соединения D, или в количестве около 1,5 эквивалентов, с последующим добавлением, по мере протекания реакции, дополнительной части, составляющей около 0,5 эквивалента. Слой объединенного органического экстракта может быть уменьшен в объеме и затравлен кристаллами желаемого продукта I для начала кристаллизации при охлаждении до около 0-10°C или около 3-6°C, с последующим выделением кристаллического продукта путем фильтрования и затем сушкой продукта в токе воздуха или в вакууме. В одном аспекте этого варианта осуществления полярный растворитель или первый, второй, третий и четвертый полярные растворители могут быть выбраны из группы, состоящей из: ДМСО, ДМФА, NMP, DMA, IPAc, MeCN, IPA и тому подобное. В одном варианте осуществления изобретения полярным растворителем является ДМФА. В одном варианте осуществления изобретения полярным растворителем является IPAc. В другом варианте осуществления изобретения первым полярным растворителем является IPAc, и вторым полярным растворителем является ДМСО. В другом варианте осуществления изобретения третьим полярным растворителем является IPAc, и четвертым полярным растворителем является IPA. В другом варианте осуществления изобретения первым полярным растворителем является IPAc, вторым полярным растворителем является ДМСО, третьим полярным растворителем является IPAc, и четвертым полярным растворителем является IPA.
В другом варианте осуществления изобретения альтернативный способ образования соединения I включает две стадии, выполняемые в порядке C→G→I, приведенном на схеме выше. На первой стадии используют стандартные условия образования амидной связи, включая, например, обработку соединения C реагентом сочетания, таким как дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIC), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDCI), гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (BOP), гексафторфосфат 7-азабензотриазол-1-илокситрис(диметиламино)фосфония (AOP), гексафторфосфат бензотриазол-1-илокситрис(пирролидин)фосфония (PyBOP), гексафторфосфат 7-азабензотриазол-1-илокситрис(пирролидин)фосфония (PyAOP), гексафторфосфат O-бензотриазол-N,N,N',N'-тетраметилурония (HBTU), тетрафторборат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), тетрафторборат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TATU) и тому подобное, с соединением E, в полярном растворителе или в смеси первого полярного растворителя и второго полярного растворителя, с получением соединения G. В одном аспекте этого варианта осуществления полярный растворитель или первый и второй полярные растворители, выбраны из группы, состоящей из: DCM, ДМСО, ДМФА, NMP, DMA, MeCN и тому подобное. Вторая стадия включает реакцию замыкания кольца соединения G с реагентом тиокарбонилирования, таким как тиофосген, и нагревание чистого раствора до около 60-120°C. В другом варианте осуществления изобретения взаимодействие осуществляют в запаянной трубке. Тиофосген или тиоэквивалент фосгена (например, 1,1-тиокарбонилдиимидазол) может присутствовать в количестве около 1-10 эквивалентов