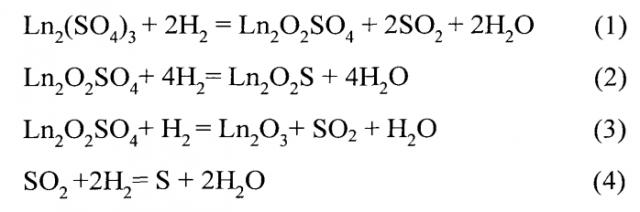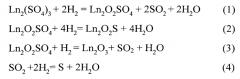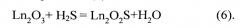Способ получения порошков соединений диоксосульфидов редкоземельных элементов ln2o2s и твердых растворов на их основе ln'2o2s-ln''2o2s ( ln, ln', ln''=gd-lu, y)
Иллюстрации
Показать всеИзобретение относится к области неорганической химии. Шихту для получения порошков соединений Ln2O2S, Ln2O2S-Ln′2O2S, где Ln, Ln′=Gd - Lu, Y готовят добавлением серной кислоты к растворам нитратов редкоземельных элементов и осаждением, соосаждением, кристаллизацией, сокристаллизацией полученных сульфатов редкоземельных элементов. Шихту термически обрабатывают на воздухе при 600°C в течение 2-3 часов, растирают до фракции менее 100 мкм и обрабатывают в потоке водорода при 500-600°C до 5-7 часов при скорости подачи водорода 7-8 л/час (стандартные условия), а затем обрабатывают в потоке H2S при 850-950°C в течение до 7-10 часов для Gd-Lu или до 5-7 часов для Y при той же скорости подачи H2S. Сокращается продолжительность высокотемпературных термических обработок и уменьшается количество сероводорода при получении оксисульфидов редкоземельных элементов. 3 пр.
Реферат
Изобретение относится к области неорганической химии, а именно к способу получения порошков диоксосульфидов редкоземельных элементов (РЗЭ) составов Ln2O2S (Ln=Gd-Lu, Y) и их взаимных твердых растворов L n 2 ' O 2 S − L n 2 " O 2 S (Ln', Ln''=Gd-Lu, Y).
К твердым растворам Ln2O2S- L n 2 ' O 2 S (Ln, Ln'=Gd-Lu) как потенциальным лазерным материалам, предъявляется ряд требований:
- высокая степень чистоты, химическая и фазовая однородность порошков твердых растворов;
- равномерное распределение ионов-активаторов по всему объему шихты (частицам шихты);
- возможность получения порошков необходимой степени дисперсности;
- технологичность метода получения твердых растворов, позволяющая нарабатывать в одной партии навески порошков твердых растворов до сотен граммов.
Известен способ получения соединений Ln2O2S путем воздействия сероводорода на оксиды, кислородсодержащие соединения РЗЭ [Супоницкий Ю.Л. Кузьмичева Г.М., Елисеев А.А. Оксосульфиды редкоземельных элементов // Успехи химии. 1988. Т LVII. Вып.3. С.367-383].
В известном способе используется свойство оксидов лантанидов вступать в реакции неполного обмена с сероводородом в определенном интервале температур: Ln2O2+H2S→Ln2O2S+H2O.
Синтез проводят при нагревании кислородсодержащих соединений РЗЭ в атмосфере сероводорода в течение 10 и более часов.
Преимущества известного способа: при подборе необходимых температурных режимов возможно получение однофазных порошков оксисульфидов Ln2O2S; способ технологичный и позволяет нарабатывать стограммовые партии порошков; в систему не вносятся возможные технологические примеси от потока газа.
При синтезе порошков твердых растворов оксисульфидов РЗЭ требуются дополнительные технологические операции в подготовке исходной шихты. При использовании смеси кислородсодержащих соединений различных РЗЭ образование твердого раствора L n 2 − 2 x ' L n 2 x ' ' O 2 S при сульфидировании кислородсодержащих соединений различных РЗЭ происходит через медленно протекающую стадию взаимной диффузии катионов, исходно сосредоточенных в различных зернах прекурсоров. Использование других видов прекурсоров, например таких, как соосажденные сокристаллизованные гидроксиды, карбонаты, должно сопровождаться их предварительным термическим разложением. Обработка гидратированных веществ приводит к спеканию шихты и резкому замедлению скорости протекания реакций.
Одновременно известный способ обладает рядом недостатков:
- использование токсичного газообразного реагента - сероводорода;
- не установлены интервалы температур, технологические параметры процесса, приводящие к образованию гомогенных твердых растворов L n 2 − 2 x ' L n 2 x ' ' O 2 S (Ln', Ln''=Gd-Lu, Y);
- длительность образования гомогенного твердого раствора L n 2 − 2 x ' L n 2 x ' ' O 2 S при использовании механической смеси прекурсоров;
- сульфидирование частиц кислородсодержащих соединений РЗЭ протекает через стадию образования в частицах поверхностного затрудняющего слоя, что определяет необходимость продолжительной обработки шихты в H2S.
Известен способ получения соединений Ln2O2S путем взаимодействия оксидов лантанидов с сероуглеродом [Супоницкий Ю.Л. Химия редкоземельных элементов. - М.: 2006 г. 108 с].
Использование CS2 энергетически более выгодно, ΔG (CS2)=66,55 кДж/моль; ΔG (H2S)=-33,50 кДж/моль.
Для осуществления данного синтеза кислородсодержащие соединения РЗЭ нагревают при 900-1200°C в парах CS2, (CS2+H2S) в течение 2-30 часов, при этом химическое превращение протекает по уравнению:
2Ln2O3+CS2→2Ln2O2S+CO2.
Недостатками известного способа являются: возможность параллельного протекания реакций образования Ln2O2S и Ln2S3, так как CS2 обладает более выраженным сульфидирующим действием, чем H2S; возможность образования оксисульфидных соединений других составов, чем Ln2O2S, а именно: Ln2OS2, Ln10S14O; отсутствие данных по технологическим режимам обработки шихты для получения гомогенных твердых растворов, которые зависят от вида РЗЭ и их соединений. В результате термической диссоциации CS2 образец загрязняется частичками углерода.
Перечисленные недостатки ограничивают возможности известного способа при получении оксисульфидов как оптических материалов.
Известен способ получения катодолюминофора на основе оксисульфида иттрия и европия [RU 2064482 C1, МПК6 C09K 11/84, опубл. 1996]. Шихту, содержащую оксиды иттрия и европия, серу и минерализаторы, термообрабатывают в три стадии: тигель помещают в разогретую до 390-410°C печь, выдерживают 0,5-1 ч, нагревают затем со скоростью 25-28°/мин до 1160-1240°C, выдерживают 3-4 ч, снижают температуру со скоростью 10-15°/мин до 1050-1120°C, выдерживают 1,5-2 ч, при последующем охлаждении снижение температуры до 880-910°C осуществляют со скоростью 45-50°/мин. Диаметр частиц 8,3-11,07 мкм, дисперсия распределения σ=0,5-0,6.
Известен способ получения люминофора на основе оксисульфида иттрия, активированного ионами титана и соактивированного ионами магния с дополнительным содержанием в катионной подрешетке трехвалентных ионов иттербия и эрбия с химическим составом, соответствующим следующей эмпирической формуле: (Y1-X-Y YbxEry)2O2S:Ti0,12,Mg0,04, где 0,01<X<0,05; 0,01<Y<0,05 [RU 2401860 C2, МПК C09K 11/77 (2006.01), C09K 11/84 (2006.01), опубл. 20.10.2010].
Известен способ получения люминофора (Ln0,996Tb0,004)2O2S (Ln=Gd, Y) (на основе оксисульфидов гадолиния и иттрия, активированных тербием) [Михитарьян Б.В. Люминесцентно-спектральные свойства твердых растворов Gd2O2S-Tb2O2S и Y2O2S-Tb2O2S: Дисс. … канд. физ.-мат. наук: Ставрополь: Сев.-Кавк. гос. техн. ун-т, 2007. 171 с.].
Синтез люминофоров осуществляется из оксидов редкоземельных элементов, полученных после прокаливания совместно осажденных оксалатов с заданным соотношением лантаноидов. В оксиды добавляли серу, карбонат щелочного металла, минерализатор, полученную шихту спекали при 1200°C в течение 2,5 часов под слоем активированного угля. Прокаленную шихту после охлаждения промывали горячей дистиллированной водой до pH промывной воды. Отмытый люминофор сушили при 110-120°C и просеивали через сито №100.
Известный способ имеет ряд недостатков: способ многостадийный и состоит только из девяти основных стадий; используется значительное количество прекурсоров: соединения РЗЭ, карбонат натрия, сера, минерализатор, уголь; основным сульфидирующим веществом является сульфид натрия Na2S, который образуется по реакции легколетучей серы с карбонатом натрия в процессе нагревания (tкип. серы при атмосферном давлении 444,6°C); не регламентирован режим нагрева, обеспечивающий необходимый выход Na2S. Сульфид натрия при температурах выше 800-900°C и атмосферном давлении заметно возгоняется из горячей зоны печи. Реакция проводится под слоем угля, который не обеспечивает герметичности системы. Уголь неизбежно попадет в продукты реакции. Возможные неоднородности в составе шихты приведут к отличающимся условиям получения Ln2O2S, что вызовет появление несформировавшихся частиц Ln2O2S, распределение частиц по размерам в широком диапазоне. При температуре спекания шихты 1200°C в ней содержится сложный набор компонентов: основной продукт оксисульфид Ln2O2S, еще не прореагировавший оксид Ln2O3, образовавшийся Na2S, Na2SO3, минерализатор LiF, уголь. В способе также не оговорен материал тигля. Из набора компонентов системы следует, что наиболее вероятно используемый тигель - алундовый (Al2O3). Известно, что структура оксисульфида является дефектной [RU 2064482 C1], что создает физико-химические предпосылки образования твердого раствора соединений катионов натрия, лития в Ln2O2S. Температура спекания 1200°C обеспечивает условия диффузии катионов в структуре. Шихту готовят осаждением оксалатов РЗЭ, которые имеют отличающиеся значения произведений растворимости. Нигде не оговорено, как должны учитываться различные значения ПР оксалатов РЗЭ при приготовлении шихты необходимой стехиометрии. Промывка шихты после термической обработки проводится раствором 10% HNO3, что неизбежно приводит к взаимодействию части диоксосульфида лантаноида с азотной кислотой по реакции: 6HNO3+Ln2O2S=H2S+2Ln(NO3)3+2H2O.
Описанные выше недостатки известного способа неизбежно должны привести к выбраковке части продукта, делают способ малопригодным для получения оптических материалов
Известен способ получения соединений Ln2O2S, основанный на взаимодействии между оксидом лантаноида и полисульфидом натрия [Супоницкий Ю.Л. Химия редкоземельных элементов. - М., 2006 г. 108 с.].
Известный способ синтеза основан на протекании при повышенной температуре следующей реакции: 2Ln2O2+2NaSn→2Ln2O2S+Na2S+SO2.
Можно выделить несколько существенных недостатков способа, делающих его малопригодным для синтеза оптических материалов: полисульфид натрия не является распостраненным прекурсором, что создает необходимость получения полисульфида натрия; полисульфид натрия термически неустойчив, поэтому температурный интервал проведения реакции сильно ограничен и, скорее всего, находится в области достаточно низких температур (500-800°C), при которых диффузионные процессы в тугоплавких соединениях РЗЭ протекают крайне медленно и протяженные отжиги до 1000 часов и более не приводят к достижению гомогенных состояний; необходима промывка образца от содержащихся в нем сульфида и полисульфида натрия; полисульфид натрия является слабым сульфидирующим реагентом, очень затруднительно при невысоких температурах провести в полном объеме ионнообменную твердофазную реакцию, протекающую через стадию образования затрудняющего слоя.
Известен способ получения соединений Ln2O2S, основанный на взаимодействии оксидов лантанидов состава Ln2O3 с сульфидами лантанидов состава Ln2S3. В основу этого способа положена способность полуторных оксидов вступать в реакцию соединения с полуторными сульфидами: 2Ln2O3+Ln2S3→3Ln2O2S [Супоницкий Ю.Л. Химия редкоземельных элементов. - М., 2006 г., 108 с.]
Для проведения синтеза смесь оксида и сульфида спрессовывают и спекают в графитовой лодочке в вакууме при температуре 1350°C в течение нескольких часов, затем спек охлаждают, измельчают, а избыток сульфида удаляют промыванием уксусной кислотой, после чего продукт сушат в вакууме.
Известный способ синтеза обладает рядом существенных недостатков: твердофазные гетерогенные реакции между двумя тугоплавкими веществами протекают очень медленно (температуры плавления Ln2S3 1700-1900°C, Ln2O3 - 2000-2500°C; реакция между полуторными оксидом и сульфидом РЗЭ, исходно сосредоточенными в пределах частиц прекурсоров, протекает через стадии образования затрудняющих слоев из фаз систем Ln2O3-Ln2S3. В системах Ln2S3-Ln2O3 образуются оксисульфиды Ln10S14O (Ln=La-Sm); LnOS2 (Ln=Y, Ho, Er); Ln2O2S (Ln=La-Lu, Y). В процессе твердофазного взаимодействия в шихте для соответствующих РЗЭ неизбежно будут образовываться побочные оксисульфидные фазы Ln10S14O и LnOS2; для проведения синтеза необходимо создание вакуума в зоне реакции или предварительное вакуумирование и создание атмосферы инертного газа, присутствие кислорода неизбежно вызовет окисление части Ln2S3, что изменит исходное соотношение компонентов; образуется твердый спек, который необходимо дополнительно размельчать ручным или автоматическим способами; для реализации метода необходимо наличие высокотехнологического нагревательного оборудования, способного длительно работать при 1350°C; существует необходимость отмывки из продуктов реакции избытка Ln2S3, при этом неизвестно, в каком избытке в исходной шихте должен находиться Ln2S3.
Все вышеизложенные недостатки делают известный способ неприменимым для синтеза диоксосульфидов с заданными оптическими свойствами.
Известен способ получения соединений Ln2O2S путем взаимодействия сульфидов лантанидов с парами воды [Супоницкий Ю.Л. Химия редкоземельных элементов. М. 2006 г. 108 с.].
В известном способе проводят температурную обработку сульфидов лантанидов в атмосфере перегретого водяного пара при значениях температур 300-600°C: Ln2S3+2H2O→Ln2O2S+2H2S.
Также имеются сведения о синтезе диоксосульфида самария при обработке тетрасульфида трисамария в парах воды при температурах 300-600°C. [Высоких А.С., Андреев О.В., Головина Л.А. Взаимодействие сульфидов самария с парами воды при 300-1000 K // Физико-химический анализ природных технических систем: Сб. статей. Тюмень: Изд-во Тюменского государственного университета. 2008. С.54].
4Sm3S4+12H2O→6Sm2O2S+10H2S+H2.
Хотя при соблюдении определенных условий возможно получение шихты оксисульфидов РЗЭ с высокой степенью химической и фазовой однородности, все же известный способ не позволяют синтезировать шихту, отвечающую требованиям к оптическим материалам.
Известный способ также неприемлем для получения порошков твердых растворов диоксосульфидов РЗЭ для оптической керамики ввиду следующих недостатков: прекурсор Ln2S3 является дорогостоящим веществом; не установлены фазовые составы продуктов при воздействии H2O на твердые растворы Ln2-2xLn2xS3; температурный интервал 300-600°C, в котором образуются гомогенные оксисульфиды, не позволяет получить гомогенный порощок твердого раствора в случае независимого образования соединений Ln2O2S и L n 2 ' O 2 S ; при использовании соединений Ln2S3, полученных в потоке CS2, порошки содержат примесные частицы углерода, которые остаются в шихте при ее термической обработке в парах воды; в процессе обработки шихты в парах воды зерна шихты приобретают разветвленную рыхлую структуру. Условия обработки шихты при 300-600°C не позволяют сформировать плотные зерна, с геометрическими характеристиками, приближенными к правильным геометрическим фигурам. Обработка в парах воды требует формирования равномерного потока газовой фазы, а локальный избыток паров воды может привести к образованию оксидов РЗЭ. Технически часто сложно реализовать поток паров воды в вертикальном реакторе. В горизонтальном реакторе поток паров воды проходит над ложечкой с веществом, что приводит к ряду ограничений по объемам обрабатываемых веществ, увеличивает продолжительность обработки.
Известен способ получения соединений Ln2O2S путем окисления полуторных сульфидов лантанидов кислородом [Супоницкий Ю.Л. Химия редкоземельных элементов. - М. 2006 г. 108 с.].
Для проведения известного синтеза сульфиды прокаливают в атмосфере воздуха или кислорода при температуре 300-600°C. При этом протекает реакция: Ln2S3+2O2→Ln2O2S+2SO2.
Известный способ полностью непригоден для получения гомогенных порошков оксисульфидов РЗЭ и в особенности их твердых растворов по следующим причинам. Гетерогенная реакция окисления частиц шихты полуторных сульфидов протекает с поверхности частиц к центру, а также с поверхности насыпного объема шихты вовнутрь. По мере окисления Ln2S3 в Ln2O2S в поверхностных слоях будет протекать реакция:
Ln2S3+6O2→2Ln2O3+3SO2+3S.
Реакции будут протекать параллельно в широком температурном интервале. Не установлены температурные интервалы, в которых преимущественно протекала бы реакция 17 окисления Ln2S3 с образованием Ln2O2S. He изучено, как будет протекать окисление твердых растворов Ln2-xLn2xS3. В системе параллельно протекающих реакций окисления неизбежно будут происходить реакции образования диоксосульфидов каждого из РЗЭ (Ln2O2S и L n 2 ' O 2 S ). Низкие температуры обработки шихты 320°C не приведут к образованию гомогенного порошка твердого раствора между соединениями Ln2O2S и L n 2 ' O 2 S . Реакции окисления могут протекать стадийно, что может привести к образованию оксисульфидов составов Ln10S14O и LnOS2, которые будут более стабильны к окислению, чем фазы Ln2S3. В процессе окисления малоуправляемо будет изменяться размер зерен шихты. Следует ожидать изменений в двух направлениях. Процессы обмена двух атомов серы из трех на атомы кислорода при невысоких температурах должны сопровождаться образованием более мелких фракций. Локально могут произойти процессы агломерации. Исходный прекурсор Ln2S3 достаточно дорог. Совершенно нецелесообразно по сложно реализуемым высокотемпературным ионообменным реакциям получать прекурсор, чтобы в дальнейшем его окислить.
Известен способ получения соединений Ln2O2S путем взаимодействия ацетатов с тиокарбамидом [Батырева В.А., Козик В.В., Серебренников В.В., Якунина Г.М. Синтезы соединений редкоземельных элементов. - Томск: Изд-во ТГУ. 1983. 143 с.]. Кристаллогидраты ацетатов РЗЭ и тиокарбамид, взятые в мольном соотношении 1:3, тщательно растирают в течение двух часов до однородной массы. Далее смесь помещают в вертикальный кварцевый реактор и прокаливают при температуре 320°C в атмосфере аргона в течение 3,5 часов. Уравнение реакции при этом имеет следующий вид:
2Ln(CH3COO)3+(NH2)2CS→Ln2O2S+3CO+3CO2+2H2O+C.
Известный способ имеет следующие недостатки:
- не установлена последовательность фазовых превращений при обработке шихты, содержащей ацетаты двух различных РЗЭ;
- в процессе реакции возможно образование других оксисульфидных фаз Ln10S14O и LnOS (в системах Ln2S3-Ln2O3 образуются оксисульфиды Ln10S14O (Ln=La-Sm); LnOS2 (Ln=Y, Ho, Er); Ln2O2S (Ln=La-Lu, Y);
- низкие температуры обработки 320°C вызовут образование частиц рыхлой зеренной структуры, мелкой дисперсности;
в результате термического разложения тиокарбамида и протекания реакции образуются частички углерода, загрязняющие продукт.
Задачей, на решение которой направлено заявляемое техническое изобретение, является разработка способа получения соединений диоксосульфидов редкоземельных элементов и твердых растворов на их основе, обеспечивающего наработку порошков для лазерных люминофоров.
При осуществлении заявленного технического решения поставленная задача осуществляется за счет достижения технического результата, который заключается в сокращении продолжительности высокотемпературных термических обработок, уменьшении использования сероводорода.
Указанный технический результат достигается тем, что в способе получения порошков диоксосульфидов редкоземельных элементов соединений Ln2O2S, твердых растворов в системах L n 2 O 2 S − L n 2 ' O 2 S (Ln, Ln'=Gd-Lu, Y) путем приготовления шихты и ее последующей обработки в потоке восстановительных и сульфидирующих газов особенностью является то, что для получения однофазных порошков диоксосульфидов редкоземельных элементов, их твердых растворов исходную шихту готовят при добавлении к растворам нитратов редкоземельных элементов серной кислоты путем осаждения, соосаждения, а также кристаллизации, сокристаллизации сульфатов редкоземельных элементов, указанную шихту термически обрабатывают на воздухе при 600°C в течение 2-3 часов, растирают до фракции менее 100 мкм и обрабатывают в потоке водорода при 500-600°C в течение до 5-7 часов при скорости подачи водорода 7-8 л/час по отношению к массе исходных безводных сульфатов редкоземельных элементов 0,02-0,03 молей, а затем обрабатывают в потоке сероводорода при 850-950°C в течение до 10-13 часов при той же скорости подачи сероводорода.
Диоксосульфиды РЗЭ Ln2O2S, твердые растворы L n 2 ' O 2 S − L n 2 ' ' O 2 S (Ln', Ln''=Gd-Lu, Y) являются конкурентно способными кристаллофосфорами, перспективными лазерными материалами [Михитарьян Б.В. Люминесцентно-спектральные свойства твердых растворов Gd2O2S-Tb2O2S и Y2O2S-Tb2O2S: Дисс. … канд. физ.-мат. наук: Ставрополь: Сев.-Кавк. гос. техн. ун-т, 2007. 171 с.]. В [Кириллович А.А. Катодолюминесцентные и оптические свойства полупроводниковых кристаллов La2S2 и La2O2S с примесью неодима: Автореф. дисс. … канд. физ.-мат. наук. М.: Моск. инж.-физ. ин-т, 1989. 22 с.] показано, что при возбуждении кристаллов La2O2S:Nd3+ электронным пучком имеет место интенсивное излучение Nd3+ в фиолетовом диапазоне.
Соединения Ln2O2S (Ln=Gd-Lu, Y) изоструктурны, имеют кристаллическую структуру гексагональной сингонии, пр. гр. P 3 ¯ m l , для Gd2O2S а=3,852 A o , с=6,664 A o , для Lu2O2S а=3,708 A o , с=6,486 A o [Михитарьян Б.В.]. Во всех изученных системах L n 2 ' O 2 S − L n 2 ' ' O 2 S (Ln', Ln''=La-Lu, Y) образуются непрерывные или протяженные твердые растворы [Андреев П.О., Федоров П.П. Фазовые диаграммы систем Ln2S3-Ln2O3 (Ln=Gd, Dy) // Журн. неорган. химии. 2013. Т.58. №6. С.1188-1193, Андреев П.О., Федоров П.П., Кремлева Ю.А. Фазовые диаграммы систем Ln2S3-Ln2O3 (Ln=La, Nd, Gd, Dy, Y) // Тез. докл. XIX Менделеевского съезда по общей и прикладной химии. Волгоград, 2011. Волгоград: ИУНЛ ВолгГТУ, 2011. С.20.].
Заявляемое техническое решение обеспечивает получение порошков диоксосульфидов редкоземельных элементов Ln2O2S (Ln=Gd-Lu, Y) и их твердых растворов L n 2 ' O 2 S − L n 2 ' ' O 2 S (Ln', Ln''=Gd-Lu, Y) в однофазном состоянии.
Заявляемый способ разработан на основе установленных закономерностей образования фаз при обработке осажденных, соосажденных, сокристаллизованных сульфатов редкоземельных элементов L n 2 ' ( S O 4 ) 3 , L n 2 ' ' ( S O 4 ) 3 (Ln', Ln''=Gd-Lu, Y) в потоке водорода, а также сероводорода, изучения изменений морфологии частиц при протекании химических реакций.
При получении соединений Ln2O2S (Ln=Gd-Lu, Y) берут необходимую по массе навеску весовой формы выбранного оксида редкоземельного элемента.
В случае получения твердых растворов L n 2 ' O 2 S − L n 2 ' ' O 2 S , в состав которых может входить от двух до нескольких редкоземельных элементов, создают многокомпонентную шихту из соответствующих масс навесок весовых форм оксидов редкоземельных элементов.
Общая масса образца определяется технологическими характеристиками установки. В лабораторных условиях массы навесок составляют в среднем 10-15 г, что составляет порядка 0,02÷0,03 молей безводного сульфата РЗЭ.
Способ осуществляют следующим образом.
Шихту растворяют в азотной кислоте марки х.ч. концентрацией 65 мол.% (ГОСТ 4461-77), взятой в избытке до 1-5% при 30-90°C. Сульфаты РЗЭ Ln2(SO4)3 (Ln'=Gd-Lu, Y) получают при воздействии на водные растворы нитратов РЗЭ серной кислотой марки х.ч. концентрацией 70 мол.% (ГОСТ 4204-77), а также в процессе кристаллизации, сокристаллизации при выпаривании до сухого остатка образовавшейся суспензии. Методом сканирующей электронной силовой микроскопии установлены размеры частиц шихты на различных стадиях ее обработки.
В соосажденных сульфатах преобладают частицы с размерами 50-150 нм (более 50%), более крупные частицы имеют размеры порядка 150-300 нм. В процессе выпаривания маточного раствора частицы укрупняются. В шихте присутствуют агломераты с размерами порядка 100-300 нм (>50%) и размерами 300-400 нм.
Во всех последующих операциях шихта находится в твердой фазе. Тщательность выполнения операций предопределяет только технологические потери шихты, которые при получении целевого продукта составляют менее 0,5% от теоретического выхода.
Сухой остаток количественно собирают, помещают в алундовый тигель и нагревают в муфеле со скоростью 50°/час до температуры 600°C, выдерживают при данной температуре в течение 2-3 часов.
Методом рентгенофазового анализа (РФА) установлено, что шихта после прокаливания образована смесью фаз безводных сульфатов РЗЭ (ограниченными твердыми растворами на основе сульфатов РЗЭ).
Не зафиксировано образование сложных сульфатов, в состав которых входило бы два или более катиона РЗЭ и которые бы имели собственную структуру.
Прокаленные безводные сульфаты редкоземельных элементов, имеющие состояние спека, механически растирают и просеивают так, чтобы все частицы имели размер менее 100 мкм.
Порошок шихты, состоящий из сульфатов РЗЭ, обрабатывают в потоке водорода при прохождении водорода через слой шихты при температуре 500-600°C. Продолжительность обработки составляет до 5-7 часов при скорости подачи водорода в стандартных условиях 7-8 л/час на массу безводного сульфата трехвалентного редкоземельного элемента 0,02-0,03 моль.
Условия проведения реакции обеспечивают полноту вступления исходных сульфатов в химические взаимодействия с водородом, которые отражают уравнения химических реакций (1-3), а также реакция образования серы (4).
При массе навески редкоземельного элемента 0,02-0,03 моль, скорости подачи водорода при стандартных условиях 7-8 л/час, при температурах 500-600°C, в наибольшей степени протекают реакции, приводящие к образованию целевого продукта - соединений Ln2O2S, начинают образовываться твердые растворы L n 2 ' O 2 S − L n 2 ' ' O 2 S (Ln, Ln', Ln''=Gd-Lu, Y).
После обработки шихты при 500-600°C в течение 4-5 часов, в ней сульфаты редкоземельных элементов методом РФА не определяются.
Обработка сульфатов РЗЭ Ln2(SO4)3 (Ln=Gd-Lu, Y) при 500°-600°C в потоке водорода приводит к максимальному выходу соединений Ln2O2S. В ряду Gd-Lu закономерно изменяется содержание оксисульфидных фаз в шихте после ее нахождения в потоке водорода при 500-600°C. Обработка Gd2(SO4)3 приводит к образованию до 95-99 мол.%, Gd2O2S; из Er2(SO4)3 получено до 90-95 мол.% Er2O2S. Сульфат лютеция переходит в соединение Lu2O2S в количестве 80-85 мол.%.
Вторым компонентом шихты являются соединения Ln2O3, образующиеся по реакции (3).
Обработка в потоке водорода шихты, состоящей из нескольких сульфатов РЗЭ, приводит к образованию смеси из диоксосульфидов РЗЭ L n 2 ' O 2 S − L n 2 ' ' O 2 S и полуторных оксидов L n 2 ' O 3 − L n 2 ' ' O 3 , начинают образовываться твердые растворы. Проявляется аддитивность в превращении каждого из сульфатов РЗЭ в смеси нескольких сульфатов РЗЭ.
Повышение температуры обработки сульфатов РЗЭ в потоке водорода до температуры выше 600°C приводит к нежелательному изменению фазового состава шихты. Так, например, обработка сульфатов РЗЭ в потоке водорода сразу при температурах 850°-950°C по сравнению с температурами 500-600°C определяет уменьшение содержания в продуктах реакций диоксосульфидов РЗЭ и увеличение содержания полуторных оксидов РЗЭ. Диоксосульфиды РЗЭ образуются в количествах: Gd2O2S - до 99 мол.%, Er2O2S - около 95 мол.%, Lu2O2S - до 85 мол.%. Соответственно, увеличивается выход соединений Ln2O3, зерна которых, по данным РФА (явно выраженные узкие рефлексы на дифрактограммах), электронной микроскопии, (фиксируется огранка зерен), имеют хорошо сформированную кристаллическую структуру. Такие частицы полуторных оксидов РЗЭ Ln2O3 проявляют химическую инертность в реакции сульфидирования сероводородом (6).
Шихту, после стадии обработки в потоке водорода при 500°-600°C, обрабатывают в потоке сероводорода H2S при повышении температуры реакционной зоны до 850°-950°C. Обработка при 850-950°C проводится либо непосредственно сразу по окончании стадии обработки при 500°-600°C, когда в реактор подают сероводород и температуру поднимают до 850°-950°C, либо после охлаждения шихты. Охлаждение шихты возможно, например, для того, чтобы дополнительно растереть образец, если происходит его спечение. Практика показала, что непрерывное проведение процесса статистически сокращает время обработки до получения однофазного диоксосульфида Ln2O2S или однофазных твердых растворов L n 2 − 2 x ' L n 2 x ' ' O 2 S (x=0÷1, Ln', Ln''=Gd-Lu, Y).
Сероводород синтезируют по реакции:
в процессе барбатирования водорода через расплав серы при 350°C. При той же скорости подачи водорода 7-8 л/час (стандартные условия) образуются эквивалентные количества H2S.
В процессе воздействия сероводородом на шихту происходит сульфидирование находящихся в образце фаз Ln2O3. Процесс отражает уравнение реакции (6):
Продолжительность обработки при 850-950°C в течение до 10-13 часов является достаточной для образования однофазных порошков образцов твердых растворов L n 2 − 2 x ' L n 2 x ' O 2 S (x=0÷1, Ln' Ln''=Gd-Lu, Y).
При получении диоксосульфидов Ln2O2S (Ln=Gd-Lu, Y) продолжительность обработки в потоке H2S в зависимости от вида РЗЭ может быть сокращена до 5-7 часов для соединения РЗЭ начала иттриевой подгруппы Gd, Tb, Dy до 7-10 часов для соединений РЗЭ Er, Tm.
Температурный интервал 850-950°C является наиболее подходящим для получения однофазных образцов диоксосульфидов РЗЭ при минимизации энергозатрат.
Продукты реакции (3) соединения Ln2O3 в процессе обработки при 500-600°C образуются в виде микро- и наноразмерных частиц, которые мало изменяются за время протекания процесса до 5-6 часов.
Такие факторы, как микро- и наноразмерность частиц фазы Ln2O3, их недостаточная окристаллизованность, наличие в кристаллической структуре фазы дефектов (размытость рефлексов фазы Ln2O3 на дифрактограммах) сокращают продолжительность протекания гетерогенной реакции взаимодействия фазы Ln2O3 с H2S до образования фазы Ln2O2S (реакция 6).
Сульфидирование частиц Ln2O3, полученных по реакции (3) при 850-950°C, до получения однофазных образцов состава Ln2O2S, требует более продолжительных обработок. В среднем, продолжительность обработки увеличивается до двух и более раз.
Обработка при температуре ниже 850°C нецелесообразна, поскольку недостаточная скорость протекания реакции (6) приведет к дополнительному расходу токсичного газа H2S. Повышение температуры обработки выше 950 C при продолжительности воздействия сероводородом более 13 часов создают условия для образования соединений Ln2S3, которые, при их образовании, фиксируются методом РФА.
По сравнению с известными способами получения соединений Ln2O2S заявляемое техническое решение обеспечивает менее продолжительные высокотемпературные (850-950°C) обработки и позволяет нарабатывать однофазные образцы соединений с минимальным привнесением в образец технологических примесей.
Соединения Ln2(SO4)3, Ln2O2SO4, Ln2O2S в интервале температур 500-950°C не взаимодействуют с кварцевым стеклом (оксидом кремния SiO2, из которого изготовлены реактор, стакан и газоотводная трубка), а также с тиглем из оксида алюминия Al2O3. Степень чистоты азотной и серной кислот марки х.ч. превышает степень чистоты исходных соединений Ln2O3 (Ln=Gd-Lu, Y) марок Г, Д.
В предлагаемом способе используют нетоксичные соединения (сульфаты и оксосульфаты РЗЭ), а также нетоксичный газообразный водород. Работа с газообразным водородом, получаемым электролизом деионизированной воды в генераторе водорода, при соблюдении всех правил работы на этом приборе, опасности не представляет. Температура в муфельных печах 500-950°C является легкодостижимой для большинства муфельных печей. Оптимизированы условия обработки в потоке H2S, что минимизирует расход данного токсичного реагента.
Пример 1. Получение однофазного диоксосульфида иттрия Y2O2S в виде порошка.
Сульфат иттрия получают из товарного оксида иттрия Y