Способ определения позиции примесей нитратных соединений в гидроксиапатите
Иллюстрации
Показать всеИспользование: для определения позиций примесей соединений азота в гидроксиапатитах. Сущность изобретения заключается в том, что облучают образец гидроксиапатита рентгеновскими, гамма- или электронными лучами с последующей регистрацией методом ЭПР возникших при облучении парамагнитных центров на сертифицированном ЭПР спектрометре, вычисляют спектральные характеристики наблюдаемого спектра ЭПР (число наблюдаемых линий и их положение) с контролем погрешности измерений и сравнивают полученные спектральные характеристики со спектральными характеристиками азотных радикалов, при этом производят дополнительное сравнение полученных ранее спектральных характеристик со спектральными характеристиками азотных радикалов в различных позициях, замещающих функциональные группы OH и(или) PO4 в структуре гидроксиапатита, в частности, с возможностью определения мест(а) внедрения (замещения) примесей соединений азота в структуру гидроксиапатита. Технический результат: обеспечение возможности определения позиций примесей соединений азота в гидроксиапатитах. 1 ил.
Реферат
Изобретение относится к физико-химическим методам анализа, а именно к способам определения позиций примесей соединений азота в гидроксиапатитах (далее ГАП).
Вещества со структурой гидроксиапатита Ca10(PO4)6(OH)2 входят в состав биологических тканей. Синтезируемый ГАП широко используется как профилактическая составляющая зубных паст и медицинский материал для заполнения костных дефектов, который должен быть полностью биологически совместим с тканями человеческого организма и по химическому и структурному составам должен быть близок к составу зубной эмали и костной ткани человека [1, 2]. В ряде известных заявителю методик для синтеза ГАП используют растворы солей азотной кислоты натрия и/или кальция [3-5]. Было показано [5], что в процессе синтеза ГАП в коллоидном растворе азотные соединения могут внедряться в кристаллическую структуру гидроксиапатита. Синтетический ГАП может также использоваться в качестве адсорбентов нитратов для удаления их из питьевой воды, например [6].
С одной стороны, многочисленные исследования (см., например, [7]) свидетельствуют о токсичности нитратов и нитритов: нитраты в пищеварительном тракте частично восстанавливаются до нитритов (более токсичных соединений), а последние при поступлении в кровь могут вызвать метгемоглобинемию. Кроме того, из нитритов в присутствии аминов могут образоваться N-нитрозамины, обладающие канцерогенной активностью, что предъявляет повышенные требования к химическому составу гидроксиапатитов как материалов, широко применяемых в лечебно-профилактических целях. С другой стороны, было показано [8], что содержание азотных соединений в следовых количествах в имплантатах на основе ГАП улучшает их резорбцию.
Изобретение может быть использовано для контроля качественного состава природного и синтезируемого ГАП в смысле определения локализации (позиции) азотных примесей в структуре ГАП в целях увеличения биосовместимости синтезируемого и природного гидроксиапатитов, ведущие к повышению эффективности гигиеническо-профилактических мероприятий и лечения с применением синтетического ГАП, синтезу новых адсорбентов нитратов на основе ГАП, разработке методик восстановления адсорбирующих возможностей ГАП.
Наиболее близким по совокупности признаков к заявленному техническому решению является патент [9] (прототип). Однако в нем представлена лишь сама возможность детектирования наличия азотных примесей и определения их концентраций в ГАП и не представлен способ определения их локализации. По реализации поставленных задач заявителю известны способы определения локализации карбонат-ионов в ГАП натурального происхождения и химически модифицированных ГАП (см. [10] и ссылки там) и способы определения локализации ионов металлов в структуре ГАП (см. [11] и ссылки там). Основными их недостатками является то, что они не предназначены и не использовались для целей определения локализации азотных соединений в веществах со структурой ГАП. Таким образом, приведенные выше способы не могут быть использованы в полной мере для реализации поставленных в заявленном техническом решении задач.
Заявленное техническое решение направлено на определение локализации азотных соединений в веществах со структурой гидроксиапатитов, применяемых для проведения медико-биологических исследований и лечебно-профилактических мероприятий, с обеспечением возможности улучшения контролируемых показателей данных материалов с целью уменьшения их токсичности и повышения биологической совместимости, что, в конечном счете, приводит к повышению эффективности гигиенических и лечебных мероприятий с применением ГАП и материалов на его основе.
Кроме указанного, заявленное техническое решение может найти применение в области материаловедения, а именно для определения локализации азотных соединений в веществах со структурой гидроксиапатитов, применяемых для адсорбции нитратов, с обеспечением возможности улучшения контролируемых показателей данных материалов.
Основываясь на изложенном, заявленное техническое решение обеспечивает реализацию следующих целей:
- определение наличия содержания примесей азотных соединений в природных и синтезируемых гидроксиапатитах;
- определение позиции (локализации) азотных соединений в структуре природных и синтезируемых гидроксиапатитов;
- определение количественных показателей: соотношения концентраций азотных соединений, находящихся в разных позициях в структуре природных и синтезируемых гидроксиапатитов и их общей концентрации;
- обеспечение возможности контроля качественного состава синтезируемых материалов со структурой гидроксиапатита в смысле наличия и распределения по позициям примесей соединений азота как в процессе синтеза, так и процессе очистки материалов от посторонних включений, что может быть использовано при принятии решения о допустимости использования синтетического ГАП в медико-биологических приложениях и позволит давать рекомендации по улучшению технологии производства материалов со структурой гидроксиапатита с целью минимизации токсичности и повышения биологической совместимости с природными материалами, что ведет, в конечном счете, к повышению эффективности гигиенических и лечебных мероприятий с применением ГАП или с целью эффективного восстановления адсорбирующих возможностей ГАП, ведущих, в конечном счете, также и к увеличению срока службы адсорбирующих материалов.
Заявленный способ определения примесей соединений азота в гидроксиапатите заключается в следующем: облучении образца гидроксиапатита рентгеновскими, гамма или электронными лучами с последующей регистрацией методом ЭПР возникших при облучении парамагнитных центров на сертифицированном ЭПР спектрометре, вычислении спектральных характеристик наблюдаемого спектра ЭПР (число наблюдаемых линий и их положение) с контролем погрешности измерений и сравнении полученных спектральных характеристик, в первую очередь констант сверхтонкой структуры, с известными спектральными характеристиками азотных радикалов в различных позициях в гидроксиапатите.
Заявленный способ характеризуется следующей последовательностью выполнения этапов:
а) помещение образца гидроксиапатита в стандартную кварцевую ампулу спектрометра ЭПР;
б) облучение образца гидроксиапатита рентгеновскими, гамма или электронными лучами (с соблюдением санитарно-гигиенических норм) при комнатной температуре, доза радиации составляет от 1 до 10 кГр (килогрей);
в) регистрация спектра ЭПР на сертифицированном ЭПР спектрометре, позволяющем проводить измерения в непрерывном или импульсном режимах работы;
г) вычисление параметров спектра ЭПР (количество линий, значение компонент g-тензора и тензора сверхтонкого взаимодействия А, а именно в условно параллельной (||) и перпендикулярной ориентациях (⊥));
д) контроль погрешности результатов измерений;
е) сравнение полученных параметров с параметрами, известными для азотных радикалов, таких как N O 3 2 − в ГАП для разных позиций в облученных кристаллических матрицах ГАП (количество линий n=3, значения компонент g-тензора и тензора сверхтонкого взаимодействия A: g||=2.003(2), g⊥=2.006(3), A||=6.6(4) мТл, A⊥=3.4(4) мТл для замещения в позиции PO4 и n=3, g||=2.003(2), g⊥=2.006(3), A||=5.2(4) мТл, A⊥=2.5(4) мТл для замещения позиции OH). При этом следует отметить, что изменение последовательности выполнения операций а) и б) не изменяет полученный технический результат.
Таким образом, отличие от прототипа [9] заключается в пункте е) указанной последовательности, позволяющей определить позицию нитрат-иона по разнице компонент тензора сверхтонкого взаимодействия A.
Достигнутый технический результат заключается в возможности определения позиции нитратов в структуре ГАП на основе регистрации спектров парамагнитных центров, полученных в результате облучения вышеуказанных материалов рентгеновскими, гамма или электронными лучами, методом ЭПР, что, в конечном счете, позволяет определить структурный и химический состав ГАП и материалов, созданных на их основе.
Заявителем впервые в составе синтетического ГАП на основе регистрации методом ЭПР были обнаружены парамагнитные центры, которые, по мнению заявителя, обусловлены наличием примесей соединений азота в позициях, замещающих группы PO4 в указанных выше соединениях. Заявленное техническое решение иллюстрируется следующими материалами.
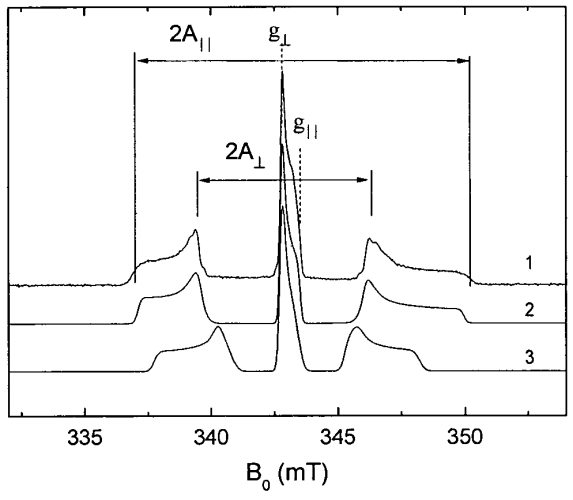
На Фиг. представлены кривая (1): спектр ЭПР, полученный с использованием методики детектирования спинового эха на частоте СВЧ 9,6 ГГц при T=300 K в синтезированных нанокристаллах ГАП со средними размерами нанокристаллитов 50 нм, подвергшийся рентгеновскому облучению с дозой 5 кГр. Указаны параллельные и перпендикулярные составляющие значений компонент g-тензора и тензора сверхтонкой структуры A. По оси абсцисс отложены значения магнитного поля (в миллитеслах), по оси ординат - амплитуда сигнала спинового эха (в условных единицах). Кривая (2): спектр ЭПР, рассчитанный известным способом (см. источник 9, описанным далее в формуле 1) с параметрами g||=2.003, g⊥=2.006, A||=6.6 мТл, A⊥=3.4 мТл. Кривая (3): спектр ЭПР, рассчитанный известным способом (см. источник 9, описанным далее в формуле 1) с параметрами g||=2.003, g⊥=2.006, A||=5.2 мТл, A⊥=2.5 мТл.
Примеры конкретного выполнения
Заявителем были получены спектры ЭПР в импульсном режиме [12] работы спектрометра Х-диапазона Bruker Elexsys 580 с рабочей частотой 9,6 ГГц синтезированных нанокристаллов ГАП с размерами нанокристаллитов 50(10) нм. Спектр ЭПР нанокристаллов гидроксиапатита, подвергшихся рентгеновскому облучению с дозой 10(1) кГр, представлен на Фиг. (кривая 1).
Спектр ЭПР описывается спиновым гамильтонианом аксиальной симметрии [9]:
где S=1/2, I=1; с параметрами гамильтониана g||=2.003(2), g⊥=2.006(3), A||=6.65(40) мТл, А⊥=3.4(3) мТл (Фиг., кривая (2)), характерным для замещения нитрат-ионом позиции PO4 в структуре ГАП и не описывается указанным выше гамильтонианом с параметрами гамильтониана g||=2.003(2), g⊥=2.006(3), A||=5.2(40) мТл, A⊥=2.5(3) мТл (Фиг., кривая (3)), характерным для замещения нитрат-ионом позиции OH в структуре ГАП. Таким образом, сопоставляя численные значения параметров A⊥ и A||, численно характеризующих положение отдельных компонентов в спектре ЭПР, в данном синтезированном образце выявлено месторасположение (локализации) нитратного иона как занимающего (замещающего) позицию иона PO4 в структуре ГАП.
Таким образом, заявленное техническое решение позволяет обеспечить достижение поставленных целей, а именно определить качественно и оценить количественно наличие содержания азотных соединений в различных позициях в природных и синтезируемых гидроксиапатитах, что позволяет контролировать качественный состав синтезируемых материалов со структурой гидроксиапатита в смысле наличия примесей соединений азота в определенных позициях в структуре ГАП как в процессе синтеза, так и процессе очистки материалов от посторонних включений, что может быть использовано потребителями при принятии решения о допустимости использования синтетического ГАП в медико-биологических приложениях и позволит давать рекомендации производителям, например, синтетического ГАП по улучшению технологии производства материалов со структурой гидроксиапатита с целью минимизации токсичности, повышения биологической совместимости с природными материалами, увеличению сорбционной способности при использовании ГАП как адсорбента нитратов, ведущих, в конечном счете, к повышению эффективности гигиенических и лечебных мероприятий с применением ГАП и более эффективному удалению нитратов, например, из питьевой и грунтовой воды, повышающих их качество.
Заявленное техническое решение соответствует критерию «новизна» предъявляемому к изобретениям, т.к. совокупность заявленных признаков не известна из исследованного заявителем уровня техники.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, т.к. не является очевидным для специалиста в данной области техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, т.к. заявленные цели реализованы заявителем в условиях лаборатории спектроскопии ЭПР Казанского (Приволжского) федерального университета.
Источники информации
1. J.P. Lafon, E. Champion and D. Bemache-Assollant, Processing of AB-type carbonated hydroxyapatite Ca 10-x (PO4) 6-x (CO3)×(OH) 2-x-2y (CO3) y, ceramics with controlled composition. J. Eur. Cer. Soc, 28 (1), p.139-147 (2008).
2. R.Z. LeGeros, Properties of osteoconductive biomaterials: calcium phosphates, Clin. Orthoped. rel. Res, 395 (1), p.81-98 (2002).
3. I.R. Gibson, W. Bonfield, Novel synthesis and characterization of an AB-type carbonate-substituted hydroxyapatite. J. Biomed. Mater. Res. 59(4), 697-708 (2002).
4. L.G. Ellies, D.G.A. Nelson, J.D.B. Featherstone, Crystallographic structure and surface morphology of sintered carbonated apatites. J. Biomed. Mater. Res. 22 (6), 541-553 (1988).
5. E.S. Kovaleva, М.Р. Shabanov, V.I. Putlyaev, Y.D. Tretyakov, V.K. Ivanov, N.I. Silkin, Bioresorbable carbonated hydroxyapatite Ca 10-x Na×(PO4) 6-x (CO3)×(OH) 2. Cent. Eur. 1 Chem. 7(2), 168-174 (2009).
6. Islam M, Mishra PC, Patel R. Physicochemical characterization of hydroxyapatite and its application towards removal of nitrate from water. J Environ Manage 2010; 91: 1883-1891.
7. Бандман АЛ., Волкова Н.В. и др. Вредные химические вещества. Неорганические соединения элементов V-VIII групп. Справочное издание. Под ред. В.А. Филова и др. Л.: Химия, 1989, 592 с.
8. M.V. J Hukkanen, J.M. Polak and S.P.F. Hughes Nitric Oxide in Bone and Joint Disease, Cambridge: Cambridge University Press. 1998, p.191.
9. Патент на изобретение RU №2465573 Авторы: Силкин Н.И., Салахов M.X., Орлинский. В., Мамин Г.В., Челышев Ю.А., Галиуллина Л.Ф., Токарев Г.А., Игумнов Е.С., Гафуров M.Р. СПОСОБ ОПРЕДЕЛЕНИЯ ПРИМЕСЕЙ СОЕДИНЕНИЙ АЗОТА В ГИДРОКСИАПАТИТЕ.
10. F. Ren, X. Lu, Y. Leng Ab initio simulation on the crystal structure and elastic properties of carbonated apatite J Mech Behav Biomed 26 (2013) 59-67.
11. В.V. Yavkin, G.V. Mamin, S.B. Orlinskii, M.R. Gafurov, M.Kh. Salakhov, T.B. Biktagirov, E.S. Klimashina, V.I. Putlayev, Yu.D. Tretyakov and N.I. Silkin Phys. Chem. Chem. Phys., 2012, 14, 2246-2249.
12. J.A. Weil, J.R. Bolton. Electron Paramagnetic Resonance: Elementary Theory and Practical Applications, 2 nd Edition. J. Wiley, 2007. ISBN 978-0471754961.
Способ определения позиций примесей соединений азота в гидроксиапатите, заключающийся в облучении образца гидроксиапатита рентгеновскими, гамма- или электронными лучами с последующей регистрацией методом ЭПР возникших при облучении парамагнитных центров на сертифицированном ЭПР спектрометре, вычислении спектральных характеристик наблюдаемого спектра ЭПР (число наблюдаемых линий и их положение) с контролем погрешности измерений и сравнении полученных спектральных характеристик со спектральными характеристиками азотных радикалов, отличающийся тем, что производят дополнительное сравнение полученных ранее спектральных характеристик со спектральными характеристиками азотных радикалов в различных позициях, замещающих функциональные группы OH и(или) PO4 в структуре гидроксиапатита, в частности, с возможностью определения мест(а) внедрения (замещения) примесей соединений азота в структуру гидроксиапатита.