Средство для лечения нарушений мозгового кровообращения и травм головного мозга
Иллюстрации
Показать всеПредложено применение N-(2-адамантил)-гексаметиленимина гидрохлорида (гимантана) в качестве средства для лечения нарушений мозгового кровообращения и травм головного мозга. Установлена способность гимантана при его введении через 3,5 часа после моделирования гематомы у крыс и последующем введении в течение 4 дней снижать смертность животных и улучшать когнитивные и моторные показатели, что свидетельствует о наличии у него нейропротекторного потенциала на модели интрацеребральной посттравматической гематомы. Технический результат состоит в реализации заявленного назначения: показано, что гимантан в дозе 5 мг/кг при внутривенном введении вызывал увеличение мозгового кровотока в коре головного мозга крыс после ишемического поражения мозга, не изменяя при этом уровня артериального давления. Препарат не оказывал значимого влияния на кровоснабжение мозга интактных животных и не вызывал изменений частоты сердечных сокращений и частоты дыхания. 1 ил., 6 табл.
Реферат
Изобретение относится к медицине, в частности к фармакологии, и касается нового применения известного вещества - N-(2-адамантил)-гексаметиленимина гидрохлорида (гимантана) (патент №1825499) - для лечения нарушений мозгового кровообращения и травм головного мозга.
Болезнь Паркинсона - нейродегенеративное заболевание, характеризующееся прогрессирующей гибелью дофаминергических нейронов. Для патогенетической терапии данного заболевания актуален поиск препаратов, замедляющих и предотвращающих нейродегенеративный процесс. Нейродегенерация ткани головного мозга также является следствием инсультов, смертность и инвалидизация при которых представляет острую проблему для современного здравоохранения. Нейропротекторные препараты, используемые для терапии нейродегенеративных заболеваний и, в частности, болезни Паркинсона, перспективно рассматривать в качестве потенциальных лекарственных средств для терапии нарушений мозгового кровообращения и травм головного мозга.
Настоящее изобретение описывает новое применение противопаркинсонического препарата гимантана в качестве средства для лечения нарушений мозгового кровообращения и травм головного мозга.
Прототипом настоящего изобретения является низкоафинный неконкурентный блокатор ионного канала глутаматных рецепторов NMDA подтипа амантадин, широко используемый для ослабления двигательных нарушений на ранних стадиях болезни Паркинсона, благодаря нейропротекторным свойствам инъекционная форма которого применяется при черепно-мозговых травмах и острых нарушениях мозгового кровообращения. Показано, что при черепно-мозговых травмах назначение амантадина в дозе 200-400 мг в сутки вызывало у больных улучшение памяти и внимания (Е.Sawyer, L.S.Mauro, M.J.Ohiinger Ann Pharmacother 2008; 42(2): 247-252). Введение амантадина гидрохлорида в течение 4 недель пациентам в посттравматическом вегетативном состоянии или минимальном сознании ускоряло функциональное восстановление, но при отмене препарата отмечено ухудшение состояния в сравнении с пациентами, получавшими плацебо (D.Brunk. Clin neurol news 2011; 7(6): 12-13).
Назначение амантадина сульфата в острейшем периоде ишемического инсульта приводило к значимому восстановлению уровня сознания и улучшению динамики регресса неврологических нарушений с наиболее интенсивным восстановлением неврологического дефицита в 1-е сутки (Д.Р.Хасанова, Р.X.Хафизьянова, Р.Р.Исламов и др. Журн. неврологии и психиатрии им. С.С.Корсакова 2009; 5: 37-43). Применение препарата ежедневно внутривенно в течение 10 дней у больных в остром периоде ишемического инсульта ускоряло восстановление двигательных нарушений и уменьшало спастичность (Е.И.Гусев, Г.Н.Авакян, Е.А.Катунина и др. Журн. неврологии и психиатрии им. С.С.Корсакова. Инсульт. 2006; 18: 55-57).
В экспериментальных исследованиях установлено, что гимантан в дозах 5-20 мг/кг обладает широким спектром противопаркинсонической активности: ослабляет основные проявления экспериментального паркинсонического синдрома у мышей линии C57BL/6 и крыс - олигокинезию, ригидность, тремор. Гимантан как противопаркинсоническое средство превосходит амантадин по дозовому диапазону и спектру специфической активности. Значимым преимуществом гимантана является способность к устранению тремора. Гимантан, в отличие от амантадина, оказывает анксиолитическое и антидепрессивное действие (Е.А.Вальдман. Автореф. дис. д-ра мед. наук, 2001, Москва). Установлены основные нейрохимические механизмы действия гимантана: низкоаффинная неконкурентная блокада ионного канала глутаматных рецепторов NMDA подтипа в концентрациях, достигаемых при системном введении (М.В.Елшанская, А.И.Соболевский и др. Эксперим. и клин. фармакология 2001; 64(1): 18-21); неконкурентное обратимое ингибирование моноаминооксидазы В (МАО-В) (Е.А.Вальдман, Т.А.Воронина, Л.И.Аксенова и др. Эксперим. и клин. фармакология 2003; 5: 3-5). Гимантан в терапевтической дозе повышает содержание внеклеточного дофамина и снижает содержание его метаболитов в стриатуме крыс. Гимантан оказывает модулирующее действие на подтипы дофаминовых и серотониновых рецепторов, а также на обратный захват дофамина. Субхроническое введение гимантана крысам приводит ex vivo к увеличению количества D1-рецепторов в стриатуме и 5-HT1A-рецепторов в гиппокампе с одновременным снижением количества 5-HT2A-рецепторов во фронтальной коре, как в норме, так и при МРР+ - вызванном паркинсоническом синдроме у животных. Острое введение гимантана не влияет на уровень белка дофаминового транспортера (DAT) в стриатуме мышей линии С57В1/6, а также на скорость обратного захвата [3Н]-ДА; совместное введение препарата с МРТР вызывает значительное снижение уровня DAT. Субхроническое введение гимантана интактным животным и животным на фоне токсина, напротив, приводит к увеличению количества DAT в стриатуме и фронтальной коре, а также увеличивает скорость обратного захвата [3Н]-ДА в стриатуме. (Г.И.Ковалев, Д.А.Абаимов, М.В.Воронин и др. Нейрохимия 2007; 24(2): 150-156; Д.А.Абаимов, Г.И.Ковалев. Эксперим. и клин. фармакология 2007; 70(4): 11-14.) Гимантан проявляет антиоксидантную активность в модельных системах in vitro и in vivo. Гимантан не оказывает негативного влияния на обучение и память, не обладает аддиктивным потенциалом, не изменяет психомоторной активности животных, то есть не имеет побочных эффектов, присущих некоторым антагонистам NMDA рецепторов (Е.А.Вальдман. Автореф. дис. д-ра мед. наук, 2001, Москва).
Прямое и опосредованное через NMDA рецепторы влияние на дофаминовые рецепторы, высвобождение, обратный захват и метаболизм дофамина способствуют повышению активности дофаминергической передачи и обусловливают симптоматический эффект препарата при болезни Паркинсона. В клиническом исследовании гимантан эффективно устранял основные двигательные нарушения у больных с ранними стадиями болезни Паркинсона при применении в дозе 25 мг в сутки (Е.А.Катунина, А.В.Петрухова, Г.Н.Авакян и др. Журн. неврологии и психиатрии им. С.С.Корсакова 2008; 108(6): 24-27).
Комплексный механизм действия, включающий свойства низкоаффинного неконкурентного блокатора ионного канала глутаматных рецепторов NMDA подтипа, неконкурентного ингибитора МАО-В, модулятора подтипов дофаминовых и серотониновых рецепторов и обратного захвата дофамина, антиоксидантные свойства позволяют предполагать наличие у гимантана нейропротекторной активности и рассматривать его как средство патогенетической терапии болезни Паркинсона, поскольку глутаматная эксайтотоксичность, оксидативный стресс и нейровоспаление лежат в основе прогрессирующей дегенерации преимущественно дофаминергических нейронов при данном заболевании. Вместе с тем эти же процессы лежат в основе гибели нейронов и при других острых состояниях, в частности при нарушениях мозгового кровообращения и травмах головного мозга.
Сущность настоящего изобретения заключается в выявлении возможности применения гимантана для терапии травм головного мозга и нарушений мозгового кровообращения и поясняется следующими примерами.
Пример 1
Влияние гимантана на динамику нарушений, вызванных интрацеребральной посттравматической гематомой, при разных способах введения
Эксперименты проводились на белых нелинейных крысах-самцах массой 220-250 г, полученных из закрытой колонии питомника «Столбовая» РАМП.
Моделирование интрацеребральной посттравматической гематомы проводили по описанной методике (А.И.Макаренко, Н.С.Косицин, Н.В.Пасикова, М.М.Свинов. Журн. высш. нервной деятельности 2002; 52(6): 760-763; Т.Л.Гарибова, И.П.Галаева, Т.А.Воронина и др. Эксперим. и клин. Фармакология, 2003; 66(3): 13-16). Крыс наркотизировали хлоралгидратом (400 мг/кг, внутрибрюшинно). После трепанации черепа при помощи специального устройства (мандрен - нож) и стереотаксиса разрушали мозговую ткань в области внутренней капсулы. Через 2-3 минуты в место повреждения вводили 0,02-0,03 мл крови, взятой из хвостовой вены животного. Таким способом достигается локальный аутогеморрагический инсульт в области внутренней капсулы (диаметр - 2 мм, глубина - 3 мм) без существенных повреждений вышерасположенных образований мозга и неокортекса.
Гимантан использовали в дозе 5 мг/кг в виде инъекционной лекарственной формы (50 мг в 2 мл) при внутривенном введении и в дозе 10 мг/кг в виде субстанции при внутрибрюшинном введении. Гимантан растворяли в физиологическом растворе. Животные были разделены на 4 группы:
1. Пассивный контроль - ложно оперированные животные (ЛО), которым под наркозом проводилась только трепанация черепа.
2. Активный контроль - животные с интрацеребральной гематомой (ИГ).
3. Группа «Гимантан 5 мг/кг в/в» - крысы с ИГ, которым вводили внутривенно гимантан в дозе 5 мг/кг.
4. Группа «Гимантан 10 мг/кг в/б» - крысы с ИГ, которым вводили внутрибрюшинно гимантан в дозе 10 мг/кг.
Первую инъекцию гимантана делали через 3,5-4 часа после операции, затем ежедневно один раз в день в течение четырех дней. Использованы наиболее эффективные в ранее проведенных исследованиях противопаркинсонической активности дозы препарата при соответствующем пути введения (Е.А. Вальдман. Автореф. дис. д-ра мед. наук, 2001, Москва; патент РФ №1825499; заявка на выдачу патента на изобретение №2011124339 от 16.06.2011 г.). Животным 1 и 2 групп вводили физиологический раствор в эквивалентном объеме.
Динамику нарушений, вызванных интрацеребральной посттравматической гематомой, и эффект гимантана при разных путях введения оценивали в течение 14 суток с регистрацией изменений координации движений в тесте «вращающийся стержень» и мышечного тонуса по подтягиванию на горизонтальной перекладине. Оценку обучения и памяти проводили в тесте условного рефлекса пассивного избегания (УРПИ) на первые, третьи, седьмые и четырнадцатые сутки после операции. В течение 14 суток после операции регистрировали выживаемость крыс (С.Б.Середенин, В.А.Крайнева. Эксперим. и клин. Фармакология, 2009; 72 (1): 24-28.). Статистическую обработку данных проводили с помощью компьютерных программ "Statistica-8" (Statistika Inc., США) и "Biostat" с использованием критерия Шапиро-Уилка для оценки нормальности распределения, t-критерия Стьюдента для независимых выборок и критерия Фишера. Результаты рассматривали как значимые при p<0,05.
Результаты
Выживаемость животных
В течение двух недель после операции наблюдалась гибель крыс во всех экспериментальных группах. Самая высокая смертность была зафиксирована в группе активного контроля и составила 40% животных, что было на 30% выше по сравнению с группой ложно оперированных (ЛО) крыс, в которой погибли 10% особей. В обеих группах животных с ИГ, которым внутривенно и внутрибрюшинно вводили гимантан, умерло по 20% крыс.
Влияние на координацию и мышечный тонус
Нарушения координации движений и ослабление мышечного тонуса были выражены у большей части животных с ИГ в 1-е и 3-й сутки с постепенным улучшением к 14-м суткам, когда нарушения регистрировались у 25% животных. У ЛО животных отмечено некоторое снижение этих показателей в первый день с полным восстановлением к 7-му дню наблюдений. В группах животных с ИГ, которым вводился гимантан, нарушения были выражены значительно меньше, чем у нелеченых крыс с ИГ. Полное восстановление к 14-м суткам зарегистрировано в обеих группах животных, получавших гимантан (таблица 1).
| Таблица 1 | ||||||||
| Влияние гимантана при разных способах введения на координацию и | ||||||||
| мышечный тонус крыс с интрацеребральной гематомой | ||||||||
| Доля животных группы, не удержавшихся на вращающемся стержне (в.с.) и не подтянувшихся на горизонтальной перекладине (т.п.), % | ||||||||
| 1-е сутки | 3-и сутки | 7-е сутки | 14-е сутки | |||||
| Группа животных | в.с. | г.п. | в.с. | г.п. | в.с. | г.п. | в.с. | г.п. |
| ЛО | 25 | 25 | 5,5 | 5,5 | 0 | 0 | 0 | 0 |
| ИГ | 66,3* | 66,3* | 57,2 | 57,2 | 53,8 | 46,16 | 25 | 25 |
| Гимантан 5 мг/кг в/в | 40 | 40 | 10# | 10# | 11# | 11 | 0 | 0 |
| Гимантан 10 мг/кг в/б | 20 # | 20 # | 33,3 | 33,3 | 0# | 12,5 | 0 | 0 |
| * - p<0,05 в сравнении с группой ложно оперированных крыс | ||||||||
| # - р<0,05 в сравнении с группой с интрацеребральной | ||||||||
| гематомой (точный критерий Фишера) |
Влияние на память
В тесте УРПИ перед проведением сеанса обучения оценивался норковый рефлекс по латентному времени первого захода в темный отсек установки. Достоверных различий в группах животных по времени выполнения рефлекса не выявлено, что свидетельствует об идентичных исходных условиях обучения.
При оценке воспроизведения памятного следа через 24 ч установлено, что в группе животных с ИГ латентный период захода в темную камеру оказался значительно ниже, чем у ЛО, большинство животных не помнили об ударе током. При воспроизведении УРПИ на 3-и, 7-е и 14-е сутки после обучения в группе ЛО животных отмечалось постепенное угасание памятного следа, но во все дни наблюдений показатель оставался достоверно выше, чем в группе животных с ИГ.
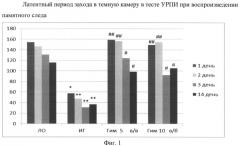
Введение гимантана 5 мг/кг внутривенно в течение 5 дней после операции полностью предотвращало нарушения памяти у животных с ИГ, показатели воспроизведения памятного следа не отличались от группы ЛО во все дни наблюдений. Эффективность гимантана при внутрибрюшинном введении в дозе 10 мг/кг была сопоставима с его активностью при внутривенном введении в дозе 5 мг/кг (фиг.1).
Пример 2
Влияние гимантана на кровоснабжение мозга интактных крыс и кровоснабжение мозга животных в условиях глобальной преходящей ишемии
Экспериментальная работа проводилась на белых нелинейных крысах-самцах массой 250-300 г, полученных из закрытой колонии питомника «Столбовая» РАМН.
Животных наркотизировали уретаном (1200 мг/кг, внутрибрюшинно). Гимантан использовали в дозе 5 мг/кг и 10 мг/кг в виде инъекционной лекарственной формы (50 мг в 2 мл) при внутривенном введении. Приток крови в мозг регистрировали в системе сонных артерий с помощью ультразвукового флоуметра фирмы Т106 фирмы "Transonic Systems Inc."(США). Датчик флоуметра диаметром 1 мм устанавливался на общей сонной артерии животных после перевязки наружной сонной артерии. Регистрацию артериального давления производили в бедренной артерии через силиконовый катетер, введение препарата осуществляли через силиконовый катетер в бедренную вену. Для оценки состояния микроциркуляции в сосудах головного мозга проводили регистрацию локального мозгового кровотока в теменной области коры головного мозга крыс с помощью лазерного допплеровского флоуметра ALF-21 фирмы "Transonic System Inc." (США). Для этой цели игольчатый датчик флоуметра диаметром 0,8 мм устанавливали на теменной области коры головного мозга на расстоянии 6-7 мм дистальнее основания средней мозговой артерии по направлению ее центральной ветви с помощью микроманипулятора и коромысла.
Глобальную преходящую ишемию у крыс вызывали окклюзией обеих общих сонных артерий в течение 10 минут. Одновременно методом кровопускания снижали уровень артериального давления до 40-50 мм рт. ст. Снижение артериального давления необходимо для нарушения функционирования вертебробазилярной системы, которая обеспечивает кровоснабжение жизненно важных центров, расположенных в стволовой области мозга. Спустя 10 минут удаляли зажимы и кровь реинфузировали. Гимантан вводили через 40-45 минут после глобальной преходящей ишемии мозга.
Все исследуемые показатели регистрировали с использованием полиграфа фирмы «BIOPAK» (США), запись показателей производили на персональном компьютере.
Статистическую обработку данных проводили с использованием пакета программ Stastistika 8,0 (Statistika Inc., США). Для оценки нормальности распределения использовали критерий Шапиро-Уилка. Так как нормальное распределение отсутствовало, для дальнейшей обработки данных использовали непараметрический двухвыборочный знаково-ранговый критерий Вилкоксона. Результаты рассматривали как значимые при р<0,05.
Результаты
Влияние гимантана на кровоснабжение мозга крыс
Проведенные опыты на наркотизированных крысах показали, что гимантан в дозе 5 мг/кг при внутривенном введении вызывает небольшое снижение мозгового кровотока во внутренней сонной артерии в среднем на 5,25% (20-я минута, таблица 2). Снижение кровотока отмечается в течение 60 минут наблюдения, однако с 30 минуты и до конца эксперимента его уменьшение статистически незначимо.
На фоне однократного внутривенного введения гимантана в дозе 5 мг/кг на 20 минуте эксперимента наблюдалась тенденция к повышению уровня артериального давления (таблица 3). Однако уже начиная с 30 минуты и до конца эксперимента уровень артериального давления статистически незначимо понижался.
| Таблица 2 | |||||||||||||
| Влияние гимантана (5 мг/кг, внутривенно) на мозговой кровоток (МК) в сонной артерии у наркотизированных | |||||||||||||
| крыс (мл/мин; доля МК относительно фона, %) | |||||||||||||
| Фон мл/мин | 10 мин после препарата мл/мин | 20 мин после препарата мл/мин | 30 мин после препарата мл/мин | 40 мин после препарата мл/мин | 50 мин после препарата мл/мин | 60 мин после препарата мл/мин | |||||||
| 10 мин | % | 20 мин | % | 30 мин | % | 40 мин | % | 50 мин | % | 60 мин | % | ||
| Минимум | 33 | 3,2 | -8,1 | 2,7 | -23,1 | 2,7 | -18,2 | 2,8 | -15,2 | 2,8 | -15,4 | 3,0 | -13,5 |
| 25-й проц. | 4,2 | 4,3 | -4,4 | 4,0 | -10,8 | 4,3 | -10,8 | 4,3 | -3,9 | 4,0 | -13,5 | 3,8 | -9,1 |
| Медиана | 4,95 | 4,9 | -3,25 | 4,5* | -5,25 | 4,7 | -5,6 | 4,95 | -0,1 | 4,75 | -3,1 | 4,6 | -3,0 |
| 75-й проц. | 5,7 | 5,4 | 1,9 | 5,4 | -2,1 | 5,4 | 0,0 | 5,6 | 2,4 | 5,6 | 4,9 | 5,8 | 1,8 |
| Максимум | 6,1 | 6,2 | 11,9 | 6,1 | 2,4 | 5,7 | 9,5 | 6,2 | 8,3 | 6,4 | 6,3 | 6,8 | 11,5 |
| * - p=0,01 - в сравнении с фоном |
| Таблица 3 | |||||||||||||
| Влияние гимантана (5 мг/кг, внутривенно) на артериальное давление (АД) наркотизированных крыс (мм рт. | |||||||||||||
| ст.; его изменение относительно фона, %) | |||||||||||||
| Фон мл/мин | 10 мин после препарата мл/мин | 20 мин после препарата мл/мин | 30 мин после препарата мл/мин | 40 мин после препарата мл/мин | 50 мин после препарата мл/мин | 60 мин после препарата мл/мин | |||||||
| 10 мин | % | 20 мин | % | 30 мин | % | 40 мин | % | 50 мин | % | 60 мин | % | ||
| Минимум | 77,0 | 81,0 | -7,7 | 86,0 | -11,5 | 71,0 | -16,7 | 77,0 | -25,0 | 78,0 | -25,0 | 75,0 | -27,9 |
| 25-й проц. | 104,0 | 104,0 | -3,1 | 102,0 | 0,0 | 92,0 | -7,8 | 86,0 | -9,8 | 85,0 | -9,8 | 86,0 | -6,5 |
| Медиана | 114,5 | 116,5 | 4,4 | 123,5 | 3,5 | 107,5 | 0,35 | 113,0 | 0,0 | 106,5 | -6,25 | 108,5 | -4,25 |
| 75-й проц. | 123,0 | 129,0 | 13,0 | 132,0 | 10,9 | 133,0 | 4,5 | 135,0 | 7,7 | 125,0 | 8,4 | 131,0 | 6,5 |
| Максимум | 139,0 | 145,0 | 20,6 | 139,0 | 21,5 | 140,0 | 11,8 | 140,0 | 13,4 | 143,0 | 10,4 | 140,0 | 10,4 |
Влияние гимантана на кровоснабжение мозга крыс после глобальной преходящей ишемии.
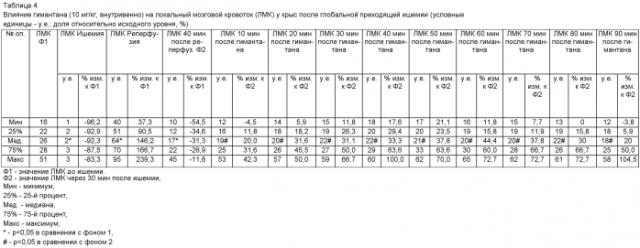
Опыты, проведенные на наркотизированных крысах в условиях глобальной преходящей ишемии головного мозга, показали, что гимантан в дозе 5 мг/кг при внутривенном введении вызывает увеличение локального мозгового кровотока в коре мозга крыс в среднем на 30% от исходного уровня. Эффект препарата наблюдается через 10 минут после введения и сохраняется на протяжении всего эксперимента (таблица 4). Следует отметить, что уровень артериального давления под влиянием гимантана в этих опытах практически не изменяется (таблица 5).
| Таблица 5 | |||||||||||||||||||||||||
| Влияние гимантана (10 мг/кг, внутривенно) на артериальное давление (АД) у крыс после глобальной преходящей ишемии (мм рт. ст.; доля относительно | |||||||||||||||||||||||||
| исходного уровня, %) | |||||||||||||||||||||||||
| № оп. | АД Ф | АД Ишемия | АД Реперфузия | АД 40 мин после реперфуз. Ф2 | АД 10 мин после гимантана | АД 20 мин после гимантана | АД 30 мин после гимантана | АД 40 мин после гимантана | АД 50 мин после гимантана | АД 60 мин после гимантана | АД 70 мин после гимантана | АД 80 мин после гимантана | АД 90 мин после гимантана | ||||||||||||
| у.е. | % изм. к Ф1 | у.е. | % изм. к Ф1 | у.е. | % изм. к Ф1 | у.е. | % изм. к Ф2 | у.е. | % изм. к Ф2 | у.е. | % изм. к Ф2 | у.е. | % изм. к Ф2 | у.е. | % изм. к Ф2 | у.е. | % изм. к Ф2 | у.е. | % изм. к Ф2 | у.е. | % изм. к Ф2 | у.е. | % изм. к Ф2 | ||
| Мин | 77 | 30 | -72,0 | 90 | 3,1 | 77 | -20,6 | 80 | -19,3 | 81 | -11,8 | 80 | -12,7 | 78 | -7,4 | 75 | -8,3 | 71 | -21,6 | 66 | -24,1 | 61 | -30,2 | 55 | -34,5 |
| 25% | 80 | 35 | -64,0 | 100 | 8,1 | 80 | -0,9 | 88 | -8,3 | 90 | -2,8 | 91 | 0,0 | 99 | -2,5 | 98 | -5,2 | 91 | -7,4 | 88 | -9,3 | 81 | -3,9 | 76 | -9,1 |
| Мед. | 97 | 40* | -61,1 | 120* | 26,2 | 96 | 4,9 | 91 | 0,9 | 99 | 1,3 | 100 | 5,5 | 100 | 4,6 | 100 | -0,9 | 99 | 2,8 | 98 | 2,8 | 98 | -0,9 | 96 | -1,9 |
| 75% | 108 | 40 | -52,9 | 120 | 34,4 | 108 | 11,1 | 98 | 3,9 | 106 | 11,7 | 116 | 13,8 | 114 | 16,9 | 110 | 14,3 | 103 | 16,9 | 109 | 13,5 | 105 | 9,4 | 106 | 3,9 |
| Макс | 116 | 45 | -33,8 | 130 | 41,2 | 116 | 20,0 | 117 | 15,6 | 117 | 23,3 | 117 | 28,9 | 116 | 26,7 | 117 | 30 | 119 | 32,2 | 121 | 34,4 | 120 | 33,3 | 120 | 33,3 |
| Ф1 - значение ЛМК до ишемии, | |||||||||||||||||||||||||
| Ф2 - значение ЛМК через 30 мин после ишемии, | |||||||||||||||||||||||||
| Мин - минимум, | |||||||||||||||||||||||||
| 25% - 25-й процент, | |||||||||||||||||||||||||
| Мед. - медиана, | |||||||||||||||||||||||||
| 75% - 75-й процент, | |||||||||||||||||||||||||
| Макс - максимум; | |||||||||||||||||||||||||
| * - р<0,05 - в сравнении с фоном 1 |
В эксперименте на интактных наркотизированных крысах параллельно с регистрацией мозгового кровотока регистрировали электрокардиограмму и частоту дыхания животных. Было показано, что гимантан не оказывает влияние на частоту сердечных сокращений и частоту дыхания экспериментальных животных (таблицы 6, 7).
| Таблица 6 | |||||||||||||
| Влияние гимантана (5 мг/кг) на частоту сердечных сокращений (ЧСС) у интактных | |||||||||||||
| наркотизированных крыс (уд./мин; относительно исходного уровня, %) | |||||||||||||
| № | Фон | 10 мин после препарата | 20 мин после препарата | 30 мин после препарата | 40 мин после препарата | 50 мин после препарата | 60 мин после препарата | ||||||
| уд./мин | % | уд./мин | % | уд./мин | % | уд./мин | % | уд./мин | % | уд./мин | % | ||
| Минимум | 368 | 372,0 | -10,7 | 372,0 | -7,9 | 380,0 | -4,9 | 380,0 | -5,0 | 384,0 | -5,8 | 380,0 | -6,8 |
| 25-й проц. | 384 | 376,0 | -3,1 | 384,0 | -1,0 | 388,0 | -3,0 | 384,0 | -0,5 | 388,0 | 0,5 | 392,0 | -1,0 |
| Медиана | 402 | 394,0 | 0,05 | 399,0 | 1,0 | 392,0 | 0,45 | 398,0 | 1,0 | 408,0 | 2,4 | 396,0 | 2,15 |
| 75-й проц. | 412 | 408,0 | 2,0 | 428,0 | 3,9 | 412,0 | 3,1 | 428,0 | 3,2 | 432,0 | 43 | 436,0 | 33 |
| Максимум | 432 | 420,0 | 5,4 | 464,0 | 12,6 | 448,0 | 5,4 | 448.0 | 8,7 | 456,0 | 10,7 | 440,0 | 6,8 |
| Таблица 7 | |||||||||||||
| Влияние гимантана (5 мг/кг) на частоту дыхания (ЧД) у интактных наркотизированных | |||||||||||||
| крыс (вдох/мин) | |||||||||||||
| № | Фон | 10 мин после препарата | 20 мин после препарата | 30 мин после препарата | 40 мин после препарата | 50 мин после препарата | 60 мин после препарата | ||||||
| вдох/мин | % | вдох/мин | % | вдох/мин | % | вдох/мин | % | вдох/мин | % | вдох/мин | % | ||
| Минимум | 68 | 64,0 | -12,0 | 72,0 | -8,0 | 72,0 | -10,0 | 72,0 | -12,0 | 68,0 | -16,0 | 68,0 | -10,0 |
| 25-й проц. | 76 | 76,0 | -5,9 | 76,0 | -5,0 | 72,0 | -5,9 | 76,0 | -4,8 | 72,0 | 0,0 | 72,0 | -4,8 |
| Медиана | 80 | 80,0 | -2,5 | 82,0 | 2,5 | 82,0 | 0,0 | 84,0 | 2,8 | 82,0 | 2,65 | 84,0 | 0,0 |
| 75-й проц. | 84 | 88,0 | 4,8 | 92,0 | 5,3 | 92,0 | 5,9 | 108,0 | 15,8 | 84,0 | 10,5 | 92,0 | 15,8 |
| Максимум | 136 | 120,0 | 35,0 | 128,0 | 35,0 | 128,0 | 35,0 | 136,0 | 47,4 | 152,0 | 40.0 | 164,0 | 40,0 |
Описание чертежа
Фиг.1 - латентный период захода в темную камеру в тесте УРПИ при воспроизведении памятного следа.
По оси абсцисс обозначены названия групп животных: «ЛО» - ложно оперированные крысы, «ИГ» - крысы с интрацеребральной гематомой, «Гим 5 в/в» - животные с интрацеребральной гематомой, которым внутривенно вводили гимантан (инъекционная форма) в дозе 5 мг/кг, «Гим 10 в/б» - животные с интрацеребральной гематомой, которым внутрибрюшинно вводили гимантан (субстанция) в дозе 10 мг/кг.
По оси ординат обозначен латентный период захода в темную камеру, секунды.
* - р<0,05; ** - р<0,01 по сравнению с ложно оперированными животными;
# - р<0,05; ## - р<0,01 по сравнению с животными с интрацеребральной гематомой, t-критерий Стьюдента для независимых выборок.
Применение N-(2-адамантил)-гексаметиленимина гидрохлорида (гимантана) в качестве средства для лечения нарушений мозгового кровообращения и травм головного мозга.