Способ получения и индукции направленной дифференцировки культуры мультипотентных клеток легких
Иллюстрации
Показать всеИзобретение относится к биотехнологии и медицине. Предложен способ дифференцировки мезенхимальных стволовых клеток фиброзированных легких в фибробластные клетки, характеризующийся тем, что из правой доли фиброзированных легких выделяют клетки с фенотипом мезенхимальных стволовых клеток (CD44+, CD73+, CD90+, CD106+, CD31-, CD34-, CD45-), способные самообновляться in vitro в течение 60 дней, затем при добавлении в культуру мезенхимальных стволовых клеток фактора роста фибробластов 2 мкг/мл получают фибробластные клетки. Способ позволяет получить донорские клетки больных идиопатическим фиброзом из тканей фиброзированных легких. 3 ил., 1 пр.
Реферат
Изобретение относится к биотехнологии, конкретно к клеточным технологиям и регенеративной медицине, и касается способа дифференцировки мезенхимальных стволовых клеток фиброзированных легких в фибробластные клетки. Изобретение может быть использовано для решения практических задач регенеративной медицины: поиска потенциальных антифибротических средств, механизм которых связан с избирательной ингибицией дифференцировки мультипотентных клеток легких фиброзированных легких в фибробласты.
Идиопатический фиброз легкого является хроническим активно прогрессирующим заболеванием неизвестной этиологии. Прогноз заболевания в большинстве своем неблагоприятный, состояние пациентов ухудшается быстрыми темпами [1, 2]. Существующий набор лечебных мероприятий для легочного фиброза ограничен и не эффективен. Клиническая практика сосредоточена преимущественно на лечении осложнений и поддерживающей терапии [1].
Перспективным подходом лечения такого хронического заболевания легких, как идиопатический фиброз, может являться клеточная терапия с использованием донорских мультипотентных мезенхимальных стромальных клеток [2, 3]. В эксперименте показано, что введение донорских мезенхимальных стволовых клеток (МСК) уменьшает блеомицин-индуцированное повреждение легких у мышей, препятствует отложению коллагена, способствует увеличению числа клеток альвеолярного эпителия [4, 5, 6]. Однако терапия экзогенными стволовыми клетками сопровождается повышенным риском бактериальных и вирусных инфекций, аллергических реакций [7, 8]. Серьезным препятствием для терапии стволовыми клетками выступают трудности, связанные с получением достаточного количества клеток для трансплантации и отсутствием стандартизированных и эффективных методов получения стволовых клеток [9]. В этой связи рассматривается вопрос о фармакологической регуляции эндогенных стволовых клеток взрослого организма. Взрослые регионарные стволовые клетки сохраняются в постнатальном периоде, созревают в клетки органа, из которого получены, по пролиферативному и дифференцировочному потенциалу незначительно уступают стволовым клеткам костного мозга и периферической крови, многие исследователи считают их мультипотентными [10].
Адекватных аналогов предлагаемый способ не имеет.
Задачей данного изобретения является получение фибробластных клеток путем дифференцировки мезенхимальных стволовых клеток фиброзированных легких для оптимизации поиска лекарственных средств, способных препятствовать развитию фиброза легких.
Способ дифференцировки мезенхимальных стволовых клеток фиброзированных легких в фибробластные клетки, характеризующийся тем, что из правой доли фиброзированных легких выделяют клетки с фенотипом мезенхимальных стволовых клеток (CD44+, CD73+, CD90+, CD106+, CD31-, CD34-, CD45-), способные самообновляться in vitro в течение 60 дней, затем при добавлении в культуру мезенхимальных стволовых клеток фактора роста фибробластов (2 мкг/мл) получают фибробластные клетки.
Новым в предлагаемом способе является получение фибробластных клеток путем индукции дифференцировки мезенхимальных стволовых клеток из фиброзированных легких фактором роста фибробластов.
В основе многих заболеваний лежит нарушение целостности ткани организма. Повреждение тканей может быть следствием различных стимулов, включая инфекции, аутоиммунные реакции, токсины, радиацию или механическое повреждение. Процесс восстановления обычно включает в себя две фазы: регенеративную фазу, в которой поврежденные клетки заменяются клетками того же типа, без видимого повреждения, и фазу, известную как фиброплазия или фиброз, в которой соединительная ткань заменяет нормальные паренхиматозные ткани. При преобладании фиброгенеза первоначально полезный процесс восстановления ткани становится неконтролируемым, что приводит к существенному осаждению компонентов экстрацеллюлярного матрикса, где нормальная ткань замещается рубцовой тканью. При некоторых заболеваниях, таких как идиопатический легочный фиброз, цирроз печени, сердечно-сосудистый фиброз, системная склеродермия и нефрит, обширная реконструкция ткани и фиброз, в конечном итоге, может привести к органной недостаточности и смерти. В этой связи огромную роль в патогенезе пневмофиброза отводят зрелым клеткам мезенхимопоэза - фиброцитам, как одним из ведущих источников коллагена [11].
Термин мезенхимальные стромальные клетки в настоящее время рекомендован Международным обществом клеточной терапии для обозначения фибробластоподобных, прилипающих к пластику клеток с определенными характеристиками (в частности, по способности in vitro дифференцироваться в различные клетки стромальной линии), иногда их называют мезенхимальными стволовыми клетками [12]. Дифференцировка в остеобласты, адипоциты, хондроциты была обнаружена у взрослых стволовых клеток мезенхимального происхождения костного мозга, жировой ткани [11, 13]. МСК выделены из бронхо-альвеолярной жидкости [14]. Необходимость получения фибробластных клеток из МСК легких при пневмофиброзе возрастает многократно, так как при этой патологии потенциальные возможности регионарных стволовых клеток взрослого организма - участие в патогенезе фиброза путем дифференцировки в фибробластные клетки, продуцирующие коллаген, могут определять тактику лечения: поиск/назначение препаратов, ингибирующих дифференцировку МСК.
Отличительные признаки проявили в заявляемой совокупности новые свойства явным образом не вытекающие из уровня техники в данной области и неочевидные для специалиста.
Идентичной совокупности признаков не обнаружено в проанализированной патентной и научно-медицинской литературе.
Техническим результатом изобретения является получение фибробластных клеток индукцией дифференцировки мезенхимальных стволовых клеток фиброзированных легких фактором роста фибробластов.
Способ может быть использован для изучения интенсивности дифференцировки мезенхимальных стволовых клеток паренхимы фиброзированных легких в фибробластные клетки с целью поиска антифибротических средств для регенераторной медицины, в частности для лечения хронических заболеваний легких, действие которых направлено на ингибицию фибробластной дифференцировки МСК. Исходя из вышеизложенного, заявляемое изобретение соответствует критериям патентоспособности изобретения «Новизна», «Изобретательский уровень» и «Промышленная применимость».
Предлагаемый способ был изучен в экспериментах на 8-10 -недельных мышах линии C57BL/6J в количестве 70 штук. Животные первой категории, инбредные мыши, получены из питомника отдела экспериментального биомедицинского моделирования ФГБУ «НИИ фармакологии» СО РАМН (сертификат имеется). Использование животных в экспериментах обосновано и согласовано с Комиссией по контролю за содержанием и использованием лабораторных животных ФГБУ «НИИ фармакологии» СО РАМН.
Изобретение будет понятно из следующего описания и приложенных к нему рис. 1, 2, 3.
На рис. 1 изображены дот-плоты, представляющие данные анализа количественной и качественной экспрессии CD31, CD34, CD44, CD45, CD73, CD90, CD106, полученные с помощью флуоресцентной цитометрии, на прилипающих клетках, выделенных из легких мышей линии С57В1/6 на 21 день эксперимента.
1 - животные, получавшие интратрахеально 0,9% NaCl; 2 - животные, получавшие интратрахеально блеомицин; a1, а2 - подтверждение фенотипа и качественный анализ экспрессии CD45/CD73/CD106 на двухмерных гистограммах; б1, б2 - подтверждение фенотипа и качественный анализ экспрессии CD73/CD31/CD90 на двухмерных гистограммах; в - подтверждение фенотипа и качественный анализ экспрессии CD73/CD34/CD44 на двухмерных гистограммах.
На рис. 2 изображена динамика и морфология клеток в первичной культуре адгезирующих мононуклеаров легкого мышей линии С57В1/6. Содержание клеток эпителиального, эндотелиального вида и фибробластоподобных клеток при образовании монослоя у животных после интратрахеального введения блеомицина (А) и физиологического раствора (Б). Г, Д, Е - клетки с фибробластной морфологией; В - клетки эпителиального типа; Ж, З - эндотелиального типа клетки. Увеличение - ×100.
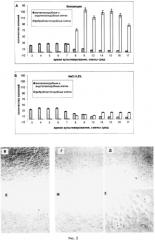
На рис. 3 изображена фибробластная дифференцировка клеток первичной культуры прилипающих клеток легкого мышей линии С57В1/6, получавших интратрахеально 0,9% NaCl либо блеомицин.
По оси ординат - содержание фибробластов (% от общего числа мононуклеаров).
Светлые столбики - значения, полученные при культивирование клеток без добавления ростового фактора, темные - с добавлением ростового фактора.
Способ осуществляют следующим образом.
Фиброз легкого моделировали однократным интратрахеальным введением 80 мкг блеомицина («Blenoxane», «Sao Paulo», Бразилия) в 30 мкл физиологического раствора. Контрольным животным в аналогичных условиях вводили эквивалентный объем физиологического раствора (контроль). Блеомицин относится к группе противоопухолевых антибиотиков. Его механизм действия до конца не выяснен, хотя известно, что он способен подавлять синтез нуклеиновых кислот (преимущественно ДНК) и белка. Препарат активен в отношении клеток, находящихся как в митотическом цикле, так и вне его, но проявляет большую активность в фазе G2. Основное токсическое действие цитостатик оказывает на легкие: вызывает пневмонию, фибротические изменения в паренхиме легких [15].
На 21-й день после введения блеомицина или NaCl проводили эвтаназию мышей передозировкой СО2 и забор легких, получали прилипающие клетки легких [16].
Полученные клетки разделяли на две группы.
У клеток первой группы на проточном цитофлюориметре FACS Canto II (BD Biosciences, США) был проведен фенотипический анализ с помощью набора моноклональных антител: CD44 (Hyaloronate receptor), CD73 (Ecto-5-nucleotidase), CD90 (Thy-1 glycoprotein), CD106 (Vascular cell adhesion molecule-1), CD31 (Platelet Endothelial Cell Adhesion Molecule-1), CD34 (stem/progenitor hemopoietic cell), CD45 (Leukocyte Common Antigen), которые являются маркерами характерными для мультипотентных мезенхимальных стромальных клеток. Исследование проводилось согласно протоколу производителя. Адгезирующие клетки легких второй группы в количестве 3-4×106 вносили в культуральный флакон («ТРР Techno Plastic Products AG», Швейцария) и инкубировали в стандартных условиях (37°C, 5% CO2, 100% влажность воздуха) в течение 2-2,5 месяцев в среде следующего состава: 90% DMEM-LG («HyClone», США), 10% FBS («HyC1one», USA), 2 mML-глютамина («Sigma», США), раствор антибиотиков (пенициллин/стрептомицин 100 U/ml и 100 mg /мл («HyClone», США)). Каждые 3-4 дня проводилась смена базовой среды и морфологическая оценка клеточной культуры. Рассчитывалось время удвоения (tD) эндотелиальных и эпителиальных клеток и фибробластных клеток по формуле: tD=(log2×t)/(logNh-logN0) [16]. N0 - количество клеток во время второй смены среды, Nh - количество клеток в изучаемый период культивирования t. После достижения максимального слияния (70-90% покрытия поверхности флакона) клетки снимали с поверхности пластика и оценивали их иммунный профиль. Часть клеток в количестве 8-10×105 на 10-15 мл базовой среды использовали для последующего культивирования (проводили 3 пассажа).
У полученных после обогащения клеток в стандартных условиях изучалась дифференцировка в фибробластные клетки. Фибробластную дифференцировку клеток изучали в 50% среды DMEM-HG (HyClone, США) с фактором роста фибробластов 2 мкг/мл (ФРФ, («Sigma», США)), дополненной 20% инактивированной FBS («HyClone», США), 280 мг/л L-глутамина («Sigma», США), 50 мг/л гентамицина («Serva», Германия). Концентрация клеток составила 6×105 клеток в 2 мл. 18-е дневные культуры фиксировали и окрашивали основным красителем Май-Грюнвальда.
Математическую обработку результатов производили с применением стандартных методов вариационной статистики. Достоверность различий оценивали с использованием параметрического t-критерия Стьюдента или непараметрического U-критерия Манна-Уитни.
Пример.
Проведенные нами эксперименты показывают, что выделенные на 21 день опыта (в период интенсивного отложения коллагена) из легких мышей контрольной и опытной групп прилипающие к пластику клетки позитивны по маркерам поверхности CD44, CD73, CD90, CD106 и не экспрессируют CD31, CD34, CD45, что позволяет нам отнести данную популяцию клеток к мезенхимальным стромальным клеткам (рис. 1).
В культурах прилипающих клеток контрольных и блеомициновых легких выявляются клетки с морфологическими особенностями фибробластов (длинные и тонкие, веретенообразный вид), эндотелиальных клеток (форма булыжника) и эпителиальных клеток (кубические). На протяжении первых 6-7 смен среды основное увеличение биомассы флакона осуществляется за счет эндотелиоподобных и эпителиоподобных клеток (рис. 2). Количество клеток с морфологией фибробластов составляет 5-10% от общей клеточности флакона. Начиная с 8-й смены среды наблюдается обогащение культуры фибробластами, количество эндотелиоподобных и эпителиоподобных клеток поступательно снижается. К окончанию исследования (17-18 смена среды) в образцах выявляются клетки преимущественно с фибробластной морфологией. Следует отметить, что по скорости формирования монослоя и времени удвоения клеток отдельных популяций опытная группа (клетки, полученные от животных, получавших блеомицин) существенно превосходит контрольную группу (клетки, полученные от животных, получавших физиологический раствор).
После достижения слияния 80% у клеток контрольной и опытной групп при исследовании иммунного профиля оказалось, что клетки экспрессируют на поверхности CD44, CD73, CD90, CD106 и не экспрессируют CD31, CD34, CD45.
При изучении дифференциации клеток первичной культуры показано, что обнаруженные в фибробластной среде (с фактором роста фибробластов и без фактора роста фибробластов) клетки из всех источников имеют веретенообразную морфологию (рис. 3). Окрашивание основным красителем Май-Грюнвальдом подтверждает присутствие фибробластов в культуре. В культуре клеток блеомициновых мышей количество фибробластов было достоверно (n-8, р<0,05) больше, чем в культуре клеток контрольных животных.
Предлагаемый способ оценивает один из механизмов накопления фибробластных клеток (продуцентов коллагена) в фиброзированных легких - дифференцировку легочных мезенхимальных стволовых клеток в фибробластные клетки. Применение способа позволит выявить основное звено патогенеза пневмофиброза и провести таргетную терапию заболевания препаратами, фармакологический эффект которых был бы основан на ингибиции фибробластной дифференцировки МСК.
Способ дифференцировки мезенхимальных стволовых клеток фиброзированных легких в фибробластные клетки, характеризующийся тем, что из правой доли фиброзированных легких выделяют клетки, с фенотипом мезенхимальных стволовых клеток (CD44+, CD73+, CD90+, CD106+, CD31-, CD34-, CD45-), способные самообновляться in vitro в течение 60 дней, затем при добавлении в культуру мезенхимальных стволовых клеток фактора роста фибробластов 2 мкг/мл получают фибробластные клетки.