Противоопухолевый антрафурандион и фармацевтические композиции на его основе
Иллюстрации
Показать всеИзобретение относится к сфере лекарственных препаратов, в частности к новому производному антрафурандиона формулы I или его фармацевтически приемлемым солям, обладающим высоким противоопухолевым эффектом и активностью в отношении опухолевых заболеваний с резистентностью к другим лекарственным средствам.
Кроме того, изобретение относится к противоопухолевым фармацевтическим композициям, содержащим соединение формулы I, фармакологически приемлемый носитель и один или несколько эксципиентов, выбранных из сорастворителей, солюбилизаторов, наполнителей, эмульгаторов, консервантов, антиоксидантов, буферных соединений, веществ для поддержания изотоничности. Данные композиции обеспечивают эффективное применение антрафурандиона, поскольку обладают высокой стабильностью при хранении как в форме лиофилизата, так и в форме раствора, а также другими улучшенными характеристиками, включая растворимость, эффективность и переносимость. Изобретение также касается способа лечения опухолевых заболеваний, предусматривающий парентеральное введение пациенту антрафурандиона формулы I или фармацевтических композиций. 5 н. и 5 з.п. ф-лы, 6 табл., 13 пр.
Реферат
Область изобретения
Настоящее изобретение относится к сфере лекарственных препаратов, в частности к новому производному антрафурандиона формулы I, обладающему более выраженным противоопухолевым эффектом и активностью в отношении опухолевых заболеваний с резистентностью к другим лекарственным средствам, а также фармацевтическим композициям на его основе и их медицинскому применению. Более конкретно, изобретение относится к 3-[(3-амино-1-пирролидинил)карбонил]-4,11-дигидрокси-2-метилантра[2,3-6]фуран-5,10-диону, его стереохимическому составу и применению его 5-изомера в качестве активной основы в противоопухолевых фармацевтических композициях с улучшенными характеристиками, такими как эффективность, переносимость, растворимость и стабильность.
Предпосылки создания настоящего изобретения
Онкологические заболевания остаются одной из основных причин смертности в большинстве развитых стран, причем в последние десятилетия прослеживается тенденция к росту числа диагностированных заболеваний. Эффективность борьбы с онкологическими заболеваниями во многом зависит от лекарственной терапии. Наряду с хирургическим и лучевым методами, химиотерапия злокачественных опухолей получила широкое распространение, тем более что при ряде локализаций опухолевого процесса она является единственным методом лечения.
Несмотря на высокую клиническую эффективность противоопухолевых средств, их применение ограничивается рядом недостатков. Помимо общей токсичности для нормальных тканей, эффективность противоопухолевых агентов зачастую ограничивается развитием у опухолевых клеток множественной лекарственной устойчивости (МЛУ) в ответ на химиотерапию или приобретенной из-за прогрессирования болезни [Shtil A.A. J. Hematother. Stem Cell Res., 2002, 11, 437]. Экспрессия АТР-связывающих кассетных транспортеров, например p-гликопротеина (p-gp), на поверхности опухолевых клеток [Ambudkar S.V., et. al. Oncogene, 2003, 22, 7468], мутации или изменения уровня экспрессии мишеней [Heisig P. Mutagenesis, 2009, 24(6), 465], а также потеря функционирующего проапоптического гена опухолевого супрессора р53 [Vousden K.H., et. al. Cell, 2005, 120, 7] являются наиболее типичными механизмами резистентности, развивающимися в опухолевых клетках в ответ на химиотерапию [Knez L., et. al. Lung Cancer, 2011, 72(3), 271]. Следовательно, одним из способов повышения эффективности химиотерапии является разработка лекарственных средств, способных воздействовать на опухолевые клетки с МЛУ, индуцированную химиотерапевтическими агентами.
Известно, что природные и синтетические производные антрахинона обладают высокой биологической активностью, а ряд из них (например, доксорубицин, фармрубицин, митоксантрон) применяют в клинике для терапии опухолевых заболеваний. Поэтому антрахиноновое ядро широко используется в медицинской химии в качестве основы для разработки новых противоопухолевых средств. Так, ряд гетероциклических производных запатентован в качестве противоопухолевых агентов с улучшенными химиотерапевтическими свойствами [WO 2006031719, RU 2412166]. В патенте RU 2412166 нами был найден оригинальный химотип производных линейных гетероаренантрацендионов с высокой активностью в отношении опухолевых клеток с различными механизмами множественной лекарственной устойчивости. Настоящее изобретение является дальнейшим развитием изобретения, описанного в RU 2412166. Целью настоящего изобретения ставилось повышение эффективности одного из производных антра[2,3-b]фуран-5,10-диона, описанного в RU 2412166, за счет оптимизации его стереохимии и солевой формы. Другой целью изобретения являлась разработка на основе этого антрафурандиона фармацевтических композиций с улучшенными свойствами, применимых для лечения опухолевых заболеваний, включая резистентные к другим препаратам новообразования.
Раскрытие изобретения
Известно, что производные гетероаренантрацендионов, содержащие в боковой цепи циклические диамины, обладающие высокой антипролиферативной активностью, способны ингибировать рост ряда резистентных линий опухолевых клеток [Shchekotikhin А.Е. et al. Bioorg. Med. Chem., 2005, 13 (6), 2285; RU 2412166]. Так, ранее гидрохлорид 3-[(3-амино-1-пирролидинил)карбонил]-4,11-дигидрокси-2-метилантра[2,3-6]фуран-5,10-диона (1) был запатентован в качестве потенциального противоопухолевого средства.
Однако описанный ранее гидрохлорид антрафурандиона 1 малорастворим в воде (<1 мг/мл при 20°C), причем его растворимость в водных фармакологически приемлемых средах, например в «изотоническом растворе» или в «растворе глюкозы для инъекций», еще ниже. Хотя растворимость гидрохлорида в воде возрастает при нагревании, при охлаждении его концентрированных растворов наблюдается образование гелеобразного осадка, видимо, за счет формирования межмолекулярных ассоциатов. Таким образом, дальнейшие исследования и практическое применение гидрохлорида антрафурандиона 1 в качестве парентерального лекарственного средства затрудняются его низкой растворимостью. В связи с этим было бы желательно на основе антрафурандиона 1 разработать препарат с улучшенной растворимостью, способный образовывать стабильные водные растворы. Авторы настоящего изобретения провели интенсивные исследования по поиску новой солевой формы антрафурандиона 1, имеющей лучшую растворимость, чем ранее известный гидрохлорид. В результате исследования других солей антрафурандиона 1 с минеральными или органическими кислотами обнаружено, что алкансульфокислоты или гидроксиалкансульфокислоты образуют с антрафурандионом 1 устойчивые соли, имеющие лучшую растворимость, чем гидрохлорид. Так, мезилат (метансульфонат) и изетионат (2-гидроксиэтансульфонат) обладают из всех протестированных солей антрафурандиона 1 наибольшей растворимостью в дистиллированной воде (3-5 мг/мл при 20°C) и высокой стабильностью как в твердом виде, так и в растворах. Поэтому в предпочтительных вариантах осуществления настоящего изобретения используются соли антрафурандиона 1 с алкансульфокислотами (предпочтительно метансульфокислотой) или гидроксиалкансульфокислотами (предпочтительно 2-гидроксиэтансульфокислотой), более предпочтительно с метансульфокислотой.
Антрафурандион 1, описываемый в настоящем изобретении, можно получить различными способами. Один из типичных подходов, разработанный нами для получения рацемического антрафурандиона 1 [RU 2412166], включает последовательную активацию 4,11-дигидрокси-5,10-диоксо-2-метилантра[2,3-b]фуран-3-карбоновой кислоты [Горелик М.В., Мишина Е.В. ЖОрХ., 1983, 2185], взаимодействие с защищенным по экзоциклической аминогруппе 3-аминопирролидином, последующее удаление защитной группы и получение соответствующей солевой формы целевого антрафурандиона 1. Для активации исходной карбоновой кислоты могут быть использованы различные методы, хорошо известные специалистам в области органического синтеза, включая превращение 4,11-дигидрокси-5,10-диоксо-2-метилантра[2,3-b]фуран-3-карбоновой кислоты в соответствующий хлорангидрид, смешанный ангидрид, имидазолид, активированный эфир или другие производные, применяемые для получения амидов. Так, для активации можно использовать обработку исходной кислоты тионилхлоридом, хлорокисью фосфора, пентахлоридом фосфора, карбонилдиимидазолом, производными карбодиимида (например, DCC или EDC), дифенилфосфорилазидом (DPPA), реагентами Кастро (BOP или PyBOP) или другими конденсирующими агентами (TBTU и HBTU), предпочтительно тионилхлоридом. Очевидно, что для региоселективного ацилирования необходимо использование защиты аминогруппы исходного 3-аминопирролидина, в качестве которой можно использовать различные защитные группы, хорошо известные специалистам в области органического синтеза, предпочтительно трет-бутоксикарбонильную группу (Вос-группу). В этом предпочтительном варианте удаление защитной Вос-группы промежуточного амида можно проводить действием метансульфокислоты, что позволяет совместить стадии удаления защитной группы и получение предпочтительной водорастворимой солевой формы целевого антрафурандиона - метансульфоната. В альтернативных вариантах осуществления изобретения для получения необходимых солевых форм антрафурандиона на заключительной стадии можно использовать взаимодействие свободного основания антрафурандиона с соответствующими кислотами (например, метансульфоновой и изетионовой кислотами) или реакции обмена.
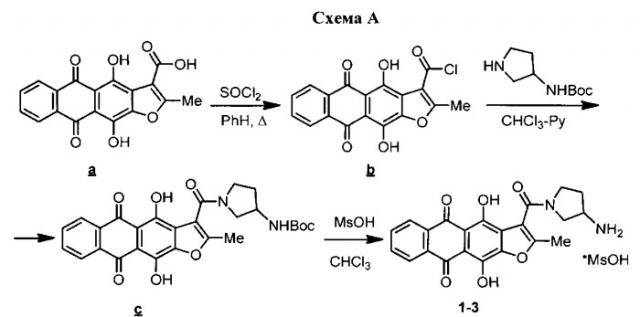
Одна из подходящих схем синтеза антрафурандиона, подробно описанная в примерах настоящего изобретения и приведенная на схеме А, включает:
1. Превращение исходной антрафуран-3-карбоновой кислоты a при нагревании с тионилхлоридом в соответствующий хлорангидрид b;
2. Ацилирование хлорангидридом b 3-(трет-бутоксикарбониламино)пирролидина с образованием амида c;
3. Расщепление защитной группы амида c действием метансульфокислоты, приводящее к метансульфонату целевого антрафурандиона 1.
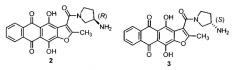
Хорошо известно, что индивидуальные стереоизомеры могут существенно отличаться друг от друга и от их рацемической смеси как по физико-химическим, так и биологическим свойствам. Прежде всего, вещества с различным стереоизомерным составом часто различаются по специфической биологической активности, по токсикологическим и фармакокинетическим параметрам, а также побочным эффектам [The Practice of Medicinal Chemistry (Third Edition). C.G. Wermuth (ed.), 2008, 537-545]. Поэтому авторы настоящего изобретения провели исследования по синтезу и изучению свойств индивидуальных стереоизомеров антрафурандиона 1, ранее известного в виде рацемической смеси. С использованием в схеме A коммерчески доступных стереоизомеров производных 3-аминопирролидина были получены R- и 5-изомеры антрафурандиона (формулы 2 и 3).
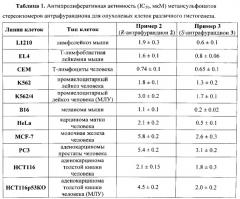
Изучение антипролиферативной активности метансульфонатов индивидуальных стереоизомеров антрафурандиона 2 и 3 выявило их различие в способности ингибировать рост опухолевых клеток. S-Изомер антрафурандиона 3 более активен, чем его антипод 2 в отношении опухолевых клеток различного гистогенеза, включая клетки с активированными механизмами МЛУ (пример 7, таблица 1). Так, он практически одинаково токсичен для клеток человеческого лейкоза линии K562 и Pgp-положительной сублинии K.562/4. Экспрессия ABC-транспортеров (например, P-гликопротеина p-gp) является одной из наиболее распространенных причин возникновения множественной лекарственной устойчивости (МЛУ) в опухолевых клетках [Shtil A.A. J. Hematother. Stem Cell Res., 2002, 11, 437]. Другой механизм развития МЛУ, связанный с мутациями, приводящими к инактивации гена проапоптического опухолевого супрессора р53, тоже часто встречается в опухолевых клетках и может приводить к резистентности ко многим химиотерапевтическим агентам, включая доксорубицин [Vousden K.H., et. al. Cell, 2005, 120, 7]. В противоположность доксорубицину, S-изомер антрафурандиона 3 практически одинаково действует как на клетки линии НСТ116 (с фенотипом р53+/+), так и на сублинию HCT116p53KO с МЛУ, обусловленной делецией гена р53 (фенотип р53-/-).
Кроме того, авторы изобретения установили, что стереоизомеры антрафурандиона 2 и 3 значительно отличаются и по специфической (противоопухолевой) активности in vivo. Так, R-изомер 2 при пятикратном применении в дозе 30 мг/кг вызывает увеличение продолжительности жизни мышей с лимфолейкозом Р388 на уровне минимального порогового значения (УПЖ=22%), в то время как 5-изомер 3 в 6 раз более активен (УПЖ=140%). Более того, по противоопухолевой активности 5-изомер 3 в 2-3 раза более активен, чем гидрохлорид и метансульфонат рацемического антрафурандиона 1 (пример 8, таблица 2).
Таким образом, проведенные авторами исследования показывают, что S-изомер антрафурандиона 3 более активно ингибирует рост опухолевых клеток и обладает значительно большей противоопухолевой активностью, чем его антипод 2 и рацемическая форма 1, поэтому данное изобретение в дальнейшем относится к лекарственным препаратам, имеющим в составе 5-изомер антрафурандиона 3 или его соли, предпочтительно алкансульфонаты или гидроксиалкансульфонаты, более предпочтительно метансульфонат.
Исследование метансульфоната индивидуального стереоизомера антрафурандиона 3 показало, что его растворимость в дистиллированной воде в нормальных условиях (~1.0 мг/мл при комнатной температуре) ниже растворимости метансульфоната рацемата 1. Растворение антрафурандиона 3 в воде при нормальных условиях протекает медленно, причем растворимость возрастает при увеличении температуры. В кипящей дистиллированной воде растворимость составляет около 20 мг/мл, однако при охлаждении полученного раствора происходит кристаллизация антрафурандиона 3. Эти обстоятельства затрудняют практическое применение антрафурандиона 3 в качестве парентерально вводимого лекарственного средства, поэтому согласно с еще одним аспектом настоящего изобретения, антрафурандион 3 может быть использован для приготовления фармацевтических композиций для парентерального применения, например, в виде жидкой лекарственной формы для инъекции.
Фармацевтические композиции для парентерального введения обычно являются водными или неводными стерильными изотоническими растворами для инъекций, которые, помимо терапевтически эффективного количества лекарственного средства, содержат фармакологически приемлемый носитель (растворитель), а также различные эксципиенты (вспомогательные вещества). Фармацевтические композиции могут являться как жидкими готовыми растворами для инъекций, так и суспензиями, стерильными порошками или лиофилизированными композициями, для применения которых необходимо добавление стерильного растворителя (например, воды для инъекций) непосредственно перед использованием. Методики получения парентеральных лекарственных композиций хорошо известны из уровня техники.
В фармакологически приемлемых водосодержащих носителях (растворителях или разбавителях), наиболее часто используемых для приготовления фармацевтических композиций для парентерального применения, например в «изотоническом физиологическом растворе (0.9% водный раствор хлорида натрия)» или в «изотоническом растворе глюкозы (5%) для внутривенных инъекций», растворимость антрафурандиона 3 ниже, чем в дистиллированной воде. Авторами настоящего изобретения обнаружено, что субстанция антрафурандиона 3 в «физиологическом растворе» растворяется существенно хуже, чем в «растворе глюкозы». Эта выявленная фармацевтическая несовместимость антрафурандиона и «физиологического раствора», очевидно, связана с высоким содержанием в «физиологическом растворе» ионов хлора, вызывающих трансформацию метансульфоната антрафурандиона 3 в менее растворимую солевую форму - гидрохлорид. Поэтому в качестве носителя (растворителя) для приготовления жидких фармацевтических композиций в настоящем изобретении предпочтительно используется «раствор глюкозы», в котором субстанция растворяется лучше, чем в «физиологическом растворе». Кроме «раствора глюкозы», для приготовления жидких лекарственных форм могут быть применены и другие менее предпочтительные носители, включая водные изотонические солевые растворы, растворы электролитов, а также неводные фармацевтически приемлемые полярные растворители, такие как масла, спирты, амиды, сложные эфиры, простые эфиры, кетоны, углеводороды и их смеси.
Помимо лекарственного средства и носителя, фармацевтические композиции могут содержать один или несколько известных из уровня техники фармацевтически приемлемых эксципиентов (вспомогательных компонентов). В частности, в настоящем изобретении эксципиенты могут быть выбраны из сорастворителей, солюбилизаторов, соединений, способствующих поддержанию pH и/или изотоничности, наполнителей, эмульгаторов, консервантов, антиоксидантов и других веществ. Эти хорошо известные компоненты фармацевтических композиций способствуют улучшению их потребительских или полезных свойств за счет облегчения применения, повышения стабильности, регулирования значения pH, изменения времени удерживания лекарственного соединения в месте введения. Так, в соответствии с еще одним аспектом настоящего изобретения растворимость метансульфоната антрафурандиона 3, а также стабильность его фармацевтических композиций и их эффективность могут быть повышены за счет одного или нескольких эксципиентов, выбранных независимо из группы сорастворителей, солюбилизаторов, наполнителей, эмульгаторов, консервантов, антиоксидантов, буферных солей и веществ для поддержания изотоничности. Количество производного антрафурандиона 3 или его фармацевтически приемлемой соли в фармацевтической композиции не ограничивается, но предпочтительно составляет от 0.1% до 10% (мас./об.), более предпочтительно от 0.1% до 5% (мас./об.). Количество растворителя (наполнителя или разбавителя) не ограничивается, но может достигать до 99 масс.% в расчете на общую массу композиции, как хорошо известно в технологии приготовления лекарственных форм. Количество сорастворителя в композиции не ограничивается и может варьироваться, например, от 1% до 60%. Количество солюбилизирующего агента в композиции не ограничивается и может варьироваться, например, от 0.1% до 20%. Количество стабилизатора и антиоксиданта в композиции не ограничивается, но может достигать, например, от 0.1 до 1%. Количество агента для поддержания изотоничности в композиции не ограничивается, но может достигать, например, от 0.5 до 10%. Количество консерванта не ограничивается и может составлять, например, от 0.001 до 5%.
В качестве сорастворителей фармацевтические композиции антрафурандиона 3 могут содержать один или несколько фармакологически приемлемых растворителей, пригодных для приготовления жидких парентеральных форм. Такие сорастворители хорошо знакомы специалистам в области фармацевтики (без ограничения перечисленным): спирты или полиолы (например, этанол, 1,2-пропиленгликоль, глицерин, 1,3-бутиленгликоль), модифицированные полиоксиалкиленом алкиленоксиды или липиды (например, полиэтиленгликоль ПЭГ), сложные полиоксиэтиленсорбитановые эфиры жирных кислот, эфиры полиэтиленгликоля, сложные полиоксиэтиленовые эфиры жирных кислот, сополимеры этиленоксида и пропиленоксида, предпочтительно полиэтиленгликоль (ПЭГ). Другие фармацевтически приемлемые сорастворители, которые могут быть использованы в настоящем изобретении, хорошо известны специалистам и описаны в литературе [например, в Modern Pharmaceutics (Fourth Edition). G. Banker et al. (eds.), 2002, 864; Remington's Pharmaceutical Sciences (21th Edition) D B. Troy, P. Beringer (ed.), 2006, 2393, A.J. Spiegel et al. J. Pharm. Sci., 1963, 52 (10), 917-927]. Эти эксципиенты могут быть получены способами, хорошо известными в данной области техники, или от промышленных поставщиков.
В качестве эксципиентов, повышающих растворимость антрафурандиона 3, его фармацевтические композиции могут содержать один или несколько фармакологически приемлемых солюбилизирующих агентов, хорошо знакомых специалистам в области фармацевтики, такие как (без ограничения перечисленным) поливинилпирролидон (ПВП), декстран, полисорбат 80 (твин 80), кремофор ЕН, гидроксиалкилированые β-циклодекстрины и γ-циклодекстрины и т.п. Добавление к «раствору глюкозы» в качестве вспомогательных компонентов ПВП, полисорбата 80 или кремофора ЕН, хотя и не ускоряют растворение субстанции при комнатной температуре, однако 0.5% растворы, полученные после растворения субстанции при нагревании, устойчивы при хранении в холодильнике (+5°C) в течение 3 месяцев. Полиэтиленгликоли (ПЭГ400 или ПЭГ200), а также β- или γ-гидроксипропилциклодекстрины не только стабилизируют раствор субстанции, но и способствуют ее растворению при комнатной температуре. Поэтому в предпочтительных вариантах осуществления настоящего изобретения для приготовления стабильных жидких фармацевтических композиций для парентерального применения антрафурандиона 3, являющихся предметом настоящего изобретения, используются ПВП, твин 80, кремофор EH, полиэтиленгликоли и β- или γ-гидроксипропилциклодекстрины.
В качестве консервантов, предохраняющих композицию от воздействия микроорганизмов, в настоящем изобретении могут быть применены различные противомикробные вещества, хорошо знакомые специалистам в области фармацевтики, такие как (без ограничения перечисленным) сульфиты, бензиловый спирт, хлорбутанол, сорбит, ксилит, сорбиновая кислота, бензойная кислота, тимеросал, парабены и их различные соли.
В качестве вспомогательных буферных компонентов в фармацевтических композициях настоящего изобретения могут быть предпочтительно использованы кислоты (например, лимонная, уксусная, фосфорная и др.) или их соли с щелочными металлами (например, цитрат, ацетат или дигидрофосфат натрия и др.), или их сочетания (например, лимонная кислота и цитрат натрия). Ионная сила буферного раствора, используемого как компонент жидкой композиции в настоящем изобретении, не ограничивается и может быть, например, на уровне 0.01-0.6.
В качестве антиоксидантов могут быть использованы, например, глюкоза, аскорбиновая кислота, метабисульфит натрия, бисульфит натрия, сульфит натрия, фенолы и тиофенолы.
В одном из вариантов приготовления жидких фармацевтических композиций фармацевтически приемлемую соль антрафурандиона 3 и необходимые эксципиенты (например, солюбилизирующие или стабилизирующие агенты, буферы, антиоксиданты и т.п.) растворяют или суспендируют в подходящем фармакологически приемлемом носителе (например, в «воде для инъекций» или в «растворе глюкозы», или ПЭГ) с выдерживанием смеси при температуре от 20 до 100°C до полного растворения всех ингредиентов. После образования раствора pH композиции доводят до значения 5-8, более предпочтительно pH 6-7, с помощью подходящего буфера (например, лимонной кислоты и цитрата натрия и др.). При необходимости раствор разбавляют водой для инъекций для получения желаемой концентрации антрафурандиона 3 (предпочтительно 0.1% до 5%), после чего, для удаления нерастворимых материалов и пирогена, раствор фильтруют через мембранный фильтр, и затем раствором заполняют герметизируемый стеклянный сосуд (ампулу или флакон), после чего стерилизуют, укупоривают и хранят в защищенном от действия света месте.
Таким образом, настоящее изобретение описывает готовые жидкие фармацевтические композиции для парентерального применения, содержащие антрафурандион 3. Кроме того, в некоторых вариантах осуществления композиция является сухой (как, например, лиофилизированной) композицией, которая может быть восстановлена, ресуспендирована или регидратирована для получения стабильной жидкой композиции фармацевтического вещества. Так, авторы настоящего изобретения путем лиофилизации жидких композиций получили ряд лиофилизированных препаратов, обладающих превосходной лекарственной стабильностью в процессе приготовления и хранения и легко восстанавливающихся в жидкую композицию при добавлении водного растворителя. Соответственно, настоящее изобретение также включает лиофилизированные композиции антрафурандиона 3. В некоторых вариантах осуществления композиция может быть промежуточной жидкой (как, например, водной) композицией, которую можно высушить (как, например, лиофилизировать) или жидкой (как, например, водной) композицией, полученной посредством восстановления или ресуспендирования сухой композиции.
Для получения лиофилизированных композиций, являющихся предметом настоящего изобретения, жидкую композицию антрафурандиона 3, полученную, как описано выше, заливают в жесткий сосуд, такой как стерильная ампула, флакон или пузырек и подвергают лиофилизации традиционным способом. Количество жидкого препарата, которым заполняют сосуд, составляет, например от 5 до 50% (об./об.) от объема сосуда, особенно предпочтительно 10-25% (об./об.). Внешнюю температуру при лиофилизации предпочтительно поддерживают от -70 до 0°C, особенно предпочтительно от -60 до -40°C, и применяемое давление для сублимации растворителя предпочтительно составляет от 0.01 до 0.2 мм рт. ст., более предпочтительно от 0.01 до 0.1 мм рт. ст. Предпочтительно скорость лиофилизации регулируется таким образом, чтобы растворитель (в расчете на раствор) сублимировался со скоростью от 10 мкл до 100 мкл на 1 см площади поверхности, с которой сублимируется растворитель в течение 1 часа.
В случае лиофилизации жидкой композиции, особенно содержащей декстран, маннит, и/или карбонат натрия и др., защита от разрушения сосуда, содержащего лиофилизируемый раствор, обеспечивается введением добавок, например сульфатов щелочных металлов (например, сульфата натрия, сульфата калия и др.) в указанный жидкий препарат. Кроме того, лиофилизируемые композиции могут содержать дополнительные криозащитные компоненты, предотвращающие осаждение лекарственного соединения, такие как поверхностно-активные вещества, смачивающие или эмульгирующие агенты (как, например, лецитин, полисорбат 80, полиоксиэтиленстеарат). Содержание указанных эксципиентов может составлять 0.01-10% от веса лекарственного препарата.
Лиофилизированные композиции, являющиеся предметом настоящего изобретения, приготовленные, как указано выше, обладают отличными свойствами в отношении стабильности действующего вещества (антрафурандиона 3) в процессе приготовления или хранения. Вышеописанные лиофилизированные формы, как и жидкие композиции для парентерального применения антрафурандиона 3, могут быть упакованы в стерильные флаконы, ампулы или пакеты, пузырьки для однократного или многократного применения. Фармацевтические композиции в сухой (лиофилизированной) или жидкой концентрированной форме, как известно из уровня техники, перед использованием могут быть восстановлены или разбавлены посредством добавления стерильного фармацевтически приемлемого растворителя с получением необходимой концентрации терапевтического агента. Это дает возможность, при необходимости, легко приготовить стерильную жидкую композицию для парентерального применения антрафурандиона 3, которая может быть непосредственно введена пациенту.
Антрафурандион 3 и жидкие фармацевтические композиции, содержащие от 0.1 до 5% соединения формулы 3 или его соли, могут быть применены парентерально (например, внутривенно, внутриартериально, внутримышечно, подкожно, ректально, интраспинально, интраперитонеально, внутриполостно) для лечения опухолевых болезней, включая заболевания, осложненные резистентностью к другим лекарственным средствам.
Термин "антрафурандион", использованный в настоящем описании, означает, 3-[(3-амино-1-пирролидинил)карбонил]-4,11-дигидрокси-2-метилантра[2,3-6]фуран-5,10-дион.
Термином "защитная группа" в настоящем изобретении обозначается группа, подходящая для блокирования функциональной группы в условиях проведения реакций, как описано литературе [Green Т.W.; Wuts P.G. М. Protective Groups in Organic Synthesis. 1991, 351]. Пример таких групп для блокирования аминогруппы включает, без ограничения перечисленным, трет-бутоксикарбонильную (Boc), адамантилоксикарбонильную (Adoc), флуоренилметоксикарбонильную (Fmoc), ацетил, карбонибензилокси (Cbz), метоксикарбонильную, этоксикарбонильную.
Термин "фармацевтическая композиция", использованный в настоящем описании, означает, например, смесь, содержащую определенное количество терапевтического агента, например, терапевтически эффективное количество лекарственного соединения, по меньшей мере, с одним фармацевтически приемлемым носителем, предназначенную для введения млекопитающему, например человеку, для лечения опухолевых заболеваний.
Термин "фармацевтически приемлемый", использованный в настоящем описании, относится к соединениям, композициям и/или лекарственным формам, которые при контакте с тканями млекопитающих, прежде всего, тканями человека, не вызывают аллергических реакций, раздражения, осложнений или других токсических проявлений, и указанные соединения характеризуются достаточно высоким соотношением польза/риск.
"Фармацевтически приемлемая соль" в настоящем изобретении означает обычные соли, получаемые прибавлением кислоты к основанию, которые сохраняют биологическую эффективность и свойства антрафурандиона 3 и образуются из его свободного основания и подходящих органических или неорганических кислот. Примеры солей, получаемых прибавлением кислоты, включают соли, полученные из органических кислот, например, метансульфоновой, этансульфоновой, 2-гидроксиэтансульфоновой, п-толуолсульфоновой кислот или неорганических кислот, например, хлористоводородной, бромистоводородной, йодистоводородной, серной, сульфаминовой кислот и т.п. Кроме того, термин "фармацевтически приемлемая соль" также включает фармацевтически приемлемые сольваты, предпочтительно гидраты. Химическое превращение антрафурандиона 3 в соль осуществляется способом, хорошо известным химикам-фармацевтам, обеспечивающим улучшенную физическую и химическую стабильность, гигроскопичность, сыпучесть и растворимость соединений [см., например, Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Edition). R.C. Rowe (Ed.), 1995, 1456-1457].
Термин "фармакологически приемлемый носитель" в настоящем изобретении означает один или несколько совместимых жидких или твердых разбавителей или наполнителей, которые подходят для введения млекопитающему, предпочтительно человеку. Предпочтительно в качестве фармацевтически приемлемого носителя в фармацевтических композициях по изобретению используются протон-содержащие среды, более предпочтительно водные среды.
Концентрация терапевтического агента в фармацевтической композиции составляет определенное значение, обеспечивающее введение терапевтически эффективного количества лекарственного средства, которое зависит от скорости абсорбции, инактивации и выведения из организма препарата, а также от тяжести состояния пациента или от других факторов, известных специалистам в данной области техники.
"Эффективное количество" или "терапевтически эффективное количество" соединения в настоящем изобретении означает количество антрафурандиона 3 или его фармацевтически приемлемой соли, которое значительно подавляет пролиферацию опухолевых клеток и эффективно для предупреждения, ослабления или смягчения симптомов заболевания или увеличения продолжительности жизни субъекта, подвергающегося лечению. Определение терапевтически эффективного количества относится к компетенции специалиста в данной области техники. Терапевтически эффективное количество или дозировка соединения, предлагаемого в настоящем изобретении, может меняться в широких пределах и может определяться способом, известным в данной области техники.
Для конкретного реципиента соответствующий курс лечения подбирается с учетом индивидуальной потребности и мнения врача, который вводит фармацевтические композиции пациенту или назначает введение фармацевтических композиций. Суточную дозу терапевтического агента можно вводить однократно в виде разовой дозы или многократно в виде разделенных доз, которые вводят через определенные периоды времени, или, при парентеральном введении, ее можно вводить путем непрерывного вливания. Таким образом, необходимое количество терапевтического агента, например необходимое терапевтически эффективное количество, определяет специалист в данной области медицины. Например, доза терапевтического агента может варьироваться в зависимости от возраста, веса тела или условий в интервале от приблизительно 1 мг до приблизительно 100 мг в расчете на антрафурандион 3 или его фармацевтически приемлемую соль на килограмм массы тела реципиента в сутки.
Следующие ниже неограничивающие примеры даны для демонстрации предпочтительных вариантов осуществления настоящего изобретения. Специалисты в данной области техники легко поймут, что для стабилизации лекарственных композиций на основе антрафурандиона 3 могут быть использованы разные эксципиенты и варианты осуществления настоящего изобретения.
Пример 1
Синтез метансульфоната (R,S)-3-[(3-амино-1-пирролидинил)карбонил]-4,11-дигидрокси-2-метилантра[2,3-b]фуран-5,10-диона (1)
Смесь 0.5 г (1.6 ммоль) 4,11-дигидрокси-5,10-диоксо-2-метилантра[2,3-b]фуран-3-карбоновой кислоты (a, схема A), бензола (25 мл) и 0.6 мл (8.5 ммоль) тионилхлорида кипятят при интенсивном перемешивании 60 мин, и отгоняют летучие компоненты смеси в вакууме. Полученный хлорангидрид b (схема A) суспендируют в хлороформе (25 мл), и при перемешивании прибавляют раствор 0.7 г (3.3 ммоль) (R,S)-3-(трет-бутоксикарбониламино)пирролидина в смеси хлороформа (10 мл) и пиридина (0.6 мл). Реакционную смесь кипятят 10 мин, переносят в делительную воронку, разбавляют теплым хлороформом (50 мл) и промывают разбавленным раствором HCl, водой, сушат Na2SO4, и отгоняют растворитель в вакууме. Остаток растворяют в хлороформе, раствор вносят в хроматографическую колонку с силикагелем, и элюируют продукт смесью хлороформ-метанол (20:1). Фракции, содержащие продукт, объединяют, и отгоняют растворитель в вакууме. Остаток перекристаллизовывают из диоксана, промывают диоксаном и сушат. Выход Boc-производного c (схема A) 0.65 г (83%) в виде красного порошка. ВЭЖХ (колонка Kromasil 100-5 C18, 4.6×250 мм (Akzo Nobel); элюэнты: A - H3PO4 (0.01 м), В - MeCN; градиент В 20→60% (30 мин); LW=260 нм): tR=8.9 мин, чистота 96%. Спектр ЯМР 1H (400 МГц, DMSO-d6), δ, м. д.: 8.18 (2H, м, Н-6,7); 7.90 (2Н, м, Н-8,9); 7.19 (1Н, м, NH); 4.08 (1Н, м, NCH2); 3.95 (1Н, м, NCH2); 3.69 (2Н, м, NCH2); 3.69 (1Н, м, CH); 2.51 (3H, с, Me); 2.08 (1Н, м, CH2CH2CH); 1.80 (1H, м, CH2CH2CH), 1.28 (9Н, с, OBut). Найдено: m/z (ESI), 507.1769 [М+Н]+. C27H27N2O8. Вычислено: 507.1762.
В круглодонной колбе, снабженной обратным холодильником с хлоркальциевой трубкой, растворяют 0.6 г (1.2 ммоль) карбоксамида с в теплом хлороформе (25 мл), и при перемешивании прибавляют раствор метансульфокислоты (0.15 мл) в хлороформе (2 мл). Смесь перемешивают 1.5-2 ч, и отфильтровывают красный осадок на воронке Бюхнера, промывают ацетоном (10 мл), эфиром (10 мл) и сушат. Выход 0.5 г (80%) метансульфоната (R,S)-3-[(3-амино-1-пирролидинил)карбонил]-4,11-дигидрокси-2-метилантра[2,3-6]фуран-5,10-дион-3-карбоксамида (1) в виде кирпично-красного порошка с Т. пл. >250°C. ТСХ (SilicaGel 60 F254 (Merck)): Rf=0.1, хлороформ-метанол-вода (10:10:1). ВЭЖХ (колонка Kromasil 100-5 C18, 4.6×250 мм (Akzo Nobel); элюэнты: A - H3PO4 (0.01 м), B - MeCN; градиент B 20 → 60% (30 мин); LW=260 нм): tR=17.2 мин, чистота 99.2%. ЭСП (EtOH), λмакс., нм, (lgε): 261 (4.4), 479 (4.0). ИК-спектр, νmax, см-1: 1615, 1584, 1462, 1419, 1351, 1301, 1166, 1044, 1021, 968. Спектр ЯМР 1H (400 МГц, DMSO-d6), δ, м.д.: 8.21 (2Н, м, Н-6,7); 7.92 (2Н, м, H-8,9); 3.89 (1H, м, NCH2); 3.80 (1H, м, NCH2); 3.55 (3H, м, NCH2, CH); 2.53 (3H, c, Me); 2.32 (3H, c, Me); 2.22 (1H, м, CH2CH2CH); 1.98 (1H, м, CH2CH2CH). Найдено, %: C 51.64, H 4.67, N 5.13. C22H18N2O6*CH4O3S*2H2O. Вычислено, %: C 51.30, H 4.87, N 5.20. Масс-спектр найдено, m/z (ESI): 407.1221 [М+H]+. C22H19N2O6. Вычислено: 407.1238.
Пример 2
Синтез метансульфоната (R)-3-[(3-амино-1-пирролидинил)карбонил]-4,11-дигидрокси-2-метилантра[2,3-b]фуран-5,10-диона (2)
Получают по методике, аналогичной приведенной в примере 1, из 4,11-дигидрокси-5,10-диоксо-2-метилантра[2,3-6]фуран-3-карбоновой кислоты (a, схема A) и (R)-3-(трет-бутоксикарбониламино)пирролидина. Выход антрафурандиона 2 - 85%. Т.пл. >250°C. ТСХ (SilicaGel 60 F254 (Merck)): Rf=0.1, хлороформ-метанол-вода (10:10:1). ВЭЖХ (колонка Kromasil 100-5 C18, 4.6×250 мм (Akzo Nobel); элюэнты: А - H3PO4 (0.01 м), B - MeCN; градиент В 20 → 60% (30 мин); LW=260 нм): tR=17.2 мин, чистота 99.2%. ЭСП (EtOH), λмакс., нм, (lgε): 261 (4.4), 479 (4.0). ИК-спектр, νmax, см-1: 1615, 1584, 1462, 1419, 1351, 1301, 1166, 1044, 1021, 968. Спектр ЯМР 1H (400 МГц, DMSO-d6), δ, м. д.: 8.21 (2H, м, H-6,7); 7.92 (2H, м, H-8,9); 3.89 (1H, м, NCH2); 3.80 (1H, м, NCH2); 3.55 (3H, м, NCH2, CH); 2.53 (3H, c, Me); 2.32 (3H, c, Me); 2.22 (1H, м, CH2CH2CH); 1.98 (1H, м, CH2CH2CH). Найдено, %: C 51.32, H 4.60, N 5.07. C22H18N2O6*CH4O3S*2H2O. Вычислено, %: C 51.30, H 4.87, N 5.20. Масс-спектр найдено, m/z (ESI): 407.1221 [М+H]+. C22H19N2O6. Вычислено: 407.1238.
Пример 3
Синтез метансульфоната (5)-3-[(3-амино-1-пирролидинил)карбонил]-4,11-дигидрокси-2-метилантра[2,3-6]фуран-5,10-диона (3)
Получают по методике, аналогичной приведенной в п