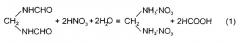Способ получения динитрата метилендиамина
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к способу получения динитрата метилендиамина, который может найти применение в синтезе мощных взрывчатых веществ. Согласно предлагаемому способу осуществляют гидролиз метиленбисформамида азотной кислотой в среде 65-75%-ной азотной кислоты при 15-25°С в течение 15-20 ч в соотношении 2,0-3,0 массовые части азотной кислоты на 1 часть метиленбисформамида. Затем полученную суспензию охлаждают до 0÷-10°С, динитрат метилендиамина отфильтровывают и промывают этанолом. Способ позволяет получать динитрат метилендиамина с хорошим выходом, избежав развития неуправляемых процессов разложения. 1 табл., 7 пр.
Реферат
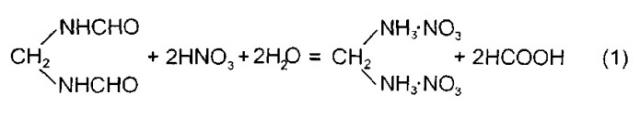
Предлагаемое изобретение относится к области органической химии, а именно к способу получения динитрата метилендиамина (ДНМДА), CH2(NH3NO3)2, в целях его использования в синтезе мощных взрывчатых веществ. Исключительно высокую активность ДНМДА обнаруживает в качестве стабилизатора реакционных растворов, в которых могут развиваться окислительно-восстановительные реакции с образованием азотистой кислоты и окислов азота (NO2, NO, N2O4). Добавки ДНМДА к таким реакционным растворам многократно увеличивают индукционный период до начала окислительных процессов и позволяют осуществлять безопасное проведение синтеза циклических N-нитраминов, в том числе недоступных ранее.
Широкому применению ДНМДА в синтезе ВВ препятствует отсутствие удобной методики получения этого продукта. В литературе имеется единственное упоминание о синтезе этого вещества гидролизом метиленбисформамида (МБФА), CH2(NHCHO)2, крепкой азотной кислотой (P. Knudsen, Chem. Ber. 1914, 47, 2698-2705), взятое за прототип. При этом подробных сведений о методике получения ДНМДА в источнике не приводится.
Реакцию образования ДНМДА можно представить уравнением:
Известно, что муравьиная кислота, образующаяся одновременно с ДНМДА по уравнению (1), является энергичным восстановителем азотной кислоты. В зависимости от концентрации азотной кислоты реакция протекает в соответствии с уравнениями (2)-(4):
В исследованиях К. Singer′a с сотр. (J.Chem.Soc. 1954, 2604-2610, 2610-2617) и Т. V. Healy (J.Appl. Chem. 1958, v.8, 553-561) показано, что эта реакция окисления является автокаталитической и значительно ускоряется азотистой кислотой, образующейся при восстановлении азотной кислоты, что может привести к развитию неуправляемых процессов разложения реакционных масс, заканчивающихся взрывом. Данное свойство бинарных смесей азотной и муравьиной кислот является естественным тормозом для использования реакции (1) для практического применения.
Технической задачей предлагаемого изобретения является разработка способа получения ДНМДА путем гидролиза МБФА в азотной кислоте. Нами установлено, что ДНМДА в условиях получения является исключительно эффективной ловушкой азотистой кислоты и окислов азота и блокирует развитие окислительно-восстановительных реакций в бинарных смесях азотной и муравьиной кислот в области концентраций азотной кислоты от 30% до 96% при 15-25°С.
Технический результат достигается тем, что гидролиз МБФА в соответствии с уравнением (1) осуществляют при использовании азотной кислоты с концентрацией 65-75% при температуре 15-25°С. При этом на 1 массовую часть МБФА используют 2,0-3,0 массовые части азотной кислоты и гидролиз осуществляется в течение 15-20 часов. В течение этого времени происходит кристаллизация образующегося ДНМДА. Для более полного выделения целевого продукта реакционную смесь охлаждают до 0 - минус 10°С, отфильтровывают кристаллы ДНМДА и промывают этанолом. Выход ДНМДА составляет 69-76% от теоретического.
Для проверки возможности развития окислительно-восстановительных реакций контролировали появление окислов азота и убыль веса в течение 72 часов после смешения компонентов. В течение этого времени окислы азота отсутствовали абсолютно. Не наблюдалось также уменьшения веса реакционной массы.
Следующие примеры поясняют сущность данного изобретения.
Пример 1
31,12 г МБФА добавили к 54 мл (77,8 г) 72%-ной азотной кислоты (массовое соотношение 1:2,5). В процессе растворения МБФА температура повысилась с 15 до 25°С. Гомогенный раствор выдержали 20 часов при 15°С. Суспензию, образовавшуюся при этом, охладили до минус 10°С, отфильтровали осадок, промыли этанолом 2×40 мл. Продукт высушили до постоянного веса на воздухе. Выход 38,20 г (70% от теории). Продукт плавится нечетко при 91-101°С с разложением и образованием новой твердой фазы. Элементным анализом найдено (%): С6.71, Н4.81, N32.8; вычислено для CH8N4O6 (%) С 6.98, Н 4.68, N 32.56.
В таблице представлены результаты примеров 2-7 гидролиза МБФА, проведенных аналогично примеру 1. Опыт №4 в таблице проводился при 25°С в течение 15 часов.
| Таблица | |||||
| Условия получения ДНМДА и количество полученного продукта | |||||
| № | ωHNO3, % | m HNO3, г | mHNO3/mMБФА | Выход ДНМДА | |
| г | % | ||||
| 2 | 67,9 | 77,8 | 2,5 | 36,36 | 69,3 |
| 3 | 67,9 | 93,3 | 3,0 | 37,78 | 72,0 |
| 4 | 70,4 | 77,8 | 2,5 | 40,61 | 76,4 |
| 5 | 70,4 | 77,8 | 2,5 | 39,61 | 75,5 |
| 6 | 72,1 | 77,8 | 2,5 | 36,72 | 70,0 |
| 7 | 72,1 | 93,3 | 3,0 | 36,57 | 69,7 |
| m - масса, | |||||
| ω - массовая доля. |
Результаты экспериментов показывают, что максимальный выход достигается при использовании 2,5 массовых частей 70,4% азотной кислоты на одну часть МБФА.
Способ получения динитрата метилендиамина гидролизом метиленбисформамида азотной кислотой, отличающийся тем, что гидролиз осуществляется в среде 65-75%-ной азотной кислоты при 15-25°С в течение 15-20 ч в соотношении 2,0-3,0 массовые части азотной кислоты на 1 часть метиленбисформамида с последующим охлаждением суспензии до 0÷-10°С и отфильтровыванием динитрата метилендиамина с промывкой этанолом.