Способ инактивации микроорганизмов рода e. coli
Иллюстрации
Показать всеИзобретение относится к области биологии и предназначено для инактивации микроорганизмов рода E.coli. Для инактивации микроорганизмов рода E.coli объект обрабатывают в газовой среде. В качестве газовой среды используют парогазовую смесь тетрафторэтана (фреон) и этилового спирта. Концентрация этилового спирта в парогазовой смеси составляет 2-5% от объема камеры, в которую помещен обрабатываемый продукт. Обработку объектов данной смесью проводят при давлении 50-100 атм и температуре 34°C. Использование способа обеспечивает сохранение биологической ценности продукта, упрощение процесса обработки необходимой продукции и повышает эффективность инактивации микроорганизмов рода E.coli. 2 ил.
Реферат
Изобретение относится к области научных исследований способов инактивации микроорганизмов и возможности использования их для фармацевтической и других видов промышленности, где необходимо проводить процедуру обеззараживания.
Под инактивацией понимается частичная или полная потеря биологически активным веществом или микроорганизмом его активности, в том числе потеря способности к размножению, и как следствие этого - потеря патогенности и способности к синтезу вредных веществ. Она является чрезвычайно важным фактором для фармацевтической и пищевой промышленности, а также для других областей, связанных с сохранением здоровья населения.
Самым применяемым методом обработки продуктов, биологических материалов, различных предметов, например, медицинских инструментов от патогенных микроорганизмов до сих пор является термическая стерилизация [Russell A.D. Principles of antimicrobial activity, in disinfection, sterilization and preservation / Ed. By S.S. Block. London: Lea, 2001. P.31] [1]. Термическая стерилизация существенно отражается на качестве производимой продукции, уменьшая количество витаминов, ухудшая питательные свойства, внешний вид и т.д.,
В тех случаях, когда термообработка невозможна, используют альтернативные нетермические методы, такие как дегидратация, холодное консервирование и брожение. Однако данные методы остаются малоэффективными в подавлении размножения микроорганизмов [Juneja V.K., Thayer D.W. Irradiation and other physically based control strategies for foodborne pathogens in Microbial Food Contamination/ Ed. by C.L. Wilson, S. Droby. CRC, Boca Ration, 2000. P.EF171] [2].
В последнее время вследствие роста производства фармацевтических изделий и свежих продуктов питания возросла необходимость в разработке более эффективных нетермических методов стерилизации, удовлетворяющих данным потребностям. Использование высокого гидростатического давления, интенсивных пульсирующих электрических полей, радиационного облучения или сочетания этих методов - вот только некоторые из нетермических методов, исследованных в последнее время в качестве альтернативных термообработке [2].
Однако применение вышеуказанных методов в промышленных масштабах оказалось малопригодным по ряду объективных причин: низкая эффективность инактивации микрофлоры и недостаточная безопасность непосредственно во время работы. Так, например, обработка при высоком гидростатическом давлении для инактивации Esherishia coli проводилась при 2000 и 6000 атм, что крайне сложно применить в промышленном масштабе [Tahiri I., Makhlouf J., Paquin P., Fliss I. Food Res. Int. 2006. Vol.39. P.98] [3].
Наиболее перспективными методами инактивации (обработки) являются технологии стерилизации, не обладающие химической или физической активностью по отношению к обрабатываемому объекту и применяемые при низких или комнатных температурах.
В последнее время наиболее активно развивается метод обработки в среде диоксида углерода (в сверхкритическом, жидком или газообразном состоянии), который в значительной степени лишен перечисленных выше недостатков, свойственных термическим и остальным методам [Spilimbergo S., Bertucco A. Bioeng. 2003. Vol.84. No.6 P.627] [4].
В процессе исследований гибель клеток объяснялась основными причинами: к примеру, экстракцией внутриклеточных субстанций, приводящих к гибели микроорганизма [Kamihira M., Tanigichi M., Kobayashi Т. Agric. Biol. Chem. 1987 Vol.51. P.407.] [5], и закислением растворенным CO2, приводящим к инактивации ключевых ферментов, определяющих ход важнейших метаболических процессов [Joslyn L.J. Sterilization by heat, in Disinfection, sterilization and preservation /Ed. by S.S. Bloc. London: Lea, 2001. P.695] [6]. Разрывы клеточной оболочки при проникновении CO2 внутрь клетки могут уменьшать ее выживаемость, а повреждение клеточной мембраны под действием сжатого газа может убивать клетки [Shimoda M., Cocunubo-Castellanos J., Kago H., Miyake M., Osajima Y., Hayakawa I.J. Appl. Microbiol. 2001. Vol.91. P.306] [7].
Большое влияние на степень инактивации микроорганизмов оказывает присутствие в обрабатываемом объекте воды или других растворителей [Ballestra P., Cuq J.L. Leben.-Wissen. Technol. 1998. Vol.31. P.84] [8].
В работе [Shimoda M., Kato H., Kojima N., Miyake M., Osajima Y., Hayakawa I Appl. Environ. Microbiol. 2002. Vol.68. No.8. P.4 162] [9] показано, что лишь комбинация различных механизмов (повреждение клеточной оболочки, экстракции ферментов, закисление и др.) приводит к инактивации клеток, а также, что величина давления, температура и продолжительность обработки являются базовыми параметрами, контролирующими степень выживания микроорганизмов.
Известен способ инактивации микроорганизмов, описанный в работе, принятый за прототип [4].
На примере E.coli показано, что наиболее высокая эффективность инактивации микроорганизмов, а именно в 108 раз падение выживаемости (-8 log), наблюдается в физиологических растворах при обработке их газом CO2 при давлении 100-200 атм, температуре 30-45°C в течение 25-60 мин.
Теория закисления предполагает, что CO2 реагирует с водой с образованием угольной кислоты и уменьшает pH как в окружающей среде, так и внутри клеток микроорганизмов [6]. А это означает, что в процессе обработки CO2 происходит нарушение целостности клеток обрабатываемой субстанции, а значит происходит и ухудшение свойств обрабатываемого продукта. Это является нежелательным эффектом при использовании этого метода как для биологических исследований, так и для возможного применения данного способа с целью дезинфекции различных предметов, оборудования и т.д.
Задачей данного изобретения является устранение этих недостатков, т.е. создание способа инактивации клеток E.coli, который обеспечит сохранение биологической ценности продукта (сохранит нативность исследуемого объекта), и упрощение процесса обработки необходимой продукции.
Поставленная задача решается за счет того, что в известном способе инактивации клеток микроорганизмов рода E.coli, заключающемся в обработке объекта в газовой среде, новым является то, в качестве газовой среды используют парогазовую смесь тетрафторэтана (фреон) и этилового спирта, при этом концентрация этилового спирта в парогазовой смеси составляет 2-5% от объема камеры, в которую помещен обрабатываемый продукт, и обработку объектов данной смесью проводят при давлении 50-100 атм и температуре 34°C.
Заявляемая совокупность признаков (а именно то, что смесь спирта и фреона инактивирует клетки E.coli при определенных условиях) была обнаружена экспериментальным путем, и этих данных нет в открытой публикации. Экспериментальным путем также установлено, что обработка материала чистым фреоном не приводит к положительному результату.
Важно также то, что при данных условиях исключена вероятность протекания механизма закисления, что характерно для способа-прототипа.
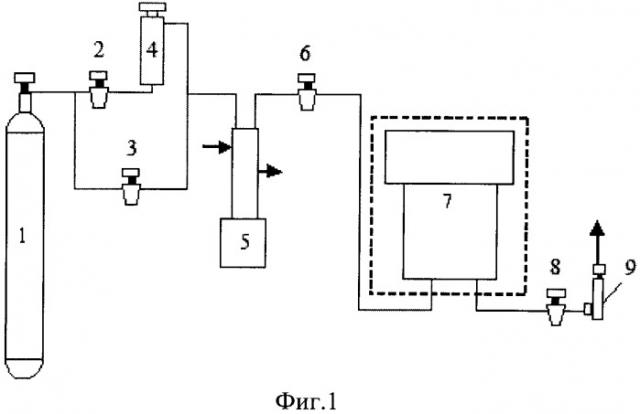
На фиг.1 представлена блок-схема для реализации данного способа, где: 1 - баллон с тетрафторэтаном, 2, 3, 6, 8 - вентили; 4 - реактор для приготовления смеси фреон + этиловый спирт; 5 - насос высокого давления с электронным блоком управления; 7 - ячейка для размещения пробы микроорганизмов - Е.coli; 9 - измеритель расхода газа.
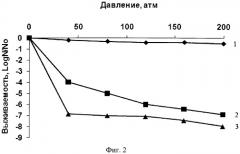
На фиг.2 представлена экспериментально полученная зависимость выживаемости влажных клеток Е.coli AB1157 от давления при 34°C в течение 20 мин при обработке их чистым 1,1,2,2-тетрафторэтаном (фреон) (кривая 1); при обработке их парогазовой смесью тетрафторэтана с 2 об.% этанола (кривая 2); при обработке их парогазовой смесью 1,1,1,2-тетрафторэтана с 5 об.% этанола (кривая 3).
Как видно из фиг.2, обработка Е.coli парогазовой смесью, состоящей из фреона и спирта, инактивирует клетки Е.Coli, а обработка чистым фреоном (тетрафторэтаном) совершенно не подавляет Е.coli (при прочих равных условиях).
Описание заявляемого способа
Для проверки способа использовались грамотрицательные бактерии рода Е.coli AB1157. Данные бактерии были взяты из-за своей распространенности, изученности генома и фенотипических свойств. Клетки Е.coli AB1157 выращивали в LB-среде (0,5% дрожжевой экстракт + 1,0% триптон + 1,0% NaCl) при 37°C в течение 18-20 часов. Для получения влажных клеток брались вновь выращенные культуры со средней концентрацией 0,5-1·108 кл/мл, что соответствует логарифмической фазе роста, переносились в стерильные микропробирки по 200 мкл и осаждались на центрифуге при скорости 10000 об/мин в течение 5 минут. После осаждения надосадочная жидкость удалялась. Микропробирки с осадками, содержащими влажные клетки Е.coli, закладывались в ячейку из нержавеющей стали (7) установки (фиг.1), которая предварительно протиралась этанолом и не менее 2 часов облучалась УФ-светом.
В ячейку (7) помещали 4 микропробирки, содержащие одинаковое количество влажных клеток Е.coli, после чего заполняли ее парогазовой смесью тетрафторэтан + этанол, пропуская ее через предварительный нагреватель, и с помощью насоса (5) набирали необходимое давление. Обработку проводили при давлениях от 20 до 200 атм в течение 20 мин при 34°C. После обработки газ стравливают из ячейки и извлекают образцы. Для определения количества живых клеток до и после эксперимента обработанные и необработанные (контрольные) клетки Е.coli высевают на чашки Петри с LB-агаром. Подсчет колоний проводили после выращивания при 37°C в течение 48 часов. По результатам трех измерений определяли среднее значение. Эффективность стерилизации оценивали по log отношения выживших клеток (N) к исходному числу клеток (No) [Суслов А.В., Суслова И.Н. и др. Сверхкритические Флюиды. Теория и Практика. 2009. Том 4. №2. Стр.20] [10]. Инактивация клеток считается полной, если обработанные тем или иным агентом клетки не образовывают клонов на чашках Петри после 48 часов инкубации при ростовой температуре.
Как видно из фиг.2, чистый фреон 134a практически не влияет на выживаемость клеток (кривая 1), в то время как парогазовая смесь фреона с 2 об.% этиловым спиртом вызывает инактивацию клеток E.coli AB1157 на ≈6,5 Log при No=0,5-1·108 кл/мл в исследованном диапазоне давлений (кривая 2). А при добавлении 5 об.% этанола инактивирующая способность парогазовой смеси возрастает уже при докритических давлениях (кривая 3). Таким образом, эти условия необходимы и достаточны для проведения процесса инактивации клеток Е.coli.
Из графика (фиг. 2) следует, что практически 100% инактивация достигается при давлении в пределах 50-100 атм. Таким образом, более высокое давление создавать нецелесообразно, что упрощает заявляемый способ в сравнении с прототипом
Если сравнивать скорость инактивации в среде CO2 [10], то для такой же степени инактивации клеток Е.coli AB1157 при обработке в среде CO2 требовалась величина давления более 150 атм.
Как известно, при таких величинах давления (свыше 70 атм) и температуры (свыше 32°C) углекислый газ переходит в сверхкритическое состояние, т.е. становится жидкостью [Tomasula P.M. Supercritical fluid extraction of food. Encyclopedia of Agricultural, Foog and Biological Engineering. Ed. By D. Heidman. New York. Dekker. 2003.] [11]. Сверхкритический CO2 обладает хорошей растворимостью и проникающей способностью, что позволяет проходить ему через клеточную оболочку внутрь и за счет образования угольной кислоты понижать pH внутриклеточной среды, а значит происходит повреждение не только клеток микроорганизмов, но и обрабатываемого продукта (т.е. запускается механизм закисления, что нежелательно). Как было сказано выше, это является одним из недостатков прототипа.
Основное преимущество заявляемого способа состоит в том, что при обработке парогазовой смесью тетрафторэтана со спиртом нет повреждения исследуемой среды, что важно при проведении научных исследований, а также в случае применения его в промышленных целях.
Заявляемый способ может быть использован для медицинской промышленности (обработка одноразовых систем для инъекций и переливаний, стерилизации инструментов и материалов), фармацевтической продукции, стерилизации оборудования для космической промышленности, а также для обработки различных видов спецодежды.
Список литературы
1. Russell A.D. Principles of antimicrobial activity, in disinfection, sterilization and preservation/Ed. By S.S. Block. London: Lea, 2001. P.31.
2. F Juneja V.K., Thayer D.W. Irradiation and other physically based control strategies for foodborne pathogens in Microbial Food Contamination/ Ed. by C.L. Wilson, S. Droby. CRC, Boca Ration, 2000. P. EF171.
3. Tahiri I., Makhlouf J., Paquin P., Fliss I. Food Res. Int. 2006. Vol.39. P.98.
4. Spilimbergo S., Bertucco A. Bioeng. 2003. Vol.84. No.6. P.627.
5. Kamihira M., Tanigichi M., Kobayashi T. Agric. Biol. Chem. 1987 Vol.51. P.407.
6. Joslyn L.J. Sterilization by heat, in Disinfection, sterilization and preservation /Ed. by S.S. Bloc. London: Lea, 2001. P.695.
7. Shimoda M., Cocunubo-Castellanos J., Kago H., Miyake M., Osajima Y., Hayakawa I.J. Appl. Microbiol. 2001. Vol.91. P.306.
8. Ballestra P., Cuq J.L. Leben.-Wissen. Technol. 1998. Vol.31. P.84.
9. Shimoda M., Kato H., Kojima N., Miyake M., Osajima Y., Hayakawa I Appl. Environ. Microbiol. 2002. Vol.68. No.8. P.4162.
10. Суслов А.В., Суслова И.Н. и др. Сверхкритические Флюиды. Теория и Практика. 2009. Том 4. №2. Стр.20.
11. Tomasula P.M. Supercritical fluid extraction of food. Encyclopedia of Agricultural, Foog and Biological Engineering. Ed. By D. Heidman. New York. Dekker. 2003.
Способ инактивации микроорганизмов рода E.coli, заключающийся в обработке объекта в газовой среде, отличающийся тем, что в качестве газовой среды используют парогазовую смесь тетрафторэтана (фреон) и этилового спирта, при этом концентрация этилового спирта в парогазовой смеси составляет 2-5% от объема камеры, в которую помещен обрабатываемый продукт, и обработку объектов данной смесью проводят при давлении 50-100 атм и температуре 34°C.