Композиция, способ и набор для альфа-1 ингибитора протеазы
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается стабильной композиции для обеспечения субъекта терапевтически или профилактически эффективным количеством альфа-1 ингибитора протеазы (API), содержащей альфа-1 ингибитор протеазы (API) и по меньшей мере одну аминокислоту, выбранную из аланина, треонина, серина или гидроксипролина, где указанная композиция включает одно или более вспомогательных веществ, где по меньшей мере одна аминокислота присутствует в композиции в общем количестве аминокислоты от приблизительно 0,01 М до приблизительно 3 М. Также группа изобретений касается набора для лечения или предотвращения заболевания или состояния, ассоциируемого с API, включающего указанную композицию; применения по меньшей мере одной аминокислоты, выбранной из аланина, треонина, серина или гидроксипролина, для стабилизации композиции, содержащей альфа-1 ингибитор протеазы (API). Группа изобретений обеспечивает стабильность состава API. 3 н. и 12 з.п. ф-лы, 27 ил., 5 табл., 8 пр.
Реферат
Родственные заявки
По настоящей заявке испрашивается приоритет по заявке США № 61/257711, поданной 3 ноября 2009 г., содержание которой включено полностью путем указания ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям, включающим альфа-1 ингибитор протеазы (API), в частности, стабильным композициям API. Настоящее изобретение также относится к способам и наборам для введения API субъекту, в частности, для обеспечения субъекта терапевтическим или профилактическим эффективным количеством API.
УРОВЕНЬ ТЕХНИКИ
Дефицит API является довольно распространенным генетическим нарушением, которое вызывает предрасположенность у индивидуумов с нарушением к заболеванию печени и/или легочной эмфиземе. Наиболее распространенный тип недостаточности API, называемого ингибитором протеаз типа Z (PiZ), передается как аутосомный рецессивный признак и проявляется приблизительно в 1 случае на 1700 живых новорожденных у большинства жителей Северной Европы и Северной Америки. Мутация PiZ представляет собой однонуклеотидную замену, которая приводит к замене одной аминокислоты (глутамат 342 на лизин).
Человеческий API содержит 394 аминокислоты, один цистеиновый остаток и три углеводных боковых цепи, и имеет общую молекулярную массу 52 кДа. Единственная петля реакционного центра (RCL) расположена в последовательности Met-Ser в положении 358-359. Третичная структура API содержит 8 четких α-спиралей (А-Н) и 3 больших β-листа (A-C). Предполагается, что серпины действуют по необратимому механизму "суицидного субстрата". При расщеплении протеазой серпин изменяет конформацию, при этом RCL расщепляется и встраивается в центр А β-листа, и протеаза перемещается к дистальному концу молекулы. Такое структурное перемещение приводит к стабилизации серпина и значительному искажению третичных структур протеазы, которое инактивирует ее каталитическую систему. Считается, что на биологическую активность API может влиять, например, химические модификации, включая меж- или внутримолекулярную полимеризацию, окисление, комплексообразование и/или расщепление неспецифичными протеазами.
Считается, что основная физиологическая функция API заключается в ингибировании эластазы нейтрофила, катепсина G и протеазы 3. API, продуцируемый у индивидуумов с PiZ - недостаточностью API, является функционально активным, хотя может наблюдаться снижение специфичной к эластазе ингибирующей активности. Основным местом синтеза API является печень, однако он также синтезируется в клетках за пределами печени, включая макрофаги, эпителиальные клетки кишечника и кишечные клетки Панета.
Патогенез повреждений легких при недостаточности API относят к значительному снижению активности доступного API. Как было установлено, API составляет более 90% активности ингибитора эластазы нейтрофила в легочно-альвеолярной промывной жидкости. Таким образом, становится очевидным, что деструктивное заболевание легких, наблюдаемое у многих индивидуумов с недостаточностью API, возникает из-за нарушения баланса в легких между эластазой и API. Неингибированная активность эластазы нейтрофила, катепсина G и протеазы 3, в свою очередь, приводит к медленной деструкции целостности соединительной ткани легких. Такое разрушение соединительной ткани приводит к растяжению и снижению сократительной силы легких, что приводит к уменьшению потока выдыхаемого воздуха. Курение усиливает проблему, приводя к окислительной инактивации в присутствии API.
В настоящее время выбор лечения для индивидуумов с патологиями, ассоциируемыми с недостаточностью API, ограничен. Заболевание печени, ассоциируемое с недостаточностью API, лечат ортотопической трансплантацией печени. Обсуждалась также соматическая генотерапия для замены дефектного гена API, но до сих пор успешных примеров применения еще нет.
Таким образом, существует потребность в композициях API, которые стабильны и которые обеспечивали бы желаемые уровни биодоступности API в плазме при введении субъекту.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В одном аспекте обеспечивается композиция, включающая: (a) альфа-1 ингибитор протеазы (API); и (b) по меньшей мере одну аминокислоту.
В другом аспекте настоящее изобретение обеспечивает способы получения композиции.
В других аспектах обеспечены наборы, включающие композицию.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
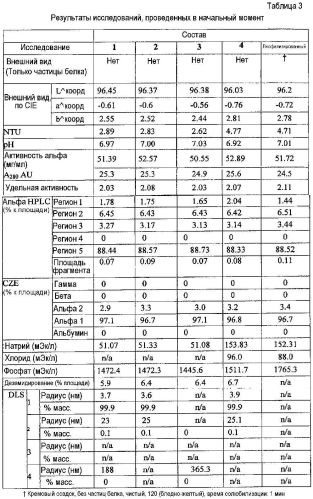
Фиг. 1 представляет собой график, показывающий профили агрегации жидких составов API, показанных в таблице 1 из примера 1.
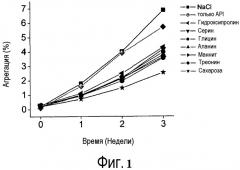
Фиг. 2 представляет собой график, показывающий профили агрегации составов API, содержащих аланин, сахарозу или сахарозу/аланин.
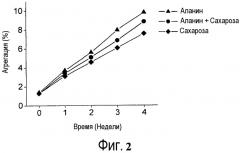
Фиг. 3 представляет собой график, показывающий профили агрегации составов API, содержащих аланин, маннит или маннит/аланин.
Фиг. 4 представляет собой график, показывающий профили агрегации составов API, содержащих аланин, сахарозу или трегалозу.
Фиг. 5 представляет собой график, показывающий влияние концентрации аминокислоты на агрегацию составов API после инкубирования при 40°C в течение одной недели.
Фиг. 6 представляет собой график, показывающий влияние концентрации аминокислоты на агрегацию составов API после инкубирования при 40°C в течение двух недель.
Фиг. 7 представляет собой график, показывающий профили агрегации составов API, содержащих аланин, не содержащих или содержащих различные концентрации акцептора кислорода.
Фиг. 8 представляет собой график, показывающий профили количества действующих веществ в составе API, описанном в примере 6 при 5°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 9 представляет собой график, показывающий нефелометрические (NTU) профили составов API, описанных в примере 6 при 5°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 10 представляет собой график, показывающий профили удельной активности составов API, описанных в примере 6 при 5°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 11 представляет собой график, показывающий профили дезамидирования составов API, описанных в примере 6 при 5°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 12 представляет собой график, показывающий профили увеличения агрегации составов API, описанных в примере 6 при 5°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 13 представляет собой график, показывающий профили агрегации составов API, описанных в примере 6 при 5°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 14 представляет собой график, показывающий олигомерные профили в составах API, описанных в примере 6 при 5°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 15 представляет собой график, показывающий мономерные профили в составах API, описанных в примере 6 при 5°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 16 представляет собой график, показывающий профили количества активных действующих веществ в составах API, описанных в примере 6 при 25°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 17 представляет собой график, показывающий NTU профили составов API, описанных в примере 6 при 25°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 18 представляет собой график, показывающий профили удельной активности составов API, описанных в примере 6 при 25°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 19 представляет собой график, показывающий профили дезамидирования составов API, описанных в примере 6 при 25°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 20 представляет собой график, показывающий профили увеличения агрегации составов API, описанных в примере 6 при 25°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 21 представляет собой график, показывающий профили агрегации составов API, описанных в примере 6 при 25°C: "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 22 представляет собой график, показывающий олигомерный профиль в составах API при 25°C. "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 23 представляет собой график, показывающий мономерный профиль составов API при 25°C. "Глицин" обозначает состав 1 (API (50 мг/мл)/Глицин (250 мМ)); "Аланин" обозначает состав 2 (API (50 мг/мл)/L-Аланин (250 мМ)); "Аланин/Сахароза" обозначает состав 3 (API (50 мг/мл)/L-Аланин (125 мМ)/Сахароза (125 мМ)); и "NaCl" обозначает состав 4 (API (50 мг/мл)/NaCl (250 мМ)).
Фиг. 24 представляет собой 2D контурную диаграмму pH и концентрации белка при агрегации в течение 1 недели, 2 недель и 3 недель в растворе API при 40°C.
Фиг. 25 представляет собой диаграмму влияния pH и агрегации раствора API при 40°C в течение 1 недели, 2недель и 3 недель.
Фиг. 26 показывает влияние pH на агрегацию в растворе API при 40°C в течение 1 недели, 2 недель и 3 недель.
Фиг. 27 показывает влияние концентрации белка на агрегационный профиль в растворе API при 40°C в течение 1 недели, 2 недель и 3 недель.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на том открытии, что относительно стабильная композиция, включающая API, может быть получена при добавлении в композицию также одной или более аминокислот. В частных вариантах осуществления настоящее изобретение охватывает стабильную фармацевтическую композицию, содержащую API, подходящую для введения API субъекту в терапевтических или профилактических целях. Неограничивающие примеры нарушений и заболеваний, ассоциируемые с API (например, уровни API в плазме ниже нормы) и для которых настоящие варианты осуществления могут быть особенно применимы, без ограничения включают заболевание легких, такое как хроническое обструктивное заболевание легких (COPD) (например, эмфизема), заболевание печени, заболевание сосудов (например, внутричерепные аневризмы, артериальная фиброзно-мышечная дисплазия, тяжелые нарушение кровотечения и гипертензия), панникулит, заболевание глаз (например, передний увеит), системный некротический васкулит и гранулематоз Вегенера.
I. Композиция
В одном аспекте настоящее изобретение обеспечивает композицию, включающую:
(i) API; и
(ii) по меньшей мере одну аминокислоту.
В некоторых вариантах осуществления композиция состоит или по существу состоит из API и по меньшей мере одной аминокислоты.
Композиция по настоящему изобретению может быть получена в относительно чистой форме. Например, в некоторых вариантах осуществления композиция может быть фармацевтического качества.
Композиция может быть получена в твердой, жидкой или полутвердой форме. Например, композиция может иметь жидкую форму, без ограничения включая водный раствор, водную суспензию, масляную суспензию и т.д. Альтернативно, композиция может быть в форме лиофилизированного препарата, сухого порошка, твердых частиц и т.д. Другие примеры без ограничения включают коллоиды, эмульсии, гели и мази.
В одном варианте осуществления композиция представляет собой жидкий состав, предпочтительно водный раствор. В другом варианте осуществления композиция подходит для фармацевтического применения, например, является фармацевтической композицией, включающей фармацевтически приемлемый носитель или разбавитель.
В одном варианте осуществления композиция представляет собой фармацевтическую композицию, включающую API, аминокислоту и фармацевтически приемлемый носитель. Как здесь используется, "фармацевтически приемлемый носитель" включает любые растворители, дисперсионные среды, покрытия и т.п., которые являются физиологически совместимыми. Тип носителя выбирается в зависимости от предполагаемого пути введения. В некоторых вариантах осуществления носитель является подходящим для введения посредством, включая без ограничения, внутривенного, ингаляционного, парентерального, подкожного, внутримышечного, внутривенного, внутрисетчатого, внутрибронхиального, интраабдоминального, интракапсулярного, внутрихрящевого, внутриполостного, интрацелиального, внутримозжечкового, интрацеребровентрикулярного, внутрикишечного (внутрь толстой кишки), интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, внутриперикардиального, интраперитонеального, внутриплеврального, внутрипростатного, внутрилегочного, интраректального, внутрипочечного, интраретинального, интраспинального, внутрисиновиального, внутригрудного, внутриматочного, внутрипузырного, болюсного, вагинального, ректального, буккального, сублингвального, интраназального или трансдермального средства. Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсию и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсии.
В некоторых вариантах осуществления композиция стерильна и стабильна при одном или более параметрах производства и хранения. Композиция может быть получена в форме раствора, микроэмульсии, липосомы или другой упорядоченной структуры. Например, стерильные инъекционные растворы могут быть приготовлены стерилизацией фильтрованием. Дисперсия может быть приготовлена включением API в стерильный носитель, который содержит дисперсионную среду. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными способами приготовления будут сушка в вакууме и сушка замораживанием, которые обеспечивают композицию, включающую порошок API и аминокислоту плюс любой необходимый дополнительный ингредиент, полученный предпочтительно из его предварительно стерилизованного фильтрованием раствора.
Примеры разбавителей (например, для разбавления, восстановления и т.д. композиции) могут без ограничения включать стерильную воду, бактериостатическую воду для инъекции (BWFI), pH буферный раствор (например, фосфатно-буферный солевой раствор), стерильный солевой раствор и раствор Рингера или декстрозный раствор. Разбавитель необязательно содержит консервант. Количество используемого консерванта определяют с учетом различных концентраций консерванта для совместимости с API и исследования эффективности консерванта.
Ингаляционная терапия заключается во введении лекарственного средства в форме аэрозоля в дыхательные пути. Аэрозольная доставка препарата основывается на той концепции, что доставка в глубокие области легких (альвеолы), которые насчитывают 95% эпителиальных тканей легких, может значительно усилить транспорт белка через эпителиальную мембрану, если молекула является биодоступной. Жидкие аэрозоли образуются распылением растворов API. Альтернативно, аэрозоли твердых частиц могут быть как в форме порошка, суспендированного в пропелленте, который вводится из дозирующего ингалятора, так и просто в форме порошка, который вводится из ингалятора сухого порошка. Например, аэрозоли твердых частиц могут быть получены лиофилизацией (например, сушка замораживанием) API из раствора и с последующим измельчением или размолом лиофилизированного лекарственного средства до желаемого гранулометрического состава для введения в легкие. По другой методике используют сушку распылением, в которой процесс дегидратации происходит под воздействием нагрева горячим потоком газа (обычно воздухом) для испарения диспергированных капель, создаваемых пульверизацией поданной жидкости. Этими методами композиция, включающая API, может быть высушена с получением мелких частиц, предпочтительно с желаемыми типами и количествами вспомогательных веществ, проявляющими свойства водозаменяющих средств.
В настоящее время в данной области широко известны дозирующие ингаляторы под давлением. Может быть использован любой герметичный дозирующий ингалятор под давлением, который подходит для доставки лекарственных средств в легкие или нос пациента. Состав аэрозоля и дозирующий клапан могут быть подобраны так, чтобы обеспечить терапевтически или профилактически эффективное количество API.
A. API
Термин "API", как здесь используется, должен пониматься широко, если конкретно не указано иное. Термин относится ко всем природным полиморфам API. Термин также включает функциональные фрагменты API, химерные белки, включающие API или его функциональные фрагменты, гомологи, полученные аналогичным замещением одной или более аминокислот API, и гомологичные виды. Термин также относится ко всем полипептидам API, которые представляют собой продукт технологии рекомбинантной ДНК, включая API, который представляет собой продукт трансгенной технологии. Например, ген, кодирующий API, может быть включен в ген млекопитающего, кодирующий сывороточный белок молока, так, чтобы последовательность ДНК экспрессировалась в молочной железе, как описано, например, в патенте США номер 5322775, содержание которого включено сюда путем указания ссылки, раскрывающего способ получения белкового соединения. Термин также относится ко всем белкам API, синтезируемым химическими способами, известными в данной области, такими как, например, твердофазный пептидный синтез. Термин также относится к API, полученному из плазмы. Термин также относится к API, который коммерчески доступен. API может относится как к человеческому, так и нечеловеческому API.
В одном варианте осуществления API представляет собой API, полученный из плазмы. В другом варианте осуществления API получают из IV-1 фракции Коэна. В других вариантах осуществления API получают из безальбуминовой фракции плазмы, преципитата V Коэна или предварительно очищенной фракции получения API. Патент США номер 6974792, включенный сюда путем указания ссылки, раскрывает способ получения API.
В других вариантах осуществления API представляет собой рекомбинантный API. Аминокислотная и нуклеотидная последовательность для API и/или получения рекомбинантного API описаны, например, в патентах США №№ 4711848; 4732973; 4931373; 5079336; 5134119; 5218091; 6072029 и Wright et al, Biotechnology, 9:830 (1991); и Archibald et al., PNAS, 87:5178 (1990), включенных сюда посредством указания ссылки, раскрывающих последовательности API, рекомбинантного API и/или рекомбинантную экспрессию API.
В одном варианте осуществления композиция охарактеризована как включающая API с чистотой более 90%. В других вариантах осуществления чистота API более чем 95%, предпочтительно по меньшей мере приблизительно 99%. В некоторых вариантах осуществления по меньшей мере приблизительно 50%, например, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 80% от общего количества API в композиции представляет собой активный API.
В одном варианте осуществления композиция включает терапевтически эффективное количество API. "Терапевтически эффективное количество" относится к количеству эффективному, в необходимых дозировках и продолжительности, для достижения желаемого терапевтического эффекта, такого как, например, снижение или замедление эмфиземы, ассоциируемой с врожденной недостаточностью API. Терапевтически эффективное количество API может изменяться в зависимости от таких факторов, как состояние заболевания, возраст, пол и масса отдельного субъекта, и способность API вызвать желаемый ответ у субъекта. Терапевтически эффективное количество также может быть таким, при котором терапевтически благоприятный эффект преобладает над любыми токсическими или нежелательными эффектами API.
В других вариантах осуществления композиция включает профилактически эффективное количество API. "Профилактически эффективное количество" относится к количеству эффективному, в необходимых дозировке и продолжительности, для получения требуемого профилактического эффекта, такого как, например, предотвращение или ингибирование эмфиземы, ассоциируемой с врожденной недостаточностью API. Профилактически эффективное количество может быть определено, как описано выше для терапевтически эффективного количества.
Одним из факторов, который следует учитывать при определении терапевтически или профилактически эффективного количества API, является концентрация функционально активного API, выделенного из биологического образца субъекта, получающего лечение, такого как, например, из бронхоальвеолярной промывной жидкости (ELF) субъекта. Другим фактором, который также можно учитывать, при определении терапевтически или профилактически эффективного количества API, является фармакология (например, фармакокинетика) API.
Фармакокинетика API касается концентрации или уровней API в крови субъекта. Фармакокинетические параметры или измерения уровней API в крови включают область под кривой (AUC), Cmin (то есть, низший порог) и Cmax. AUC показывает воздействие общего количества API в крови субъекта за определенный период дозирования (например, 8, 12 и 24 часа). Cmin (то есть, низший порог) представляет собой самым низкий уровень API в крови за определенный период времени дозирования. Cmax представляет собой самое высокое или пиковое содержание, достигнутое API в крови субъекта за определенный период дозирования.
В одном варианте осуществления терапевтически или профилактически эффективное введенное количество достаточно для достижения или обеспечения в крови (например, плазме) низшего порога API, которое будет выше целевого порогового значения. В одном варианте осуществления целевое пороговое значение составляет по меньшей мере приблизительно 10 мг/дл, иллюстративно, приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 и 200 мг/дл.
В другом варианте осуществления терапевтически или профилактически эффективное количество достаточно для достижения или обеспечения нижнего порога API в крови по меньшей мере приблизительно 50 мг/дл. В других вариантах осуществления терапевтически или профилактически эффективное количество API достаточно для обеспечения низшего порога API в крови по меньшей мере приблизительно 80 мг/дл.
В одном варианте осуществления концентрация API в композиции составляет по меньшей мере приблизительно 0,1 мг/мл, иллюстративно, по меньшей мере приблизительно: 0,1, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 и 1000 мг/мл. В одном варианте осуществления удельная активность API в композиции составляет по меньшей мере приблизительно 0,05 мг активного API на мг общего белка, иллюстративно, по меньшей мере приблизительно 0,05, 0,1, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг или более активного API на мг общего белка.
В некоторых вариантах осуществления концентрация API, содержавшегося в композиции, составляет, из расчета по массовому проценту (масс./об.), по меньшей мере приблизительно 1%, иллюстративно, от приблизительно 1 до приблизительно 60%, от приблизительно 5 до приблизительно 55%, от приблизительно 10 до приблизительно 45%, от приблизительно 20 до приблизительно 30% (масс./об.).
B. Аминокислота
Должно быть понятно, что аминокислоты, конкретно указаны здесь только в иллюстративных целях и не служат для ограничения аминокислот, которые могут быть использованы по настоящему изобретению. Другие аминокислоты, конкретно не указанные здесь, могут быть легко подобраны на основании проявляемых ими физических и химических свойств. Дополнительно, некоторые из аминокислот, упомянутые здесь, были указаны в терминах генетически кодируемых аминокислот, однако, аминокислоту не должна ограничиваться генетически кодируемыми аминокислотами, но также может включать генетически некодируемые аминокислоты. Например, аминокислота также может включать природные некодируемые аминокислоты и синтетические аминокислоты (например, β-аланин, гидроксипролин). Также могут рассматриваться L-энантиомерные аминокислоты (L-аминокислоты) и D-аминокислоты, а также свободные аминокислотные формы и/или физиологически приемлемые солевые формы и/или их смеси.
В таблице 1 перечислены некоторые неограничивающие примеры аминокислот.
| Таблица 1Аминокислоты | ||
| Аминокислота | Трехбуквенный код | Однобуквенный код |
| Глицин | Gly | G |
| Аланин | Ala | A |
| Валин | Val | V |
| Лейцин | Leu | L |
| Изолейцин | Ile | I |
| Метионин | Met | M |
| Фенилаланин | Phe | F |
| Триптофан | Trp | W |
| Пролин | Pro | P |
| Серин | Ser | S |
| Треонин | Thr | T |
| Цистеин | Cys | C |
| Тирозин | Tyr | Y |
| Аспарагин | Asn | N |
| Глутамин | Gln | Q |
| Лизин | Lys | K |
| Аргинин | Arg | R |
| Гистидин | His | H |
| Аспарагиновая кислота | Asp | D |
| Глутаминовая кислота | Glu | E |
В одном варианте осуществления композиция включает по меньшей мере одну аминокислоту, где каждая выбрана из группы, состоящей из Ala (A), Thr (T), гидроксипролина, Gly (G), Ser (S), Gln (Q), Phe (F), Trp (W), Met (M), ацетилцистеина, Leu (L), Ile (I), Val (V), Lys (K), Pro (P), Tyr (Y), His (H), Glu (E), Asn (N), Asp (D) и Arg (R).
В другом варианте осуществления по меньшей мере каждая одна аминокислота выбирается из группы, состоящей из Ala (A), Thr (T), гидроксипролина, Gly(G) и Ser(S).
В других вариантах осуществления по меньшей мере одна аминокислота представляет собой Ala (A) или Gly (G).
В некоторых вариантах осуществления аминокислота представляет собой нейтральную аминокислоту или гидрофильную аминокислоту. В другом варианте осуществления гидрофильная аминокислота представляет собой аминокислоту, которая проявляет гидрофобность менее нуля по общей шкале гидрофобности.
В одном варианте осуществления по меньшей мере одна аминокислота присутствует в композиции в общем количестве аминокислоты, которое достаточно для обеспечения стабильной композиции API, например, как определено при сравнении с композицией API, не содержащей по меньшей мере одну аминокислоту.
В другом варианте осуществления общее количество аминокислоты составляет количество, достаточно для сохранения API по меньшей мере приблизительно 5% активности API в течение определенного периода времени при определенной температуре, иллюстративно, по меньшей мере от приблизительно 5% до приблизительно 100%, от приблизительно 10% до приблизительно 95%, от приблизительно 20% до приблизительно 90%, от приблизительно 30% до приблизительно 80%, от приблизительно 40% до приблизительно 70% и от приблизительно 50% до приблизительно 60% активности API в течение определенного периода времени при определенной температуре. В некоторых вариантах осуществления период времени и/или температура определены как срок и/или температура хранения (например, срок годности). В одном варианте осуществления период времени составляет по меньшей мере приблизительно 1 день, 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 8 месяцев, 1 год, 2 года и 3 года. В другом варианте осуществления температура равна или более чем приблизительно -120°C, -70°C, -20°C, 0°C, 5°C, 25°C, 37°C, 40°C и 50°C.
В одном варианте осуществления активность API может быть определена по ингибированию свиной панкреатической эластазы, как описано, например, в Coan et al., Vox Sang., 48:333 (1985), содержание которого включено полностью путем указания ссылки. В некоторых вариантах осуществления активность API может быть оценена как активность или токсичность in vitro, in vivo и/или ex vivo исследованиями (например, терапевтический индекс, LD50, ED50 и т.д.) на животных. Например, при последовательных разведениях из исходного или основного раствора, или восстановлении лиофилизированных или высушенных под вакуумом композиций, содержащих API, содержание API в ресуспендированной или водной композиции (в присутствии по меньшей мере одной аминокислоты и/или по меньшей мере одной аминокислоты от общего количества) составляет более чем по меньшей мере приблизительно от 5% до приблизительно 100% активности или токсичности, которую биологически активный API проявлял до включения в композицию.
В других вариантах осуществления стабильность API может быть определена, например, методами определения разложения API, без ограничения включающими образование продуктов окисления, протеолиз и/или дезамидирование, изменение в распределении молекулярной массы, изменение активности, изменение функциональных групп, увеличение нерастворимых субстанций, таких как агрегаты, или модификацию продукта, обусловленную вспомогательными веществами, такую как неферментативное гликозилирование. Кроме того, стабильность может быть определена как изменение концентрации, обусловленное, например, испарением, адсорбцией, химической модификацией и т.п. Соответственно, в некоторых вариантах осуществления стабильные при хранении композиции API представляют собой композиции, в которых наблюдается менее чем 5, 10, 15, 20, 25, 30, 40, 50, 60, 70% разложения API. В стабильных при хранении композициях также может наблюдаться любая комбинация этих характеристик.
В другом варианте осуществления общего количество аминокислот в композиции представляет собой количество, достаточное для повышения точки плавления API по сравнению с композицией, не содержащей по меньшей мере одной аминокислоты. Специалист в данной области легко может определить точку плавления, например, при помощи дифференциального сканирующего калориметра (DSC). В одном варианте осуществления общее количество аминокислоты композиции достаточно для увеличения точки плавления на по меньшей мере приблизительно 0,01°C, 0,1°C, 1°C, 1,2°C, 1,4°C, 1,6°C, 1,8°C и 2°C.
В других вариантах осуществления общее количество аминокислоты в композиции после хранения композиции за определенный период времени при определенной температуре составляет количество, достаточное для того, чтобы процент мономерного API в композиции составлял по меньшей мере приблизительно 50%, иллюстративно, от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 99%, от приблизительно 98%, от приблизительно 70% до приблизительно 98%, от приблизительно 80% до приблизительно 95% и от приблизительно 85% до приблизительно 90%. В одном варианте осуществления период времени составляет по меньшей мере приблизительно 1 день, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 8 месяцев, 1 год, 2 года и 3 года. В другом варианте осуществления температура равна или более чем приблизительно -120°C, -70°C, -20°C, 0°C, 5°C, 25°C, 37°C, 40°C и 50°C.
В другом варианте осуществления общее количество аминокислоты в композиции составляет количество, достаточное, чтобы после хранения композиции за определенный период времени при определенной температуре процент агрегатов белка в композиции составлял менее чем или равно приблизительно 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5% и 0%. В одном варианте осуществления период времени составляет по меньшей мере приблизительно 1 день, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 8 месяцев, 1 год, 2 года и 3 года. В другом варианте осуществления температура равна или более чем приблизительно -120°C, -70°C, -20°C, 0°C, 5°C, 25°C, 37°C, 40°C и 50°C.
Уровни агрегации белка в композиции могут быть определены любой обычной в данной области методикой, например, эксклюзионной высокоэффективной жидкостной хроматографией (SE-HPLC).
В одном варианте осуществления общее количество аминокислоты, присутствующей в композиции, составляет по меньшей мере приблизительно 0,01 М, иллюстративно, от приблизительно 0,01 до приблизительно 3 М, от приблизительно 0,03 до приблизительно 1 М, от приблизительно 0,05 до приблизительно 0,5 М и от приблизительно 0,1 до приблизительно 0,3 М.
В другом варианте осуществления общее количество аминокислоты, присутствующей в композиции, составляет по меньшей мере приблизительно 0,01 М, по меньшей мере приблизительно 0,03 М или по меньшей мере приблизительно 0,3 М.
В других вариантах осуществления композиция включает аланин, где общая концентрация аланина составляет по меньшей мере приблизительно 0,01 М аланина, иллюстративно, от приблизительно 0,01 до приблизительно 1 М и от приблизительно 0,01 до приблизительно 0,75 М аланина. В некоторых вариантах осуществления по меньшей мере одна аминокислота представляет аланин, где композиция не содержит каких-либо аминокислот, за исключением аланина.
В одном варианте осуществления композиция включает треонин, где общая концентрация треонина составляет по меньшей мере приблизительно 0,01 М треонина, иллюстративно, от приблизительно 0,01 до приблизительно 1 М и от приблизительно 0,1 до приблизительно 0,3 М треонина. В некоторых вариантах осуществления по меньшей мере одна аминокислота представляет собой треонин, где композиция не содержит каких-либо аминокислот, за исключением треонина.
В другом варианте осуществления композиция включает гидроксипролин, где общая концентрация гидроксипролина составляет по меньшей мере приблизительно 0,01 М гидроксипролина, иллюстративно, от приблизительно 0,01 до приблизительно 1 М и от приблизительно 0,1 до приблизительно 0,3 М гидроксипролина. В некоторых вариантах осуществления по меньшей мере одна аминокислота представляет собой гидроксипролин, где композиция не содержит каких-либо аминокислот, за исключением гидроксипролина.
В одном варианте осуществления композиция включает глицин, где общая концентрация глицина составляет по меньшей мере приблизительно 0,01 М глицина, иллюстративно, от приблизительно 0,01 до приблизительно 1 М и от приблизительно 0,1 до приблизительно 0,3 М глицина. В некоторых вариантах осуществления по меньшей мере одна аминокислота представляет собой глицин, где композиция не содержит каких-либо аминокислот, за исключением глицина.
В других вариантах осуществления композиция включает серин, где общая концентрация серина составляет по меньшей мере приблизительно 0,01 М серина, иллюстративно, от приблизительно 0,01 до приблизительно 1 М и от приблизительно 0,1 до приблизительно 0,3 М серина. В некоторых вариантах