Штамм микроводоросли desmodesmus sp. для конверсии углекислоты из промышленных сбросных газов в сырье для производства биотоплива и кормовых добавок
Иллюстрации
Показать всеИзобретение относится к фотобиотехнологии. Штамм микроводоросли Desmodesmus sp. 3Dp86E-1 обладает высокими показателями фиксации CO2 и толерантностью к высоким концентрациям CO2 в среде культивирования, а также высокой способностью к накоплению липидов, обогащенных полиненасыщенными жирными кислотами. Штамм депонирован в Коллекции культур микроводорослей Института физиологии растений им К.А. Тимирязева РАН (IPPAS) под регистрационным номером Desmodesmus sp. IPPAS S-2014 и может быть использован для конверсии углекислоты из промышленных сбросных газов в сырье для производства биотоплива и кормовых добавок. Изобретение позволяет повысить скорость фиксации CO2 в газовоздушной смеси. 4 ил., 1 табл.
Реферат
Область применения
Изобретение относится к фотобиотехнологии и представляет собой новый штамм микроводоросли Desmodesmus sp. 3Dp86E-1, предназначенный для конверсии углекислоты из промышленных сбросных газов в сырье для производства биотоплива и кормовых добавок.
Уровень техники
Согласно отчетам Межправительственной группы экспертов по изменению климата (IPCC), повышение содержания CO2 в атмосфере из-за техногенных выбросов - одна из основных причин глобального потепления, а биологическая (фотосинтетическая) фиксация - единственный на сегодня рентабельный и экологичный метод утилизации техногенного CO2 (М. Huntley, D. Redalje. CO2 mitigation and renewable oil from photosynthetic microbes: a new appraisal. Mitigation and Adaptation Strategies for Global Change. 2007, V.12-4, p.573-608; B. Wang, Y. Li, N. Wu, C. Lan. CO2 biomitigation using microalgae. Applied microbiology and biotechnology. 2008. V.79-5, p.707-718). Особенно эффективно биологическое изъятие с помощью микроводорослей. Существенное преимущество технологий биоизъятия CO2 с помощью микроводорослей - возможность их интеграции с существующими технологическими процессами генерации электроэнергии и очистки выбросов без существенной переделки этих технологий (М. Cuaresma, М. Janssen, С. Vilchez, R.Н. Wijffels. Horizontal or vertical photobioreactors? How to improve microalgae photosynthetic efficiency. Bioresource Technology. 2011, V.102, №8, p.5129-5137). Тем не менее, одной из ключевых трудностей при разработке фотобиотехнологий для биоизъятия является недостаток информации о физиологических эффектах высоких концентраций CO2 и механизмов толерантности микроводорослей к этому фактору.
Одним из наиболее перспективных способов биологической конверсии CO2 в биомассу, содержащую биологически активные вещества, пигменты-антиоксиданты и исходные вещества для производства биотоплива, считается использование фотоавтотрофных микроорганизмов (микроводорослей). Известны некоторые эффекты широкого диапазона концентраций (от атмосферной до 100%) CO2 в газовоздушной смеси, которой продуваются культуры MB, преимущественно из родов Chlorella sp., Scenedesmus sp., Nannochloropsis sp. и Chlorococcum (M. Negoro, N. Shioji, K. Miyamoto, Y. Micira. Growth of Microalgae in High CO2 Gas and Effects of SOX and NOX. Applied Biochemistry and Biotechnology. 1991, V.28-29, №1. p.877-886; M. Olaizola. Microalgal removal of CO2 from flue gases: Changes in medium pH and flue gas composition do not appear to affect the photochemical yield of microalgal cultures. Biotechnology and Bioprocess Engineering. 2003, V.8, №6, p.360-367; N. Kurano et all. Fixation and utilization of carbon dioxide by microalgal photosynthesis. Energy Conversion and Management. 1995, V.36, №6-9, p.689-692; K. Maeda et all. CO2 fixation from the flue gas on coal-fired thermal power plant by microalgae. Energy Conversion and Management. 1995, V.6, №6-9. p.717-720).
Рост и фотосинтез чувствительных штаммов при CO2 2-5% замедляется или прекращается. У толерантных штаммов рост и фотосинтез замедляются при существенно более высоких концентрациях CO2 и возобновляются после лаг-периода, длина которого зависит от концентрации CO2 и видовых особенностей (A. Satoh, N. Kurano, Н. Senger, S. Miyachi. Regulation of energy balance in photosystems in response to changes in CO2 concentrations and light intensities during growth in extremely-high-CO2-tolerant green microalgae. Plant and Cell Physiology. 2002, V.43, №4, p.440-451). У одних микроводорослей (например, у Chlorella) при акклимации к высоким уровням CO2 наблюдается существенное повышение скорости фотосинтеза, в то время как у других (Chlamydomonas) этого не происходит (М. Baba, I. Suzuki, Y. Shiraiwa. Proteomic Analysis of High-CO2-Inducible Extracellular Proteins in the Unicellular Green Alga, Chlamydomonas reinhardtii. Plant and Cell Physiology. 2011, V.52, №8, p.1302-1314).
Известна микроводоросль, толерантная к высоким уровням CO2 - Chlorococcum littorale, выделенная из солоноводного пруда и сохраняющая способность к быстрому росту при концентрации CO2 до 60% (S. Miyachi, I. Iwasaki, Y. Shiraiwa. Historical perspective on microalgal and cyanobacterial acclimation to low - and extremely high-CO2 conditions. Photosynthesis Research. 2003, V.77, №2. p.139-153).
| Таблица 1 | ||
| CO2-толерантность некоторых видов микроводорослей | ||
| Вид | Макс. концентрация CO2 | Источник |
| Cyanidium caldarium | 100% | Seckbach J, Baker FA, Shugarman PM (1970) Algae thrive under pure CO2. Nature 227 (5259): 744-745 |
| Scenedesmus sp. | 80% | Hanagata N, Takeuchi T, Fukuju Y, Barnes DJ, Karube I (1992) Tolerance of microalgae to high CO2 and high temperature. Phytochemistry 31 (10): 3345-3348. |
| Chlorococcum littorale | 60% | Kodama M, Ikemoto H, Miyachi S (1993) A new species of highly CO2-tolreant fast-growing marine microalga suitable for high-density culture. J Mar Biotechnol 1: 21-25 |
| Synechococcus elongatus | 60% | Miyairi S (1995) CO2 assimilation in a thermophilic cyanobacterium. Energy Convers Manage 36 (6): 763-766 |
| Moheimani NR (2013) Inorganic carbon and pH effect on growth and lipid productivity of Tetraselmis suecica and Chlorella sp (Chlorophyta) grown outdoors in bag |
| Вид | Макс. концентрация CO2 | Источник |
| photobioreactors. J Appl Phycol 25 (2): 387-398 | ||
| Euglena gracilis | 45% | Nakano Y, Miyatake K, Okuno H, Hamazaki K, Takenaka S, Honami N, Kiyota M, Aiga I, Kondo J Growth of photosynthetic algae Euglena in high CO2 conditions and its photosynthetic characteristics. In:International Symposium on Plant Production in Closed Ecosystems 440, 1996. pp 49-54 |
| Chlorella sp. | 40% | Hanagata N, Takeuchi T, Fukuju Y, Barnes DJ, Karube I (1992) Tolerance of microalgae to high CO2 and high temperature. Phytochemistry 31 (10): 3345-3348. |
| Eudorina spp. | 20% |
Кроме толерантности к высоким концентрациям CO2, для эффективного использования микроводорослей в промышленности, необходимо, чтобы биомасса содержала значительные количества ценных соединений, таких как жирные кислоты, каротиноиды, витамины и пр.
При культивировании микроводоросли Botryococcus braunii шт 765 удается получить биомассу, содержащую до 12% общих липидов и 8% жирных кислот, при этом продуктивность по жирным кислотам составляет 0,08 г/л за 15 суток культивирования при барботировании газовой смесью с содержанием в ней 20% CO2 (Ge, Y., J. Liu, et al. Growth characteristics of Botryococcus braunii 765 under high CO2 concentration in photobioreactor. Bioresource Technology, 2011. 102 (1): p.130-134).
Известна микроводоросль Parietochloris incisa, содержащая в составе внутриклеточных липидов жирные кислоты, продуктивность по которым достигает 0,25 г/л (что составляет 12-14% ЖК от веса сухой биомассы), путем ее выращивания на минеральной среде, барботированной газовой смесью с повышенным содержанием углекислоты в ней в количестве не менее 1% по объему, не содержащей связанного азота, и освещенности порядка 400 мкЕ ФАР м-2 с-1 (Solovchenko, A., et al., Effects of light intensity and nitrogen starvation on growth, total fatty acids and arachidonic acid in the green microalga Parietochloris incisa. Journal of Applied Phycology, 2008. 20 (3): p.245-251).
Наиболее близким аналогом (прототипом) является микроводоросль Scenedesmus sp., депонированная в Корейской Коллекции Культур (KCTC) под номером KCTC11336BP (US 20110076749 A1, 2010). Культура характеризуется скоростью фиксации CO2 0.88 мг/л/сут при максимальной концентрации CO2 в газовоздушной смеси 10% и требуемой освещенности 125 мкЕ/(м2*с). К недостаткам прототипа можно отнести недостаточно высокую скорость фиксации CO2, невысокие максимальные концентрации CO2 в газовоздушной смеси и необходимость в создании условий с достаточно высокой освещенностью культуры.
Раскрытие изобретения
Задача изобретения - получение штамма микроводорослей для конверсии углекислоты из промышленных сбросных газов в сырье для производства биотоплива и кормовых добавок, характеризующегося высокой скоростью фиксации CO2 и толерантностью к высоким концентрациям CO2 в среде культивирования.
Эта задача была решена получением штамма микроводоросли Desmodesmus sp. 3Dp86E-1, выделенного авторами из Ругозергской губы Кандалашского залива Белого моря и депонированного в Российской Коллекции Микроводорослей при учреждении Российской Академии Наук Институте Физиологии Растений им. К.А. Тимирязева (IPPAS) с присвоенным идентификатором IPPAS C-2014.
Новизной настоящего изобретения является то, что впервые был получен штамм микроводоросли, способный к активному росту на средах с высокой концентрацией CO2 и способностью к высокой степени фиксации углекислого газа.
Сущность изобретения заключается в том, что для достижения цели используют зеленую микроводоросль Desmodesmus sp. штамм 3Dp86E-1, выделенный и идентифицированный авторами заявки, сиквенс которого зарегистрирован в международной базе данных GenBank (http://www.ncbi.nlm.nih.gov/genbank/) под номером JQ313132. В результате полученный штамм характеризуется способностью расти на средах, с высоким содержанием CO2 в газовоздушной смеси (до 99-100%), высокой способностью к фиксации CO2 (до 1,5-2 мг/л/сут) и обладает высокой продуктивностью. При этом биомасса микроводоросли Desmodesmus sp. штамм 3Dp86E-1 содержит значительное количество ценных соединений, в частности жирных кислот. Инокулят вносят в среду при конечной концентрации хлорофилла в смеси 4-6 мкг/мл, культивирование проводят в фотобиореакторе при постоянном освещении с интенсивностью 60-80 мкЕ ФАР м-2с-1 с помощью светодиодов при постоянном продувании среды газовоздушной смесью с концентрацией CO2 20-100%, при скорости продувания - 0,2-0,4 л/мин при температуре 25-27°C. После этого отделяют биомассу от среды центрифугированием. В результате получают накопление биомассы 60-80 г сухого веса/м2 в сутки; фиксацию CO2 со скоростью 2-3 г/л культуры в сутки и накопление жирных кислот 33-35%).
Краткое описание чертежей
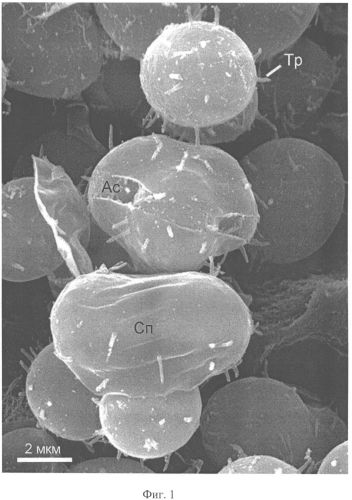
На Фиг.1 представлен электронно-микроскопический снимок в режиме сканирующей микроскопии, отражающий морфологию микроводоросли Scenedesmus sp. 3Dp86E-1. Обозначения: Ас - автоспора; Сп - спорангий; Тр - трубочка.
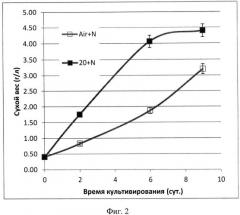
На Фиг.2 показана характерная кинетика роста Scenedesmus sp. 3Dp86E-1 при продувании культуры атмосферным воздухом (светлые символы, Air+N) и газовоздушной смесью, содержащей 20 объемных % CO2 (темные символы, 20+N).
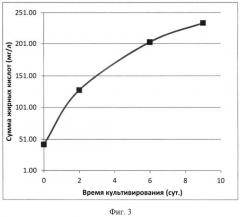
На Фиг.3 представлены данные о накоплении жирных кислот липидов биомассы Desmodesmus sp. 3Dp86E-1 во время роста при продувании 20% CO2 в атмосферном воздухе. Содержание линоленовой кислоты (18:3) в биомассе - 15-20% от суммы жирных кислот.
На Фиг.4 приводится частичная последовательность нуклеотидов гена 18S рРНК микроводоросли Scenedesmus sp. 3Dp86E-1.
Осуществление изобретения
Штамм Desmodesmus sp. 3Dp86E-1 выделен из фрагментов беспозвоночного животного гидроида Dynamena pumila, собранного в районе поселка Приморский Беломорской биологической станции им. Н.А. Перцова, Ругозергской губы Кандалакшского залива Белого моря. Отселектирован в результате скрининга по толерантности к сверхвысоким концентрациям CO2 и накоплению нейтральных липидов в биомассе культуры.
Способ выделения - из накопительной культуры, полученной из предварительно простерилизованных перекисью водородом фрагментов гидроида Dynamena pumila и помещенных на среду BG-11, с дальнейшим интенсивным культивированием на среде BG-11.
Морфологические признаки.
Клетки округлой формы, размером от 4 до 6 мкм. Пиреноид присутствует, размер 1-1,5 мкм, хроматофор многолопастной, окраска зеленая, жгутик отсутствует, на поверхности клеточной стенки выраженные эпиструктуры в виде бородавок и розеток (Фиг.1).
Физиологические свойства штамма.
Оптимальные условия культивирования
Для культивирования используют жидкую питательную среду BG-11 следующего состава:
K2HPO4 - 0,04 г/л,
NaNO3 - 1,5 г/л,
MgSO4·7H2O - 0,075 г/л,
CaCl2·2H2O - 0,037 г/л,
лимонная кислота - 0,006 г/л,
FeSO4·7H2O - 0,006 г/л,
Na2CO3 - 0,2 г/л,
ЭДТА - 0,001 г/л,
раствор FeSO4·7H2O (7,45 г/л)+ЭДТА (5,57 г/л) - 1 мл/л,
раствор микроэлементов (H3BO3 - 2,86 г/л, MnCl2·4H2O - 1,86 г/л, ZnSO4·7H2O - 0,22 г/л, CuSO4·5H2O - 0,08 г/л, Na2MoO4·7H2O - 0,39 г/л, Co(NO3)2·6H2O - 0,05 г/л) - 1 мл/л,
pH - 7,0-7,2,
содержание CO2 в ГВС - 2-100%,
скорость барботажа 0,3 л/мин,
температура 27°C,
освещение круглосуточное,
освещенность: 5-12 Вт/м2, 60-80 мкмоль квантов ФАР на м2 в с,
тип ламп: люминесцентные либо белые светодиодные.
Продуктивность в оптимальных условиях культивирования:
по накоплению биомассы (сухой вес, мг/мл в сутки): 200-250;
скорость роста 0,2-0,3 млн/мл в сутки;
выход полезного продукта (липиды) 20-40 мг/сутки на мг биомассы.
Для данной культуры отсутствует сезонность, отмечается высокая бактерицидность, не выявлен автолиз, характерная слабая агглютинация.
Характеристика роста культуры при повышенных концентрациях CO2:
хорошо растет при высоких концентрациях CO2, ингибирующих рост большинства других микроводорослей (характерная кривая роста представлена на Фиг.2). При этом культура фиксирует до 3 г/л в сутки углекислоты при содержании хлорофилла 100 мкг/л.
Биотехнологическая характеристика штамма.
Штамм Desmodesmus sp. 3Dp86E-1 обладает следующими ценными биотехнологическими характеристиками: интенсивный рост (Фиг.2 при высоких (20-100 об.%) концентрациях CO2 в газовоздушной смеси; биомассой, обогащенной нейтральными липидами, содержащими полиненасыщенные жирные кислоты (Фиг.3), и каротиноидами (до 90 мкг/г сухого веса клеток), пригодной для производства кормовых добавок.
Генотипирование.
Выделение ДНК.
Для выделения ДНК отбирали 5-10 мг биомассы культуры микроводоросли. Выделение ДНК проводили методом фенол-хлороформной экстракции. Перед выделением проводили трехкратное замораживание образцов при -4°C с последующим оттаиванием. Это было необходимо для разрушения прочных клеточных стенок водорослей. Образцы инкубировали в течение часа в 300 мкл TE буфера (10 mM Tris-Cl (pH 7.5), 1 mM EDTA), содержащего 10 мг/мл лизоцима при 37°C. Затем добавляли 2% додецилсульфата натрия и инкубировали в течение часа при 40°C и интенсивном перемешивании. Далее добавляли 1 М NaCl и оставляли на ночь на льду для высаливания белков. После чего проводили процедуру фенол-хлороформной экстракции. Чистоту образцов ДНК оценивали методом электрофореза в 1,5% агарозном геле. Полученные образцы ДНК хранили в TE-буфере при -4°C.
Множественное выравнивание.
Проведено множественное выравнивание известных нуклеотидных последовательностей Desmodesmus для участка генов 18S рибосомальной РНК, включающих в себя последовательности ITS1, ITS2 с использованием программы ClustalW.
Проведена ПЦР амплификация соответствующих участков геномной ДНК исследуемых изолятов. Продукты ПЦР очищены с использованием набора для очистки Cleanup Standard (Евроген, Россия) и отсеквенированы с использованием автоматического секвенатора. Для культуры получена последовательность нуклеотидов указанного участка как смысловой (Фиг.4), так и антисмысловой цепи ДНК.
При помощи программы BLAST в базе данных GenBank был проведен поиск ближайших гомологов исследуемых последовательностей. Наибольшее сходство наблюдалось с последовательностями генов 18S pРНК водорослей из родов Desmodesmus. При помощи полученного множественного выравнивания в программе ClustalW было построено филогенетическое дерево.
Филогенетический анализ.
В результате анализа, полученного в работе множественного выравнивания, имеющуюся последовательность можно отнести к роду Desmodesmus.
В результате проведенного филогенетического анализа установлена видовая принадлежность исследуемого изолята. Изолят идентифицирован как Desmodesmus sp. и получил идентификатор 3Dp86E-1; после депонирования в Российской Коллекции Микроводорослей при учреждении Российской Академии Наук Институте Физиологии Растений им. К.А. Тимирязева (IPPAS) ему присвоен идентификатор IPPAS C-2014.
Полученный сиквенс зарегистрирован в международной базе данных GenBank (http://www.ncbi.nlm.nih.gov/genbank/) под номером JQ313132.
Следующие материалы иллюстрируют достижение цели.
Скорость фиксации CO2 у культуры микроводорослей Desmodesmus sp. штамм 3Dp86E-1 составляет 2-3 г/л культуры в сутки, что в несколько раз превышает аналогичный показатель у прототипа при равной плотности инокулята, максимальная концентрация CO2 в газовоздушной среде составляет 100%, что в 10 раз выше, чем у прототипа, необходимая освещенность составляет 80 мкЕ/(м2*c), что приблизительно на 35% ниже, чем у прототипа, что также показывает экономическую привлекательность использования данного штамма по сравнению с аналогами.
Штамм микроводоросли Desmodesmus sp. 3Dp86E-1 успешно прошел предварительное тестирование и этап пробного культивирования в экспериментальных и полупромышленных фотобиореакторах объемом до 50 л. Таким образом, можно считать степень готовности штамма к масштабированию культуры для промышленного применения высокой.
В результате получен штамм микроводоросли Desmodesmus sp. 3Dp86E-1, депонированный в Российской Коллекции Микроводорослей при учреждении Российской Академии Наук Институте Физиологии Растений им. К.А. Тимирязева (IPPAS) с присвоенным идентификатором IPPAS C-2014, который обладает более высокими показателями фиксации CO2 и толерантностью к высоким концентрациям CO2 в среде культивирования, а также более высокой способностью к накоплению нейтральных липидов по сравнению с известными аналогами.
Штамм микроводорослей Desmodesmus sp., депонированный в Коллекции культур микроводорослей Института физиологии растений им К.А. Тимирязева РАН (IPPAS) под регистрационным номером IPPAS S-2014, для конверсии углекислоты из промышленных сбросных газов в сырье для производства биотоплива и кормовых добавок.