Члены связывания против il-1r1
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и иммунологии. Описаны различные варианты антител, специфические в отношении IL-1R1. Раскрытые антитела могут быть пригодны для лечения расстройств, опосредованных IL-1R1, включая ревматоидный артрит, астму, хроническое обструктивное заболевание легких (ХОЗЛ). Предложенная группа изобретений может быть использована в медицине. 13 н. и 8 з.п.ф-лы, 14 ил., 12 табл., 5 пр.
Реферат
Изобретение относится к членам связывания, особенно молекулам антитела, для рецептора-1 интерлейкина 1 (IL-1R1). Члены связывания применяются для лечения нарушений, опосредованных IL-1R1, включая ревматоидный артрит, астму и хроническое обструктивное заболевание легких (ХОЗЛ). Изобретение также относится к способам получения таких членов связывания, способам лечения нарушений, опосредованных IL-1R1 с применением членов связывания по изобретению, и применению членов связывания по изобретению для получения лекарственного средства для лечения нарушений, опосредованных IL-1R1.
Интерлейкин 1 (IL-1) является многофункциональным цитокином, который играет важную роль в воспалительных реакциях при иммуно-обусловленных заболеваниях и инфекциях. IL-1 продуцируется различными типами клеток после стимуляции бактериальными продуктами, цитокинами или иммунными комплексами. IL-1 демонстрирует аутокринную и паракринную активность в различных типах клеток, способствуя выработке медиаторов воспаления, таких как простагландины, оксид азота, цитокины, хемокины, металлопротеиназы и адгезивные молекулы. Блокада биологической активности IL-1 должна быть благоприятной для предотвращения повреждений тканей, вызванных чрезмерной выработкой или дисрегуляцией активности IL-1 или нормализацией аберрантных ответов на патогенные факторы, например, во время обострения ХОЗЛ.
Семейство цитокинов IL-1 на данный момент состоит из одиннадцати отдельных членов, IL 1 альфа (IL-1α), IL-1 бета (IL-1β), интерлейкин-18 (IL-18), антагонист интерлейкина 1 (IL-1Ra), IL1F5-10 и интерлейкин-33 (IL-33). Четыре из них, а именно: IL-1α, IL-1β, IL-18 и IL-1Ra (антагонист рецептора IL-1), охарактеризованы наиболее полно и связаны с патологическими процессами при различных заболеваниях, и IL-1α, IL-1β и IL-1Ra, как было показано, взаимодействуют с мембранным IL-1R1 (1, 2, 3). IL-1α и IL-1β являются продуктами отдельных генов. Эти белки связаны на аминокислотном уровне, IL-1α и IL-1β обладают 22% гомологии, в случае IL-1α и IL-1Ra степень гомологии составляет 18%. IL-1β обладает 26% гомологии с IL-1Ra. Гены для IL-1α, IL-1β и IL-1Ra членов находятся на аналогичных участках в человеческой хромосоме 2q14 (4, 5).
Как IL-1α, так и IL-1β синтезируются в виде предшественников пептидов с массой 31кДа, которые расщепляются для создания зрелых IL-1α и IL-1β размером 17кДа. IL-1β продуцируется с помощью различных типов клеток, включая эпителиальные клетки и макрофаги. Он высвобождается из клетки после расщепления цистеинпротеазой каспазой-1 (IL-1β преобразующий фермент (ICE) (6)). IL-1α расщепляется протеазой кальпаином и может оставаться на клеточной мембране, откуда он активирует клетки с помощью прямого контакта клетки с клеткой (7). Рrо-IL-1α содержит последовательность ядерной локализации на N-конце, что может привести к активации ряда клеточных путей (8).
IL-1Ra является естественным ингибитором IL-1. Он продуцируется в виде четырех различных изоформ, полученных путем альтернативного сплайсинга и альтернативной инициации трансляции. Секретируемая изоформа IL-1Ra размером 17 кДа экспрессируется в виде вариабельно гликозилированной формы, размером 22-25 кДа (9, 10), которая названа sIL-1Ra. Внутриклеточная изоформа размером 18 кДа называется icIL-1Ra1 (11). Изоформа icIL-1Ra2 продуцируется с помощью альтернативного транскрипционного сшивания с экзоном, расположенным между icIL-1Ra1 и sIL-1Ra первыми экзонами (12). Третья внутриклеточная изоформа icIL-1Ra3 размером 16 кДа также была определена (13). Кинерет® (анакинра) является рекомбинантной, негликозилированной формой растворимого антагониста человеческого рецептора интерлейкина-1 (IL-1Ra). Кинерет® отличается от природного человеческого IL-1Ra тем, что содержит один добавленный остаток метионина на N-конце. Кинерет® состоит из 153 аминокислот, и его молекулярная масса составляет 17,3 кДа. Кинерет® одобрен для лечения умеренного и тяжелого активного ревматоидного артрита.
IL-1α и IL-1β проявляют свои биологические эффекты через связывание с трансмембранным рецептором IL-1R1 (RefSeq NM_00877), который принадлежит к семейству рецепторов IL-1. В настоящее время найдены 10 членов семейства рецепторов IL-1 (14); IL-1 рецептор 1 (IL-1R1 (80 кДа)), IL-1RII (68 кДа) и IL-1 рецептор акцессорного белка (IL-1RacP), имеющие актуальное значение для проведения сигнала IL-1α и β. IL-1R1 и IL-1RacP образуют комплекс в клеточной мембране для формирования рецептора с высоким сродством, способного проводить сигнал при связывании с IL-1α и IL-1β. IL-1Ra связывается с IL-1R1, но не взаимодействует с IL-1RAcP. IL-1α, IL-1β и IL-1Ra также связываются с IL-RII, который не имеет внутриклеточного сигнального домена.
Все три этих рецептора могут быть экспрессированы как мембраносвязанные или растворимые белки. IL-1R типа I (IL-1R1), IL-1RII и IL-1R акцессорный белок (IL-1RAcP) принадлежат к суперсемейству гена иммуноглобулина (Ig), с внеклеточным участком, содержащим три Ig-подобных домена. IL-1R1 и IL-1RacP содержат цитоплазматические домены (Toll-подобные IL-1R (TIR) домены), которые связаны с суперсемейством Toll-подобных рецепторов (TLR). IL-1R1 называется сигнальным рецептором, который в результате связывания с лигандом и комплексообразования с IL-1RAcP инициирует трансдукцию сигнала через цитоплазматический концевой сегмент из 213 аминокислотных остатков (15). Современная литература указывает на то, что IL-1RII действует только как "рецептор-ловушка", на поверхности клетки или внеклеточно, как растворимая форма (16).
Кристаллическая структура внеклеточного участка IL-1R1 связана с IL-1β была проанализирована с разрешением 2,5А (17). Два N-конца Ig доменов образуют жесткие связи с дисульфидным линкером, для третьего домена показана большая пластичность. IL-1R1 является обернутым вокруг IL-1β, с двумя существенными поверхностями контакта. Одна из них находится в бороздке между доменами 1 и 2, а вторая поверхность контакта с меньшей площадью локализована на третьем домене. Любопытно, что IL-1Ra также является связанным с участком бороздки между доменами 1 и 2 IL-1R1, однако там не будет происходить каких-либо контактов между IL-1Ra и третьим доменом Ig IL-1R1 (18).
Если IL-1 связан с цепью IL-1R1, IL-1RAcP укрепляет пару «лиганд-рецептор» и формирует рецепторный комплекс с высоким сродством, что приводит к инициированию трансдукции сигнала.
Модель взаимодействия IL-1RAcP с IL-1-IL-1R1 была предложена на основе исследований мутагенеза и антитела (19, 20 и 21). Это указывает на то, что IL-1RAcP взаимодействует с поверхностью контакта между IL-1 и IL-1R1. Эти исследования также показали, что АсР не может взаимодействовать с парой IL-1Ra-IL-lRl, которая является более расслабленной структурой. Greenfeder и др., (22) показали, что IL-1R1 связанный с IL-1Ra не в состоянии укреплять IL-1RacP, и поэтому не в состоянии передавать сигнал. ILRa действует, занимая сайт связывания на IL-1R1 для IL-1β и IL-1α и, кроме того, неспособен формировать сигнальный комплекс с IL-1RAcP.
Еще одним членом семейства IL-1R является тип II IL-1R (IL-1RII). Этот рецептор обладает высокой степенью гомологии с IL-1R1 во внеклеточном участке и может связываться с IL-1α и IL-1β. Существующие данные свидетельствуют о том, что IL-1RII, несмотря на это, не инициирует передачу сигнала, за неимением внутрицитоплазматического домена. Этот рецептор может быть расщеплен на поверхности клетки и вместе с мембранной формой выполнять функцию ингибиторов активности IL-1, выступая в качестве рецептора-ловушки (16). IL-1RII обладает высоким сродством к IL-1β и низким сродством к IL-1Ra, и это означает, что IL-1RII не блокирует ингибирующую активность IL-1Ra (23). Лиганд связывания для IL-1RII является причиной рекрутмента IL-1RAcP, однако этот комплекс остается без передачи сигнала (24). Поскольку IL-1RAcP устранен таким образом на IL-1RII и предотвращает IL-1RAcP связывание с IL-1R1, он может также блокировать действие IL-1 по этому механизму, что называется "корецепторной конкуренцией" (24). Однако, не было окончательно опровергнуто на данный момент, что IL-1RII может участвовать и в других цепях передачи сигнала, хотя клетки, которые экспрессируют высокие уровни IL-1RII, становятся нечувствительными к IL-1β (25).
Формирование комплекса с высоким сродством при связывании IL-1 с IL-1R1 приводит к формированию IL-1RAcP и инициации рецепторов передачи сигнала. IL-1R1 и IL-1RacP содержат цитоплазматические домены (Toll-подобные IL-1R (TIR) домены), которые связаны с суперсемейством Toll-подобного рецептора (TLR).
Во время трансдукции сигнала домен TIR адаптерной молекулы MyD88, взаимодействует с доменом TIR IL-1RAcP и вызывает формирование рецепторного комплекса, содержащего IRAK-4 и IRAK-1. Было предположено, что фосфорилированный IRAK, в свою очередь, вовлекает TRAF6 в рецепторный комплекс.Далее IRAK переносит TRAF6 к ТАК1, ТАВ1 и ТАВ2, которые тесно связаны на мембране до инициации формирования мембраносвязанного комплекса II. Формирование комплекса II приводит к фосфорилированию ТАК1 и ТАВ2 на мембране с помощью неизвестной киназы, с последующей диссоциацией TRAF6-TAK1-TAB1-ТАВ2 (комплекс III) от IRAK, что приводит в результате к транслокации комплекса III в цитозоле. Формирование комплекса III и его взаимодействие с дополнительными цитозольными факторами приводит к активации ТАК1. Фосфорилированный IRAK остается на мембране и в конечном итоге поддается убиквитинированию и расщеплению. Активация ТАК-1 приводит к активации IKK, расщеплению белков IkB, что приводит к активации NF-кВ, который активирует транскрипцию в ядре. Было также показано, что ТАК-1 играет роль в активации пути митоген-активированной протеинкиназы (МАРК), которая через активацию р38, INK и ERK1/2 регулирует активность транскрипционных факторов, включая AP1 (26). Поскольку проведение сигнала усиливается вниз по этим многоступенчатым путям, процент рецепторов, заполненных только лигандом, на клетку тоже должен быть низким для инициации физиологических реакций в экспрессирующих IL-1R клетках (возможно, всего 10 заполненных рецепторов на клетку).
IL-1 является одним из основных воспалительных цитокинов, которые играют важную роль во многих хронических воспалительных заболеваниях. Экспрессия IL-1 на уровне гена и белка была изучена при различных заболеваниях. Повышение уровней IL-1 было зарегистрировано при диабете 2 типа (27, 28, 29), солидных опухолях при ВИЧ-1, лейкозе, болезни Альцгеймера, ишемической болезни (30) и атеросклерозе (31), астме, ХОЗЛ и остеоартрите (32). С помощью разнообразных исследований in vitro и in vivo было показано, что IL-1 проявляет многочисленные биологические эффекты. Его плейотропное действие связанно с его важной ролью в экспрессии генов различных медиаторов воспаления, включая простаноиды, оксид азота, цитокины, хемокины, протеазы, молекулы адгезии и цитокины рецепторов экспрессии (32). Чрезмерная выработка или экспрессия этих медиаторов воспаления связана с патогенезом заболеваний, а также ремоделированием и разрушением тканей. Таким образом, IL-1 представляет собой ключевую терапевтическую мишень при многих распространенных воспалительных заболеваниях, таких как ревматоидный артрит, остеоартроз (ОА), бронхиальная астма и хроническое обструктивное заболевание легких (ХОЗЛ), сахарный диабет 2 типа, ишемическая болезнь и атеросклероз.
В настоящем изобретении предлагаются члены связывания, которые связываются с IL-1R1 и подавляют биологическую активность IL-1α и/или IL-1β, включая полностью человеческие антитела или антигенсвязывающие их части.
Члены связывания, направленные на IL-1R1, раскрыты в следующих международных патентных заявках: WO 2004/022718, WO 2005/023872, WO 2007/063311, WO 2007/063308 и WO 2006/059108.
В другом варианте изобретения предлагается выделенный член связывания, например, антитело, специфичное в отношении IL-1R1, которое конкурирует с IL-1Ra за связывание с IL-1R1.
В другом варианте изобретения предлагается выделенный член связывания, специфичный в отношении IL-1R1, который конкурирует с IL-1 и IL-1Ra за связывание с IL-1R1, и связывается с IL-1R1 с KD 10 пМ или менее, по данным Kinexa™. В одном из вариантов IL-1 имеет отношение к IL-1α, в другом варианте IL-1 имеет отношение к IL-1β. В другом варианте IL-1 имеет отношение к IL-1α и к IL-1β.
Антитела, которые блокируют связывание как IL-1, так и IL1Ra, считаются особенно эффективными. В отсутствие IL-1 IL-1R1 интернализируется с t1/2 около 11 час, однако в присутствии рецепторов IL-1 происходит более быстрая интернализация, таким образом, что t1/2 составляет примерно 1,5 часа [33, 34]. Напротив, IL-1Ra связывается с IL-1R1, но не вызывает увеличения интернализации рецептора [35]. Когда IL-1R1 является интернализированным, его нелегко вернуть обратно к поверхности мембраны [33], таким образом, вполне возможно, что антитела, которые связываются с эпитопом, сходным с собственно IL-1, могут быть легко интернализированы, и таким образом, могут быть направлены в эндосомальные пути и подвергаться клиренсу с высокой скоростью с помощью этого опосредованного рецептором механизма клиренса. Антитела к эпитопам, более сходным с IL-1 ra, могут быть менее восприимчивы к увеличению скорости интернализации рецепторов и могут не подвергаться усиленному клиренсу с помощью опосредованного рецептором механизма, и поэтому с большей вероятностью могут демонстрировать клиренс из кровотока и период полувыведения, характерные для человеческого IgG. В международной патентной заявке WO 2004/022718 раскрыт класс антител, которые блокировали связывание как IL-1, так и IL-1Ra с IL-1R1, однако, этот класс является гораздо менее эффективным, чем предпочтительный класс раскрытых антител, которые связываются с третьим доменом IL-1R и предотвращают связывание с IL-1β. Напротив, антитела по данному изобретению способны блокировать связывание IL-1 и IL-1Ra с IL-1R1 и связываться с IL-1R1 с высоким сродством.
В другом варианте изобретения предлагается выделенный член связывания, специфичный в отношении IL-1R1, демонстрирующий среднее значение IC50, для, по крайней мере, 6 разных доноров, менее 1 нМ для ингибирования индуцированной IL-1β выработки IL-6 в цельной человеческой крови в присутствии 30 пМ IL-1β. В других вариантах, среднее значение IC50 получено для, по крайней мере, 10, 15 или 20 различных доноров. В других вариантах средне значение IC50 составляет менее 800 пМ, менее 700 пМ, менее 600 пМ, менее 500 пМ, менее 400 пМ, менее 300 пМ, менее 300 пМ, менее 200 пМ, менее 100 пМ или менее 50 пМ.
Члены связывания по изобретению связываются с IL-1R1 и нейтрализуют IL-1R1 с высокой эффективностью. Нейтрализация обозначает ингибирование биологической активности IL-1R1. Члены связывания по изобретению могут нейтрализовать один или несколько видов биологических активности IL-1R1, как правило, члены связывания по изобретению ингибируют связывание IL1α и IL1β с IL-1R1.
Члены связывания по изобретению могут также связываться и нейтрализовать нечеловеческий IL-1R1, это ортолог IL-1R1, который встречается в природе в других видах, исключая человека.
Члены связывания по изобретению, как правило, специфичны в отношении IL-1R1 по сравнению с другими белками, и, таким образом, выборочно связываются с IL-1R1. Такая избирательность может быть определена или продемонстрирована, например, в стандартном анализе конкуренции.
Соответствующие тесты для измерения нейтрализации IL-1R1 путем связывания с членами по изобретению включают, например, лиганд-рецепторные биохимические тесты и поверхностный плазменный резонанс (SPR) (например, BIACORE™).
Кинетика и сродство связывания (выраженное в виде равновесной константы диссоциации KD) IL-1R1 с членом связывания для человеческого IL-1R1 могут быть определены, например, с помощью поверхностного плазменного резонанса (BIACORE™). Члены связывания по изобретению обычно обладают сродством к человеческому IL-1R1 (KD) менее приблизительно 1 нМ, а в некоторых вариантах KD менее приблизительно 100 мкМ, в других вариантах KD менее 50 пМ, в других вариантах KD менее 25 пМ, в других вариантах KD менее 10 пМ, в других вариантах KD менее 5 пМ, в других вариантах KD менее 3 пМ, в других вариантах kd менее 1 пМ.
Существует ряд методик для измерения сродства связывания антитела с антигенами, одной из таких методикой является KinExA™. Кинетический анализ исключения (KinExA™) является многоцелевой платформой иммуноанализа (с использованием проточного спектрофлуориметра), что позволяет измерять равновесные константы диссоциации и ассоциации и константы скорости диссоциации для взаимодействия антиген/антитело. Поскольку KinExA™ выполняется после достижения равновесия, это подходящий способ выполнения, используемый для измерения KD взаимодействия с высоким сродством, где скорость диссоциации для взаимодействия может быть очень медленной. Использование KinExA™ особенно уместно в данном случае, когда сродство антитела и антигена выше, чем можно точно предсказать по методу поверхностного плазменного резонанса. Методика KinExA™ может быть проведена, как описано в Drake et al (2004) Analytical Biochemistry 328, 35-43.
В одном из вариантов изобретения члены связывания по изобретению являются специфичными в отношении IL-1R с KD 300 пМ или ниже, по данным измерения с помощью методики KinExA™. Как вариант, KD равна 200 пМ или ниже, 100 пМ или ниже, 50 пМ или ниже, 20 пМ или ниже, или 10 пМ или ниже, 5 пМ или ниже, 3 пМ или ниже, 1 пМ или ниже.
Ингибирование биологической активности может быть частичным или полным. Члены связывания могут ингибировать биологическую активность IL-1R1, такую как индуцированное IL-1β высвобождение IL-8 в клетках CYNOM-K1, или индуцированное IL-1α и IL-1β высвобождение IL-8 в клетках HeLa, на 100%, или, альтернативно, не менее 95%, не менее 90%, не менее 85%, не менее 80%, не менее 75%, не менее 70%, не менее 60% или не менее 50% от активной концентрации IL-1α или β, которая индуцирует 50% или 80% от максимально возможной активности в отсутствие члена связывания.
Нейтрализующая способность членов связывания, как правило, выражается как значение IC50, в нМ, если не указано иное. В функциональных тестах, IC50 является концентрацией члена связывания, снижающей биологическую реакцию на 50% от максимальной. В исследованиях связывания с лигандом, IC50 является концентрацией, которая уменьшает связывание с рецептором на 50% от максимального уровня специфичного связывания. Значение IC50 может быть рассчитано путем построения зависимости % максимальной биологической реакции, как логарифмической функции, от концентрации членов связывания, с использованием программного обеспечения, такого как Prism (GraphPad Software Inc, Ла-Хойя, Калифорния, США), для перевода сигмоидальной функции в данные для генерации значений IC50. Эффективность может быть определена или измерена с помощью одного или нескольких тестов, известных специалисту, и/или как описано или упомянуто в данном описании. Эффективность нейтрализации членом связывания может быть выражена как геометрическое среднее значение (Geomean).
Нейтрализация активности IL-1R1 членом связывания в тесте, описанном в данном описании, означает, что член связывания связывается и нейтрализует IL-1R1. Другие способы, которые могут быть использованы для определения связывания IL-1R1 с членом связывания, включают ELISA, Вестерн-блоттинг, иммунопреципитацию, аффинную хроматографию и биохимические тесты.
Член связывания по изобретению может обладать таким же или более сильным сродством к человеческому IL-1R1, чем к IL-1R1 других видов. Сродство члена связывания к человеческому IL-1R1 может быть аналогичным или, например, в 5 или 10 раз превышать сродство к IL-1R1 яванского макака. Кроме того, член связывания может обладать аналогичным сродством к IL-1R1 человека и яванского макака.
Член связывания по изобретению включает обязательный мотив IL-1R1, содержащий один или нескольких участков CDR, например, "множество CDR" в структуре. Множество CDR состоит из одного или нескольких участков, выбранных из CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3. В одном из вариантов множество CDR включает HCDR3 из табл.2, дополнительно скомбинированый с одним или несколькими CDR, выбранными из: HCDR1, HCDR2, LCDR1, LCDR2 и LCDR3, например, одним или несколькими CDR, выбранными из: HCDR1, HCDR2, LCDR1, LCDR2 и LCDR3 из табл.2. В другом варианте изобретения множество CDR, содержащих HCDR3 и LCDR3 из табл.2, дополнительно скомбинировано с одним или несколькими CDR, выбранными из: HCDR1, HCDR2, LCDR1 и LCDR2, например, один или несколько выбранных из CDR: HCDR1, HCDR2, LCDR1 и LCDR2 в табл.2. В другом варианте изобретения множество CDR состоит из HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3 табл.2. Хотя это является предпочтительным для выбора одного или нескольких CDR из одного и того же антитела в табл.2, CDR может быть выбран из одного или нескольких антител, перечисленных в табл.2.
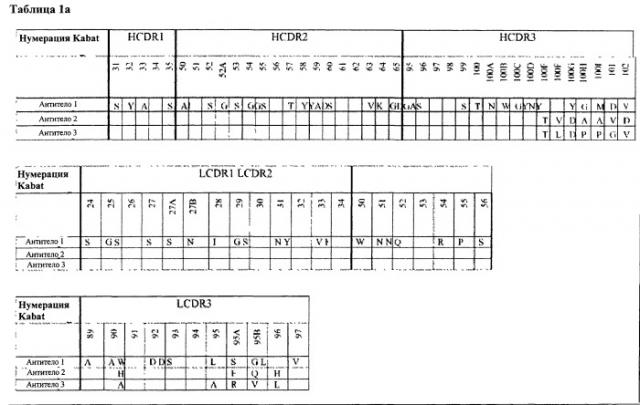
В другом варианте член связывания по изобретению, например, антитело, состоит из мотива связывания IL-1R1, включая один или несколько участков, выбранных из CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3, например, как указано в табл.1а и 1b, в которых указанный член связывания специфично связывается с IL-1R1.
В другом варианте член связывания по изобретению, например, антитело, состоит из мотива связывания IL-1R1, включая один или несколько участков выбранных из CDR: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3, например, как указано в табл.1а и 1b, в которых указанный член связывания специфично связывается с IL-1R1 и конкурирует с IL-1β и IL-1Ra за связывание с IL-1R1, и связывается с IL-1R1 с KD 10 пМ или менее, по данным измерения с помощью KinExA™.
Как описано в данном описании, была выделена исходная молекула антитела, содержащая множество последовательностей участков CDR, как показано в табл.1 (см. Антитело 1). В рамках процесса оптимизации мы получили панель клонов антитела, пронумерованных 2-3, с участками CDR последовательности, полученными из гибридной последовательности CDR, с изменениями в положениях, указанных в табл.1. Так, например, как видно из табл.1а, Антитело 2 содержит гибридный HCDR1, HCDR2, LCDR1 и LCDR2, и гибридную последовательность HCDR3, в которой: остаток Kabat 100E заменен на Т, остаток Kabat 100F заменен на V, остаток Rabat 100G заменен на D, остаток Kabat 100H заменен на А, остаток Kabat 100I заменен на А, остаток Kabat 101 заменен на V и остаток Kabat 102 заменен на D.
Как описано в данном описании, была выделена вторая исходная молекула антитела, содержащая множество последовательностей участков CDR, как показано в табл.1b (см. Антитело 4). В рамках процесса оптимизации мы получили панель клонов антитела, пронумерованных 5-10, с последовательностями участков CDR, полученными из гибридной последовательности CDR, с изменениями в положениях, указанных в табл.1b. Например, как видно из табл.1b, Антитело 5 содержит исходные HCDR1, HCDR2, LCDR1 и LCDR2, и исходную последовательность HCDR3, в которой: остаток Kabat 100А заменен на А, остаток Kabat 100В заменен на Р, остаток Kabat 100С заменен на Р, остаток Kabat 100D заменен на Р, остаток Kabat 100E заменен на L, остаток Kabat 100F заменен на G, и остаток Kabat 100I заменен на G. Как видно из табл.1b, Антитело 6 содержит исходную последовательность HCDR1, HCDR2, LCDR1 и LCDR2, и исходную HCDR3, в которой: остаток Kabat 100A заменен на Е, остаток Kabat 100В заменен на Q, остаток Kabat 100C заменен на Y, остаток Kabat 100D заменен на G, остаток Kabat 100E заменен на V, остаток Kabat 100F заменен на V, остаток Kabat 100J был удален, остаток Kabat 101 заменен на F и остаток Kabat 102 заменен на V.
Описанный в данном описании, является членом связывания, содержащим множество исходных CDR, как показано в табл.1 (Антитело 1), где HCDR1 является SEQ ID NO: 93 (остатки Kabat 31-35), HCDR2 является SEQ ID NO: 94 (остатки Kabat 50-65), HCDR3 является SEQ ID NO: 95 (остатки Kabat 95-102), LCDR1 является SEQ ID NO: 98 (остатки Kabat 24-34), LCDR2 является SEQ ID NO: 99 (остатки Kabat 50-56) и LCDR3 является SEQ ID NO: 100 (остатки Kabat 89-97). Член связывания в соответствии с изобретением может также быть исходным членом связывания (Антитело 1), как показано в табл.1, где один или несколько CDR содержат одно или несколько добавление, замен, делеций и/или вставок аминокислот. В некоторых вариантах, член связывания включает множество CDR, содержащих от 1 до 12 добавлений, замен, делеций и/или вставок по отношению к исходной последовательности Антитела 1. В другом варианте содержится от 1 до 10 добавлений, замен, делеций и/или вставок относительно Антитела 1. В другом варианте содержится от 1 до 5 добавлений, замен, делеций и/или вставок по отношению к исходной последовательности Антитела 1. В другом варианте содержится от 1 до Зрех добавлений, замен, делеций и/или вставок относительно Антитела 1.
В некоторых вариантах член связывания по изобретению включает HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, и LCDR3; где HCDR3 содержит аминокислотную последовательность SEQ ID NO: 95, дополнительно включающую от 1 до 7 добавлений, замен, делеций и/или вставок аминокислот; и LCDR3 содержит аминокислотную последовательность SEQ ID NO: 100, дополнительно включающую от 1 до 5 добавлений, замен, делеций и/или вставок аминокислот. В таких вариантах HCDR1 может содержать аминокислотную последовательность SEQ ID NO: 93; HCDR2 может содержать аминокислотную последовательность SEQ ID NO: 94; LCDR1 может содержать аминокислотную последовательность SEQ ID NO: 98 и LCDR2 может содержать аминокислотную последовательность SEQ ID NO: 99. Кроме того, HCDR1, HCDR2, LCDR1, и LCDR2 могут также совместно содержать одно или несколько добавлений, замен, делеций и/или вставок аминокислот по отношению к исходной последовательности (Антитело 1), например, от 1 до 10 замен.
В данном описании описан член связывания, содержащий множество исходных CDR, как показано в табл.1b (Антитело 4), где HCDR1 является SEQ ID NO: 103 (остатки Kabat 31-35), HCDR2 является SEQ ID NO: 104 (остатки Kabat 50-65), HCDR3 является SEQ ID NO: 105 (остатки Kabat 95-102), LCDR1 является SEQ ID NO: 108 (остатки Kabat 24-34), LCDR2 является SEQ ID NO: 109 (остатки Kabat 50-56) и LCDR3 является SEQ ID NO: 110 (остатки Kabat 89-97). Член связывания в соответствии с изобретением может также быть исходным членом связывания, как показано в табл.1b, где один или несколько CDR включают одно или несколько добавлений, замен, делеций и/или вставок аминокислот. В некоторых вариантах член связывания включает множество CDR, содержащих от 1 до 15 добавлений, замен, делеций и/или вставок по отношению к исходной последовательности Антитела 4. В другом варианте содержится от 1 до 10 добавлений, замен, делеций и/или вставок относительно Антитела 4. В другом варианте содержится от 1 до 5 добавлений, замен, делеций и/или вставок по отношению к исходной последовательности Антитела 4. В другом варианте содержится от 1 до 3 добавлений, замен, делеций и/или вставок относительно Антитела 4.
В некоторых вариантах член связывания по изобретению включает HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, и LCDR3; где HCDR3 содержит аминокислотную последовательность SEQ ID NO: 105, дополнительно содержащую от 1 до 9 добавлений, замен, делеций и/или вставок аминокислот; и LCDR3 содержит аминокислотную последовательность SEQ ID NO: 110, дополнительно содержащую от 1 до 6 добавлений, замен, делеций и/или вставок аминокислот. В таких вариантах HCDR1 может содержать аминокислотную последовательность SEQ ID NO: 103; HCDR2 может содержать аминокислотную последовательность SEQ ID NO: 104; LCDR1 может содержать аминокислотную последовательность SEQ ID NO: 108; и LCDR2 может содержать аминокислотную последовательность SEQ ID NO: 109. Кроме того, HCDR1, HCDR2, LCDR1, и LCDR2 могут также совместно содержать одно или несколько добавлений, замен, делеций и/или вставок аминокислот по отношению к исходной последовательности (Антитело 4), например, от 1 до 10 замен.
В данном описании описан член связывания, содержащий множество CDR Антитела 6, как показано в табл.1b, в котором HCDR1 является SEQ ID NO: 63 (остатки Kabat 31-35), HCDR2 является SEQ ID NO: 64 (остатки Kabat 50-65), HCDR3 является SEQ ID NO: 65 (остатки Kabat 95-102), LCDR1 является SEQ ID NO: 68 (остатки Kabat 24-34), LCDR2 является SEQ ID NO: 69 (остатки Kabat 50-56) и LCDR3 является SEQ ID NO: 70 (остатки Kabat 89-97). Член связывания в соответствии с изобретением может быть также членом связывания Антитела 6, как показано в табл.1b, в котором один или несколько CDR содержат одно или несколько добавлений, замен, делеций и/или вставок аминокислот. В некоторых вариантах член связывания включает множество CDR, содержащих от 1 до 17 добавлений, замен, делеций и/или вставок по отношению к последовательности Антитела 6. В другом варианте содержится от 1 до 10 добавлений, замен, делеций и/или вставок относительно Антитела 6. В другом варианте содержится от 1 до 5 добавлений, замен, делеций и/или вставок по отношению к последовательности Антитела 6. В другом варианте содержится от 1 до 3 добавлений, замен, делеций и/или вставок относительно Антитела 6. В другом варианте содержится от 1 до 2 добавлений, замен, делеций и/или вставок относительно Антитела б. В другом варианте содержится одно добавление, замена, делеция или вставка относительно Антитела 6.
В некоторых вариантах член связывания по изобретению включает HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, и LCDR3; где HCDR3 содержит аминокислотную последовательность SEQ ID NO: 65, дополнительно содержащую от 1 до 11 добавлений, замен, делеций и/или вставок аминокислот; и LCDR3 содержит аминокислотную последовательность SEQ ID NO: 70, дополнительно содержащую от 1 до 6 добавлений, замен, делеций и/или вставок аминокислот. В таких вариантах HCDR1 может содержать аминокислотную последовательность SEQ ID NO: 63; HCDR2 может содержать аминокислотную последовательность SEQ ID NO: 64; LCDR1 может содержать аминокислотную последовательность SEQ ID NO: 68; и LCDR2 может содержать аминокислотную последовательность SEQ ID NO: 69. Кроме того, HCDR1, HCDR2, LCDR1, и LCDR2 могут также совместно содержать одно или несколько аминокислотных добавлений, замен, делеций и/или вставок по отношению к последовательности Антитела 6, как например, от одной до десяти замен.
Член связывания по изобретению может содержать одно или сочетание участков CDR, как описано в данном описании. Например, член связывания по изобретению может включать HCDR1 с аминокислотной последовательностью SEQ ID NO: 93; HCDR2 с аминокислотной последовательностью SEQ ID NO: 94; HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 95, 5 или 125; LCDR1 с аминокислотной последовательностью SEQ ID NO: 98; LCDR2 с аминокислотной последовательностью SEQ ID NO: 99; и LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 100, 10 или 130.
Член связывания по изобретению может содержать один или сочетание участков CDR, как описано в данном описании. Например, член связывания по изобретению может включать HCDR1 с аминокислотной последовательностью SEQ ID NO: 103; HCDR2 с аминокислотной последовательностью SEQ ID NO: 104; HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 105, 15, 65, 25, 35, 75, 45, 115, 55 или 85; LCDR1 с аминокислотной последовательностью SEQ ID NO: 108; LCDR2 с аминокислотной последовательностью SEQ ID NO: 109; и LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 110, 20, 70, 30, 40, 80, 50, 120, 60 или 90.
Член связывания по изобретению может содержать один или сочетание участков CDR, как описано в данном описании. Например, член связывания по изобретению может включать HCDR1 с аминокислотной последовательностью SEQ ID NO: 93; HCDR2 с аминокислотной последовательностью SEQ ID NO: 94; HCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 95, 5, 125, 105, 15, 65, 25, 35, 75, 45, 115, 55 или 85; LCDR1 с аминокислотной последовательностью SEQ ID NO: 98 или 108; LCDR2 с аминокислотной последовательностью SEQ ID NO: 99 или 109; и LCDR3 с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 100, 10, 130, 110, 20, 70, 30, 40, 80, 50, 120, 60 или 90.
В некоторых вариантах член связывания или домен VH по изобретению содержит HCDR3 (SEQ ID NO: 95) Антитела 1 с одной или несколькими из следующих замен или делеций:
остаток Kabat 100Е, замененный на Т;
остаток Kabat 100F, замененный на V или L;
остаток Kabat 100G, замененный на D;
остаток Kabat 100H, замененный на А или Р;
остаток Kabat 1001, замененный на А или Р;
остаток Kabat 101, замененный на V или G;
остаток Kabat 102, замененный на D или V;
В некоторых вариантах член связывания или домен VH по изобретению содержит HCDR3 (SEQ ID NO: 105) Антитела 4 с одной или несколькими из следующих замен или делеций:
остаток Kabat 100А, замененный на А или Е;
остаток Kabat 100В, замененный на Р, Q, или А;
остаток Kabat 100C, замененный на Р, Y, S или L;
остаток Kabat 100D, замененный на Р, G или А;
остаток Kabat 100Е, замененный на L или V;
остаток Kabat 100F, замененный на G, V или Р;
остаток Kabat 100G, замененный на V;
остаток Kabat 100Н, замененный на Y;
остаток Kabat 100I, замененный на G или D;
остаток Kabat 100J, замененный на А или удаленный;
остаток Kabat 101, замененный на F;
остаток Kabat 102, замененный на V.
В некоторых вариантах член связывания или его домен VL может содержать LCDR3 (SEQ ID NO 100) Антитела 1 с одной или несколькими из следующих замен:
остаток Kabat 94, замененный на А или Н;
остаток Kabat 95, замененный на А;
остаток Kabat 95A, замененный на Е или R;
остаток Kabat 95В, замененный на Q или V;
остаток Kabat 97, замененный на Н или L.
В некоторых вариантах член связывания, или его домен VL может содержать LCDR3 (SEQ ID NO 110) Антитела 4 с одной или несколькими из следующих замен:
остаток Kabat 94, замененный на А, V, D, Н, L или R;
остаток Kabat 95, замененный на G, R или А;
остаток Kabat 95A, замененный на G, L, А, V или D;
остаток Kabat 95В, замененный на Н, R, А или D;
остаток Kabat 96, замененный на Н, Р и А.
остаток Kabat 97, замененный на Н, V или Q.
В некоторых вариантах член связывания или домен VH по изобретению содержит HCDR3 (SEQ ID NO: 65) Антитела 6 с одной или несколькими из следующих замен или добавлений:
остаток Kabat 100А, замененный на G или А;
остаток Kabat 100В, замененный на S, Р или А;
остаток Kabat 100C, замененный на D, Р, S или L;
остаток Kabat 100D, замененный на Y, Р или А;
остаток Kabat 100Е, замененный на Т или L;
остаток Kabat 100F, замененный на Т, G или Р;
остаток Kabat 100G, замененный на V;
остаток Kabat 100Н, замененный на Y;
остаток Kabat 100I, замененный на G или D;
остаток Kabat 100J удален в Антителе 6, восстановлен как А или F;
остаток Kabat 101, замененный на D;
остаток Kabat 102, замененный на I.
В некоторых вариантах член связывания или его домен VL может содержать LCDR3 (SEQ ID NO 70) Антитела 6 с одной или несколькими из следующих замен:
остаток Kabat 94, замененный на S, А, D, Н, L или R;
остаток Kabat 95, замененный на L, G или А;
остаток Kabat 95A, замененный на S, G, А, V или D;
остаток Kabat 95В, замененный на G, R, или D;
остаток Kabat 96, замененный на S, Р или А.
остаток Kabat 97, замененный на L, Н или Q.
В одном из вариантов изобретения содержится член связывания, включающий множество участков CDR, в том числе: HCDR1 с аминокислотной последовательностью SEQ ID NO: 3, HCDR2 с аминокислотной последовательностью SEQ ID NO: 4, HCDR3 с аминокислотной последовательностью SEQ ID NO: 5, LCDR1 с аминокислотной последовательностью SEQ ID NO: 8, LCDR2 с аминокислотной последовательностью SEQ ID NO: 9 и LCDR3 с аминокислотной последовательностью SEQ ID NO: 10.
В одном из вариантов изобретения содержится член связывания, включающий множество CDR, в том числе: HCDR1 с аминокислотной последовательностью SEQ ID NO: 63, HCDR2 с аминокислотной последовательностью SEQ ID NO: 64, HCDR3 с аминокислотной последовательностью SEQ ID NO: 65, LCDR1 с аминокислотной последовательностью SEQ ID NO: 68, LCDR2 с аминокислотной последовательностью SEQ ID NO: 69 и LCDR3 с аминокислотной последовательностью SEQ ID NO: 70.
В одном из вариантов изобретения содержится член связывания, включающий множество CDR, в том числе: HCDR1 с аминокислотной последовательностью SEQ ID NO: 23, HCDR2 с аминокислотной последовательностью SEQ ID NO: 24, HCDR3 с аминокислотной последовательностью SEQ ID NO: 25, LCDR1 с аминокислотной последовательностью SEQ ID NO: 28, LCDR2 с аминокислотной последовательностью SEQ ID NO: 29 и LCDR3 с аминокислотной последовательностью SEQ ID NO: 20.
В одном из вариантов изобретения содержится член связывания, включающий множество CDR, в том числе: HCDR1 с аминокислотной последовательностью SEQ ID NO: 113, HCDR2 с аминокислотной последовательностью SEQ ID NO: 114, HCDR3 с аминокислотной последовательностью SEQ ID NO: 115, LCDR1 с аминокислотной последовательностью SEQ ID NO: 118, LCDR2 с аминокислотной последовательностью SEQ ID NO: 119 и LCDR3 с аминокислотной последовательностью SEQ ID NO: 120.
В одном из вариантов изобретения содержится член связывания, включающий множество CDR, в том числе: HCDR1 с аминокислотной последовательностью SEQ ID NO; 53, HCDR2 с аминокислотной последовательностью SEQ ID NO: 54, HCDR3 с аминокислотной последовательностью SEQ ID NO: 55, LCDR1 с аминокислотной последовательностью SEQ ID NO: 58, LCDR2 с аминокислотной последовательностью SEQ ID NO: 59 и LCDR3 с аминокислотной последовательностью SEQ ID NO: 60.
Член связывания по изобретению может быть единственным, который конкурирует или перекрестно конкурирует за связывание с IL-1R1 с каким-либо членом связывания, описанным в данном описании, где оба связываются с IL-1R1 и включают элемент связывания, такой как домен VH и/или VL CDR, например, HCDR3, и/или множество CDR, описанных в данном описании, например, антитела, раскрытые в табл.2. Конкуренция между членами связывания может быть проанализирована с легкостью in vitro, например, с помощью ELISA и/или с помощью меченой специфической молекулы репортера одного их членов связывания, которая может быть обнаружена в присутствии одного или нескольких других немеченых членов связывания, чтобы можно было установить члены связывания, которые связывают