Культура плюрипотентных стволовых клеток на микроносителях
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Раскрыт способ выращивания эмбриональных стволовых клеток человека. Способ предусматривает прикрепление популяции клеток к микроносителю в среде, содержащей ингибитор Rho-киназы. Далее проводят культивирование клеток, отделение клеток от микроносителя и прикрепление полученных клеток ко второму микроносителю в среде, содержащей ингибитор Rho-киназы. Изобретение может быть использовано в медицине. 6 з.п. ф-лы, 48 ил., 3 табл., 11 пр.
Реферат
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
В рамках настоящего изобретения истребуется приоритет заявки с серийным номером 61/116447, поданной 20 ноября 2008 года.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам выращивания, размножения и дифференцирования плюрипотентных стволовых клеток на микроносителях.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Плюрипотентные стволовые клетки, например эмбриональные стволовые клетки, имеют способность дифференцировать во все типы взрослых клеток. Таким образом, эмбриональные стволовые клетки могут являться источником резервных клеток и тканей для органов, поврежденных в результате заболевания, инфекции или врожденных аномалий. Реализация потенциальных возможностей использования эмбриональных стволовых клеток в качестве источника резервных клеток осложняется особенностями их размножения in vitro с сохранением плюрипотентности.
Существующие способы выращивания недифференцированных эмбриональных стволовых клеток требуют использования сложных условий культивирования, например культивирования эмбриональных стволовых клеток в присутствии слоя питающих клеток. В альтернативном варианте для культивирования эмбриональных стволовых клеток может использоваться среда, подвергнутая действию питающих клеток. В системах для культивирования, в которых реализованы указанные способы, нередко применяются клетки, полученные из организма другого вида по отношению к организму, чьи стволовые клетки культивируются (ксеногенные клетки). Кроме того, в эти культуральные среды может вводиться животная сыворотка.
Эмбриональные стволовые клетки обладают большим потенциалом для научно-исследовательской работы и скрининга лекарственных препаратов. В настоящее время крупномасштабное культивирование линий эмбриональных стволовых клеток человека представляет большие проблемы и связано со значительными трудностями. По существующим способам плюрипотентные стволовые клетки выращивают in vitro в культуральных флаконах, на плоских поверхностях, покрытых белками экстраклеточного матрикса (ЭКМ) или питающими клетками. При культивировании на плоскости необходимо часто пересевать клетки, поскольку ограниченная площадь не позволяет выращивать плюрипотентные стволовые клетки в течение долгого времени. Решением могут стать способы культивирования плюрипотентных стволовых клеток, основанные на использовании микроносителей. Микроносители имеют высокое отношение поверхности к объему, и, следовательно, снимается ограничение площади поверхности, характерное для выращивания плюрипотентных стволовых клеток на плоских поверхностях.
Например, в работе Fok et al. описаны культуральные системы для выращивания недифференцированных эмбриональных стволовых клеток (ЭСК) с перемешиванием суспензионных культур на микроносителе и агрегатных культур (Stem Cells 2005; 23: 1333-1342).
В другом примере Abranches et al. описал тестирование микропористого микроносителя Cytodex 3® (GE Healthcare Life Sciences, Нью Джерси, США), изготовленного из декстранового матрикса с коллагеновым слоем на поверхности, на предмет возможности выращивания мышиных ЭС клеток линии S25 в ротационных колбах (Biotechnol. Bioeng. 96 (2007), pp. 1211-1221).
В другом примере (патент № US20070264713) описан процесс культивирования недифференцированных стволовых клеток в суспензии и, в частности, способ культивирования стволовых клеток на микроносителях в сосудах.
В другом примере (заявка № WO2006137787) описано использование средства скрининга, состоящего из частиц или микроносителей, например капель, прикрепленных к твердой подложке, например планшете для микротитрования, для культивирования клеток на указанных микроносителях.
В другом примере (заявка № WO2008004990) описан способ стимулирования прикрепления, выживания и/или пролиферации стволовых клеток в культуре, заключающийся в культивировании стволовых клеток на опорной поверхности, которая имеет положительный заряд.
В другом примере (заявка № WO2007012144) описан биореактор, включающий опорную поверхность и синтетический прикрепляющий полипептид, связанный с опорной поверхностью, при этом синтетический прикрепляющий полипептид характеризуется высокой способностью к связыванию эмбриональных стволовых клеток или мультипотентных клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении описаны способы выращивания, размножения и дифференцирования плюрипотентных стволовых клеток на микроносителях.
В одном из вариантов осуществления настоящего изобретения предлагается способ выращивания плюрипотентных стволовых клеток, включающий следующие этапы:
a) прикрепление популяции плюрипотентных стволовых клеток к первому объему микроносителей;
b) культивирование плюрипотентных стволовых клеток на первом объеме микроносителей;
c) отделение плюрипотентных стволовых клеток от первого объема микроносителей;
d) прикрепление популяции плюрипотентных стволовых клеток ко второму объему микроносителей.
КРАТКОЕ ОПИСАНИЕ ФИГУР
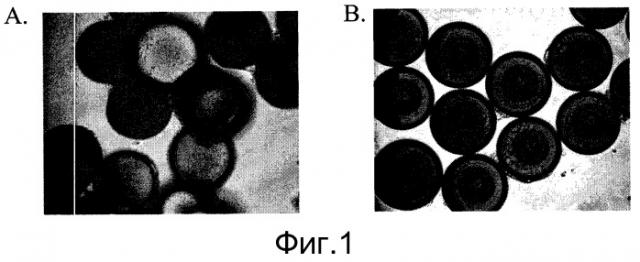
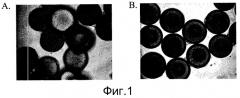
Фиг.1 - Ингибитор Rho-киназы стимулирует прикрепление человеческих эмбриональных стволовых клеток к микроносителям и их рост. Изображения клеток H9, выращенных в статичной культуре в течение двух суток на микроносителях HILLEX®II (Solohill, Мичиган, США). Клетки культивировали в среде, кондиционированной мышиными эмбриональными фибробластами (MEF-CM) в присутствии или отсутствие 10 мкМ ингибитора Rho-киназы, Y27632 ((Sigma-Aldrich, Миссури, США) A и B соответственно).
Фиг.2 - Клетки H9, выращенные на микроносителях. Клеткам H9 дали возможность прикрепиться к различным микроносителям и поместили их на качающуюся платформу при 37°C. Использовали микроносители Plastic, ProNectinF, HILLEX®II (Solohill, Мичиган, США) и микроносители Plastic Plus (A, B, C, D соответственно). Через 3 суток выращивания наилучшее прикрепление клеток наблюдалось на микроносителях HILLEX®II (Solohill, Мичиган, США). Стрелками показаны клетки, образующие агрегаты без прикрепления к микроносителям.
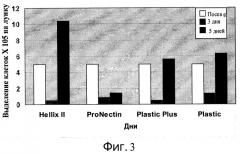
Фиг.3 - Пролиферация клеток H9 на микроносителях. Клетки H9 прикрепляли к микроносителям HILLEX®II, ProNectinF, Plastic Plus и Plastic (Solohill, Мичиган, США) и помещали в 6-луночном планшет на качающуюся платформу при 37°C в присутствии 10 мкМ Y27632 (Sigma-Aldrich, Миссури, США) и среды MEF-CM. Исходная плотность посева клеток - значение в день 0. Представлены количества клеток в день 3 и день 5.
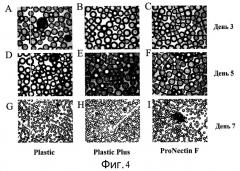
Фиг.4 - Изображения клеток H1 после прикрепления к микроносителям. Представлены изображения клеток, прикрепленных к микроносителям ProNectinF, Plastic Plus и Plastic в дни 3, 5 и 7. Клетки выращивали в среде MEF-CM с добавлением 10 мкМ Y27632 (Sigma-Aldrich, Миссури, США) в 12-луночный планшет на качающейся платформе при 37°C. Клетки образовывали агрегаты независимо от прикрепления к микроносителям Plastic Plus и Plastic (стрелки на панелях G и H).
Фиг.5 - Изображения клеток H1 после прикрепления к микроносителям. Представлены изображения клеток, прикрепленных к микроносителям Cytodex 1®, Cytodex 3® (GE Healthcare Life Sciences, Нью Джерси, США) и HILLEX®II (Solohill, Мичиган, США). Клетки выращивали в среде MEF-CM с добавлением 10 мкМ Y27632 (Sigma-Aldrich, Миссури, США) в 12-луночный планшет на качающейся платформе при 37°C.
Фиг.6 - Пролиферация клеток H1 на микроносителях. Клеткам H1 дали возможность прикрепиться к микроносителям HILLEX®II (Solohill, Мичиган, США), Cytodex 1® (GE Healthcare Life Sciences, Нью-Джерси, США), Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США), ProNectinF (Solohill, Мичиган, США), Plastic Plus (Solohill, Мичиган, США) и Plastic (Solohill, Мичиган, США) и поместили в 12-луночный планшет на качающуюся платформу при 37°C в присутствии 10 мкМ Y27632 (Sigma-Aldrich, Миссури, США) и MEF-CM. Исходная плотность посева клеток - значение в день 0. Представлены количества клеток в дни 3, 5 и 7. Исходная плотность посева составляла 13333 клетки/см2, как показано линией.
Фиг.7 - Пролиферация клеток H9 на микроносителях при различных концентрациях ингибиторов Rho-киназы. Клетки выращивали в 12-луночном планшете на качающейся платформе и подсчитывали их количество в дни 4 и 7 для определения степени прикрепления и скорости пролиферации. А: Клетки H9 выращивали в среде MEF-CM с добавлением 1, 2,5, 5 или 10 мкМ Y27632 (Sigma-Aldrich, Миссури, США). B: Клетки H9 выращивали в среде MEF-CM с добавлением 0,5, 1, 2,5 или 5 мкМ глицил-H 1152 дигидрохлорида (Tocris, Миссури, США).
Фиг.8 - Клетки H1 выращивали в убывающих концентрациях ингибиторов Rho-киназы. Клетки H1p38 выращивали в присутствии Y27632 (Sigma-Aldrich, Миссури, США) или глицил-H 1152 дигидрохлорида (Tocris, Миссури, США) в течение двух дней в убывающих концентрациях (10 мкМ/5 мкМ, 2,5 мкМ/0,5 мкМ или 1,0 мкМ/0,5 мкМ) или при постоянной концентрации 0,25 мкМ глицил-H 1152 дигидрохлорида (Tocris, Миссури, США). Клеткам давали возможность прикрепиться к микроносителям HILLEX®II (Solohill, Мичиган, США), Cytodex 1® или Cytodex 3® ((GE Healthcare Life Sciences, Нью-Джерси, США) A, B, C соответственно). Количество клеток подсчитывали на 3, 5 и 7 день после посева.
Фиг.9 - Определение прикрепления клеток к микроносителям при разных плотностях посева в ротационные колбы. Клетки H1 сеяли на микроносители Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) с уровнями плотности, указанными слева: низкой (0,4×104 клеток/см2), средней (1,2×104 клеток/см2) или высокой (3×104 клеток/см2). На 3, 5 и 7 дни клетки фотографировали и определяли процентную долю микроносителей с прикрепленными клетками (указано на изображении).
Фиг.10 - На рост клеток в ротационных пробирках влияет исходная плотность посева. Клетки H1 сеяли на микроносители Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) с уровнями плотности, указанными слева: низкой (0,4×104 клеток/см2), средней (1,2×104 клеток/см2) или высокой (3×104 клеток/см2). На 3, 5 и 7 дни клетки отделяли от микроносителей и подсчитывали их количество.
Фиг.11 - Определение скорости роста клеток на микроносителях при разных плотностях посева в ротационные колбы. Клетки H1 сеяли на микроносители Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) с разными уровнями плотности (день 0): низкой (0,4×104 клеток/см2), средней (1,2×104 клеток/см2) или высокой (3×104 клеток/см2). На 3, 5 и 7 дни клетки отделяли от микроносителей и подсчитывали их количество. Показана зависимость кратности увеличения количества клеток от исходной плотности посева.
Фиг.12 - Показан рост клеток H1 на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) через 7 дней культивирования. Клетки получали среду MEF-CM без ингибитора Rho-киназы, начиная с 3 дня и далее. Клетки оставались прикрепленными к микроносителям.
Фиг.13 - Рост и диссоциация клеток H9 на микроносителях HILLEX®II (Solohill, Мичиган, США). А, B: 10- и 20-кратные изображения клеток H9, выращиваемых в течение шести дней на микроносителях HILLEX®II (Solohill, Мичиган, США). C: 20-кратное изображение клеток, диссоциировавшихся от микроносителей HILLEX®II (Solohill, Мичиган, США) за 10 минут воздействия 0,05% раствором Трипсин/EDTA. D: 20-кратное изображение клеток, диссоциировавшихся от микроносителей HILLEX®II (Solohill, Мичиган, США) за 10 минут воздействия раствором TrypLE™ Express.
Фиг.14 - Диссоциация клеток H9 от микроносителей. Клетки H9, выращенные на микроносителях HILLEX®II (Solohill, Мичиган, США) на качающейся платформе, диссоциировались при помощи раствора TrypLE™ Express или 0,05% Трипсин/EDTA. Представлено количество клеток и их жизнеспособность - A и B соответственно.
Фиг.15 - Диссоциация клеток H1 от микроносителей. Клетки H1, выращенные на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) в ротационной колбе, диссоциировались при помощи реактива TrypLE™ Express (Invitrogen, CA), Accutase™ или коллагеназы (10 мг/мл). Представлено количество клеток и их жизнеспособность - A и B соответственно.
Фиг.16 - Клетки H9, выращенные на микроносителях HILLEX®II (Solohill, Мичиган, США), не переносятся между микроносителями.
Фиг.17 - Клетки H9, пассаж 43, выращивались на протяжении 5 пассажей на микроносителях HILLEX®II (Solohill, Мичиган, США) в ротационной колбе. Количество клеток подсчитывали каждые 2-3 дня и пересевали по достижении плотности 1-2×105 клеток/см2.
Фиг.18 - Клетки H9, пассаж 43, выращивались на протяжении 5 пассажей на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) в ротационной колбе. Количество клеток подсчитывали каждые 2-3 дня и пересевали по достижении плотности 1-2×105 клеток/см2.
Фиг.19 - Путем сортировки флуоресцентно-активированных клеток (FACS) показана плюрипотентность клеток H9, выращенных в ротационных колбах. A: большинство клеток H9 p43, выращенных на микроносителях HILLEX®II (Solohill, Мичиган, США), экспрессируют белки-маркеры плюрипотентности. Для клеток пассажей 1 и 3 не проводился анализ на TRA-1-81. B: большинство клеток H9 p43, выращенных на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США), экспрессируют белки-маркеры плюрипотентности. Для клеток пассажа 1 не проводился анализ на TRA-1-81.
Фиг.20 - Клетки H1 p49 выращивались на протяжении 5 пассажей на микроносителях Cytodex 1® (GE Healthcare Life Sciences, Нью-Джерси, США) в ротационной колбе. Количество клеток подсчитывали каждые 2-3 дня и пересевали по достижении плотности 4-8×104 клеток/см2.
Фиг.21 - Клетки H1, пассаж 49, выращивались на протяжении 5 пассажей на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) в ротационной колбе. Количество клеток подсчитывали каждые 2-3 дня и пересевали по достижении плотности 1-2×105 клеток/см2.
Фиг.22 - Путем сортировки флуоресцентно-активированных клеток (FACS) показана плюрипотентность клеток H1, выращенных в ротационных колбах.
Фиг.23 - Удвоение популяции клеток H1 и H9 на микроносителях. Сроки удвоения популяции клеток вычисляли от дня 3 до дня пересевания (день 5, 6 или 7).
Фиг.24 - Клетки H9, культивированные на микроносителях в определенной среде. Клетки культивировали на микроносителях HILLEX®II (HII, (Solohill, Мичиган, США)) или Cytodex 3® (C3, (GE Healthcare Life Sciences, Нью-Джерси, США)). Клетки культивировали на микроносителях в одной из следующих сред: mTESR (StemCell Technologies, Ванкувер, Канада), StemPro или MEF-CM. К среде добавляли 10 мкМ Y27632 (Y (Sigma-Aldrich, Миссури, США)) или 2,5 мкМ глицил-H 1152 дигидрохлорида (H (Tocris, Миссури, США)). Скорость роста определяли на 3, 5 и 7 день после посева.
Фиг.25 - Клетки H1, пассаж 38, культивировали на микроносителях в определенной среде. Клетки культивировали на микроносителях HILLEX®II (HII (Solohill, Мичиган, США)) или Cytodex 3® (C3 (GE Healthcare Life Sciences, Нью-Джерси, США)). Клетки культивировали на микроносителях в одной из следующих сред: mTESR (StemCell Technologies, Ванкувер, Канада), StemPro и MEF-CM. К среде добавляли 10 мкМ Y27632 (Y (Sigma-Aldrich, Миссури, США)) или 2,5 мкМ глицил-H 1152 дигидрохлорида (H (Tocris, Миссури, США)). Скорость роста определяли на 3, 5 и 7 день после посева.
Фиг.26 - Клетки H1, пассаж 50, культивировали на микроносителях HILLEX®II (Solohill, Мичиган, США) в определенной среде в ротационных колбах. A: изображения клеток H1 p50, выращенных в среде MEF-CM, через 3, 7 или 9 дней культивации в ротационной колбе. B: изображения клеток H1 p50, выращенных в среде mTESR (StemCell Technologies, Ванкувер, Канада), через 3, 7 или 9 дней культивации. Стрелками указаны кластеры клеток, не прикрепившихся к микроносителям.
Фиг.27 - Дифференцирование человеческих эмбриональных стволовых клеток, пересевавшихся пять раз в ротационных колбах. A: клетки H9, пассаж 43, пересевали пять раз на микроносители Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США). B: клетки H1, пассаж 49, пересевали пять раз на микроносители Cytodex 1® (GE Healthcare Life Sciences, Нью-Джерси, США). Оба типа клеток отделяли от микроносителей и сеяли на планшеты, покрытые материалом MATRIGEL (BD Biosciences, Калифорния, США). В отношении клеток, имевших конфлюэнтность 80-90%, реализовали протокол дифференцирования эмбриональных стволовых клеток в сформированную эндодерму. Анализ проводили методом FACS для определения процентной доли клеток, экспрессирующих CXCR4, маркер сформированной эндодермы. Процент CXCR4-положительных клеток указан в верхнем правом углу графика.
Фиг.28 - Дифференцирование клеток H1 в сформированную эндодерму на микроносителях. На графиках FACS представлена процентная доля клеток, экспрессирующих маркер сформированной эндодермы CXCR4. Процент клеток с положительным результатом указан в верхнем правом углу. Перед обработкой клетки выращивались на микроносителях в ротационных колбах. A: клетки H1, пассаж 40, перед дифференцированием выращивались на микроносителях Cytodex 1® (GE Healthcare Life Sciences, Нью-Джерси, США) в течение 6 дней после пассажа 5. B: клетки H1, пассаж 40, перед дифференцированием выращивались на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) в течение 8 дней после пассажа 1. C: клетки H1, пассаж 50, перед дифференцированием выращивались на микроносителях HILLEX®II (Solohill, Мичиган, США) в течение 6 дней после пассажа 1.
Фиг.29 - Дифференцирование клеток H1 в сформированную эндодерму на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США). A: клетки H1, пассаж 40, выращивали на микроносителях 8 дней. B: клетки H1, пассаж 40, выращивали на микроносителях 11 дней. Затем обе популяции клеток дифференцировались в сформированную эндодерму на качающейся платформе при 37°C. На графиках FACS представлена процентная доля клеток, экспрессирующих маркер сформированной эндодермы CXCR4. Процент клеток с положительным результатом указан в верхнем правом углу.
Фиг.30 - Дифференцирование человеческих эмбриональных стволовых клеток линии H1, культивированных на микроносителях, в сформированную эндодерму. По оси Y представлены результаты FACS с процентной долей CXCR4-положительных клеток. Клетки H1 находились на микроносителях HILLEX®II, Cytodex 1® или Cytodex 3® как до, так и во время дифференцирования.
Фиг.31 - Дифференцирование человеческих эмбриональных стволовых клеток линии H1, культивированных на микроносителях, в клетки панкреатической эндодермы. По оси Y представлены значения CT для маркеров панкреатической эндодермы, Ngn3, Nkx6.1 и Pdx1. Клетки H1 дифференцировались на микроносителях HILLEX®II (HII), Cytodex 1® (C1) или Cytodex 3® (C3) в среде DMEM-High Glucose (HG) или DMEM-F12 (F12). Продолжительность протокола дифференцирования составила 13 дней.
Фиг.32 - Дифференцирование человеческих эмбриональных стволовых клеток линии H1, культивированных на микроносителях, в гормон-продуцирующие панкреатические клетки. По оси Y представлены результаты FACS с процентной долей клеток, положительных по маркерам гормон-продуцирующих панкреатических клеток, синаптофизину, глюкагону и инсулину. Клетки H1 сеяли в двух концентрациях - 10×105 (10) или 20×105 (20) - на микроносители Cytodex 3® (C-3). Клетки дифференцировались в среде DMEM-High Glucose (HG) с четвертого по девятый день, а затем подвергались дальнейшей дифференцировке в среде HG или DMEM-F12 (F12) с 10 по 24 день.
Фиг.33 - Дифференцирование клеток H1 в эндокринные клетки на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США). Клетки H1 дифференцировались в панкреатические эндокринные клетки через панкреатическую эндодерму (день 14), панкреатические эндокринные клетки (день 21) в инсулинэкспрессирующие клетки (день 28). Был определен уровень экспрессии генов Pdx1, глюкагона и инсулина (A, B, C соответственно). Клетки H1, выращенные и дифференцированные на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) (C3), сравнивались с клетками, выращенными и дифференцированными на 6-луночных планшетах (плоских), покрытых материалом MATRIGEL (BD Biosciences, Калифорния, США). Значения уровня экспрессии генов для клеток, выращенных на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США), были получены в трех повторностях.
Фиг.34 - Клетки H9 дифференцировались в сформированную эндодерму (СЭ) на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США). Графики FACS по экспрессии CXCR4. Процентная доля клеток, положительных по маркеру сформированной эндодермы CXCR4, указана в верхнем правом углу. A: клетки H9, пассаж 39, росли на 6-луночных планшетах, покрытых материалом MATRIGEL (BD Biosciences, Калифорния, США), и дифференцировались в СЭ. B, C: дублированные образцы клеток H9 на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) переносили из ротационных колб в 12-луночный планшет и инкубировали на качающейся платформе.
Фиг.35 - Дифференцирование клеток H9 в инсулин-экспрессирующие клетки на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США). Клетки H9 дифференцировались в панкреатические эндокринные клетки через панкреатическую эндодерму (день 14), эндокринные клетки (день 22) в инсулинэкспрессирующие клетки (день 29). Были определены уровни экспрессии генов Pdx1, глюкагона и инсулина (A, B, C соответственно). Клетки H9, выращенные и дифференцированные на микроносителях Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) (C3), сравнивались с клетками, выращенными и дифференцированными на 6-луночных планшетах (плоских), покрытых материалом MATRIGEL (BD Biosciences, Калифорния, США).
Фиг.36 - Сохранение плюрипотентности человеческих эмбриональных стволовых клеток, культивированных в течение 5 пассажей на микроносителях Cytodex 3®, а затем перенесенных и культивированных на указанных плоских субстратах в присутствии ингибитора Rho-киназы. На панели A представлена экспрессия маркеров плюрипотентности CD9, SSEA3, SSEA4, Tra-160 и Tra-181, определенная проточной цитометрией. На панели B представлена экспрессия маркеров плюрипотентности Nanog, Pou5F1, SOX2 и ZFP42, а также маркеров дифференцирования FOXA2, FOXD3, GATA2, GATA4 и брахиурии, определенных методом ПЦР в реальном времени.
Фиг.37 - Образование сформированной эндодермы человеческими эмбриональными стволовыми клетками, культивированными в течение 5 пассажей на микроносителях Cytodex 3®, а затем перенесенными и культивированными на указанных плоских субстратах в присутствии ингибитора Rho-киназы. На панели А представлена экспрессия CXCR4, определенная проточной цитометрией. На панели B представлена экспрессия указанных маркеров, определенная методом ПЦР в реальном времени.
Фиг.38 - Образование сформированной эндодермы человеческими эмбриональными стволовыми клетками, культивированными в течение 5 пассажей на микроносителях Cytodex 3®, а затем перенесенными и культивированными на плоском субстрате PRIMARIA™. Экспрессия указанных генов определялась проточной цитометрией.
Фиг.39 - Человеческие эмбриональные стволовые клетки, культивированные на плоских субстратах, сохраняют плюрипотентность. Отбирались образцы мРНК, пересеянные с помощью TrypLE™, Accutase™ или коллагеназы человеческих эмбриональных стволовых клеток, и проводился анализ на экспрессию в мРНК гена плюрипотентности. Клетки выращивались в течение 4 дней (один пассаж) либо в культуре на материале MATRIGEL в среде, кондиционированной мышиными эмбриональными фибробластами (МЭФ) (A), либо в течение одного пассажа на материале Primaria™ в среде, кондиционированной МЭФ, с добавлением ингибитора Rock (B), либо в течение двух пассажей на материале Primaria™ в среде, кондиционированной МЭФ, с добавлением ингибитора Rock (C).
Фиг.40 - Человеческие эмбриональные стволовые клетки H1, выращиваемые в течение свыше 7 пассажей (больше p45) на материале PRIMARIA, пересеянные с использованием реактива AccutaseTM или TrypLETM с разведением 1:4, 1:8 или 1:16 на материал PRIMARIA в присутствии ингибитора Rho-киназы глицил-H 1152 дигидрохлорида, были проверены на плюрипотентность (A) и на способность дифференцироваться в сформированную эндодерму (B). Контролем служат человеческие эмбриональные стволовые клетки H1 p48, выращенные на 1:30 MATRIGEL, пересеянные с использованием коллагеназы. 10mA = пересев с 10-минутным воздействием Accutase™. 10mT = пересев с 10-минутным воздействием TrypLE™. Указана информация о соотношении при пересеве 1:4, 1:8 или 1:16. Значение P(X) показывает номер пассажа с момента переноса с питающих клеток МЭФ на пластик Primaria™.
Фиг.41 - Человеческие эмбриональные стволовые клетки H1, выращиваемые в течение свыше 7 пассажей (больше p45) на материале PRIMARIA, пересеянные с использованием реактива Accutase™ или TrypLE™ с разведением 1:4 на PRIMARIA в присутствии ингибитора Rho-киназы глицил-H 1152 дигидрохлорида, были проверены на экспрессию мРНК маркеров плюрипотентности и дифференцирования. Контролем является исходная популяция клеток пассажа - 37. 10min Accutase™ = пересев с 10-минутным воздействием Accutase™. Значение P(X) показывает номер пассажа с момента переноса с питающих клеток МЭФ на пластик PRIMARIA™.
Фиг.42 - Человеческие эмбриональные стволовые клетки H1, выращиваемые в течение свыше 7 пассажей (больше p45) на материале PRIMARIA™, пересеянные с использованием реактива Accutase™ или TrypLE™ с разведением 1:8 на PRIMARIA в присутствии ингибитора Rho-киназы глицил-H 1152 дигидрохлорида, были проверены на экспрессию мРНК маркеров плюрипотентности и дифференцирования. Контролем является исходная популяция клеток пассажа - 37. 10min Accutase™ = пересев с 10-минутным воздействием Accutase™. Значение P(X) показывает номер пассажа с момента переноса с питающих клеток МЭФ на пластик PRIMARIA™.
Фиг.43 - Человеческие эмбриональные стволовые клетки H1, выращиваемые в течение свыше 7 пассажей (больше p45) на материале PRIMARIA, пересеянные с использованием реактива Accutase™ или TrypLE™ с разведением 1:16 на PRIMARIA в присутствии ингибитора Rho-киназы глицил-H 1152 дигидрохлорида, были проверены на экспрессию мРНК маркеров плюрипотентности и дифференцирования. Контролем является исходная популяция клеток пассажа - 37. 10min Accutase™ = пересев с 10-минутным воздействием Accutase™. Значение P(X) показывает номер пассажа с момента переноса с питающих клеток МЭФ на пластик PRIMARIA™.
Фиг.44 - Изображения клеток H1, выращенных на плоских субстратах Primaria™ (№ по каталогу 353846, Becton Dickinson, Franklin Lakes, Нью-Джерси, США), а затем перенесенных на микроносители через 3 дня после посева. A-C: клетки H1 сеяли на микроносители Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США). D-F: клетки сеяли на микроносители HILLEX®II (Solohill, Мичиган, США). A, D: клетки H1 сеяли на плоские планшеты Primaria™ (№ по каталогу 353846, Becton Dickinson, Franklin Lakes, Нью-Джерси, США) и проходили 10-минутную обработку реактивом TrypLE™ Express (Invitrogen, Калифорния, США) перед переносом на микроносители. A, E: клетки H1 сеяли на плоские планшеты Primaria™ (№ по каталогу 353846, Becton Dickinson, Franklin Lakes, Нью-Джерси, США) и проходили 10-минутную обработку реактивом Accutase™ перед переносом на микроносители. C, F: клетки H1, пассаж 46, сеяли на планшеты с покрытием MATRIGEL (BD Biosciences, Калифорния, США) и обрабатывали коллагеназой (1 мг/мл) перед переносом на микроносители.
Фиг.45 - Плюрипотентность клеток H1, выращенных на плоских субстратах Primaria™ (№ по каталогу 353846, Becton Dickinson, Franklin Lakes, Нью-Джерси, США), а затем перенесенных на микроносители Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США) и HILLEX®II. Результаты FACS-анализа на белки клеточной поверхности, являющиеся маркерами плюрипотентности. Клетки при пересеве на планшеты Primaria™ (№ по каталогу 353846, Becton Dickinson, Franklin Lakes, Нью-Джерси, США) проходили обработку реактивом Accutase™ или TrypLE™ Express (Invitrogen, Калифорния, США) в течение 3-10 минут.
Фиг.46 - Дифференцирование клеток H1, выращенных на планшетах Primaria™ (№ по каталогу 353846, Becton Dickinson, Franklin Lakes, Нью-Джерси, США), а затем перенесенных на микроносители Cytodex 3® (GE Healthcare Life Sciences, Нью-Джерси, США). Результаты FACS-анализа на экспрессию CXCR4, маркера сформированной эндодермы, на поверхности клеток. Клетки при пересеве на планшеты Primaria™ (№ по каталогу 353846, Becton Dickinson, Franklin Lakes, Нью-Джерси, США) проходили обработку реактивом Accutase™ или TrypLE™ Express (Invitrogen, Калифорния, США) в течение 3-10 минут.
Фиг.47 - Результаты FACS-анализа для человеческих эмбриональных стволовых клеток, которые перед культивированием на микроносителях культивировали на плоских субстратах, состоящих из смеси эфиров целлюлозы.
Фиг.48 - Результаты FACS-анализа по экспрессии маркеров, характерных для линии сформированной эндодермы, в эмбриональных стволовых клетках, которые перед культивированием и дифференцированием на микроносителях культивировали на плоских субстратах из смеси эфиров целлюлозы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не для ограничения изобретения, подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые по способности на уровне единичной клетки как самообновляться, так и дифференцироваться с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцирования из нескольких зародышевых листков (эндодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от нескольких зародышевых листков, и вносить существенный вклад в формирование большинства, если не всех, тканей после инъекции в бластоцисты.
По потенциалу развития стволовые клетки классифицируются следующим образом: (1) тотипотентные, т.е. способные давать начало всем эмбриональным и внеэмбриональным типам клеток; (2) плюрипотентные, т.е. способные давать начало всем эмбриональным типам клеток; (3) мультипотентные, т.е. способные давать начало группе клеточных линий дифференцирования в пределах конкретной ткани, органа или физиологической системы (например, гематопоэтические стволовые клетки (HSC) могут давать таких потомков, как HSC (самообновление), олигопотентные предшественники, ограниченные клетками крови, и все типы клеток и клеточных элементов (таких как тромбоциты), являющиеся нормальными компонентами крови); (4) олигопотентные, т.е. способные давать начало более ограниченному набору клеточных линий дифференцировки, чем мультипотентные стволовые клетки; (5) унипотентные, т.е. способные давать начало единственной клеточной линии дифференцировки (например, сперматогенные стволовые клетки).
Дифференцирование представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например нервной или мышечной клетки. Дифференцированная клетка или клетка с индуцированным дифференцированием представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцирования клетки. Термин «коммитированная» применительно к процессу дифференцирования обозначает клетку, дошедшую в ходе процесса дифференцирования до стадии, от которой в нормальных условиях она продолжит дифференцироваться до определенного типа клеток или набора типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться обратно к менее дифференцированному типу. Дедифференцированием называется процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцирования. Используемый в настоящем документе термин «линия дифференцирования клетки» определяет наследственность клетки, то есть определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В линии дифференцирования клетка помещается в наследственную схему развития и дифференцирования. Маркером, специфичным для линии дифференцирования, называется характерная особенность, специфически ассоциированная с фенотипом клеток конкретной линии дифференцирования, которая может использоваться для оценки дифференцирования некоммитированных клеток в клетки данной линии дифференцирования.
Для описания клеток в процессе культивирования используются различные термины. Термин «поддержание» относится в целом к клеткам, помещенным в среду роста в условиях, которые способствуют росту и/или делению клеток, в результате чего популяция клеток может увеличиваться или не увеличиваться. Термин «пересевание» означает процесс изъятия клеток из одного культурального сосуда и переноса их в другой культуральный сосуд в условия, которые способствуют росту и/или делению клеток.
Конкретная популяция клеток или клеточная линия иногда описывается или характеризуется количеством выполненных с ней пересеваний (пассажей). Например, пересеянная 10 раз культивируемая популяция клеток может описываться как культура десятого пассажа, или культура P10. Первичная культура, т.е. первая культура после выделения клеток из ткани, получает обозначение P0. После первого пересева клетки описываются как вторичная культура (P1, или культура первого пассажа). После второго пересева клетки превращаются в третичную культуру (P2, или культура второго пассажа) и т.д. Специалистам в данной области будет понятно, что за период пассажа численность популяции может многократно удваиваться. Следовательно, количество удвоений численности популяции превышает номер пассажа. Уровень размножения клеток (то есть количество удваиваний популяции) за промежуток времени между последовательными пересевами зависит от многих факторов, включая, помимо прочего, плотность посева, тип субстрата, тип среды, условия роста и время между пересевами.
Термин «β-клеточная линия дифференцирования» относится к клеткам, положительным по экспрессии гена транскрипционного фактора PDX-1 и по меньшей мере одного из следующих транскрипционных факторов: NGN-3, Nkx2.2, Nkx6.1, NeuroD, Isl-1, HNF-3 beta, MAFA, Pax4 или Pax6. К клеткам, экспрессирующим маркеры, характерные для β-клеточной линии дифференцирования, относятся β-клетки.
Термин «клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы» в настоящем документе означает клетки, экспрессирующие по меньшей мере один из следующих маркеров: SOX-17, GATA-4, HNF-3 beta, GSC, Cer1, Nodal, FGF8, Brachyury, гомеобоксный белок Mix-like, FGF4, CD48, эомезодермин (EOMES), DKK4, FGF17, GATA-6, CXCR4, C-Kit, CD99 или OTX2. К клеткам, экспрессирующим маркеры, характерные для линии сформированной эндодермы, относятся клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезоэндодермы и клетки сформированной эндодермы.
Термин «клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы» в настоящем документе означает клетки, экспрессирующие по меньшей мере один из следующих маркеров: PDX-1, HNF-1 beta, PTF-1 alpha, HNF-6 или HB9. К клеткам, экспрессирующим маркеры, характерные для линии панкреатической эндодермы, относятся клетки панкреатической эндодермы.
Используемый в настоящей заявке термин «клетки с экспрессией маркеров, характерных для линии дифференцирования в панкреатические эндокринные клетки» относится к клеткам с экспрессией по меньшей мере одного из следующих маркеров: NGN-3, NeuroD, Islet-1, PDX-1, NKX6.1, Pax-4, Ngn-3 и PTF-1 alpha. Клетки, экспрессирующие маркеры, характерные для линии дифференцирования в панкреатические эндокринные клетки, включают панкреатические эндокринные клетки, панкреатические экспрессирующие гормоны клетки и панкреатические секретирующие гормоны клетки, а также клетки β-клеточной линии дифференцирования.
Используемый в настоящем документе термин «сформированная эндодерма» относится к клеткам, обладающим характерными особенностями клеток, происходящих в ходе гаструляции от эпибласта и формирующих желудочно-кишечный тракт и его производные. Клетки сформированной эндодермы экспрессируют следующие маркеры: CXCR4, HNF-3 beta, GATA-4, SOX-17, Cerberus, OTX2, goosecoid, c-Kit, CD99 и Mixl1.
Термином «внеэмбриональная эндодерма» в настоящем документе означает популяцию клеток, экспрессирующих по меньшей мере один из следующих маркеров: SOX-7, AFP или SPARC.
Используемый в настоящей заявке термин «маркеры» означает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в интересующих клетках. В данном контексте под дифференциальной экспрессией подразумевается повышение уровня экспрессии для положительного маркера и понижение уровня экспрессии для отрицательного маркера. Поддающийся обнаружению уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличить ее от других клеток с помощью любого из множества известных в данной области способов.
Термин «мезэндодермальная клетка» в настоящем документе означает клетку, экспрессирующую по меньшей мере один из следующих маркеров: CD48, эомезодермин (EOMES), SOX-17, DKK4, HNF-3 beta, GSC, FGF17 и GATA-6.
Термин «панкреатическая эндокринная клетка» или «клетка, экспрессирующая панкреатические гормоны» в настоящем документе относится к клеткам, способным к экспрессии по меньшей мере одного из следующих гормонов: инсулина, глюкагона, соматостатина и панкреатического полипептида.
Термин «панкреатическая секретирующая гормоны клетка» в настоящем документе относится к клеткам, способным к секреции по меньшей мере одного из следующих гормонов: инсулин, глюкаго