Набор синтетических олигонуклеотидов для детектирования количества копий гена бета-глюкуронидазы в трансгенных растениях
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к набору синтетических олигонуклеотидов для детектирования количества копий бета-глюкуронидазы в трансгенных растениях, включающему проведение полимеразной цепной реакции с помощью праймеров и разрушаемой пробы. Изобретение позволяет эффективно детектировать количество копий бета-глюкуронидазы в трансгенных растениях. 1 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к области молекулярной биологии и генной инженерии растений. Может быть использовано для выявления копийности рекомбинантного гена бета-глюкуронидазы в трансгенных растениях.
Для исследований в области генной инженерии растений, оптимизации методов трансформации и генетических конструкций часто используют репортерные гены, в том числе ген бета-глюкуронидазы [Jefferson R.A., Kavanagh T. A., and Bevan M.W. (1987) GUS fusions: beta-glucuronidase a sasensitive and versatile gene fusion marker, in higher plants // EMBOJ. 6(13): 3901-3907]. Ген бета-глюкуронидазы является удобным модельным объектом при конструировании и трансфекции в связи с простотой в визуализации трансгенных участков в ходе биохимической цветной реакции расщепления экспрессируемым продуктом субстрата - 5-бромо-4-хлоро-3-индолил-β-D-глюкуронида. В результате генетической модификации возможно добиться максимального количества копий рекомбинантной ДНК и увеличить экспрессию репортерного гена, который в последующем возможно заменить на целевой ген, не оптимизируя метод трансфекции и конструкцию заново.
Известно, что наиболее часто для определения копийности рекомбинантной конструкции в трансгенных растениях используют Саузерн-блот анализ [Southern Е.М. (1975) Detection of specific sequences among DNA fragments separated by gelelectrophoresis // J Mol Biol. 98 (3): 509-517]. Для выявления количества копий трансгена используют тотальную ДНК исследуемого образца, фрагментированную рестриктазами с высокочастотой встречаемости сайтов рестрикции. Фрагментированную ДНК разделяют в электрофорезном геле и переносят на нитроцеллюлозную мембрану с последующим осуществлением гибридизации радиоактивно (флюоресцентно) меченной пробой с известной последовательностью ДНК. После гибридизации избыток пробы отмывают с мембраны и визуализируют продукты гибридизации путем авторадиографии. Недостатками метода является трудоемкость, длительность, а также существует возможность ошибки, в случае если несколько копий рекомбинантной конструкции находятся между сайтами рестрикции, что во время визуализации мембраны может быть интерпретировано как одна копия.
Известно использование обратной дот-блот гибридизации для детектирования копий рекомбинантной ДНК [Patent US WO 1993009245 A1, 13.05.1993 Reverse dot blot hybridization using tandem head-to-tail monomers containing probes synthesized by staggered complementary primers]. Способ обнаружения присутствия или отсутствия последовательности нуклеиновой кислоты на основе связывания с полимерным субстратом, выбранных олигонуклеотидных зондов с комплементарными областями в последовательности нуклеиновой кислоты, которая должна быть обнаружена. Основным недостатком данного метода является невозможность определения количества копий встроенной ДНК, т.к. метод позволяет только определить присутствие или отсутствие гена.
Из известных решений наиболее близким является использование полимеразной цепной реакции в реальном времени для детектирования копий гена бета-глюкуронидазы [Chen G.Q. and Lin J. (2010) Use of Quantitative Polymerase Chain Reaction for Determining Copy Numbers of Transgenes in Lesquerella fendleri //American Journal of Agricultural and Biological Sciences 5 (3): 415-421]. Для проведения полимеразной цепной реакции используют праймеры - короткие ДНК-затравки, между которыми происходит синтез определенной последовательности, где в качестве праймеров используют последовательности ДНК со следующим нуклеотидным составом:
5′ACAACGTCGTGACTGGGAAAA3′
5′TGTGCTGCAAGGCGATTAAG3′
В качестве флуоресцентного красителя используется SYBR® Green, по мере увеличения копий ампликонов усиливается уровень флюоресценции, для сравнения используется положительный контроль. Впоследствии в результате математического расчета выводятся данные о количестве копий гена в выделенной ДНК.
Основными недостатками данного метода является:
1. Производится расчет количества копий конструкции в «пробирке», что не позволяет оценить количество копий на геном;
2. Использование неспецифических красителей, таких как SYBR® Green (Life technolodies, США), возводит высокие требования к специфичности реакции - любая двуцепочечная ДНК, в том числе димеры праймеров, будет генерировать флуоресценцию, что повышает риск ошибки», кроме того возможно ингибирование реакции, соответственно эффективность детекции копий гена бета-глюкуронидазы ближайшего аналога D1 сильно зависит от условий ПЦР и качества ПЦР смеси. Кроме того, владелец торговой марки SYBR Green и ДНК-зонда TaqMan (Life technologies Inc.) в спецификации к красителю не указывает возможность его применения для диагностики количества копий генов [http://www.lifetechnologies.com/ru/ru/home/life-science/pcr/real-time-pcr/qpcr-education/taqman-assays-vs-sybr-green-dye-for-qpcr.html], таблица.
Задачей данного изобретения является подбор универсальных олигонуклеотидов, применимых для точного измерения количества копий репортерного гена бета-глюкуронидазы в исследуемых трансгенных растениях.
Поставленная задача решается посредством определения последовательности праймеров, а именно для детектирования количества копий гена бета-глюкуронидазы в трансгенных растений предложена пара олигонуклеотидов совместно с флуоресцентно меченным гибридизационным зондом следующего нуклеотидного состава:
primerGUS-f GATCGCGAAAACTGTGGAAT
primerGUS-r TAATGACTGACCGCATCGAA
probe GUS Q 5′ TATAGACTGACCGCATCGAA F 3′, где F - флуорофор, Q - гаситель.
Заявляемый набор синтетических олигонуклеотидов для детектирования копий гена бета-глюкуронидазы проверяют на различных видах трансгенных сосудистых растениях.
Ход работы с применением набора синтетических олигонуклеотидов для детектирования гена бета-глюкуронидазы трансгенных растений состоит из следующих шагов.
1) Растительный материал перед проведением ПЦР с помощью заявляемого набора проводится через процедуру пробоподготовки, например с использованием набора Diamont DNA kit (ООО «АБТ», Россия) в соответствии с инструкцией производителя; в ходе этой процедуры из растительного материала выделяется ДНК, которую, в свою очередь, используют для ПЦР.
2) В качестве стандарта используют агробактериальный вектор, содержащий ген бета-глюкуронидазы. Концентрации исследуемого образца и стандарта доводят до одинакового значения. Размер стандарта (пг) рассчитывают из количества пар оснований и их молекулярных масс. Размер генома образца исследуют с помощью проточной цитометрии (пг). Осуществляют десятикратные разведения (1х, 10х, 100х, 1000х, 10000х). В программном обеспечении прибора - амплификатора CFX96 (Bio-Rad, США) - виртуально обозначают лунки стандарта с условными разведениями 104, 103, 102, 10, 1.
3) Полимеразную цепную реакцию проводят на амплификаторе CFX96. Амплификация проводится по следующей программе:
1 цикл: 95°С - 180 сек, 39 циклов: 95°С - 10 сек, 60°С - 30 сек, 72°С - 30 сек; завершающая стадия: 72°С - 10 мин, охлаждение при 4°С.
Инкубационная смесь конечным объемом 25 мкл содержит: 16,5 мкл H2O; 2 мкл ДНК; 2,5 мкл 10Х буфер; по 1 мкл 10 мкМ каждого праймера; зонд 10 мкМ 0,5 мкл; 1 мкл 60 мМ dNTPs; 1 ед. Taq-полимеразы.
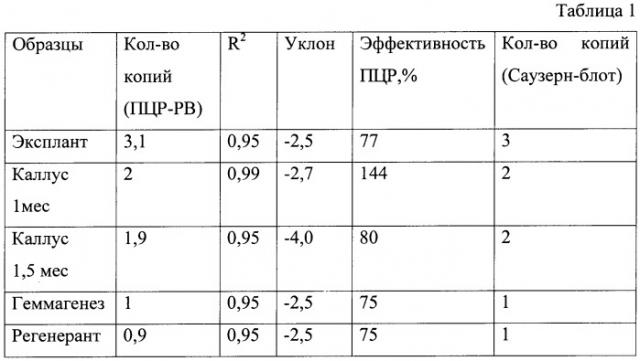
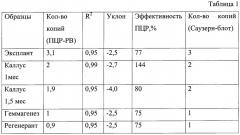
4) Продукты амплификации детектируются аналитической частью прибора. Достоверность данных ОЕФ полимеразной цепной реакции подтверждают данными калибровочной кривой ПЦР-РВ (Е, R^2, Уклон) (рис.1)
5) Расчет количества копий гена проводят из соотношения порядкового номера порогового цикла амплификации образца и стандарта.
Пример 1
Расчет количества копий бета-глюкуронидазы для трансгенного щавеля кислого (Rumex acetosa L.) трансформированного вектором pBIK102iGs.
Предварительно проводят ПЦР стандарта и ПЦР образца (каждый в отдельной пробирке):
Условия:
Разбавление 1/104
По калибровочному графику ПЦР стандарта получены следующие значения концентраций:
Концентрация стандарта в ПЦР смеси=0,02*106 пг
Концентрация образца в ПЦР смеси=0,02*106 пг
Размер генома стандарта=1,664*10-5 пг
Размер генома образца (C-value)=3,3 пг
ОЕФэксп (относительное разбавление)=0,563
Количество копий гена в пробирках:
для стандарта=0,02*106 пг/1,664*10-5 pg=0,012*1011 копий
для образца=0,563*0,012*1011/10000=0,0067*107 копий
Кол-во геномов щавеля в пробирке=0,02*107 пг/3,3 пг=0,006 геномов
Количество копий гена на геном щавеля=0,0067*107/0,006*106=1,1
Данные о количестве копий, подсчитанные предлагаемым методом и методом Саузерн-блот при анализе, различаются лишь на десятые доли и при округлении являются равными (Таблица 1). Набор для синтеза, детектирования и последующего расчета количества копий бета-глюкуронидазы в трансгенных растениях является более эффективным.
Исходя из учета требуемых усилий и времени для проведения Саузерн-блоттинга, заявленное изобретение является более эффективным. При условии использования различных подходов к генерации флуоресцентного сигнала применение флуоресцентного ДНК-зонда является более эффективным в связи с более высокой специфичностью и устойчивостью реакции. Кроме того, использование дополнительной разрушаемой пробы увеличивает чувствительность реакции и позволяет использовать для анализа следовые количества ДНК, тогда как для различного рода блоттингов необходима концентрация 5-10 мг/мл. Использование метода проточной цитометрии позволяет непосредственно перед экспериментом установить относительное содержание ДНК в растении, тем самым возможно производить расчеты индивидуально для каждого образца.
Набор синтетических олигонуклеотидов для детектирования количества копий бета-глюкуронидазы в трансгенных растениях, включающий проведение полимеразной цепной реакции с помощью праймеров и разрушаемой пробы, отличающийся тем, что используют набор синтетических олигонуклеотидов для детектирования копий гена бета-глюкуронидазы с праймерами и гибридизационным зондом в следующей последовательности:primerGUS-f GATCGCGAAAACTGTGGAATprimerGUS-r TAATGACTGACCGCATCGAAprobe 5' Q TATAGACTGACCGCATCGAA 3' F, где F - флуорофор, Q - гаситель.