Композиция инсулина длительного действия
Иллюстрации
Показать всеНастоящее изобретение относится к фармацевтической композиции, содержащей соединение инсулина в концентрации, достаточной для поддержания терапевтически эффективного уровня соединения инсулина в плазме крови в течение по меньшей мере 3 дней. Соединение инсулина относится к пролекарственному соединению, представляющему собой конъюгат инсулина с линкером, соединенный с гидрогелевым носителем. Также описана суспензия, содержащая фармацевтическую композицию конъюгата инсулина, способ получения суспензии, набор, включающий фармацевтическую композицию конъюгата инсулина и контейнер для введения композиции. Фармацевтическая композиция конъгата инсулина по изобретению характеризуется тем, что имеет фармакокинетический профиль in vivo по существу без выброса соединения инсулина. 6 н. и 20 з.п. ф-лы, 9 ил., 21 пр.
Реферат
Область техники
Настоящее изобретение относится к фармацевтической композиции, содержащей соединение инсулина, применению композиции, способу лечения, набору, а также к комбинированному лечению с соединением GLP-1, таким как агонист GLP-1. Фармацевтическую композицию можно вводить менее часто относительно существующих препаратов инсулина длительного действия, и она отличается высвобождением структурно интактного инсулина в течение всего периода времени между введения по существу без выброса соединения инсулина. Этот метод лечения может помочь пациентам снизить частоту инъекций, сохраняя при этом возможность оптимального контроля уровня инсулина в плазме и, соответственно, уровня глюкозы в крови.
Предпосылки создания изобретения
Лечение инсулином характеризуется тем, что высвобождение препарата инсулина необходимо поддерживать в очень ограниченном диапазоне концентраций из-за узкого «терапевтического окна», а побочные эффекты гиперинсулинемии потенциально опасны для жизни. В продаже имеется множество препаратов инсулина с различными профилями действия, удовлетворяющих определенным потребностям популяции людей с диабетом. Быстродействующие аналоги инсулина вводят непосредственно перед едой для контроля пиковых концентраций глюкозы в плазме после принятия пищи, в то время как аналоги инсулина длительного действия обычно принимаются один или два раза в день для обеспечения постоянного базального уровня инсулина.
Современные разработки также включают пероральный инсулин и ингаляционный инсулин. Однако вследствие того что инсулин представляет собой белок, при пероральном приеме он легко расщепляется в желудке и желудочно-кишечном тракте. В качестве альтернативы в течение короткого периода времени в продаже был доступен ингаляционный инсулин, вводимый в легкие с помощью ингалятора (Эксубера®, компания Pfizer прекратила его выпуск в 2007 году). Этот состав обеспечивал инсулин в течение длительного периода времени (часы), но тем не менее требовал введения пациентами базального инсулина длительного действия с помощью инъекций. Другие недостатки ингаляционного инсулина включали сложность изготовления, приводящую к непомерно дорогой системе доставки. В результате все доступные в продаже составы инсулина необходимо вводить с помощью инъекций, подкожных либо внутривенных.
Различные доступные в продаже инсулины отличаются различными профилями их концентрации в плазме. Указанные профили концентрации в плазме можно описать как профили с максимальной и минимальной концентрацией в плазме, которые зависят от состава и типа используемого инсулина. Для того чтобы было возможно прогнозировать эффект снижения уровня глюкозы в плазме в результате действия введенного инсулина, очень важно получить профиль концентрации в плазме, воспроизводимый как от пациента к пациенту, так и у одного пациента. Кроме того, при многократном введении базального инсулина, желательно чтобы отличие между максимальной и минимальной концентрацией в плазме было минимально возможным. Это приводит к более постоянной концентрации инсулина в плазме, и, поэтому, к более унифицированному эффекту снижения уровня глюкозы в течение всего интервала дозирования.
Существующая на сегодняшний день базальная инсулиновая терапия состоит из ежедневного введения или введения дважды в день базальных инсулинов длительного действия, таких как NPH-инсулин, инсулин гларгин или инсулин детемир. Хотя при разработке новых инсулиновых аналогов целью являлось снижение вариабельности инсулинотропных эффектов, эффект снижения уровня глюкозы у этих составов длительного действия все еще отличается сильной вариабельностью как у отдельных субъектов, так и между ними, что описано в работе Heise et al. (Diabetes, 2004 (53), 1614-1620). В этом исследовании инсулин детемир проявлял наименьшую фармацевтическую вариабельность с коэффициентом вариабельности (CV) 15 по сравнению с CV для NPH-инсулина и инсулина гладрина, составляющими 26 и 34, соответственно. Эта достаточно высокая вариабельность является основным препятствием к достижению оптимального контроля уровня глюкозы, так как трудно предсказать уровень доступности инсулина.
В этом же исследовании изучали фармакодинамическую вариабельность, оцениваемую по скорости инфузии глюкозы (GIR). В этом исследовании также было продемонстрировано, что инсулин детемир имел меньшую вариабельность у индивидуальных субъектов по сравнению с NPH-инсулином и инсулином гладрин в отношении фармакодинамического маркера - GIR. Кроме того, в этом исследовании было продемонстрировано, что эффект инсулина на скорость инфузии глюкозы не длился в течение всего периода дозирования 24 часов, что указывает на явную необходимость в инсулине длительного действия, который будет полноценно снижать уровень глюкозы на протяжении всего интервала времени между дозами. Чтобы преодолеть проблему того, что существующие базальные инсулины для ежедневного приема не действуют на протяжении 24 часов, некоторые пациенты разбивают свою дозировку базального инсулина на две ежедневные инъекции для лучшего контроля уровня глюкозы в течение дня.
Поэтому, очевидно необходимы новые препараты инсулина длительного действия, которые постоянно высвобождают инсулин на протяжении всего периода времени между введениями препарата.
Кроме того, даже если пациенты могут регулировать свой уровень глюкозы в крови с помощью ежедневных инъекций базального инсулина, то из-за ежедневных инъекций они сопротивляются началу инсулиновой терапии. Это является нежелательным, так как Американская Ассоциация Диабета (ADA) и Европейская Ассоциация по Исследованиям Диабета (EASD) называют инсулин препаратом первой линии после перорального метформина, как обеспечивающий наилучший результат лечения (DM Nathan et al., Diabetologica (2008) 51: 8-11).
При снижении частоты введения инсулина вероятно снижение физиологического барьера перед началом инсулиновой терапии, что дает возможность пациентам начать терапию инсулином на более ранней стадии и значительно улучшает их состояние здоровья.
Проблема при разработке составов базального инсулина длительного действия заключается в узком терапевтическом диапазоне концентраций инсулина и высоком соотношении между максимальной и минимальной концентрациями в фармакокинетическом профиле инсулина, кроме того, во всех случаях необходимо избегать выброса инсулина.
Для снижения частоты введения с сохранением высвобождения инсулина в узком диапазоне концентраций были предложены несколько подходов, но они не увеличивали продолжительность эффекта снижения уровня глюкозы более чем на пару дней, хотя отличались низким соотношением между максимальной и минимальной концентрацией инсулина в плазме.
В публикации WO 06003014 описан способный высвобождать инсулин гидрогель с возможностью снижения частоты дозирования по сравнению со стандартными ежедневными инъекциями базального инсулина. Однако высвобождение инсулина происходит со слишком большой скоростью для гарантии жесткого инсулинотропного контроля в течение периодов времени больше 2 дней. В действительности, время высвобождения инсулина составляет приблизительно 30 часов, поэтому, пролекарственное соединение необходимо вводить по меньшей мере каждые 30 часов для того чтобы соотношение между максимальной и минимальной концентрациями было ниже 2 в равновесном состоянии.
Концепция получения обратимого полимерного конъюгата инсулина исследовалась группой Shechter и др. и описана в научных статьях и патентных заявках (например, в European Journal of Pharmaceutics and Biopharmaceutics 2008(70), 19-28 и WO 2004/089280). Инсулин конъюгирован с ПЭГ-полимером 40 кДа через спейсерную молекулу 9-гидроксиметил-7-(амино-3-малеимидопропионат)-флуорен-N-гидроксисукцинимид. Гидролиз указанной спейсерной молекулы высвобождает инсулин с временем полужизни приблизительно 30 часов, то есть пролекарственное соединение необходимо вводить по меньшей мере каждые 30 часов, для того чтобы соотношение между максимальной и минимальной концентрациями было ниже 2 в равновесном состоянии.
Были проведены другие попытки снижения частоты дозирования инсулина. Группой Hinds и др. (Journal of Controlled Release, 2005 (104), 447-460) был описан способ получения инсулина для введения один раз в неделю, в результате первоначального необратимого ПЭГилирования молекулы инсулина и затем последующего заключения ПЭГилированного инсулина в микрокапсулы (в PLGA-микрочастицы). Было показано, что заключение белков в PLGA вызывает побочные реакции сложных эфиров полимера с аминогруппами пептида или белка. После воздействия на составы буферных растворов с нейтральным рН наблюдались продукты ацилирования молочной кислоты. (Nat. Biotechnol. 18 (2000) 52-57; Pharm. Res. 11 (1994) 865-868; Pharm. Res. 19 (2002) 175-181).
Конкретно в случае инсулина было продемонстрировано негативное воздействие полимерных составов (Pharm. Dev. Technol. 4 (1999) 633-642; Pharm. Dev. Technol. 5 (2000) 1-9).
В указанном выше случае инсулин претерпевал значительные структурные изменения в результате перманентной модификации высокомолекулярным полимером, так как ПЭГилирование инсулина, по-видимому, служит для защиты пептида от разрушения в составе PLGA-полимера.
К сожалению, такие высокомолекулярные инсулины могут проявлять меньшую эффективность в результате ослабления связывания с рецепторами, а также могут давать реакцию в месте инъекций, такую как липодистрофия, вследствие более длительного присутствия высоких концентраций высокомолекулярного инсулина в подкожной ткани. Кроме того, такие ПЭГилированные инсулины будут иметь меньший объем распределения, что является значительным недостатком в лечении диабета.
Кроме того, фармакокинетический профиль высвобождаемого конъюгата инсулина отличается первоначальным выбросом непосредственно после введения, за которым следует падение концентрации конъюгата инсулина в плазме с последующим увеличением концентрации конъюгата инсулина в плазме в течение следующих дней. Этот фармакокинетический профиль типичен для микрокапсулированных составов лекарственных средств и может привести к непрогнозируемой реакции на глюкозу у субъектов, получающих лечение таким составом.
Поэтому остается проблемой разработка инсулина длительного действия без нарушения фармакодинамики инсулина в результате перманентного присоединения высокомолекулярного соединения.
Ситуация дополнительно осложняется тем, что инсулин легко вступает в побочные реакции, что связано с присутствием в его молекуле трех дисульфидных связей. Например, инсулин может разбиваться на А и В-цепи в результате расщепления дисульфидных связей, или могут формироваться димеры или олигомеры вследствие обменных реакций между дисульфидными группами. Такая «перетасовка» дисульфидных связей особенно вероятна, если молекулы инсулина принудительно находятся в близком контакте случайным образом ("Stability of insulin: studies on the physical and chemical stability of insulin in pharmaceutical formulation", Jens Brange, Springer, 1994). Такая природная лабильность молекулы инсулина существенно затрудняет прогресс в разработке депо-составов длительного действия и не позволяет использовать другие полимерные составы, в которых инсулин заключен в форме, подобной аморфному осадку, который, как известно, дает различные продукты деградации, возникающие в результате интенсивных реакций обмена между дисульфидными группами.
На скорость побочных реакций дополнительно влияет концентрация инсулина - скорость повышается при высокой концентрации инсулина. Поэтому, проблемой является получение составов с высокой концентрацией инсулина длительного действия, в которых инсулин не претерпевает нежелательных побочных реакций.
Поэтому, существует явная необходимость в новых препаратах инсулина длительного действия, которые постоянно высвобождают структурно интактный инсулин в течение всего периода времени между введениями препарата и, кроме того, сохраняют низкое соотношение между максимальной и минимальной концентрацией инсулина в плазме для исключения слишком высоких или слишком низких концентраций инсулина, потенциально вредных для пациента.
Количество инсулина, требуемое пациентам с диабетом, является весьма индивидуальным, причем доза зависит от нескольких физиологических факторов, включая функцию панкреатических бета-клеток, чувствительность к инсулину, массу тела и пищевой рацион. Довольно часто пациентам требуется 40 МЕ инсулина (или больше) в день. Это равняется 280 МЕ в неделю, что соответствует 12,6 мг инсулина человека в неделю. Для минимизации дискомфорта у пациента это количество должно быть введено в маленьком объеме, например, одном миллилитре. Поэтому, задача настоящего изобретения относится к составу инсулина, в котором концентрация инсулина составляет по меньшей мере 10 мг/мл, одновременно высвобождающему структурно интактный инсулин и имеющему фармакокинетический профиль по существу без выброса инсулина. Кроме того, в результате вышеуказанного, задача настоящего изобретения заключается в возможности введения одной дозы инсулина длительного действия в виде одной инъекции состава, содержащего по меньшей мере 10 мг соединения инсулина.
В US2007/0207210 A1 описан способ получения аморфных микрочастиц высокомолекулярных белков и, в частности, антител. Согласно описанию в примере упомянут инсулин, введенный в состав в концентрации до 400 мг/мл. Однако задача изобретения относится к составу с фармакокинетическим профилем, аналогичным нативному белку, то есть не относится к пролонгированному высвобождению. Поэтому, US2007/0207210 A1 не предлагает решения снижения частоты введения инсулина.
Определения
Ниже в настоящем документе изложены некоторые определения, важные для понимания настоящего изобретения.
Предполагается, что используемый в настоящем документе термин «по существу нет выброса» или «по существу без выброса» (оба термина используются взаимозаменяемо в настоящем описании) означает, что после введения соединения инсулина, которое может представлять собой пролекарственное соединение или действующее соединение инсулина, соотношение пиковой концентрации детектируемого соединения инсулина в плазме крови в течение первых 48 часов после введения, например, подкожного или внутримышечного, к минимальной концентрации детектируемого соединения инсулина в плазме крови после пиковой концентрации в течение первых 48 часов после введения составляет меньше 2 (по существу нет детектируемого выброса), предпочтительно - меньше 1,5 (нет детектируемого выброса).
Предполагается, что используемый в настоящем документе термин «выброс» означает, что после введения соединения инсулина, которое может представлять собой пролекарственное соединение или действующее соединение инсулина, соотношение пиковой концентрации детектируемого соединения инсулина в плазме крови в течение 48 часов после введения, например, подкожного или внутримышечного, к минимальной концентрации детектируемого соединения инсулина в плазме крови после пиковой концентрации в течение 48 часов после введения составляет 2 или выше.
В отношении детекции соединения инсулина в плазме крови, такое соединение инсулина может представлять собой структурно интактную форму введенного соединения инсулина, или в случае когда введенное соединение инсулина представляет собой пролекарственное соединение, детектируемым соединением инсулина будет интактное соединение инсулина, высвобождаемое из пролекарственного соединения, например, инсулин человека, аналоги инсулина, производные инсулина и их фрагменты.
Предполагается, что используемый в настоящем документе термин «соединение GLP-1» означает любое соединение GLP-1, например GLP-1(7-37), GLP-1(7-36)NH2 и аналог GLP-1, включая агониста GLP-1. Примерами агонистов GLP-1, используемых в настоящем изобретении, являются агонисты GLP-1, эксендина-3 или эксендина-4, в том числе без ограничений:
(i) аналоги эксендина-4 и амидированные аналоги эксендина-4, в последовательностях которых один или несколько аминокислотных остатков были заменены другими аминокислотными остатками, включая N-концевые модификации,
(ii) укороченный эксендин-4 и амидированные укороченные формы,
(iii) укороченный эксендин-4 и амидированные укороченные формы, в последовательностях которых один или несколько аминокислотных остатков были заменены другими аминокислотными остатками,
(iv) GLP-1 и амидированный GLP-1,
(v) аналоги GLP-1 и амидированные аналоги GLP-1, в последовательностях которых один или несколько аминокислотных остатков были заменены другими аминокислотными остатками, включая N-концевые модификации,
(vi) укороченный GLP-1 и амидированные укороченные формы,
(vii) укороченный GLP-1 и амидированные укороченные формы, в последовательностях которых один или несколько аминокислотных остатков были заменены другими аминокислотными остатками,
(viii) известные вещества AVE-0010(ZP-10) (Sanofi-Aventis Zealand Pharma), BAY-73-7977 (Bayer), TH-0318, BIM-51077 (Ipsen, Tejin, Roche), NN-2211 (Novo Nordisk), LY315902.
Агонисты GLP-1 имитируют функции нативного GLP-1, в результате связывания рецепторов, на которые оказывает действие GLP-1, являющееся полезным в качестве инсулинотропного, а также при лечении сахарного диабета, или в результате имитации эффектов эксендина на выделение мочи, замедление эвакуации содержимого желудка, повышение чувства сытости, повышение выведения натрия с мочой и/или снижение концентрации калия в моче в результате связывания рецептора(ов), через которые эксендин осуществляет это действие.
Предполагается, что используемый в настоящем документе термин «отношение пиковой концентрации к остаточной» означает соотношение между максимальной концентрацией в плазме и минимальной концентрацией в плазме соединения инсулина, например, инсулина человека, в заданный период времени между введениями.
Предполагается, что используемый в настоящем документе термин «структурно интактное соединение инсулина» означает интактный инсулин, состоящий из двух пептидов, называемых А и В-цепями, соединенными двумя дисульфидными мостиками. Кроме того, А-цепь содержит внутримолекулярный дисульфидный мостик. Потеря внутри- или межмолекулярных дисульфидных мостиков или перестановка двух цепей, например, А-А или В-В гомодимеры, могут вызывать инактивацию инсулина. Структурную целостность измеряют, расщепляя инсулин соответствующей эндопротеазой, например, эндопротеиназой Glu-C, и анализируя полученные фрагменты с помощью масс-спектрометрии. Отсутствие сигналов, возникающих от одиночных инсулиновых цепей, указывает на интактный инсулин. Предполагается, что используемый в настоящем документе термин «пролекарственное соединение» означает соединение инсулина, которое претерпевает биотрансформацию перед проявлением своих фармакологических эффектов. Поэтому, пролекарственные соединения можно рассматривать в качестве биологически активных остатков, содержащих специализированные нетоксичные защитные группы, используемые временно для изменения или устранения нежелательных свойств исходной молекулы. Например, пролекарственным соединением может быть биогидролизуемый амид и биогидролизуемый сложный эфир, а также это понятие охватывает: а) соединения, в которых биогидролизуемая функциональная группа в таком пролекарственном соединении включена в соединение, и b) соединения, которые могут биологически окисляться или восстанавливаться по данной функциональной группе. Типичные пролекарственные соединения могут представлять собой связанное с носителем пролекарственное соединение, содержащее временную связь данного действующего вещества с временной группой носителя, которая обеспечивает улучшенные физико-химические или фармакокинетические свойства, и которая легко удаляется in vivo, обычно в результате гидролитического расщепления; или это может быть каскадное пролекарственное соединение, для которого отщепление носителя становится эффективным только после демаскировки активирующей группы.
Для усиления физико-химических или фармакокинетических свойств лекарственного соединения, например, инсулина, такое лекарственное соединение можно конъюгировать с носителем. Если лекарственное соединение транзиентно соединено с носителем и/или линкером, то такие системы обычно называют связанные с носителем пролекарственные соединения. По определению, данному IUPAC (цитата из http://www.chem.qmul.ac.uk/iupac.medchem, по состоянию на 22 июля, 2009 года), связанное с носителем пролекарственное соединение представляет собой пролекарственное соединение, которое содержит временную связь данного действующего вещества с транзиентной группой-носителем, которая обеспечивает улучшенные физико-химические или фармакокинетические свойства, и которая легко удаляется in vivo, обычно в результате гидролитического расщепления.
Используемые в таких связанных с носителями пролекарственных соединениях линкеры являются транзиентными, то есть они гидролитически деградируют (расщепляются) без привлечения ферментов при физиологических условиях (водный буфер при рН 7,4, 37°C) с временем полужизни в диапазоне, например, от одного часа до трех месяцев.
Подходящими носителями являются полимеры, и они могут быть либо конъюгированы с линкером напрямую, либо через нерасщепляемый спейсер. «Пролекарственное соединение инсулин-гидрогеля» относится к пролекарственному соединению, в котором инсулин транзиентно соединен с гидрогелевым носителем. Термины «гидрогелевое пролекарственное соединение» и «связанное с гидрогелем пролекарственное соединение» относятся к пролекарственным соединениям биологически активных агентов, транзиентно связанных с гидрогелем, и используются в качестве синонимов.
Термины «лекарственное соединение», «биологически активная молекула», «биологически активная часть молекулы», «биологически активный агент», «действующий агент» и т.п. означают любое вещество, которое может влиять на физически или биохимические свойства биологического организма, включая без ограничений, вирусы, бактерии, грибы, растения, животных и человека. В частности, используемые в настоящем изобретении биологически активные молекулы, включают любое вещество, предназначенное для диагностики, излечения, смягчения, лечения или предупреждения заболевания у человека или животных, или в противном случае - для усиления физического или душевного здоровья человека или животного.
Используемое в настоящем документе выражение «терапевтически эффективное количество» инсулина означает количество, достаточное для излечения, ослабления или частичной остановки клинических проявлений данного заболевания или его осложнений. Количество, достаточное для этого, определяют как «терапевтически эффективное количество». Эффективное количество для каждой цели будет зависеть от тяжести заболевания или поражения, а также от массы и общего состояния субъекта. Понятно, что соответствующую дозировку можно определить с использованием стандартных экспериментов путем создания матрицы значений и тестирования различных элементов в матрице, что входит в компетенцию опытного терапевта.
«Стабильный» и «стабильность» означает, что в пределах указанного времени хранения конъюгаты остаются конъюгированными и не гидролизуются в значительной степени, а также имеют приемлемый состав примесей относительно инсулина. Стабильной считается композиция, содержащая менее 5% лекарственного соединения в свободной форме.
Используемый в настоящем документе термин «биогидролизуемый сложный эфир» представляет собой сложный эфир соединения, который либо (а) не нарушает биологическую активность исходного вещества, но придает данному веществу предпочтительные свойства in vivo, такие как длительность действия, начало действия и т.п., либо b) является биологически неактивным, но легко превращается in vivo субъектом в биологически активное начало.
Используемый в настоящем документе термин «биогидролизуемый амид» представляет собой амид соединения, который либо (а) не нарушает биологическую активность исходного вещества, но придает данному веществу предпочтительные свойства in vivo, такие как длительность действия, начало действия и т.п., либо b) является биологически неактивным, но легко превращается in vivo субъектом в биологически активное начало.
Предполагается, что используемый в настоящем документе термин «гидрогель» означает трехмерную, гидрофильную или амфифильную полимерную сель, способную поглощать большое количество воды. Сети состоят из гомополимеров или сополимеров, являются нерастворимыми вследствие присутствия ковалентных химических или физических (ионных, гидрофобных взаимодействий, переплетений) сшивок. Сшивки обеспечивают структуру сети и физическую целостность. Гидрогели проявляют термодинамическую совместимость с водой, которая позволяет им набухать в водной среде. Цепи соединены в сети, образуя поры, и размер значительной части данных пор находится между 1 нм и 1000 нм.
Термин «гель» относится к несшитому, гелеподобному раствору полимера.
Предполагается, что используемый в настоящем документе термин «депо-препарат» означает систему доставки для лекарственного соединения инсулина, обычно вводимую с помощью подкожной или внутримышечной инъекции и способную к постоянному высвобождению действующего соединения в течение продолжительного периода времени.
Предполагается, что используемый в настоящем документе термин «пиковая концентрация» означает максимальную концентрацию, полученную после введения соединения инсулина.
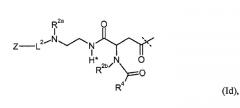
Предполагается, что используемый термин «соединение инсулина» означает любой инсулин млекопитающих, например, инсулин человека, свиной инсулин или бычий инсулин с дисульфидными мостиками между CysA7 и CysB7 и между CysA20 и CysB19, а также с внутримолекулярным дисульфидным мостиком между CysA6 и CysA11, рекомбинантный инсулин млекопитающих, например, рекомбинантный инсулин человека, аналоги инсулина, производные инсулина и их фрагменты, типичными примерами являются rh инсулин, инсулин гларгин, инсулин детемир, инсулин глулизин, инсулин аспартат, инсулин лизпро, инсулин, конъюгированный с низкомолекулярным ПЭГ, где низкомолекулярный ПЭГ имеет молекулярную массу меньше 10 кДа. Соединение инсулина может находиться в форме пролекарственного соединения, в случае которого соединение, высвобождаемое в плазму, является активным инсулином, которое образуется после введения пролекарственного соединения.
Под «аналогом инсулина», используемым в настоящем изобретении, понимается полипептид, имеющий молекулярную структуру, которую формально можно получить из структуры природного инсулина, например, инсулина человека, в результате удаления и/или замены по меньшей мере одного аминокислотного остатка, присутствующего в природном инсулине, и/или в результате добавления по меньшей мере одного аминокислотного остатка. Добавляемые и/или используемые для замены аминокислотные остатки могут представлять собой либо кодируемые аминокислотные остатки, либо другие природные остатки, либо чисто синтетические аминокислотные остатки.
Аналогами инсулина могут быть белки, в которых природный остаток Pro в позиции 28 в В-цепи может быть изменен на один из Asp, Lys или Ile. В другом аспекте Lys в позиции B29 изменен на Pro. Также Asn в позиции A21 может быть изменен на Ala, Gln, Glu, Gly, His, Ile, Leu, Met, Ser, Thr, Trp, Tyr или Val, в частности, на Gly, Ala, Ser или Thr и, предпочтительно, на Gly. Кроме того, Asn в позиции B3 может быть изменен на Lys или Asp. Дополнительными примерами аналогов инсулина являются инсулин des(B30) человека; аналоги инсулина des(B30) человека; аналоги инсулина, в которых удален PheB1; аналоги инсулина с удлиненной с N-конца А-цепью и/или В-цепью и аналоги инсулина с удлиненной с С-конца А-цепью и/или В-цепью. Таким образом, один или два остатка Arg могут быть добавлены к позиции B1.
Под «инсулин desB30», «инсулин desB30 человека» понимается природный инсулин или его аналог, у которого отсутствует аминокислотный остаток В30. Аналогичным образом «инсулин desB29desB30» или «инсулин desB29desB30 человека» означает природный инсулин или его аналог, у которого отсутствуют аминокислотные остатки В29 и В30.
Под «В1», «А1» и т.д. понимается аминокислотный остаток в позиции 1 в В-цепи инсулина (считая с N-конца) и аминокислотный остаток в позиции 1 в А-цепи инсулина (считая с N-конца), соответственно. Также может быть указан аминокислотный остаток в указанной позиции, как например, PheB1, означающий, что аминокислотным остатком в позиции В1 является остаток фенилаланина.
Используемый в настоящем документе термин «неактивный линкер» означает линкер, который не оказывает фармакологических эффектов лекарственного соединения, полученного из биологически активного агента.
Используемый в настоящем документе термин «алкил» означает прямую или разветвленную углеродную цепь. Каждый водород углерода в алкиле может быть замещен заместителем.
Используемый в настоящем документе термин «С1-4алкил» означает алкильную цепь, имеющую 1-4 атомов углерода, например, на конце молекулы: метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил или, например, -CH2-, -CH2-CH2-, -CH(CH3)-, -CH2-CH2-CH2-, -CH(C2H5)-, -C(CH3)2-, когда две части молекулы соединены алкильной группой. Каждый водород углерода в С1-4алкиле может быть замещен заместителем.
Используемый в настоящем документе термин «С1-6алкил» означает алкильную цепь, имеющую 1-6 атомов углерода, например, на конце молекулы: С1-4алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гексил или, например, -CH2-, -CH2-CH2-, -CH(CH3)-, -CH2-CH2-CH2-, -CH(C2H5)-, -C(CH3)2-, когда две части молекулы соединены алкильной группой. Каждый водород углерода в С1-6алкиле может быть замещен заместителем.
Соответственно, «С1-18алкил» означает алкильную цепь, имеющую от 1 до 18 атомов углерода, а «С8-18алкил» означает алкильную цепь, имеющую от 8 до 18 атомов углерода. Соответственно, «С1-50алкил» означает алкильную цепь, имеющую от 1 до 50 атомов углерода.
Используемый в настоящем документе термин «С2-50алкенил» означает прямую или разветвленную алкенильную цепь, имеющую от 2 до 50 атомов углерода, например, на конце молекулы: -CH=CH2, -CH=CH-CH3, -CH2-CH=CH2, -CH=CH-CH2-CH3, -CH=CH-CH=CH2, или, например, -CH=CH-, когда две части молекулы соединены алкенильной группой. Каждый водород углерода в С2-50алкениле может быть замещен дополнительно указанным заместителем. Соответственно, термин «алкенил» относится к углеродной цепи по меньшей мере с одной двойной углеродной связью. Необязательно, могут присутствовать одна или несколько тройных связей.
Используемый в настоящем документе термин «С2-50алкинил» означает прямую или разветвленную алкинильную цепь, имеющую от 2 до 50 атомов углерода, например, на конце молекулы: -C≡CH, -CH2-C=CH, CH2-CH2-C=CH, CH2-C≡C-CH3, или, например, -C≡C-, когда две части молекулы соединены алкинильной группой. Каждый водород углерода в С2-50алкиниле может быть замещен дополнительно указанным заместителем. Соответственно, термин «алкинил» относится к углеродной цепи по меньшей мере с одной тройной углеродной связью. Необязательно, могут присутствовать одна или несколько двойных связей.
Используемый в настоящем документе термин «С3-7циклоалкил» или «С3-7циклоалкильное кольцо» означает циклическую алкильную цепь, имеющую от 3 до 7 атомов углерода, которая может иметь углеродные двойные связи, при этом по меньшей мере частично насыщенную, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил. Каждый водород углерода в циклоалкиле может быть замещен заместителем. Термин «С3-7циклоалкил» или «С3-7циклоалкильное кольцо» также включает соединенные мостиками бициклы, такие как норбонан или норбонен. Соответственно, «С3-5циклоалкил» означает циклический алкил, имеющий от 3 до 5 атомов углерода.
Соответственно, «С3-10циклоалкил» означает циклический алкил, имеющий от 3 до 10 атомов углерода, например, «С3-7циклоалкил», циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил, циклооктил, циклононил, циклодецил. Термин «С3-10циклоалкил» также включает по меньшей мере частично насыщенные карбомоно- и -бициклы.
Используемый в настоящем документе термин «галоген» означает фтор, хлор, бром или йод. Обычно предпочтительно, чтобы галогеном являлся фтор или хлор.
Используемый в настоящем документе термин «4-7-членный гетероциклил» или «4-7-членный гетероцикл» означает кольцо с 4, 5, 6 или 7 атомами в кольце, которое может содержать до максимального количества двойных связей (ароматическое или неароматическое кольцо, полностью насыщенное, частично насыщенное или ненасыщенное), в котором по меньшей мере один атом в кольце (и до 4 атомов в кольце) заменен гетероатомом, выбранным из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая =N(O)-), и когда кольцо присоединено к остальной молекуле через атом углерода или азота. Примерами 4-7-членных гетероциклов являются азетидин, оксетан, тиетан, фуран, тиофен, пиррол, пирролидин, имидазол, имидазолин, пиразол, пиразолин, оксазол, оксазолин, изоксазол, изоксазолин, тиазол, тиазолин, изотиазол, изотиазолин, тиадиазол, тиадиазолин, тетрагидрофуран, тетрагидротиофен, пирролидин, имидазолидин, пиразолидин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин, тиадиазолидин, сульфолан, пиран, дигидропиран, тетрагидропиран, имидазолидин, пиридин, пиридазин, пиразин, пиримидин, пиперазин, пиперидин, морфолин, тетразол, триазол, триазолидин, тетразолидин, диазепан, азепин или гомопиперазин.
Используемый в настоящем документе термин «9-11-членный гетеробициклил» или «9-11-членный гетеробицикл» означает гетероциклическую систему из двух колец с 9-11 атомами в кольце, причем по меньшей мере один кольцевой атом входит в оба кольца, и которая может содержать до максимального количества двойных связей (ароматическое или неароматическое кольцо, полностью насыщенное, частично насыщенное или ненасыщенное), в которой по меньшей мере один атом в кольце (и до 6 атомов в кольце) замещен гетероатомом, выбранным из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая =N(O)-), и когда кольцо присоединено к остальной молекуле через атом углерода или азота. Примерами 9-11-членных гетеробициклов являются индол, индолин, бензофуран, бензотиофен, бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензимидазол, бензимидазолин, хинолин, хиназолин, дигидрохиназолин, хинолин, дигидрохинолин, тетрагидрохинолин, декагидрохинолин, изохинолин, декагидроизохинолин, тетрагидроизохинолин, дигидроизохинолин, бензазепин, пурин или птеридин. Термин 9-11-членный гетеробицикл также включает спироструктуры из двух колец, такие как 1,4-диокса-8-азаспиро[4.5]декан или соединенные мостиком гетероциклы, такие как 8-аза-бицикло[3.2.1]октан.
Используемый в настоящем документе термин «фармацевтически приемлемый» означает одобренный надзорными органами, такими как EMEA (Европа) и/или FDA (США), и/или любыми другими национальными надзорными органами для применения у животных, предпочтительно у человека.
Используемый в настоящем документе термин «фармацевтическая композиция» или «композиция» означает одни или несколько действующих ингредиентов, и один или несколько инертных ингредиентов, а также любой продукт, который получается прямо или непрямо в результате объединения, образования комплексов или агрегации любых двух или нескольких ингредиентов, или в результате диссоциации одного или нескольких ингредиентов, или в результате других типов реакций или взаимодействий одного или нескольких ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению охватывают любую композицию, изготовленную путем смешивания соединения по настоящему изобретению и фармацевтически приемлемого вспомогательного вещества (фармацевтически приемлемого носителя).
«Свободная форма» лекарственного соединения от