Способ анализа рнк
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способу анализа пригодности РНК, экстрагированной из ткани или клетки (клеток), фиксированных с помощью фиксатора, для анализа экспрессии генов. Способ включает проведение электрофореза с указанной РНК. Определяют, удовлетворяет ли указанная РНК следующему уравнению: В/А≤1, где А представляет массовое соотношение (%) РНК в диапазоне от 1000 до 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, а В представляет массовое соотношение (%) РНК в диапазоне более чем 4000 нуклеотидов к общей массе РНК, что определено электрофорезом. Если указанная РНК, экстрагированная из ткани или клетки (клеток), удовлетворяет указанному уравнению, то она пригодна для анализа экспрессии генов. Предложенное изобретение позволяет быстро и с высокой эффективностью определить пригодность РНК для анализа экспрессии генов. 6 з.п. ф-лы, 3 ил., 11 табл., 7 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу анализа РНК, экстрагированной из ткани или клетки(клеток), фиксированной(ых) с помощью фиксатора.
УРОВЕНЬ ТЕХНИКИ
В последние годы существенно возросла потребность в разработке техник анализа генов в большом числе образцов, которые хранятся в больницах и научно-исследовательских институтах в виде тканей или клеток, фиксированных с помощью фиксатора, таких как фиксированные в формалине залитые в парафин (FFPE) ткани. Поскольку было накоплено большое количество полученных ранее данных по заболеваниям, особенно в виде тканей FFPE, разработка техники, которая позволяет экстрагировать и анализировать экспрессию генов, экстрагированных из тканей FFPE, дает возможность проводить ретроспективные исследования, используя ткани, хранившиеся в течение длительного периода, в значительной степени содействуя разработке перспективного лечения и профилактики заболеваний.
Тем не менее, поскольку при обычных условиях фиксации и хранения происходит деградация и фрагментация РНК, экстрагированных из фиксированных тканей и фиксированных клеток, таких как образцы FFPE, полагали, что анализ экспрессии генов с помощью такой РНК затруднителен. Кроме того, формальдегид (формалин), который наиболее часто используется в качестве фиксатора, иногда вызывает перекрестное связывание РНК-РНК или РНК-белок или добавление к РНК формальдегида или модификацию РНК формальдегидом. В случаях, когда РНК находится в таком состоянии, ферментативные реакции и/или химические реакции протекают с трудом, что приводит к проблематичности анализа экспрессии генов. Поэтому существовала потребность в технологии, посредством которой может быть осуществлен анализ экспрессии генов с участием образца РНК, у которого наблюдается обширная деградация и/или фрагментация, или с участием образца РНК, в котором происходит перекрестное связывание, добавление и/или модификация. Кроме того, она может в значительной степени помочь оценить перед анализом экспрессии генов такого образца РНК качество образца РНК, определив степени деградации/фрагментации, перекрестного связывания и добавления/модификации, чтобы определить, возможен или нет анализ, для осуществления точного анализа экспрессии генов и анализа экспрессии миРНК, и поэтому была необходима техника, которая дает возможность такой оценки.
В патентных документах 1-4 описаны техники, относящиеся к способам, в которых анализ экспрессии генов осуществляют после амплификации деградированной РНК.
В патентном документе 1 предлагается способ, композиция и набор, относящиеся к амплификации полинуклеотида-мишени для продукции большого числа его копий. Фактор амплификации мРНК на каждое время реакции амплификации обычно составляет от 50 до 100 или до 250; от 500 до 1000; или от 500 до не меньше чем 2000; и из суммарной РНК получают как можно больше амплифицированной РНК в количестве меньше нанограмма. Тем не менее, в случаях использования такого способа, в котором амплифицируют как можно больше РНК из небольшого количества РНК, фактор амплификации варьирует среди генов, то есть возрастает систематическая погрешность амплификации, так что можно утверждать, что уровень экспрессии каждого гена не может быть проанализирован точно.
Патентный документ 2 относится к способу применения фрагментированной РНК или подобного материала, такого как содержащийся в сохраненном материале зафиксированной залитой в парафин ткани, в полном анализе экспрессии генов, и предлагается способ получения образца, который дает возможность полной амплификации даже из образца, составленного из очень малой или предельно фрагментированной РНК. Тем не менее, этот способ содержит стадию полиаденилирования фрагментированной РНК, и в результате вариативность реакции на этой стадии может значительно повлиять на профиль экспрессии генов. Кроме того, в патентном документе 2 описан новый способ амплификации линейной РНК. В этом способе синтезируют двухцепочечную кДНК, имеющую якорную последовательность на 5'-конце и промоторную последовательность для РНК-полимеразы на 3'-конце, и с кДНК синтезируют кРНК зависимо от промоторной последовательности РНК-полимеразы с последующим праймингом якорной последовательности для повторного синтеза кДНК с этой кРНК, таким образом, амплифицируя небольшое количество РНК, полученное из небольшого количества клеток/ткани, полученных посредством лазерной захватывающей микродиссекции или сортировки клеток, чтобы супрессировать делецию региона кДНК или кРНК, соответствующего 5'-региону мРНК, которая возникает каждый раз при повторении цикла синтез кДНК-синтез кРНК, что было проблематичным в известных способах амплификации.
Способы и патентного документа 1 и патентного документа 2 описаны в качестве способов, в которых не наблюдается систематической ошибки при амплификации, и полагают, что систематическая ошибка на каждый цикл меньше, чем в принятых способах. Тем не менее, поскольку они фокусируются на амплификации как можно большего количества РНК из небольшого количества РНК, фактор амплификации весьма велик. Поэтому систематические ошибки могут накапливаться, что приводит к появлению большой систематической ошибки амплификации.
Патентный документ 3 относится к способу применения фрагментированной РНК или подобного материала, такого как содержащийся в сохраненном материале зафиксированной залитой в парафин ткани, в полном анализе экспрессии генов, и предлагается способ получения образца, который дает возможность полной амплификации даже из образца, составленного из очень малой или предельно фрагментированной РНК. Тем не менее, этот способ содержит стадию полиаденилирования фрагментированной РНК, и в результате вариативность реакции на этой стадии может существенно влиять на профиль экспрессии генов.
В патентном документе 4 описаны композиция и способ амплификации мишени в образце деградированной нуклеиновой кислоты, к которому относится способ измерения качества нуклеиновой кислоты в образце нуклеиновой кислоты, а также описан способ получения профиля экспрессии генов, используя образец деградированной РНК. Эффективности амплификации ампликонов (продуктов амплификации), обладающих различными размерами, полученных из одного и того же гена, используют как показатели оценки качества, принимая во внимание, что эффективность амплификации ампликона, обладающего большим размером, снижается, поскольку происходит деградация образца. В этом способе осуществляют ПЦР большого числа размеров почти каждого из от десяти до двадцати с лишним генов. При появлении деградации РНК прохождение амплификации становится менее вероятным, поскольку увеличивается размер ПЦР-зонда, так что полагают, что степень деградации может быть определена до некоторой степени. Тем не менее, поскольку на один образец РНК требуется ПЦР-амплификация в целом нескольких десятков генов, полагают, что этот способ затруднителен для реального осуществления.
В патентном документе 5 описан способ, в котором на чип для анализа нуклеиновых кислот загружают зонды, представляющие собой нуклеиновые кислоты, позволяющие определить индекс деградации, созданные на основе нуклеиновых последовательностей РНК, которые содержатся в длинноцепочечной фракции, если они не разрушаются, и образец РНК, полученный фракционированием коротких цепей суммарной РНК, гибридизуют с чипом для анализа нуклеиновых кислот с последующим измерением на основе наличия/отсутствия сигналов от нуклеиновых кислот-зондов для определения индекса деградации степени деградации образца РНК; и техника связана с чипом нуклеиновых кислот для измерения степени деградации РНК. Тем не менее, поскольку чип нуклеиновых кислот создан для короткоцепочечных РНК, таких как микроРНК (миРНК), полагают, что применение чипа для анализа экспрессии генов затруднительно. Кроме того, в случаях экстракции РНК из фиксированной ткани или фиксированной(ых) клетки(клеток), таких как FFPE, количество РНК, которое может быть получено, часто мало в отличие от случаев экстракции РНК из клетки(клеток) или замороженной ткани, и при таких условиях невозможно осуществить эксперимент, используя образец в количестве от нескольких до нескольких десятков микрограммов лишь для подтверждения качества образца РНК. С учетом стоимости также полагают, что этот способ никогда не сможет быть предпочтительным способом.
В патентном документе 6 существует описание способа измерения степени фрагментации нуклеиновой кислоты. Заявители этого патентного документа продают набор для решения, возможен или нет анализ образца РНК, причем решение принимают, измерив количества 2 видов рибосомальной РНК (18S и 28S), чтобы определить соотношение 28S/18S. Полагают, что при разрушении РНК сначала деградирует 28S и после этого деградирует 18S. В этом наборе в случаях, когда 28S/18S составляет не больше чем 0,1, полагают, что качество РНК неудовлетворительно. Тем не менее, относительно РНК, экстрагированной из ткани или клетки(клеток), фиксированных с помощью фиксатора, в процессе фиксации РНК обычно разрушается, и более того, поскольку фиксированные ткани и клетки обычно хранятся при комнатной температуре, РНК дополнительно разрушается со временем. Поэтому в РНК, экстрагированной из фиксированной формалином залитой в парафин (FFPE) ткани, вышеописанные 2 вида рибосомальной РНК часто не могут быть детектированы, и в таких случаях согласно описанному выше стандарту оценки качества образца РНК большинство образцов определяют как не анализируемые. Таким образом, очень проблематично использовать набор для осуществления ретроспективного исследования, используя фиксированную ткань или фиксированную(ые) клетку(клетки), хранившиеся в течение длительного периода.
Патентный документ 7 представляет собой способ анализа РНК, в котором миРНК в сохраненной ткани, содержащей деградированную мРНК, причем миРНК связывается с RISC (индуцированным РНК комплексом сайленсинга) и не деградирует, высвобождается с помощью обработки нагреванием или подобным с последующим определением миРНК посредством ПЦР-амплификации. Поскольку для высвобождения миРНК из RISC необходима обработка при высокой температуре 95°С, нельзя исключить возможность деградации в этом процессе, и в этом документе не упоминается способ подтверждения качества РНК.
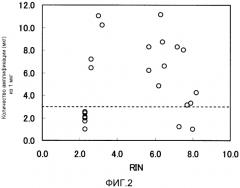
Кроме того, в случаях использования системы капиллярного электрофореза (например, “Bioanalyzer”, продукция фирмы Agilent Technologies) в качестве индекса деградации РНК рассчитывают RIN (число целостности РНК), которое представляет собой стандарт измерения, разработанный фирмой Agilent Technologies. RIN рассчитывают, исходя из полной электрофореграммы образца РНК, подвергнутого электрофорезу, и оно варьирует в диапазоне от 0 до 10 (непатентный документ 1). Биоанализатор, производимый фирмой Agilent Technologies, представляет собой прибор, широко используемый для оценки качества нуклеиновой кислоты, и в случаях использования этого прибора RIN представляет собой индекс, широко используемый для представления качества РНК. Тем не менее, при анализе РНК, экстрагированных из фиксированных тканей или фиксированных клеток, с помощью биоанализатора даже у РНК с четко отличающимися электрофореграммами и большим числом показателей деградации наблюдаются практически одинаковые величины RIN между 2 и 3. Поэтому существовала вероятность того, что RIN не обязательно отражал действительное состояние РНК. Способы оценки, может ли РНК, экстрагированная из большого числа тканей или клеток, фиксированных с помощью фиксатора, быть подвергнута анализу, в действительности ограничены.
ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Патентные документы
[Патентный документ 1] японская выложенная переведенная патентная заявка РСТ № 2006-520603.
[Патентный документ 2] JP 2005-224172 A.
[Патентный документ 3] японская выложенная переведенная патентная заявка РСТ № 2007-515964.
[Патентный документ 4] японская выложенная переведенная патентная заявка РСТ № 2008-541699.
[Патентный документ 5] JP 2008-35779 A.
[Патентный документ 6] JP 2008-43332 A.
[Патентный документ 7] японская выложенная переведенная патентная заявка РСТ № 2009-501531.
Непатентный документ
[Непатентный документ 1] Schroeder A, Mueller O, Stocker S, Salowsky R, Leiber M, Gassmann M, Lightfoot S, Menzel W, Granzow M, Ragg T: The RIN: an RNA integrity number for assigning integrity values to RNA measurements; BMC Molecular Biology 7:3 (2006).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
При необходимости анализа РНК, экстрагированной из ткани или клетки(клеток), фиксированных фиксатором, в предшествующем уровне техники не оказалось доступного способа оценки, простой и с высокой вероятностью, подходит ли экстрагированная РНК для анализа, и поэтому было трудно оценить адекватность данных, полученных с помощью анализа.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМ
В связи с описанной выше проблемой, авторы настоящего изобретения тщательно проанализировали ее, обнаружив, что при осуществлении анализа экспрессии генов, исходя из РНК, экстрагированной из ткани или клетки(клеток), фиксированных фиксатором, могут быть получены в высокой степени адекватные и воспроизводимые данные, отражающие исходное количество РНК, при проведении перед анализом электрофореза РНК и оценки, подходит ли РНК для анализа, исходя из паттерна электрофореза, с последующим проведением анализа в случаях, когда решали, что РНК подходит для анализа, таким образом, завершив настоящее изобретение.
Кроме того, авторы настоящего изобретения также обнаружили, что в случаях, когда при амплификации РНК берется фактор амплификации от 2 до 20 по отношению к исходному количеству РНК, систематическая ошибка вследствие амплификации может быть снижена, и поэтому могут быть получены в высокой степени адекватные и воспроизводимые данные, отражающие исходное количество РНК, таким образом, завершая настоящее изобретение.
Таким образом, настоящее изобретение определяется пунктами с (1) по (7) ниже.
(1) Способ анализа РНК, экстрагированной из ткани или клетки(клеток), фиксированных фиксатором, причем способ содержит стадию, на которой определяют, удовлетворяет ли РНК следующему уравнению:
Уравнение: В/А ≤1
[где А представляет массовое соотношение (%) РНК в диапазоне от 1000 до 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, и В представляет массовое соотношение (%) РНК в диапазоне от более чем 4000 нуклеотидов к общей массе РНК, что определено электрофорезом].
(2) Способ анализа РНК по (1), причем способ дополнительно содержит стадию, на которой оценивают, составляет ли соотношение А (%) не меньше чем 25%.
(3) Способ анализа РНК по (1) или (2), в котором анализируют продукт амплификации, полученный амплификацией оцененной РНК с фактором амплификации от 2 до 20.
(4) Способ анализа РНК по (1) или (2), в котором оцененную РНК анализируют без амплификации.
(5) Способ анализа РНК по (4), в котором РНК представляет собой миРНК.
(6) Способ анализа РНК по любому из п.п. с (1) по (5), в котором фиксатор содержит формальдегид и/или параформальдегид.
(7) Способ анализа РНК по любому из п.п. с (1) по (6), в котором ткань или клетку(клетки), фиксированные фиксатором, заливают в парафин или заливают в соединение ОСТ.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
С помощью способа по настоящему изобретению для анализа РНК возможен анализ, точно отражающий исходное количество гена даже с РНК, экстрагированной из ткани или клетки(клеток), фиксированных фиксатором, и предпочтительный эффект может быть получен особенно в анализе на микрочипе. Кроме того, с помощью способа по настоящему изобретению для анализа РНК может быть оценено до анализа, подходит ли для анализа РНК, экстрагированная из ткани или клетки(клеток), фиксированных фиксатором, и таким образом заранее может быть предотвращена трата реагентов и подобное.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
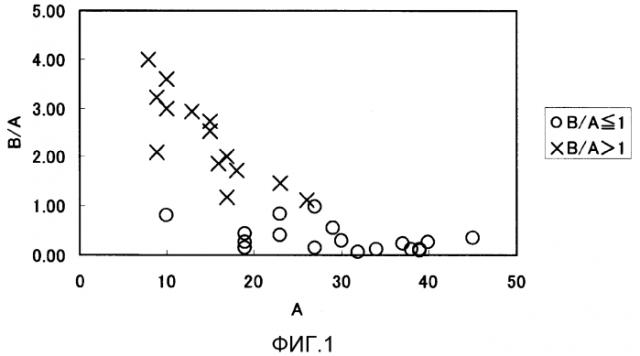
На фиг. 1 показана диаграмма, полученная определением массового соотношения (%) РНК в диапазоне от 1000 до 4000 нуклеотидов (А) и массового соотношения (%) РНК в диапазоне более чем 4000 нуклеотидов (В), эти соотношения определяли, используя биоанализатор, для большого числа РНК, и отмечая А на оси абсцисс и В/А на оси ординат.
На фиг.2 показана диаграмма, на которой отмечали величины RIN и количества амплификации большого числа РНК.
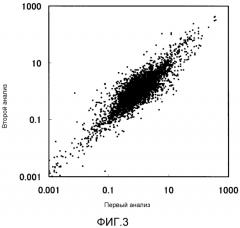
На фиг.3 показана диаграмма рассеивания, полученная при двукратном осуществлении анализа экспрессии для тканей FFPE мозга и печени мышей, используя микрочип, таким образом измеряя интенсивность сигнала для каждого гена в каждом из первых и вторых анализов с последующим нанесением на график соотношений мозг/печень, определенных, исходя из этих анализов.
ЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение далее будет описано более конкретно.
Под «тканью или клеткой(ами), фиксированными фиксатором» по настоящему изобретению понимают ткань или клетку(клетки), подвергнутые обработке для сохранения биологического образца в насколько возможно природном состоянии путем погружения ткани или клетки(клеток) в раствор, названный фиксатором, то есть обработке фиксацией. К предпочтительным примерам фиксатора, использованного в этой обработке, относятся растворы формальдегида; растворы параформальдегида; растворы, содержащие спирт, такой как этанол или метанол, ацетон или хлороформ; фиксаторы, содержащие кислоту, такую как пикриновая кислота или бихромат калия (например, фиксатор Боуина, фиксатор Замбони или фиксатор Орта); и растворы, содержащие металл, такие как ацетат цинка, хлорид цинка или сульфат цинка. Кроме того, также предпочтительно используются смеси 2 или больше видов вышеуказанных растворов, такие как фиксатор Карноя, который составлен из этанола, хлороформа и уксусной кислоты; и фиксатор метакарн, который составлен из метанола, хлороформа и уксусной кислоты.
По настоящему изобретению в качестве фиксатора более предпочтительно используется раствор, содержащий формальдегид или параформальдегид. Раствор формальдегида может быть получен разбавлением коммерчески доступного формалина (формальдегид в концентрации 37%) водой или также может быть предпочтительно получен доведением величины рН водного раствора до нейтральной с помощью карбоната кальция, карбоната магния или подобного или разбавлением формальдегида фосфатным буфером для доведения величины рН до нейтрального значения. Кроме того, может быть использован раствор формалина после удаления его дурного и вызывающего раздражение запаха и доведения его концентрации (торговое наименование: Maskedform). Содержание формальдегида в растворе формальдегида предпочтительно составляет от 1 до 30%, более предпочтительно от 2 до 20%. Раствор параформальдегида может быть получен растворением порошка параформальдегида в воде, фосфатном буфере или подобном, или растворением порошка параформальдегида в воде и небольшом количестве гидроксида натрия и затем доведением величины рН фосфатным буфером или подобным до нейтрального значения; или может быть использован коммерчески доступный раствор параформальдегида. Концентрация предпочтительно составляет от 1 до 10%, более предпочтительно от 2 до 8%.
Фиксированная ткань или клетка(клетки) может(могут) быть залита(ы) в парафин. В случаях заливки фиксированной ткани или клетки(клеток) в парафин процедура может быть осуществлена согласно широко используемой технике, известной специалистам в данной области. А именно, фиксированную ткань или клетку(клетки) подвергают замещению спиртом для обезвоживания ткани или клетки(клеток) с последующим замещением ксилолом, бензолом или подобным. После чего в форму, в которую наливали парафин, расплавленный нагреванием, помещают ткань или клетку(клетки) и заливают для получения парафинового блока. При экстракции РНК из ткани или клетки(клеток), залитых в парафин, перед применением ткань или клетку(клетки) нарезают, используя микротом, такой как ротационный микротом или санный микротом. Толщина каждого тонкого среза не ограничивается и предпочтительно составляет от 1 до 100 мкм, более предпочтительно от 2 до 50 мкм. Альтернативно, вместо парафина может быть использовано соединение ОСТ (оптимальная температура нарезания), которое используют в основном для получения срезов замороженной ткани. Также предпочтительно используют способ, заключающийся в экстракции РНК из ткани, извлеченной посредством микродиссекции или подобного, в котором парафиновый блок нарезают и прикрепляют к предметному стеклу, и часть ее собирают путем лазерной захватывающей микродиссекции (LCM), применения скальпеля или подобного для сбора анализируемой ткани. В случаях осуществления LCM ткань или клетка(клетки) может(могут) быть окрашена(ы) для повышения возможности их визуального контроля при получении анализируемой ткани или клетки(клеток). В качестве красителя для применения в этой обработке могут быть использованы крезилвиолет, гематоксилин-эозин (НЕ), ядерный прочный красный (NFR) или подобное.
«РНК, экстрагированная из ткани или клетки(клеток), фиксированной(ых) фиксатором» по настоящему изобретению представляет собой РНК, которую экстрагируют из ткани или клетки(клеток), фиксированной(ых), используя вышеуказанный фиксатор, путем расщепления белков в ткани или клетке(ах) с помощью фермента. К их примерам относятся мРНК, рРНК, тРНК и миРНК, и РНК предпочтительно представляет собой мРНК или миРНК, более предпочтительно миРНК. Поскольку экстракт может быть контаминирован примесями, такими как ДНК и белки, после экстракции предпочтительно осуществляют процедуру очистки. Способ очистки, используемый в этой процедуре, не ограничивается, и к его примерам относятся способ, в котором используют колонку, имеющую кремниевую мембрану, анионообменную смолу или подобное, способ, в котором используют жидкостную хроматографию, такую как обратнофазовая хроматография, способ, в котором РНК осаждают, используя органический растворитель, способ, в котором к раствору, содержащему РНК, добавляют раствор ацетата аммония в высокой концентрации для избирательного осаждения РНК, и способ, в котором используют магнитные шарики. В вышеуказанных экстракции и очистке может быть предпочтительно использован набор для экстракции РНК для фиксированных формалином залитых в парафин тканей, такой как «набор для выделения суммарной нуклеиновой кислоты для тканей FFPE RecoverAll (торговое наименование)» (продукция фирмы Ambion), «набор для тканей FFPE RNeasy» (продукция фирмы Qiagen), «набор ISOGEN PB» (продукция фирмы Nippon Gene Co., Ltd), «набор для очистки РНК из тканей FFPE» (продукция фирмы Norgen), «набор для выделения РНК из тканей FFPE PureLink (торговое наименование)» (продукция фирмы Invitrogen), «High Pure FFPE RNA Micro» (продукция фирмы Roche Applied Science), «набор Agencourt FormaPure (торговое наименование)» (продукция фирмы Beckman Coulter) или «набор для экстракции из тканей FFPE QuickExtract (торговое наименование)» (продукция фирмы Epicentre).
Поскольку компоненты фиксатора могут вызывать деградацию и/или перекрестное связывание/модификацию РНК, экстрагированной из ткани или клетки(клеток), фиксированной(ых) вышеописанным фиксатором, во многих случаях было затруднительно подвергать образец анализу, пользуясь межмолекулярным взаимодействием с веществом, которое может непосредственно или косвенно и избирательно связываться с РНК (далее в настоящем документе обозначаемым как избирательно связывающееся вещество). Поэтому предварительная оценка, подходит ли образец для анализа, оказалась технически сложно осуществимой. Как описано в последующих примерах и подобном, авторы настоящего изобретения обнаружили, что подходит ли РНК, экстрагированная из ткани или клетки(клеток), для анализа на микрочипе, можно оценить путем осуществлении стадии определения массового соотношения РНК в диапазоне от 1000 до 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, и массового соотношения РНК в диапазоне более чем 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, для того, чтобы заранее устранить образцы РНК, содержащие высокие соотношения низкомолекулярной РНК в качестве индекса деградации и фрагментации РНК и/или высокомолекулярной РНК в качестве индекса перекрестного связывания и добавления/модификации РНК. Под «подходящим для анализа» в настоящем документе понимают состояние, когда при анализе РНК, используя межмолекулярное взаимодействие между РНК и избирательно связывающимся веществом, информация, сохраненная образцом, может быть точно считана. Как описано выше, при анализе РНК в случаях высоких степеней деградации и фрагментации или большого количества продуктов из-за наличия перекрестного связывания или добавки/модификации межмолекулярное взаимодействие с избирательно связывающимся веществом может быть ингибировано, при амплификации может не продуцироваться достаточное количество продукта или может возникнуть систематическая ошибка, так что существует большая вероятность того, что точный анализ может быть не осуществим.
В отношении РНК, экстрагированной из ткани или клетки(клеток), к примерам способа определения массового соотношения РНК в диапазоне от 1000 до 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, и массового соотношения РНК в диапазоне более чем 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, относится способ, в котором РНК сортируют, исходя из молекулярной массы и оценки количественного соотношения РНК в каждом диапазоне молекулярной массы. К конкретным примерам электрофореза в качестве способа сортировки образца РНК, экстрагированной из фиксированной ткани, клетки(клеток) или подобного, исходя из молекулярной массы, для определения распределения по молекулярной массе, относятся электрофорез в агарозном геле, электрофорез в полиакриламидном геле, капиллярный электрофорез и электрофорез на чипе. К примерам способов оценки количественного соотношения РНК в определенном диапазоне нуклеотидов относятся в случаях гель-электрофореза способы, в которых для оцифровки интенсивности полос используют большое число денситометров или устройств для формирования изображения, таких как “Typhoon” (продукция фирмы GE Healthcare), известных специалистам в данной области. В случаях осуществления электрофореза на чипе, используя систему для проведения электрофореза, такую как «биоанализатор Agilent 2100» (продукция фирмы Agilent Technologies), количественное соотношение РНК в конкретном диапазоне молекулярных масс может быть подходящим образом рассчитано путем осуществления анализа пятен, включенного в специальное программное обеспечение. Необходимо отметить, что в случаях анализа электрофорезом не деградированной РНК (интактной РНК) может появляться 28S рибосомальная РНК, которая, как полагают, имеет около 4700 нуклеотидов, в виде полосы, имеющей пик на молекулярной массе, соответствующей молекулярной массе РНК, имеющей несколько меньше чем 4000 нуклеотидов. Как полагают, это связано с тем, что каждая молекула 28S содержит большое число двухцепочечных регионов и поэтому обладает компактной структурой, что приводит к большей скорости миграции, чем ожидаемая, исходя из действительной молекулярной массы. Сходное описание этого явления можно найти в часто задаваемых вопросах (FAQ), представленных на домашней странице фирмы Agilent Technologies. Поэтому по настоящему изобретению 28S рибосомальная РНК рассматривается как находящаяся при электрофорезе по существу в диапазоне от 1000 до 4000 нуклеотидов. Кроме того, поскольку молекулярная масса 18S соответствует массе 1874 нуклеотидов и полоса 18S при электрофорезе появляется в диапазоне от 1000 до 4000 нуклеотидов, то 18S, конечно, включается в диапазон.
По настоящему изобретению конкретный способ оценки, подходит ли для анализа РНК, экстрагированная из фиксированной ткани или клетки(клеток), представляет собой способ, в котором для оценки, может ли образец подходящим образом быть подвергнут анализу, определяют, является ли А, массовое соотношение (%) РНК в диапазоне от 1000 до 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, меньше или таким же как В, массовое соотношение (%) РНК в диапазоне больше чем 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, то есть подтверждают, выполняется ли формула В/А≤1. Полагают, что фракция, содержащая РНК длиннее, чем 4000 нуклеотидов, содержит перекрестно сшитую РНК, которая может быть неспособна гибридизоваться с зондом. Поэтому в случаях анализа образца РНК, в котором соотношение В больше, чем соотношение А, количественно оцененная величина имеет тенденцию быть меньше, чем количество в действительности существующей мРНК или миРНК, и существует даже случай, когда мРНК или миРНК не может быть определена даже при ее существенной экспрессии. Таким образом, перед осуществлением анализа РНК, экстрагированной из фиксированной ткани или клетки(клеток), можно быстро оценить, подходит ли РНК для анализа, путем определения, не больше ли величина В/А РНК чем 1.
В случае наличия РНК, соответствующей В/А≤1, может быть получена высокая корреляция с результатами анализа на микрочипах не деградированной (интактной) РНК, экстрагированной из той же ткани или клетки(клеток). Под коэффициентом корреляции в настоящем документе понимают индекс, количественно представляющий силу взаимосвязи между 2 данными, и он варьирует между -1 и 1. Положительная величина представляет позитивную корреляцию; отрицательная величина представляет негативную корреляцию, и значение ноль представляет отсутствие корреляции. В целом, в случаях, когда абсолютная величина составляет не меньше чем 0,5, можно полагать, что корреляция существует; в случаях, когда абсолютная величина составляет меньше чем 0,5, можно полагать, что корреляция отсутствует; и чем значительнее степень корреляции между 2 данными, тем ближе абсолютная величина к 1. Для расчета коэффициента корреляции с помощью «Microsoft Office Excel» (продукция фирмы Microsoft) может быть использована функция «correl». По настоящему изобретению при определении коэффициента корреляции для генов, экспрессию которых обнаруживали одновременно в двух образцах, величина предпочтительно составляет не меньше чем 0,7, более предпочтительно не меньше чем 0,8, еще более предпочтительно не меньше чем 0,9.
Кроме того, в РНК, экстрагированной из фиксированной ткани или клетки(клеток), чем выше величина А, массовое соотношение (%) РНК в диапазоне от 1000 до 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, тем ближе РНК к интактному состоянию с отсутствием деградации, в этом случае велика вероятность получить показатели экспрессии генов или миРНК, сходные с таковыми у интактной РНК. В частности, находится ли РНК в состоянии, близком к интактному состоянию, можно быстрее оценить в случаях, когда соотношение А предпочтительно составляет не меньше чем 15%, более предпочтительно не меньше чем 20%, еще более предпочтительно не меньше чем 25%.
Кроме того, меньшая величина (А+В), которая представляет собой сумму А, массового соотношения (%) РНК в диапазоне от 1000 до 4000 нуклеотидов к общей массе РНК, что определено электрофорезом, и В, массового соотношения (%) РНК в диапазоне больше чем 4000 нуклеотидов к общей массе РНК, что определено электрофорезом (0≤(А+В)≤100) указывает на более высокое массовое соотношение РНК, меньшей чем 1000 нуклеотидов, то есть большее количество деградированной РНК. В случаях большого количества деградированной РНК может быть высока вероятность возникновения явления, названного перекрестной гибридизацией, при котором с зондом связывается РНК, отличная от РНК, гибридизация которой изначально ожидается, особенно в случаях осуществления анализа на микрочипе короткоцепочечной миРНК. В таких случаях полученный результат может указывать на более сильную экспрессию РНК, чем предполагалось, исходя из реального количества РНК, или может указывать на большее количество экспрессированной РНК, чем ее реальное количество. По настоящему изобретению величина А+В предпочтительно составляет (А+В)≥15, более предпочтительно (А+В)≥20, еще более предпочтительно (А+В)≥25.
Кроме того, также предпочтительно для более подробной оценки, может ли РНК быть проанализирована, определять наличие/отсутствие конкретного гена в РНК, экстрагированной из фиксированной ткани или клетки(клеток). При осуществлении этой процедуры с более высокой степенью достоверности можно оценить, возможен ли анализ. В таком случае путем обратной транскрипции РНК синтезируют кДНК, и кДНК используют в качестве матрицы для амплификации конкретного гена с помощью ПЦР. Полученный продукт амплификации затем оценивают посредством электрофореза, и в случаях, когда наличие конкретного гена может быть распознано, РНК оценивают как анализируемую. В качестве конкретного гена в настоящем документе предпочтительно выбирают ген, у которого, как полагают, теоретически маловероятно, чтобы наблюдалась вариативность среди образцов, такой как ген, названный ген домашнего хозяйства, или внутренний контроль. К примерам гена относятся глицеральдегид-3-фосфатдегидрогеназа, β-актин, β2-микроглобулин, гипоксантинрибозилтрансфераза, порфобилиногендезаминаза, фосфоглицераткиназа, циклофилин А и β-глюкуронидаза.
Настоящее изобретение не ограничено при условии, что в анализе используется межмолекулярное взаимодействие между РНК и избирательно связывающимся веществом, и к предпочтительным примерам средства для осуществления анализа относятся микрочипы.
Микрочип получают иммобилизацией большого числа типов избирательно связывающихся веществ на субстрате, составленном из неорганического(их) материала(ов), такого(их) как стекло, керамика и/или силикон; металла(ов), такого(их) как нержавеющая сталь и/или золото (позолота); и/или макромолекулярного(ых) материала(ов), такого(их) как полиэтилентерефталат, полиметилметакрилат (РММА), ацетат целлюлозы, поликарбонат, полистирол, полидиметилсилоксан и/или силоксановый каучук; и используют в качестве средства анализа для определения наличия/отсутствия связывания между иммобилизованным большим числом типов избирательно связывающихся веществ и тестируемым веществом и вместе с тем уровней связывания тестируемого вещества. К примерам избирательно связывающихся веществ, иммобилизованных на микрочипе, относятся нуклеиновые кислоты и другие антигенные соединения. К примерам нуклеиновых кислот относятся дезоксирибонуклеиновая кислота (ДНК), рибонуклеиновая кислота (РНК), пептидная нуклеиновая кислота (PNA), комплементарная ДНК (кДНК) и комплементарная РНК (кРНК). К примерам других антигенных соединений относятся низкомолекулярные соединения. Особенно предпочтительным избирательно связывающимся веществом является нуклеиновая кислота. Такое избирательно связывающееся вещество может быть коммерчески доступно, может быть синтезировано или может быть получено из природного источника, такого как биологическая ткань или клетки.
Микрочип не ограничен, и к его предпочтительным примерам относятся микрочипы, имеющие на поверхности субстрата нерегулярный(е) участок(и), где сверху выступающего(их) участка(ов) дополнительно может быть создано покрытие. В таком случае покрытие предпочтительно имеет один или несколько проникающих внутрь каналов, сообщающихся с полостью(ями). Эти каналы предназначены для введения жидкости(ей), такой(их) как раствор нуклеиновой кислоты и/или буфер для связывания и в то же время для поддержания давления внутри субстрата на уровне атмосферного давления. Предпочтительно существует большое число проникающих внутрь каналов на одну полость, и количество каналов особенно предпочтительно составляет от 3 до 6 с учетом простоты заполнения раствором образца. Способ продукции вышеописанного покрытия не ограничен, и к предпочтительным примерам способа относятся литье под давлением, горячее тиснение и машинная обработка в случае смолы; пескоструйная обработка в случае стекла или керамики; и способы, используемые в известных полупроводниковых процессах в случае силикона. Кроме того, посредством инкапсулирования микрочастиц между микрочипом и покрытием после внесения в полость(и) раствора образца возможно применить вибрацию раствора образца, создавая энергичное передвижение инкапсулированных микрочастиц в растворе. В резу