Конъюгат гликопротеина, обладающего активностью эритропоэтина, с производными n-оксида поли-1,4-этиленпиперазина (варианты), фармацевтическая композиция и способ получения конъюгата
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению конъюгатов гликопротеина, обладающего активностью эритропоэтина, с производными N-оксида полиэтиленпиперазина, и может быть использовано в медицине. Получают конъюгат эритропоэтина, соответствующий общей формуле (1): [-Aк-Bl-Cm-(D-C(O)-NH-EPO)p-]n, с молекулярной массой 50-190 кДа. Изобретение позволяет получить стабильный конъюгат эритропоэтина, который содержит биодеградируемые фрагменты N-оксидов поли-1,4-этиленпиперазина, что позволяет повысить безопасность препарата за счет резкого снижения антигенности (иммуногенности), токсичности и, следовательно, вероятности побочных эффектов, снижении частоты инъекций и режима дозирования, а также обеспечивает возможность проведения синтезов в водных растворах, повышение технологичности, экономичности и экологической безопасности производства. 3 н. и 13 з.п.ф-лы, 2 табл., 9 пр.
Реферат
Изобретение относится к биотехнологии и медицине и касается биологически активного конъюгата эритропоэтипа с физиологически активными производными N-оксидов поли-1,4-этиленпиперазина, которые могут содержать биодеградируемые фрагменты.
Эритропоэтин, в частности эритропоэтин бета (далее EPO), представляет собой биологически активный гликопротеин, являющийся митозостимулирующим фактором и гормоном дифференцировки, способствующим образованию эритроцитов из стволовых клеток, увеличивает число эритроцитов, ретикулоцитов, гематокрит, уровень гемаглобина в крови, а также скорость включения железа в клетки. Специфически влияет на эритропоэз, не оказывает влияния на лейкопоэз. Благодаря своим свойствам ПРО широко применяется в медицине.
Поскольку человеческий эритропоэтин играет ключевую роль в образовании эритроцитов, этот гормон может применяться при лечении заболеваний крови, для которых характерно низкое производство пли производство аномальных эритроцитов. В клинических условиях ЕРО применяют, например, для лечения анемии у пациентов с хронической почечной недостаточностью Eschbach J.W., Abdulhadi M.H., Browne J.K. и др., Ann. Intern. Med. 111:992 (1988); Lim V.S., Degowin R.L., Zavala D. и др., Ann. Intern. Med. 110:108-114 (1989), и страдающих СПИДом и раковых больных, подвергающихся химиотерапии (Danna R.P., Rudnick S.A., Abels R.I. в: M.B. Garnick (ред.) Erythropoietin in Clinical Application An International Perspective, New York, NY: Marcel Dekker; 1990: стр.301-324).
Вместе с этим доступность терапий с использованием различных белков, в частности терапия EPO, ограничена коротким периодом полураспада (T1/2) в плазме крови, что препятствует их лечебному действию. Так, T1/2 ЕРО в плазме составляет в среднем 6-8 часов.
Короткое время действия таких препаратов в организме предусматривает их многократное введение для достижения требуемого терапевтического эффекта. Еще одним важным негативным фактором, ограничивающим применение нативных или рекомбинаитных белковых препаратов, является их высокая реактогенность, иммуногенность и связанные с ней реакции сенсибилизации. Отдельно следует отметить технологические и практические проблемы, сопряженные с производством и хранением таких препаратов.
В последние годы для улучшения стабильности и увеличения T1/2 терапевтических белков широко исследуется возможность создания их конъюгатов на основе различных полимерных соединений.
Известны конъюгаты эритропоэтина (патент RU 2232163, патент RU №2433134), в которых в качестве субстрата для конъюгации эритропоэтина и его аналогов используют полиэтиленгликоль (ПЭГ).
ПЭГ и производные ПЭГ применяются для химической модификации разнообразных терапевтических белков. При конъюгации с такими молекулами ПЭГ повышает молекулярную массу и образует макромолекулярные структуры. Преимущество конъюгатов ПЭГ с биологическими молекулами заключается в том, что они характеризуются повышенным удерживанием активного вещества и замедленным метаболизмом в организме. ПЭГилированные эритропоэтины характеризуются более продолжительным временем полужизни в плазме крови по сравнению с немодифицированным эритропоэтином.
В то же время полиэтиленгликоль не разрушается в организме, накапливается в нем, что может вызывать нежелательные побочные эффекты, что является существенным недостатком его использования.
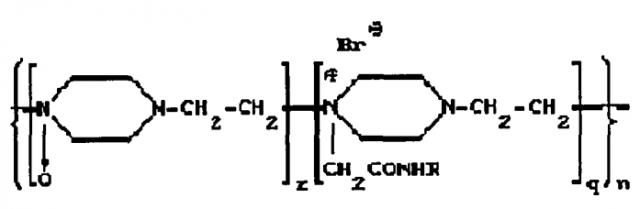
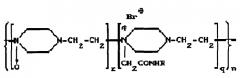
Известны конъюгаты белка с производными поли-1,4-этиленпиперазина. Например, в патенте RU 2112542 описывается препарат для лечения патологических состояний соединительной ткани на основе конъюгата фермента гиалуронидазы с синтетическим носителем полиоксидонием, при соотношении фермент(белок):носитель 1:(1-5). Конъюгат связан химической ковалентной связью и соответствует общей формуле:
R - фермент гиалуронидаза;
n=300-700 - количество элементарных звеньев;
q=0,2-0,4 - количество алкилированных звеньев;
z=0,4-0,8 - количество окисленных звеньев,
для лечения патологических состояний соединительной ткани.
Полиоксидоний, представляющий собой сополимер N-оксида 1,4-этиленпиперазина и N-карбоксиметил-1,4-пиперазиний бромида, обладает собственной физиологической активностью, что повышает эффективность лечения при использовании конъюгата. В частности полиоксидоний обладает свойствами иммуномодулятора и детоксиканта. Эффективность конъюгата гиалуронидазы показано на модели пневмофиброза. Конъюгат не только задерживает развитие пневмофиброзного процесса, но и обладает выраженной способностью рассасывать имеющуюся в легких фиброзную ткань. Конъюгат получают методом активированных эфиров либо конденсацией гидразида полиоксидония с гиалуронидазой.
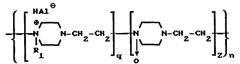
В патенте RU 2073031 описаны производные поли-1,4-этиленпиперазина, обладающие иммуномодулирующей, противовирусной и антибактериальными активностями. Указанные производные соответствуют общей формуле:
где R1 - алкил(C1-C16), (CH2)1-16OH, -(CH2)1-5COR2,
где R2 - -OH, -OCH3, -O(CH2)1-3CH3, -NHNH2, -NH(CH2)1-10NH2,
n=310-2000,
Z=0,1-0,8,
q=0,2-0,9, если в полимере звеньев q=0,2, тогда звеньев Z=0,8, если q=0,9, тогда звеньев Z=0,1,
Hal - Cl, Br, I.
Соединения получают частичным N-оксидированием поли-1,4-этиленпиперазипа перекисью водорода и полученные N-оксиды поли-1,4-этиленпиперазина алкилируют с образованием четвертичных аммониевых солей.
В патенте RU 2185388 описываются производные поли-1,4-этиленпиперазина и способ их получения. Способ включает «живую» катионную полимеризацию мономера триэтилендиамина при нагревании в присутствии катализатора. Полученный поли-1,4-пиперазин подвергают окислению в водном растворе и затем алкилированию Полученный в процессе алкилирования раствор сополимера N-оксида поли-1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний бромида после очистки, например, ультрафильтрацией может быть использован для дальнейшего синтеза водорастворимых биогенных соединений, в частности конъюгатов или комплексов с биологически активными веществами для получения препаратов пролонгированного действия и различного назначения. Раствор полученного сополимера N-оксида поли-1,4-этиленпиперазина и (N-карбоксиметил)-1,4-этиленпиперазиний бромида может быть использован также в качестве самостоятельного лекарственного препарата или как составная часть фармацевтических композиций.
Как разновидность поли-1,4-этиленпиперазинов известны полимеры триэтилендиаминов, получаемые катионной полимеризацией с размыканием кольца (см. патент RU 2041217). Наличие N-оксидных звеньев в полимерной цепи приводит к термодеструкции в физологических условиях по свободно-радикальному механизму с образованием олигомеров молекулярной массы 1000-2000 (Некрасов А.В., Пучкова Н.Г., Кинетика и механизм деструкции гетероцепных полимерных N-окисей, Высокомолекулярные соединения 1983, т. XXV Б, №9, стр.691-696). Установленные кинетические закономерности свидетельствуют о протекание деструкции N-оксидов поли-1,4-этиленпиперазинов в условиях, реализующихся в живом организме и выведения продуктов деструкции, что было подтверждено с помощью меченных по 14С полимерным N-оксидам. Кроме того, известно, что N-оксиды полиэтиленпиперазинов и их производные биодеструктирует до низкомолекулярных продуктов, способных выводиться из организма (см. авторское свидетельство СССР 523908).
Наиболее близким из известных аналогов к настоящему изобретению является эритропоэтин, конъюгированный с производным полиэтиленгликоля (препарат Мирцера по патенту WO №2002/049673). В данном конъюгате ЕРО с ПЭГ одна линейная молекула полимера массой 30 кДа присоединена к терминальной альфа-аминогруппе белка посредством амидной связи. Использование различных производных ПЭГ в качестве полимерных носителей для конъюгации с белками выявило существенные недостатки их применения. Эти недостатки ПЭГ обусловлены химическим строением и свойствами полимера. ПЭГ-жесткоцепной, не биодеградируемый полимер, что накладывает существенные ограничения по возможности его введения в живой организм. Вместе с этим применяемые в настоящее время ПЭГ-носители для конъюгации различных белков имеют в своем составе, преимущественно, только одну функциональную «якорную» группу на молекулу полимера, что приводит к необходимости использования большого избытка носителя для полноты прохождения реакции и, как следствие, к серьезным техническим проблемам, связанным с очисткой и выделением продуктов конъюгации.
Многостадийный, технически сложный процесс очистки (препаративная хроматографическая очистка целевых продуктов) и выделения приводит к существенному уменьшению выходов и, что не менее важно, к потере нативной активности белков в составе конъюгатов. Значительная потеря удельной специфической активности белков в составе конъюгатов приводит к необходимости увеличения активного вещества в лекарственном препарате. Как следствие всего вышеперечисленного, получаемые конъюгаты на основе ПЭГ-носителей, крайне дороги и малодоступны при лечении и профилактике различных заболеваний.
Помимо технологических проблем необходимо учитывать ряд клинических аспектов безопасности которые включают:
- токсичность промежуточных продуктов;
- вакуолизацию почек и селезенки;
- аккумуляцию высокомолекулярных ПЭГов в организме;
- при введении некоторых препаратов регистрируют активацию системы комплемента.
Задачей настоящего изобретения является создание новых стабильных физиологически активных препаратов эритропоэтина на основе биодеградируемых носителей, долговременно циркулирующих в кросотоке, в расширении спектра фармакологического действия препаратов на основе эритропоэтина за счет детоксидирующих и антиоксидантных свойств носителя, повышении безопасности препаратов за счет резкого снижения антигенности (иммуногенности), токсичности и, следовательно, вероятности побочных эффектов, снижении частоты инъекций и режима дозирования, а также в возможности проведения синтезов в водных растворах, повышение технологичности, экономичности и экологической безопасности производства.
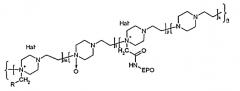
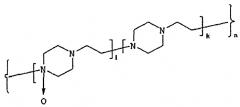
Поставленная задача решается новым соединением, представляющим собой конъюгат гликопротеина, обладающего активностью эритропоэтина, с производными N-оксида полиэтиленпиперазина, соответствующий общей формуле (1):
[-Ak-B1-Cm-(D-C(O)-NH-EPO)p-]n, и имеющий молекулярную массу 50-190 кДа, где C(O)-группа сополимера, которая образует амидную связь с аминогруппой гликопротеина NH-EPO,
Ak обозначает
где k - количество звеньев, содержащих этиленпиперазин, равно 50-235,
Bl обозначает
где l - количество звеньев, содержащих N-оксид этиленпиперазина, равно 120-475;
Cm обозначает
где Hal- - галоген, например, Br-, Cl-,
m - количество звеньев, содержащих функциональную группу, равно 4-77,
(D-CO-NH-EPO)p обозначает
Hal- - галоген, например, Br-, Cl-,
p - количество звеньев, содержащих эритропоэтин, (ЕРО) от 1 до 3,
n=k+l+m+p обозначает число примерно от 175 до 790, при этом этиленпиперазиновые звенья A, B, C и D сополимера, соединены между собой химическими связями и распределены по цепи сополимера статистически.
Полимер может начинаться с любого этиленпиперазинового звена A, B, C или D, вторым звеном может быть любое из этих же звеньев (A, B, C или D), третьим звеном может быть любое звено (A, B, C или D) и т.д.
Ранее не было известно конъюгатов гликопротеина, обладающих активностью эритропоэтина, с производным полиэтиленпиперазина указанной структурной формулы.
Конъюгат может содержать сополимер, содержащий биодеградируемый фрагмент производного N-оксида полиэтиленпиперазина, молекулярная масса которого составляет от 20 кДа до 90 кДа.
Предпочтительным является конъюгат, соответствующий общей структурной формуле (II):
где EPO - гликопротеин, представляющий собой эритропоэтин бета или альфа;
R - означает -COOH;
Hal- - Br-, Cl-;
k - количество звеньев, содержащих этиленпиперазин, от 50 до 235;
l - количество звеньев, содержащих N-оксид этиленпиперазина, от 120 до 475;
p - количество звеньев, содержащих EPO, от 1 до 3;
m - количество звеньев, содержащих функциональную группу R, 4-77;
n=k+l+m+p=175-790.
Для получения конъюгата может быть использован эритропоэтин альфа или бета. Может быть использован человеческий или рекомбинантный эритропоэтин.
Специфическая активность конъюгатов, обладающих активностью эритропоэтина, определяемая по увеличению количества ретикулоцитов, значительно выше по сравнению с исходным эритропоэтином. При этом конъюгаты обладают пролонгированным действием.
Конъюгаты настоящего изобретения могут быть использованы для лечения анемий связанных с хронической почечной недостаточностью, раковых больных, подвергающихся химиотерапии, больных СПИДом.
Изобретение также относится к фармацевтической композиции, содержащей конъюгат соответствующий общей формуле (I) в эффективном количестве. Предпочтительным является конъюгат соответствующий общей формуле (II).
Фармацевтическая композиция предназначена для приготовления растворов для внутривенного введения или подкожного введения и содержит обычно в конъюгате человеческий или рекомбинантный эритропоэтин. Фармацевтическая композиция может содержать различные количества эритропоэтина в составе конъюгата от 10 до 1000 мкг/мл, например 50 или 250 мкг/мл. Одна доза (в 1 мл) обычно содержит 50 мкг, 75 мкг, 100 мкг, 250 мкг или 1000 мкг конъюгата (из расчета на эритропоэтин), а также содержит вспомогательные вещества, например, натрия хлорид, натрия цитрат, Полисорбат 20, вода для инъекций.
Фармацевтическая композиция может использоваться для лечения анемий у пациентов с хронической почечной недостаточностью, раковых больных, подвергающихся химиотерапии, больных СПИДом.
Изобретение также относится к способу получения конъюгатов, соответствующих общей формуле (I).
Способ получения включает реакцию между гликопротеином, обладающим активностью эритропоэтина, и активированной формой полимерного носителя на основе N-оксида полиэтиленпиперазина общей формулы (III):
l - количество звеньев, содержащих N-оксид этиленпиперазина от 120 до 475, располагающиеся в составе полимера в любой последовательности;
k - количество звеньев, содержащих этиленпиперазин, от 55 до 315,
n=l+k=175-790, полученной введением реакционных групп алкилирующим реагентом, для образования химической ковалентной амидной связи между карбоксилсодержащим сополимером N-оксида полиэтиленпиперазина и аминогруппой гликопротеина, обладающего активностью эритропоэтина, в условиях карбодиимидного или азидного или сукцинимидного метода, при масс. соотношении сополимера и эритропоэтина, позволяющем получить конъюгат со значением p=1-3.
Способ получения соединения общей формулы (I) включает стадию предварительного образования электростатического комплекса конъюгата при pH 5,0-5,5 между гликопротеином и активированной формой полимерного носителя на основе N-оксида полиэтиленпиперазина общей формулы (III):
l - количество звеньев, содержащих N-оксид этиленпиперазина от 120 до 475, располагающиеся в составе полимера в любой последовательности;
k - количество звеньев, содержащих этиленпиперазин, от 55 до 315,
n=l+k=175-790, где указанные звенья соединены между собой химическими связями и распределены по цепи полимера статистически.
Активированную форму получают введением реакционноспособных групп в N-оксид поли(этиленпиперазина) общей формулы (III): с помощью алкилирующего реагента, например, бромуксусной кислотой, либо N-гидроксисукцинимидного эфира бромуксусной кислоты либо гидразида бромуксусной кислоты. Затем проводят конъюгацию путем ковалентного связывания с гликопротеином, обладающим активностью эритропоэтина.
При этом стадию образования межмолекулярного электростатического комплекса целесообразно проводить при pH 5,0-5,5 при температуре 2-6°C в течение 2 часов между гликопротеином и активированной формой носителя, полученной по реакции алкилирования бромуксусной кислотой N-оксида поли(этиленпиперазина) общей формулы (III), затем реакцию конъюгации осуществляют карбодиимидным методом при pH 5,0-5,5, температуре 2-6°C в течение 2-4 часов.
Реакцию конъюгации карбодиимидным методом обычно осуществляют в присутствии водорастворимого карбодиимида, например, 1-этил-3-(3-диметиламинопропил)-карбодиимида. Реакцию с использованием карбодиимидного метода проводят при pH 5,0-5,5, для получения конъюгатов с высокой специфической активностью.
Возможно проводить предварительную стадию образования межмолекулярного электростатического комплекса при pH 5,0-5,5 между EPO и активированной формой носителя, полученной на основе N-оксида поли(этиленпиперазина) общей формулы (III) по реакции алкилирования N-гидроксисукцинимидным эфиром бромуксусной кислоты, затем реакцию конъюгации завершают сукцинимидным методом при pH 8,0 при температуре 2-6°C в течение 6 часов.
Ковалентное связывание гликопротеина, обладающего активностью эритропоэтина, можно проводить азидным методом реакцией активированной формы N-оксида полиэтиленпиперазина общей формулы (III), полученной по реакции алкилирования гидразидом бромуксусной кислоты.
При этом в способе получения соединения ковалентное связывание гликопротеина, обладающего активностью эритропоэтина, проводят с носителем, содержащим биодеградируемые фрагменты с молекулярной массой от 20 кДа до 90 кДа. содержащиеся в N-оксида поли(этиленпиперазине) общей формулы (III).
Как видно из приведенных ниже данных, конъюгаты КГ-1 - КГ-6, полученные согласно предлагаемому способу, обладают специфической активностью, и значительно увеличивают количества ретикулоцитов при сравнении с ЕРО или сопоставимы по активности с ПЭГилированным эритропоэтином (Мирцера).
Производные N-оксида поли(этиленпиперазина) (FINO) являются ионогенными носителями, и за счет использования в качестве промежуточной стадии pH 5,0-5,5 происходит образование электростатического комплекса между эритропоэтином и макромолекулой носителя, поскольку поверхность белковой глобулы оказывается комплементарной поверхности полимера, что позволяет существенно повысить не только уровень стабилизации, но и количественный выход конечного продукта при проведении реакции ковалентной конъюгации путем образования амидной связи между молекулами эритропоэтина и носителя.
Представляется особенно важным различие в механизме обеспечения доставки стабилизированных препаратов к органам-мишеням, т.к. конъюгаты ПМО с активными соединениями образуют истинные растворы в физиологических средах и, циркулируя в кровотоке, обеспечивают высокую биодоступность стабилизированного препарата, значительно превышающую биодоступность гелеобразных ПЭГелированных структур. При этом сравнительные исследования показывают, что определенная эффективность достигается при значительно меньших концентрациях ПNO-конъюгатов, чем ПЭГ-конъюгатов. Таким образом, дозировки ПNO-конъюгатов могут быть существенно снижены, и, как следствие, становятся очевидными преимущества в безопасности и фармакоэкономике.
Создание пролонгированных эритропоэтинов в соответствии с изобретением решает основную задачу - стабилизацию эритропоэтинов, а именно:
1. В результате модификации эритропоэтина, обладающего определенной специфической активностью, растворимым полимером, который одновременно и стабилизирует активную конформацию гликопротеина и замедляет его выведение из системы циркуляции, получены долговременно циркулирующие в кровотоке стабильные соединения.
2. Для стабилизации эритропоэтина используют носитель, обладающий полезной биологической активностью и способный усиливать действие эритропоэтина, что является наиболее перспективным подходом для создания комплексных безбалластных активных биопрепаратов.
3. Поскольку UNO представляет собой объемную и достаточно жесткую полимерную матрицу, не оказывающую существенного влияния на специфические свойства гликопротеина, то обеспечивается резкое повышение его стабильности по отношению к различным инактивирующим воздействиям. В организме такие препараты по сравнению с нативным белком обладают не только увеличенным временем активного функционирования, но и повышенной безопасностью, резко сниженными антигенностью и токсичностью, нередко осложняющих применение нативных физиологически активных белков в качестве лекарственных препаратов.
Под ЕРО понимают природный или рекомбинантный гликопротеин, предпочтительно человеческий, получаемый, например, из донорской крови человека или получаемый генно-инженерными методами путем микробиологического синтеза гликопротеина из культуры клеток млекопитающих с использованием нативных и (или) рекомбинантных клеток. Методика получения и выделения эритропоэтина из природных или рекомбинантлых источников хорошо известна Huang S.L., Proc. Natl. Acad. Sci. USA 2708-2712 (1984), Lai P.H. и др., J. Biol. Chem. 261 3116-3121 (1986). Широко используется процедура, включающая ферментацию рекомбинантных клеток перевиваемой линии яичника китайского хомячка (CHO-клетки), которые содержат ген ЕРО, Kowar J. и Franek F. Methods in Enzymology 421 (1986) 277-292.
Конъюгаты в соответствии с настоящим изобретением обладают активностью, сопоставимой с препаратом пегилированнанного эритропоэтина и превосходящей нативный эритропоэтин, резко сниженной токсичностью и иммуногенностью. Вместе с этим полученные конъюгаты обладают пролонгированным действием, характеризуются резко увеличенным периодом полураспада в кровотоке и временем нахождения в плазме и могут найти широкое применение в медицине для лечения анемии у пациентов с хронической почечной недостаточностью.
Исключительной особенностью пролонгированных эритропоэтинов в соответствии с изобретением является то, что они получены на основе биодеградируемых сополимеров производных N-оксида полиэтиленпиперазина (ПNO) с общей формулой (III).
Наличие свободного третичного атома азота в основной цепи макромолекулы позволяет использовать ПNO в качестве носителя белковых молекул, что открывает широкие возможности модификации и введения различных высокореакционных функциональных групп, таких как карбоксильная группа и аминогруппа, с последующим образованием амидных связей в конъюгате с протеином, включая гликопротеины. Данная структура носителя ПNO отличается от ПЭГ, который имеет в своей структуре две конечные слабореакционные OH-группы.
Благодаря наличию в составе ПNO N-оксидных функциональных групп, носитель деструктируется в организме на олигомерные и низкомолекулярные соединения, способные полностью выводиться из организма после выполнения своей полезной функции. Производные ПNO обладают высокой реакционной способностью, позволяющей получать конъюгаты с белковыми молекулами (молекулами эритропоэтина) в мягких условиях и с высоким выходом. Кроме того, производные ПNO обладают физиологической и фармакологической активностью, проявляя антиоксидантные и детоксицирующие свойства, чем существенно отличаются от абсолютно нейтрального полиэтиленгликоля. Таким образом, химическая конъюгация ПNO, обладающего собственной физиологической активностью с физиологически активным белком, решает проблему создания безбаластного фармакологического средства.
Конъюгат в соответствии с изобретением отличает резко сниженная иммуногенность.
Конъюгат по настоящему изобретению имеет те же или большие области применения, что и ЕРО, например, при использовании в качестве средств для лечения анемии при хронической почечной недостаточности (диализные и предиализные пациенты), при онкологических заболеваниях (цитостатическая терапия), при комплексном лечении СПИД.
Создание нового пролонгированного препарата на основе конъюгатов ПNO с лекарственным препаратом ЕРО позволяет:
1. Снизить частоту инъекций и изменить режим дозирования препарата за счет повышения стабильности и времени нахождения препарата в крови, снижения протеолиза и инактивации белка сывороточными ингибиторами, а также почечной экскреции.
2. Существенно повысить специфическую и общетоксическую безопасность препарата (снижение аллергизирующих свойств, токсичности, иммуногенности).
3. Повысить эффективность проводимой терапии, особенно в условиях организма, ослабленного хроническим заболеванием, за счет наличия собственной активности носителя ПNO, обладающего антиоксидантным и детоксицирующим действием.
Пролонгированные препараты, получаемые по настоящему изобретению, представляют собой вещества с заданной молекулярной структурой. Они получены контролируемой и направленной химической модификацией гликопротеинов, обладающих свойствами эритропоэтина, с помощью оригинального полимерного носителя. При этом управление процессами осуществляют как на этапе получения необходимого носителя, так и при химическом манипулировании функциональными группами гликопротеина для создания амидных связей между эритропоэтином и синтетическим носителем. В новой молекуле белковая компонента защищена от денатурирующего воздействия среды, чем преимущественно достигается пролонгированное действие разрабатываемого лекарственного средства. Применяемые технологические способы получения путем конъюгирования ПNO с ЕРО позволяет получать гораздо более эффективные новые лекарственные средства.
Физиологически активные конъюгаты формулы 1 обладают активностью ЕРО, под которой понимают любую известную специфическую активность ЕРО, определяемую различными известными способами. При получении конъюгатов ЕРО с производными ПNO специфическая активность эритропоэтина в конъюгате составляет 3,0-3,5×105 МЕ/мг белка из исходного 1×105 МЕ/мг. При традиционном подходе (препарат Мирцера, Швейцария) специфическая активность эритропоэтина в составе пегилированного конъюгата 3,0×105 МЕ/мг белка из исходного 1×105 МЕ/мг Результаты, полученные в ходе синтеза конъюгатов эритропоэтина с ПNO, свидетельствуют о преимуществах разработанных способов по сравнению с известными методами. Прежде всего, это касается практически количественного выхода конечного продукта с увеличением специфической активности. Достижение количественного выхода конечного продукта стало возможным благодаря предварительной стадии образования электростатического комплекса между молекулами белка (эритропоэтина) и полимерного носителя. Следует отметить также, что реакция конъюгации протекает в мягких условиях, преимущественно в гомогенных водных растворах. Разработанные способы синтеза позволяют получать конъюгаты с высокой эффективностью, безопасностью, с выгодными фармакоэкономическими показателями по сравнению с существующими препаратами.
В некоторых случаях способ получения конъюгатов ПNO с ЕРО осуществляют следующим образом:
предварительно получают активированную форму ПNO путем введения реакционно-способных групп по реакции взаимодействия с алкилирующими реагентами (в частности, бромуксусной кислотой BrCH2COOH, гидразидом бромуксусной кислоты BrCH2CONHNH2), после чего добавляют раствор ЕРО в фосфатном буферном растворе (pH 5,0-5,5) и выдерживают при комнатной температуре в течение 2 часов. В этих условиях происходит электростатическое связывание двух противоположно заряженных макромолекул и образование устойчивого межмолекулярного комплекса. Затем проводят непосредственно реакцию конъюгации.
Для активации реакции конъюгации ПNO с эритропоэтином вводят любые известные, предназначенные для этой цели реагенты, например, из группы водорастворимых карбодиимидов или N-гидроксисукцинимидов в присутствии карбодиимидов. Ход реакции конъюгации контролируют по данным высокоэффективной жидкостной хроматографии (ВЭЖХ). Соотношение сополимер/эритропоэтин выбирают таким образом, чтобы в конъюгате получить преимущественно p=1-3. После завершения реакции реакционную смесь подвергают очистке методом ультрафильтрации, целевой продукт используют в виде жидкого раствора.
Нижеследующие примеры 1-6 иллюстрируют способы получения конъюгатов эритропоэтинов в соответствии с описываемым изобретением, а 7-8 - изучение их фармакологических свойств, где пример 7 иллюстрируют специфическую активность пролонгированного эритропоэтина, пример 8 - посвящен оценке фармакокинетики, пример 9 - различным аспектам доклинического исследования безопасности.
Пример 1. Получение пролонгированных эритропоэтинов путем конъюгации с ПNO карбодиимидным методом (синтез образца КГ-1).
1,0 г поли(этиленпиперазина) (ПЭП) растворяют в 30 мл 0,1 М раствора уксусной кислоты и добавляют 0,8 мл 30% перекиси водорода. Реакцию окисления ПЭП проводят в течение 20 часов при температуре 40°C.
Полученный полиэтиленпиперазин-N-оксида анализируют на содержание N-оксидных группы с помощью метода ИК-спектроскопии (характеристическая полоса 960 см-1) и определяют молекулярную массу методом ВЭЖХ с использованием детекторов малоуглового лазерного рассеяния и рефрактометрии. В результате определены следующие характеристики ПNО согласно формуле (III): l=400, к=210, n=610. Молекулярная масса фрагмента биодеградируемого ПNO составляет 70 кДа.
Для синтеза сополимера N-оксида этиленпиперазина и N-(карбоксиметил)-этиленпиперазиний галогенида (C-ПNO) к полученному ПNO добавляют 0,25 мл бромуксусной кислоты и при нагревании (50°C) и энергичном перемешивании реакцию проводят в течение 48 часов. Раствор фильтруют и проводят очистку на ультрафильтрационной установке.
В раствор, содержащий 100 мг C-ПNO, при температуре 4-6°C добавляют при перемешивании раствор эритропоэтина, содержащий 50 мг ЕРО в 20 мл 0,05 м фосфатного буферного раствора pH 5,0-5,5. Смесь перемешивают при температуре 2-6°C в течение 2 часов. Затем добавляют 1,1 мг водорастворимого карбодиимида -1-этил-3-(3-диметиламинопропил)-карбодиимида гидрохлорида) и перемешивают раствор при pH 5,0-5,5, температура 4-6°C в течение 2-6 часов при контроле степени конъюгации методом ВЭЖХ. После чего раствор очищают ультрафильтрацией на кассете с мембранами с номинальным удерживанием молекулярных масс 5 кДа при температуре 2-6°C (12,5 мМ нитратный буферный раствор), наличие примесей контролируют ВЭЖХ.
Получены следующие характеристики препарата формулы (1): выход конъюгата в расчете на белок 96%; конъюгат имеет чистоту более 98%, не содержит свободного эритропоэтина. Специфическая активность эритропоэтина в субстанции конъюгата представлена в таблице 1. Полученный конъюгат соответствует общей формуле II и характеризуется следующими параметрами: l=400, m=20, k=190, n=610, p=1.
Характеристики полученного конъюгата определяют следующими методами.
А. Количественное определение конъюгата эритропоэтина с C-ПNO проводят методом высокоэффективной ионообменной хроматографии.
Оборудование и условия анализа: насос для хроматографии при высоких давлениях в градиентном режиме; хроматографическая колонка: TSK SP-5PW, 75×7,5 мм;
спектрофлуориметрический детектор: λex 280 нм, λem 330 нм;
программно-аппаратный комплекс для сбора и обработки хроматографических данных МультиХром 1,5х. Подвижная фаза А: раствор 0,02 М NaH2PO4·H2O, pH 6,5.
Подвижная фаза Б: раствор 0,02 М NaH2PO4·H2O и 1,0 М натрия хлорида, pH 6,5.
Скорость потока: 1 мл/мин. Температура колонки: комнатная.
Хроматографируют 50 мкл стандартного образца конъюгата эритропоэтина с С-ПNО. Затем анализируют 50 мкл испытуемого препарата. На хроматограммах измеряют площадь пика испытуемого конъюгата и площадь пика конъюгата стандартного образца. Концентрацию ЕРО в составе конъюгата, Cк, в мкг/мл рассчитывают по формуле:
где Sк - площадь пика конъюгата на хроматограмме испытуемого препарата, мВ·с;
Sc - площадь пика конъюгата на хроматограмме стандартного образца, мВ·с;
Cc - концентрация ЕРО в стандартном образце, мг/мл;
Б. Количественное определение немодифицированного эритропоэтина проводят путем измерения площади пика индивидуального ЕРО со временем удерживания (4,5±0,5) минут и площадь конъюгата на хроматограмме, полученной согласно разделу А «Количественное определение конъюгата эритропоэтина с C-ПNO. Процентное содержание немодифицированного ЕРО (ω) в %, а также конъюгата рассчитывают по формуле
где SЭ - площадь пика ЕРО, мВ·с
S0 - суммарная площадь ЕРО и конъюгата, мВ·с.
В. Определение молекулярной массы конъюгата эритропоэтина с C-ПNO проводят методом высокоэффективной ситовой хроматографии.
Оборудование и условия анализа: насос для хроматографии при высоких давлениях; хроматографическая колонка: TSK G3000SW, 300×7,5 мм; спектрофлуориметрический детектор: λex 280 нм, λem 330 нм; программно-аппаратный комплекс для сбора и обработки хроматографических данных МультиХром 1,5х. Скорость потока: 0,8 мл/мин. Температура колонки: комнатная.
Хроматографируют по 20 мкл белки-калибранты в концентрации, 10 мкг/мл - бета-амилазу (200000 Да), алкогольдегидрогеназу (150000 Да), бычий сывороточный альбумин (66000 Да), бычья карбоновую ангидразу (29000 Да) (Sigma, кат. № MW-GF-1000) и конъюгаты эритропоэтина с C-ПNO. Определяют время удерживания и объем удерживания белков-калибрантов и конъюгата. Время выхода конъюгата составляет (6-12,5)±0,5 мин. Методом линейной регрессии с использованием программы Microsoft Excel, строят калибровочный график, откладывая по оси ординат логарифмы молекулярных масс белков-калибрантов, а по оси абсцисс - объем удерживания.
Молекулярную массу конъюгата определяют по калибровочному графику, учитывая объем удерживания. Молекулярная масса Мм конъюгата эритропоэтина составляет 115 кДа.
Пример 2. Получение пролонгированных эритропоэтинов путем конъюгации ЕРО с ПNO гидразидным методом (синтез образца КГ-2).
40 мг ПNO, полученного, как описано в примере 1, имеющего следующие характеристики: l=475, k=315, n=790, молекулярная масса (Мм) биодеградируемого ПNО 90 кДа, растворяют в 80 мл смеси диметилформамида и воды (в соотношении 3:1 по объему), при нагревании (40°C) и энергичном перемешивании добавляют 3 мл гидразида бромуксусной кислоты. Реакцию проводят в течение 48 часов. Затем раствор подвергают ультрафильтрационной очистке. Выход гидразидного производного ПNO 91%. Содержание гидразидных групп k=60 (метод титрования первичных аминогрупп 2,4,6-тринитробензолсульфокислотой).
3 мл 1н. HCl добавляют к 3 мл водного раствора, содержащего 20,0 мг гидразидного производного ПNO. Раствор охлаждают до 0-2°C. Затем при перемешивании и охлаждении добавляют 0,15 мл 3% раствора нитрита натрия. Через 30 минут доводят pH раствора до 7,0 добавлением 1 М Na2CO3.
Раствор 5,0 мг эритропоэтина в 2,0 мл 0,05 М фосфатного буфера pH 7,0 добавляют к реакционному раствору. Поддерживают pH реакционной смеси равным 7,0 добавлением 1 н. NaOH. Реакция продолжается в течение 12 часов при перемешивании и охлаждении (2-4°C). Для выделения и очистки конъюгата реакционную смесь наносят на колонку (2,6×90), заполненную Сефадекс G-100, в качестве элюента используют 0,01М фосфатный буферный раствор pH 6,0, содержащий 0,1М NaCl. Выход конъюгата контролируют с помощью проточного УФ-детектора при 226 нм. Определение содержания белка и анализ конъюгата проводят методами ВЭЖХ с помощью флуоресцентного детектора.
Получены следующие характеристики конъюгата общей формулы (II), определяемые методами, описанными в примере 1: выход конъюгата в расчете на белок 95%; конъюгат имеет чистоту более 95%, не содержит свободного эритропоэтина, l=475, k=235 m=77, n=790, p=3. Мм конъюгата эритропоэтина 190 кДа.
Пример 3. Получение пролонгированных эритропоэтинов путем конъюгации ЕРО с ПNO сукцинимидным методом (синтез образца КГ-3).
Получение ПNO проводят по м