Способ определения риска развития фибрилляции предсердий у больных с предсердной экстрасистолией
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиологии. Больному с предсердной экстрасистолией (ПЭ) проводят ЭКГ исследование. Осуществляют регистрацию сигнал-усредненной ЭКГ. Определяют продолжительность фильтрованной волны «Р» (FiP-P) сигнал-усредненной ЭКГ (в мс), дисперсию зубца «Р», определяемую как разницу между максимальными и минимальными значениями продолжительности зубца «P» при регистрации 12 отведений стандартной ЭКГ (Pd) (в мс), линейное отклонение (А), B - число ПЭ в час, индекс риска развития фибрилляции предсердий (ИРРФП) по оригинальной формуле. При значениях ИРРФП до 0,5 прогнозируют высокий, в течение 1-3 месяцев, от 0,5 до 1,5 - средний, от 3 месяцев до 1 года, более 1,5 - низкий, более 1 года, риск развития ФП после первого обследования больного с ПЭ. Способ позволяет повысить точность определения риска развития ФП после первого обследования и скорректировать терапию. 3 табл., 4 пр.
Реферат
Изобретение относится к медицине, а именно к кардиологии, в частности к способам прогнозирования развития наджелудочковых нарушений сердечного ритма, в частности фибрилляции предсердий (ФП) у больных с предсердной экстрасистолией (ПЭ).
Аналогом предлагаемого решения является способ прогнозирования развития пароксизмов ФП, заключающийся в определении ширины и амплитуды зубца Ρ электрокардиограммы (ЭКГ), причем при выявлении зубца Ρ более 0,12 с и (или) амплитудой более 2,5 мм прогнозируется развитие пароксизмов этих аритмий в течение нескольких лет после первого обследования (Кушаковский М.С. Аритмии сердца: руководство для врачей / М.С. Кушаковский. - 3-е изд, испр. и доп. - СПб.: Фолиант, 2004. - 672 с.).
По наиболее близкой технической сущности в качестве прототипа нами выбран способ определения риска развития пароксизмов ФП у больных с наджелудочковой экстрасистолией, заключающийся в определении наклоной линейной регрессии предэктопического интервала экстрасистолии (ПДИ), корригированного по частоте сердечных сокращений (ПДИкор.) не менее чем в 10 экстрасистолах, причем при значениях наклона линейной регрессии от 2 до 5 мс/ПДИкор. прогнозируют развитие пароксизмов ФП в течение 1 месяца, от 6 до 9 мс/ПДИкор. - в течение 1-2 месяцев, от 10-12 мс/ПДИкор. - в течение 2-3 месяцев, более 12 мс/ПДИкор. - в течение от 3 месяцев до 2 лет после первого обследования пациента (Олесин А.И., Шабров А.В., Просяникова О.Н., Семенова Е.А., Козий А.В. Способ прогнозирования пароксизмов мерцания и трепетания предсердий у больных с наджелудочковой экстрасистолией. - Патент №2312592 от 2007, БИ. №30).
Недостатком аналога и прототипа является недостаточная точность определения риска развития ФП.
Техническим результатом изобретения является повышение точности определения риска развития ФП у больных с ПЭ после первого обследования.
Технический результат изобретения заключается в том, что больному с ПЭ проводят ЭКГ исследование, регистрацию сигнал-усредненной ЭКГ. Риск развития ФП у больных с ПЭ определяют по формуле: ИРРФП=(FiP-P)÷Pd×(А÷В), где ИРРФП - индекс риска развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс), Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, А - линейное отклонение коррегированного предэктопического интервала не менее чем в 20 ПЭ, В - количество предсердных экстрасистол в час. При значениях ИРРФП до 0,5 прогнозируют высокий риск развития ФП в течение 1-3 месяцев, от 0,5 до 1,5 - средний в течение от 3 месяцев до 1 года, более 1,5 - низкий риск развития ФП более 1 года после первого обследования больного.
Способ осуществляется следующим образом:
Больному с ПЭ проводят ЭКГ исследование, регистрацию сигнал-усредненной ЭКГ и ЧПЭКС. Затем определяют Pd по стандартной ЭКГ, зарегистрированной в 12 отведениях, продолжительность фильтрованной волны «Р» (FiP-P) сигнал-усредненной ЭКГ, ЛО ПДИ-кор. ПЭ не менее чем в 20 экстрасистол. Затем риск развития ФП у больных с ПЭ определяют по формуле:
ИРРФП=(FiP-P)÷Pd×(А÷В), где ИРРФП - индекс риска развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс), Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, А - линейное отклонение коррегированного предэктопического интервала не менее чем в 20 ПЭ, В - количество предсердных экстрасистол в час. При значениях ИРРФП до 0,5 прогнозируют высокий, в течение 1-3 месяцев, от 0,5 до 1,5 - средний, от 3 месяцев до 1 года, более 1,5 - низкий, более 1 года, риск развития ФП после первого обследования больного с ПЭ.
Существенные отличительные признаки заявляемого способа и причинно-следственная связь между ними и достигаемым результатом:
- определение дисперсии волны «Р» (Pd) по стандартной ЭКГ, зарегистрированной в 12 отведениях;
- определение ЛО ПДИкор. не менее чем в 20 ПЭ;
- риск развития ФП у больных с ПЭ определяют по формуле:
ИРРФП=(FiP-P)÷Pd×(А÷В), где ИРРФП - индекс риска развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс), Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, А - линейное отклонение коррегированного предэктопического интервала не менее чем в 20 ПЭ, В - количество предсердных экстрасистол в час;
- при значениях ИРРФП до 0,5 прогнозируют высокий, в течение 1-3 месяцев, от 0,5 до 1,5 - средний, от 3 месяцев до 1 года, более 1,5 - низкий, более 1 года, риск развития ФП после первого обследования больного.
В настоящее время известно, что при регистрации возбуждения по миокарду предсердий проведение возбуждения подчиняется закону "стока" от одного кардиомиоцита к другому (Физиология и патофизиология сердца: Т. 1.: пер. с англ. - Под. ред. Н. Сперелаксиса. - М: Медицина, 1990., Olshansky В., Okumura K., Hess P.G., Waldo A.L Demonstration of the area of slow conduction in human atrial flutter. // J. Amer. Coll. Cardiol. - 1991. - Vol. 16, N. 6. - P. 1639-1648., Shimisu A., Nosaki A., Rudy Y., Waldo A.L. Multiplexing studies of effects of rapid atrial pacing on the area of slow conduction during atrial flutter in canine pericarditis model. // Circulation. - 1991. - Vol. 83, N. 3. - P. 983-994.). Поэтому путем прямого наложения электродов на миокард регистрируют характер и направление проведение возбуждения по сердечной мышце. Кроме того, миокард предсердий является тканью с быстрым ответом, т.е. для мембранного потенциала сократительных волокон предсердий характерны быстрая деполяризация (Физиология и патофизиология сердца: Т. 1.: пер. с англ. - Под. ред. Н. Сперелаксиса. - М: Медицина, 1990).
Наличие наджелудочковых аритмий обусловлено тем, что отмечается замедление и неравномерное проведение возбуждения в верхних и средних отделах предсердий, что отражает дисперсию возбудимости миокарда предсердий (Бокерия Л.А. Лекции по кардиологии /Л.А. Бокерия, Е.З. Голухова. - M., 2002. - 296 с., Braunwald′s Heart Disease: a textbook of cardiovascular medicine / Ed. by P. Libby et al. - Phyladelfhia, W.B. Saunders Company, 2007. - 2183 p.), причем у этих больных нарушение предсердной проводимости отмечается задолго до увеличения предсердий и других предикторов развития ФП (Шабров А.В., Олесин А.И., Голуб Я.В., Голуб В.И. Клиническая оценка использования неинвазивного метода определения внутри и межпредсердной проводимости у больных ишемической болезнью сердца. // Тер. архив. - 1999. - №1. - С. 34-39). Одним из методов, выявляющих наличие дисперсии возбудимости миокарда предсердий, является регистрация сигнал-усредненной ЭКГ и Pd (Braunwald′s Heart Disease: a textbook of cardiovascular medicine / Ed. by P. Libby et al. - Phyladelfhia, W.B. Saunders Company, 2007. - 2183 p.).
В заявляемом нами способе предполагается, что наличие дисперсии проведения возбуждения, выявляемой по данным сигнал-усредненной ЭКГ и Pd, свидетельствует о возможном развитии циркуляции возбуждения (re-entry) в миокарде предсердий или вокруг анатомического препятствия, например, при движении волны вокруг полых или легочных вен. Уменьшение соотношения ЛО ПДИкор. не менее чем в 20 ПЭ, отнесенное к числу ПЭ, используемых для исследования, выраженное в количестве экстрасистол в час, свидетельствует о наличии фиксированного эктопического очага в предсердиях и(или) развития циркуляции возбуждения (re-entry) в миокарде предсердий, причем использование определения ПЭИкор. в не менее чем 20 экстрасистолах обусловлено тем, что это количество интервалов ПДИкор., взятых для исследования, исключает наличие ложноположительных данных в оценке ЛО ПДИкор. ПЭ (Гланц С. Медико-биологическая статистика. Пер. с англ. - М., Практика, 1998. - 459 с.). Одной из возможных причин «фиксированного» ПДИкор., с одной стороны, является модулирующий эффект, который оказывают на ПЭ предшествующие ей синусовые возбуждения, с другой, - развитие ПЭ в период сверхнормальной фазы возбуждения предшествующего синусового комплекса, что «закрепляет» ПЭ в определенном месте наличием продольной диссоциации петли re-entry ПЭ (Физиология и патофизиология сердца: Т. 1.: пер. с англ. - Под. ред. Н. Сперелаксиса. - М: Медицина, 1990, Бокерия Л.А. Лекции по кардиологии / Л.А. Бокерия, Е.З. Голухова. - М., 2002. - 296 с.). После формирования фронта волны возбуждения, например, при развитии ПЭ, она фракционируется, разделяется на дочерние волны, каждая из которых становится независимой, причем при разделении более крупной волны в локальном участке блокированного проведения либо при активном движении по направлению к другому предсердию может формироваться критическое число блуждающих волн, необходимых для формирования ФП, причем формирование этих волн является случайным или «хаотическим» процессом (Allessie Μ.Α., Rensma P.L., Brugada J. et al. Pathophysiology of atrial fibrillation. // Cardiac electrophysiology. From cell to bedside. - Eds. Zipes D.P., Jalife J. - Philadelphia: W.B. Saunders, 1990. - P. 548-559, Allessie M.A., Konings K., Kirchhof C. Mapping of atrial fibrillation. In: Ollson S.B., Allesie M.A., Campbel R.W.F., eds. Atrial fibrillation: mechanism and therapeutic strategies. Armonk NY: Futura Publishing Company, 1994. - P. 37-49). Следует отметить, что M.A. Allessie et al. (1990, 1994) подчеркивает, что для формирования пароксизма ФП необходимо наличие 3 и более волн рециркуляции, а если число движущихся волн понижается менее 3, - аритмия прекращается.
Поэтому ИРРФП является независимым предиктором развития ФП, определяемого путем комплексной оценка предикторов развития ФП.
Совокупность отличительных существенных признаков является новой и позволяет повысить точность определения риска развития ФП у больных с ПЭ.
Для иллюстрации заявляемого способа приводим примеры из клинической практики:
Пример 1
Больной С., 65 лет, поступил в дневной стационар 03.09.2012 г. по направлению участкового врача по поводу ИБС: стенокардии, периодических приступов сердцебиения. Из анамнеза известно, что больной страдает ишемической болезнью сердца (ИБС): стенокардией II функционального класса в течение последних 4-5 лет. Постоянно принимает предуктал MB, аспирин в дозе 300-400 мг в сутки, метопролол в дозе 25-50 мг в сутки. В последние 3-4 месяца стал отмечать появление перебоев в работе сердца. При суточном мониторировании ЭКГ, выполненном амбулаторно 10.08.2012 г., была выявлена одиночная желудочковая экстрасистолия с частотой до 2 экстрасистол в час, ПЭ с частотой 25 экстрасистол в час.
В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: стабильная стенокардия напряжения II функционального класса, данных за наличие "свежих" очаговых изменений миокарда выявлено не было. Больному была продолжена терапия предукталом MB, аспирином в дозе 300 мг в сутки, эналоприлом (эднит) в дозе 5 мг в сутки, метопрололом в дозе 50 мг в сутки.
На второй день пребывания больного в стационаре была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях, сигнал-усредненная ЭКГ на протяжении 5 минут с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). Затем после компьютерной обработки была определена FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс) и Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ. У больного С., 65 лет, FiP-P и Pd составили 138 мс и 63 мс соответственно. Больному повторно было проведено суточное мониторирование ЭКГ, где было выявлено наличие ПЭ с частотой 48 экстрасистол в час, а также до 2 желудочковых экстрасистол в час. ЛО ПДИкор. ПЭ составило 8 мс, рассчитанное в 65 экстрасистолах, что составило 52 ПЭ/час. Затем пациенту была проведена чреспищеводная электрокардиостимуляция. Результаты исследования показали, что показатели, отражающие функцию синусового узла, такие, как время восстановления функции синусового узла, корригированное время восстановления функции синусового узла, время синоатриального проведения, определенные по общепринятой методике (Кушаковский М.С. Аритмии сердца. - Л.: Медицина, 1993), не выходили за пределы колебаний нормальных величин. Затем был рассчитан РРФП, определяемый по формуле: ИРРФП=(FiP-P)÷Pd)×(A÷B),
где ИРРФП - индекс риска развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс), Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, A - линейное отклонение коррегированного предэктопического интервала не менее чем в 20 ПЭ, B - число ПЭ, используемых для исследования, выраженное в количестве экстрасистол в час.
В последующем больному была проведена терапия предукталом, аспирином, ренитеком (эналаприлом), метопрололом в дозах, указанных выше. Противоаритмические препараты не назначались. Спонтанные приступы ФП длительностью от 45 секунд до 23 минут были выявлены при суточном мониторировании ЭКГ, проведенном через 5 дней после вышеуказанного обследования.
Данный пример иллюстрирует, что при выявлении значений ИРРФП 0,33 определяют высокий риск развития ФП, то есть в течение 5 дней после первого обследования.
Пример 2
Больной К., 58 лет, поступил в стационар 21.01.2012 г. по направлению врача скорой помощи по поводу ИБС: прогрессирующей стенокардии. Из анамнеза известно, что больной страдает ИБС: стенокардией II функционального класса в течение последних 3 лет. Постоянно принимает нитросорбид, антиагреганты. За два дня до госпитализации у больного усилились ангинозные боли по частоте, длительности, интенсивности, а также изменился характер болевого синдрома. Госпитализация в стационар.
В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: прогрессирующая стенокардия, данных за наличие "свежих" очаговых изменений миокарда выявлено не было. Больному была выполнена коронароангиография, где был выявлен стеноз более 85% передней нисходящей артерии. Затем была проведена реваскуляризация методом стентирования, после чего был полностью восстановлен коронарный кровоток. После реваскуляризации продолжена терапия плавиксом в дозе 75 мг в сутки, аспирином в дозе 300 мг в сутки, ренитеком в дозе 5 мг в сутки, метопрололом в дозе 50 мг в сутки. После восстановления кровотока ангинозные боли купировались и в дальнейшем не рецидивировали.
На третий день пребывания больного в стационаре была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях на протяжении 40 минут с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). Затем после компьютерной обработки была определена FiP-Р - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс) и Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ. У больного К., 58 лет, FiP-P и Pd составили 146 мс и 57 мс соответственно. Больному было проведено суточное мониторирование ЭКГ, где было выявлено наличие ПЭ с частотой 23 экстрасистол в час, а также до 5 желудочковых экстрасистол в час. ЛО ПДИкор. ПЭ составило 10 мс, рассчитанное в 68 экстрасистолах, что составило 25 ПЭ/час.
Затем был рассчитан РРФП, определяемый по формуле:
ИРРФП=(FiP-P)÷Pd)×(A÷B),
где ИРРФП - индекс риска развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс), Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, A - линейное отклонение коррегированного предэктопического интервала не менее чем в 20 ПЭ, B - число ПЭ, используемых для исследования, выраженное в количестве экстрасистол в час.
В последующем больному была проведена терапия плавиксом, аспирином, ренитеком (эналаприлом), метопрололом в дозах, указанных выше. Спонтанные приступы ФП длительностью от 45 секунд до 16 минут были выявлены при суточном мониторировании ЭКГ, проведенном на через 4 месяца после вышеуказанного обследования.
Данный пример иллюстрирует, что при выявлении значений ИРРФП 1,02 определяют средний риск развития ФП, то есть в течение 4 месяцев после первого обследования.
Пример 3
Больной Р., 63 лет, поступил в стационар 27.11.2012 г. по направлению врача поликлиники по поводу ИБС: впервые возникшей стенокардии. Из анамнеза известно, что больной ранее считал себя практически здоровым.
В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: впервые возникшая стенокардия, данных за наличие "свежих" очаговых изменений миокарда выявлено не было. Больному была выполнена коронароангиография, где был выявлен стеноз более 75% передней нисходящей и более 80% огибающей артерий. Затем была проведена реваскуляризация методом стентирования, после чего был полностью восстановлен коронарный кровоток. После реваскуляризации продолжена терапия плавиксом в дозе 75 мг в сутки, аспирином в дозе 300 мг в сутки, ренитеком в дозе 5 мг в сутки, метопрололом в дозе 50 мг в сутки. После восстановления кровотока ангинозные боли купировались и в дальнейшем не рецидивировали.
На третий день пребывания больного в стационаре была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях на протяжении 35 минут с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). Затем после компьютерной обработки была определена FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс) и Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ. У больного Р., 63 лет, FiP-P и Pd составили 134 мс и 62 мс соответственно. Больному было проведено суточное мониторирование ЭКГ, где было выявлено наличие ПЭ с частотой 12 экстрасистол в час, а также до 2 желудочковых экстрасистол в час. ЛО ПДИкор. ПЭ составило 10 мс, рассчитанное в 45 экстрасистолах, что составило 15 ПЭ/час.
Затем был рассчитан РРФП, определяемый по формуле:
ИРРФП=(FiP-P)÷Pd)×(A÷B),
где ИРРФП - индекс риска развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс), Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, А - линейное отклонение коррегированного предэктопического интервала не менее чем в 20 ПЭ, B - число ПЭ, используемых для исследования, выраженное в количестве экстрасистол в час.
В последующем больному была проведена терапия плавиксом, аспирином, ренитеком (эналаприлом), метопрололом в дозах, указанных выше. В дальнейшем было неоднократно проведено суточное мониторирование ЭКГ, на которых сохранялась ПЭ. Спонтанные приступы ФП длительностью от 53 секунд до 15 минут были выявлены при суточном мониторировании ЭКГ, проведенном на через 10 месяцев после вышеуказанного обследования.
Данный пример иллюстрирует, что при выявлении значений ИРРФП 1,44 определяют средний риск развития ФП, то есть в течение 10 месяцев после первого обследования.
Пример 4
Больной X., 66 лет, поступил в стационар 15.01.2011 г. по направлению участкового врача по поводу ИБС: стенокардии, периодических приступов сердцебиения. Из анамнеза известно, что больной страдает ИБС: стенокардией II функционального класса в течение последних 6 лет. Постоянно принимает моночинкве в дозе 50 мг в сутки, аспирин в дозе 300-400 мг в сутки, эналаприл (ренитек) в дозе 20 мг в сутки. В последние 3-4 месяца стал отмечать появление перебоев в работе сердца. При суточном мониторировании ЭКГ, выполненном амбулаторно 14.12.2010 г., была выявлена одиночная ПЭ с частотой до 11 экстрасистол в час.
В стационаре по данным клинико-инструментального обследования состояние больного было расценено как ИБС: стабильная стенокардия напряжения II функционального класса, данных за наличие "свежих" очаговых изменений миокарда выявлено не было. Больному была продолжена терапия моночинкве в дозе 50 мг в сутки, аспирином в дозе 300-400 мг в сутки, эналаприлом (ренитек) в дозе 20 мг в сутки.
На второй день пребывания больного в стационаре была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях на протяжении 25 минут с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). Затем после компьютерной обработки была определена FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс) и Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ. У больного X., 66 лет, FiP-P и Pd составили 128 мс и 46 мс соответственно. Пациенту была проведена чреспищеводная электрокардиостимуляция. Результаты исследования показали, что показатели, отражающие функцию синусового узла, такие, как время восстановления функции синусового узла, корригированное время восстановления функции синусового узла, время синоатриального проведения, определенные по общепринятой методике (Кушаковский М.С. Аритмии сердца. - Л.: Медицина, 1993), не выходили за пределы колебаний нормальных величин.
Больному было проведено суточное мониторирование ЭКГ, где было выявлено наличие ПЭ с частотой 10 экстрасистол в час. ЛО ПДИкор. ПЭ составило 16 мс, рассчитанное в 57 экстрасистолах, что составило 12 ПЭ/час.
Затем был рассчитан РРФП, определяемый по формуле:
ИРРФП=(FiP-P)÷Pd)×(A÷B),
где ИРРФП - индекс риска развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс), Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, A - линейное отклонение коррегированного предэктопического интервала не менее чем в 20 ПЭ, B - число ПЭ, используемых для исследования, выраженное в количестве экстрасистол в час.
В последующем больному была проведена терапия нитратами, аспирином, ренитеком (эналоприлом) в дозах, указанных выше. Противоаритмические препараты не назначались. В дальнейшем было неоднократно проведено суточное мониторирование ЭКГ, на которых сохранялась ПЭ. Спонтанный приступ ФП развился через 1,7 года после обследования, купированный сублингвальным приемом метопролола в дозе 50 мг. В качестве противорецидивной терапии пароксизмов ФП больному дополнительно к проводимой терапии был назначен метопролол в дозе 100 мг в сутки. Аритмия не рецидивировала на протяжении 2 лет.
Данный пример иллюстрирует, что при выявлении значений ИРРФП 3,71 определяют низкий риск развития ФП, то есть в течение 1,7 года после первого обследования.
Наблюдалось 228 больных ИБС, осложненной ПЭ. Всем больным проводилась терапия нитратами пролонгированного действия, антиагрегантами, ингибиторами ангиотензинпревращающего фермента (ренитек, эналоприл, энап). Антиаритмические препараты не назначались.
Всем больным проводилась регистрация ЭКГ одновременно в 12 стандартных отведениях, сигнал-усредненной ЭКГ на протяжении 5 минут с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). Затем после компьютерной обработки была определена FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс) и Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ. Всем больным проводилось суточное мониторирование ЭКГ. Всем больным, согласно предлагаемому способу, рассчитывалось ЛО ПДИкор. ПЭ в не менее 20 экстрасистолах, а согласно прототипу - определялся наклон линейной регрессии ПДИкор. ПЭ в не менее чем в 10 экстрасистолах. При невозможности определения на ЭКГ, включая суточное мониторирование ЭКГ, начала или окончания волны «Р», для ее выявления проводилось чреспищеводная регистрация ЭКГ. У всех больных определение ИРРФП проводилось по предлагаемому способу, а также прогнозирование развития ФП осуществлялось согласно прототипу.
Статистический анализ полученных результатов проведен на ЭВМ.
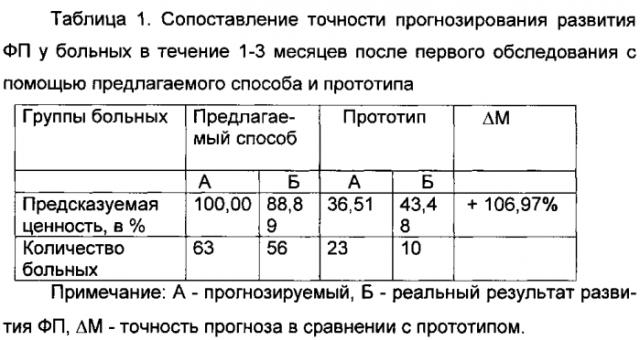
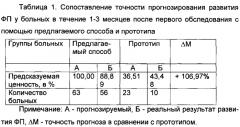
У 63 (27,63%) больных, согласно заявляемому способу, значения ИРРФП составили <0,5 (в среднем 0,14±0,05) (у этих больных прогнозировалось развитие ФП в течение 1-3 месяцев после первого обследования). Развитие ФП наблюдалось у 56 (88,89%) из 63 больных в течение 1-3 месяцев после первого обследования.
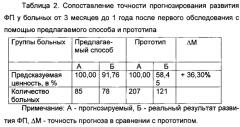
У 85 (37,28%) больных, согласно заявляемому способу, значения ИРРФП составили от 0,5 до 1,5 (в среднем 0,76±0,09) (у этих больных прогнозировалось развитие ФП в течение от 3 месяцев до 1 года после первого обследования). Развитие ФП наблюдалось у 78 (91,76%) из 85 больных в течение от 3 месяцев до 1 года после первого обследования.
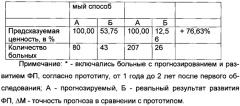
У 80 (35,09%) больных, согласно заявляемому способу, значения ИРРФП составили >1,5 (в среднем 3,6±0,3) (у этих больных прогнозировалось развитие ФП в течение более чем 1 год после первого обследования). Развитие ФП наблюдалось у 43 (53,75%) из 80 больных в течение более чем 1 год (в среднем через 2,1±0,3 года), причем у 26 (32,50%) из них развитие ФП отмечалось на протяжении 1-2 лет после первого обследования.
У 23 (10,09%) из всех обследованных пациентов, согласно прототипу, прогнозировалось развитие ФП в течение 1-3 месяцев, а у остальных - от 3 месяцев до 2 лет после обследования. Развитие ФП наблюдалось у 10 (43,48%) из 23 больных в течение 1-3 месяцев после первого обследования.
Сравнительные данные по заявляемому способу и способу прототипу представлены в таблицах 1-3.
Точность способа прогнозирования РРФП по заявляемому способу, по сравнению с прототипом, в течение 1-3 месяцев после первого обследования повышается на 106,97% в течение от 3 месяцев до 1 года - на 36,30% и более чем 1 года - на 76,63%.
Таким образом, точность способа прогнозирования РРФП по заявляемому способу, по сравнению с прототипом, в течение 1-3 месяцев после первого обследования повышается на 106,97%, в течение от 3 месяцев до 1 года - на 36,30% и более чем 1 года - на 76,63%.
Способ определения риска развития фибрилляции предсердий (ФП) у больных с предсердной экстрасистолией (ПЭ) путем проведения электрокардиографического (ЭКГ) исследования, регистрации сигнал-усредненной ЭКГ, отличающийся тем, что риск развития ФП определяют по формуле: ИРРФП=(FiP-P)÷Pd×(А÷В), где ИРРФП - индекс риска развития ФП, FiP-P - продолжительность фильтрованной волны «Р» сигнал-усредненной ЭКГ (в мс), Pd - дисперсия зубца «Р» (в мс), определяемая как разница между максимальными и минимальными значениями продолжительности зубца «Р» при регистрации 12 отведений стандартной ЭКГ, А - линейное отклонение коррелированного предэктопического интервала не менее чем в 20 ПЭ, В - количество предсердных экстрасистол в час, и при значениях ИРРФП до 0,5 прогнозируют высокий риск развития ФП в течение 1-3 месяцев, от 0,5 до 1,5 - средний в течение от 3 месяцев до 1 года, более 1,5 - низкий риск развития ФП более 1 года после первого обследования больного.