Способ интраоперационной оценки несостоятельности коронарных шунтов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиохирургии. Оценку кровотока в шунтах проводят в условиях искусственного кровообращения и пережатой аорты. После формирования дистального анастомоза подключают шунт к контуру аппарата искусственного кровообращения с помощью системы для внутривенной инфузии. Осуществляют оценку последовательно каждого анастомоза. Способ позволяет интраоперационно оценить кровоток в шунтах и провести ревизию проблемного анастомоза до снятия зажима с аорты и дополнительного применения кардиоплегического раствора. 3 ил.
Реферат
Изобретение относится к медицине, а именно к кардиохирургии, и может быть использовано для интраоперационной диагностики несостоятельности коронарных шунтов.
По данным многих авторов окклюзия шунтов может возникнуть еще во время операции у 4-12% пациентов [1, 2, 3]. На момент выписки из стационара этот показатель достигает 5-20% и возрастает до 30% в течение первого года [4]. Нарушение функции шунтов в свою очередь приводит к ранним послеоперационным осложнениям, таким как рецидив стенокардии, инфаркт миокарда, злокачественные аритмии [5]. Во многих случаях несостоятельность шунтов является следствием ошибок в хирургической технике, соответственно эти цифры могут быть сокращены путем улучшения контроля качества коронарного шунтирования.
Известны способы интраоперационной оценки функции шунта, такие как эхокардиография и коронарная ангиография. Интраоперационную чреспищеводную эхокардиографию используют для выявления зон нарушения локальной сократимости миокарда, которые косвенно свидетельствуют о несостоятельности шунта. Недостатком метода является его низкая информативность при наличии исходного кардиосклероза в зоне ответственности шунта или при использовании этого метода на этапе реперфузии миокарда перед остановкой искусственного кровообращения. Коронарная ангиография является «золотым стандартом» для оценки коронарных шунтов [6, 7]. Данный метод обеспечивает визуализацию потока крови внутри шунта, позволяет оценить кровоток в русле шунтированной артерии, тем самым отражает качество сформированного анастомоза. Однако интраоперационное использование ангиографии ограничено в связи с необходимостью организации оборудованной гибридной лаборатории. Кроме того, возможно развитие осложнений, связанных с инвазивной техникой и использованием контрастных нефротоксичных веществ [8, 9].
Из известных наиболее близким по технической сущности является способ интраоперационного исследования коронарных шунтов (патент №2481059, опубликован 10.05.2013 г.). Как и предлагаемый нами, способ интраоперационного исследования коронарных шунтов заключается в ультразвуковом сканировании трансплантатов. Однако данный способ применим исключительно после завершения основного этапа операции, прекращения искусственного кровообращения, в условиях стабильной гемодинамики и присоблюдении строгих правил измерения (расположение датчика под углом 45° к оси шунта на расстоянии не более 10-15 мм, ограничение подвижности шунта, наличие жидкости в полости перикарда).
Техническим результатом предлагаемого способа является возможность исключить нарушение кровотока по коронарным шунтам во время основного этапа операции до снятия зажима с аорты.
Сущность предлагаемого способа заключается в том, что ультразвуковую оценку коронарных шунтов, согласно предлагаемому изобретению, проводят в условиях искусственного кровообращения и пережатой аорте, при этом в случае секвенциального шунтирования проводят последовательную оценку каждого анастомоза, при аутовенозном шунтировании измерения осуществляют после подключения аутовенозного шунта к контуру аппарата искусственного кровообращения с помощью системы для внутривенной инфузии.
Такое сочетание новых признаков позволит сократить количество ранних послеоперационных осложнений в виде повторных инфарктов миокарда, рецидивов стенокардии, аритмий.
Способ осуществляется следующим образом.
Измерения проводят с помощью флоуметра VeryQ MediStim® (Осло, Норвегия) после формирования каждого анастомоза датчиками 1,5-3 мм (частота 3,7 MHz). В случае секвенциального шунтирования кондуит пережимали дистальнее анастомоза зажимом Дебейки. При аутовенозном шунтировании измерение проводят после формирования дистального анастомоза и подключения аутовенозного шунта к контуру аппарата искусственного кровообращения. Для этих целей используют систему для внутривенной инфузии и иглу Дебейки. Иглу Дебейки вводят в просвет аутовены и фиксируют лигатурой. От системы для внутривенной инфузии отделяют воздушный фильтр, сохраняя часть трубки с канюлей. Свободный от канюли конец трубки подключают к трехходовому крану артериальной канюли. С профилактикой воздушной эмболии соединяют трубку с иглой Дебейки, осуществляют кратковременный пуск кровотока по шунту. Во время пуска кровотока проводят измерение параметров гемодинамики в аутовенозном кондуите.
Контрольное измерение осуществляют после окончания ИК и инактивации антикоагулянтов, при систолическом давлении 100-110 мм рт.ст.
Для описания параметров кровотока используют следующие показатели:
1) средняя объемная скорость кровотока (Qmean) - усредненная величина всех средних значений за один сердечный цикл в определенном промежутке времени (на спектре программа отображает эти величины в виде поперечной линии красного цвета);
2) индекс пульсации (PI) - отражает состояние периферических сегментов коронарного русла, уровень периферического сопротивления потоку;
3) DF («predominantly diastolic flow») - доля диастолического объемного кровотока в общем объемном кровотоке за один сердечный цикл, выраженная в процентах.
Пример выполнения способа
Больной N., 56 лет. Произведена ревизия анастомоза «конец в бок» между ЛВГА и ПНА. Выявлено расслоения сосудистой стенки в дистальной части ЛВГА. Проблема устранена путем иссечения дистального фрагмента ЛВГА и повторного формирования анастомоза «конец в бок».
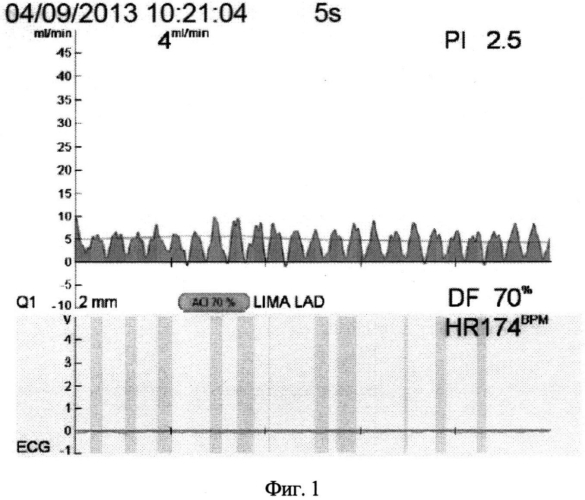
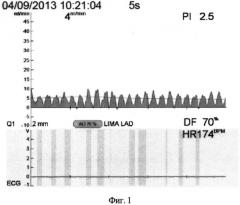
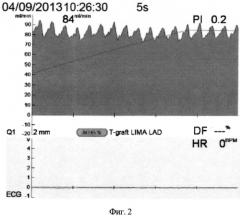
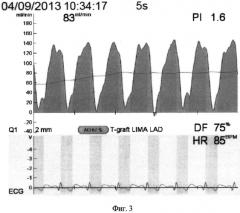
На фиг.1, 2 и 3 изображены графики флоуметрических кривых для данного шунта.
На фиг.1 показано снижение объемной скорости кровотока (Qmean=4 мл в мин-1), повышение индекса периферического сопротивления (PI=4) и появление диастолической фазы кровенаполнения кондуита (DF=70%).
При ревизии анастомоза выявлено расслоение дистальной части ЛВГА. После иссечения расслоившегося фрагмента артерии и повторного формирования анастомоза получены удовлетворительные параметры кровотока. На фиг.2 показана флоуграмма шунта ЛВГА - ПНА после ревизии анастомоза: Qmean=84 мл в мин-1; PI=0,2; диастолическая фаза кровенаполнения отсутствует.
На фиг.3 показана фоуграмма шунта ЛВГА - ПНА после остановки искусственного кровообращения: Qmean=83 мл в мин-1; PI=1,6; DF=75%.
Источники информации
1. Alderman, E.L. Analyses of coronary graft patency after aprotinin use: results from the International Multicenter Aprotinin Graft Patency Experience (IMAGE) trial / E.L. Alderman, J.H. Levy, J.B. Rich // The Journal of Thoracic and Cardiovascular Surgery - 1998. - №116. - P.716-730.
2. Goldman, S. Department of Veterans Affairs Cooperative Study Group. Starting aspirin therapy after operation. Effects on early graft patency / S. Goldman, J. Copeland, T Moritz // Circulation - 1991. - №84. - P.520-526.
3. Poirier, N.C. Quantitative angiographic assessment of coronary anastomoses performed without cardiopulmonary bypass // N.C. Poirier, M. Carrier, J. Lesperance // The Journal of Thoracic and Cardiovascular Surgery - 1999. - №117. - P.292-297.
4. Alexander, J.H. Efficacy and safety of edifoligide, an E2F transcription factor decoy, for prevention of vein graft failure following coronary artery bypass graft surgery: PREVENT IV: a randomized controlled trial / J.H. Alexander, G. Hafley, R.A. Harrington, et al. // Journal of the American Medical Association - 2005. - №294. - P.2446-2454.
5. Taggart, D.P. Biochemical assessment of myocardial injury after cardiac surgery: effects of a platelet activating factor antagonist, bilateral internal thoracic artery grafts, and coronary endarterectomy / D.P. Taggart // The Journal of Thoracic and Cardiovascular Surgery - 2000. - №120. - P.651-659.
6. Leacche, M. Intraoperative grafts assessment / M. Leacche, J.M. Balaguer, J.G. Byrne // Seminars in Thoracic and Cardiovascular Surgery - 2009. - №21. - P.207-212.
7. Mack, M.J. Intraoperative coronary graft assessment / M.J. Mack // Current Opinion in Cardiology - 2008. - №23. - P.568-572.
8. Zhao, D.X. Routine intraoperative completion angiography after coronary artery bypass grafting and 1-stop hybrid revascularization results from a fully integrated hybrid catheterization laboratory/operating room / D.X. Zhao, M. Leacche, J.M. Balaguer, K.D. Boudoulas, et al. // Journal of the American Collage of Cardiology - 2009. - №.53. - P.232-241.
9. Hol, P.K. Intraoperative angiography leads to graft revision in coronary artery bypass surgery / P.K. Hol, P.S. Lingaas, R. Lundblad, et al. // The Annals of Thoracic Surgery - 2004. - №.78. - P.502-505.
Способ интраоперационной оценки несостоятельности коронарных шунтов, заключающийся в ультразвуковом исследовании трансплантатов, отличающийся тем, что оценку кровотока в шунтах проводят в условиях искусственного кровообращения и пережатой аорте, для чего после формирования дистального анастомоза подключают шунт к контуру аппарата искусственного кровообращения с помощью системы для внутривенной инфузии, при необходимости проводят последовательную оценку каждого анастомоза.