Способ определения генотипа человека по полиморфной позиции rs1613662 в гене gp6, кодирующем гликопротеин vi
Иллюстрации
Показать всеИзобретение относится к области медицины, молекулярной биологии и биотехнологии. Предложен способ определения полиморфизма гена GP6 человека, кодирующего гликопротеин VI, по полиморфной позиции rs 1613662, основанный на снятии кривых плавления с флуоресцентно-мечеными аллель-специфичными олигонуклеотидными пробами. Благодаря увеличению надежности определения вариабельных позиций и возможности проводить определение в одной пробирке на стандартном оборудовании способ может быть эффективно использован для диагностики наследственных предрасположенностей человека с регистрацией результатов ПЦР в реальном времени. 1 ил.
Реферат
1. Область техники.
Предложенный способ относится к области медицины, биологии и биотехнологии и может быть использован при диагностике заболеваний с генетической составляющей (генетической предрасположенностью), прогнозирования тяжести и скорости прогрессии заболевания и алгоритма лечения заболевания в зависимости от индивидуального генетического профиля пациента.
Известно, что развитие и течение множества заболеваний человека в значительной степени определяется его генотипом. За последние 10-15 лет получены первые результаты по идентификации широкого спектра генетических маркеров различных заболеваний и предрасположенности к ним.
Гликопротеины - это сложные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов. Гликопротеины являются важным структурным компонентом клеточных мембран. Гликопротеины мембран эритроцитов, специфически гликозилированные теми или иными углеводными остатками, но имеющие гомологичную белковую часть, предопределяют группу крови у человека. Также гликопротеинами являются все антитела, интерфероны, компоненты комплемента, белки плазмы крови, молока, рецепторные белки и др. Важная роль гликопротеинов в организме определяет развитие ряда ассоциированных с ними заболеваний человека.
Для полиморфизма в позиции rs1613662 в гене GP6, кодирующем гликопротеин VI, показана взаимосвязь с развитием венозного тромбоза [1].
2. Уровень техники.
Широко распространен способ определения типа нуклеотида, находящегося в определенном месте ДНК, основанный на использовании аллель-специфичных праймеров с регистрацией результатов ПЦР по окончании реакции с помощью электрофореза. При использовании ПЦР с регистрацией результатов в ходе реакции известны различные способы определения генотипа исследуемого образца.
Существуют различные способы, позволяющие определить тип нуклеотида, находящегося в определенном месте ДНК, основанные на использовании аллель-специфичных праймеров с регистрацией результатов ПЦР непосредственно в ходе реакции с помощью использования флуоресцентно-меченых проб (олигонуклеотидов) (Andreas R. Tobler at all, "THE SNPlex Genotiping System: A Flexible and Scalable Platform for SNP Genotyping", Journal of Biomolecular Techniques, V.16, issue 4, Desember 2005).
Например, в наборах производства Applied Biosystems используют одну пару праймеров для каждого аллеля и два зонда с различными флуорецентными метками, в зависимости от генотипа аллеля фиксируют разгорание различных меток ("TaqMan SNP Genotyping Assays", Applied Biosistems, Prodakt Bulletin, USA, 06/2006). Недостатком способа, используемого в данных наборах, является сравнительно невысокая достоверность результатов исследования из-за небольшой разницы между получаемыми кривыми флуоресценции для разных аллелей.
Предлагаемым подходом к детекции генетического полиморфизма является использование двух аллель-специфичных и меченых разными флуоресцентными метками олигонуклеотидов, а также олигонуклеотида, несущего гаситель флуоресценции и гибридизирующегося на матрицу рядом с аллель-специфичным олигонуклеотидом. Гибридизация аллель-специфичного олигонуклеотида на матрицу ведет к переносу энергии с находящегося на нем флуорофора-донора на гаситель флуоресценции расположенного рядом «гасящего» олигонуклеотида. Регистрацию результатов амплификации ведут по окончании ПЦР путем снятия спектра флуоресценции при изменении температуры реакционной смеси в диапазоне от 25 до 80 градусов по Цельсию (так называемые «кривые плавления»). При получении графиков флуоресценции возможен как нагрев, так и охлаждение реакционной смеси в указанном интервале температур.
Предлагаемое изобретение делает определение вариабельных позиций в ДНК более надежным и удешевляет подобные исследования благодаря использованию стандартного оборудования.
3. Раскрытие изобретения.
Техническим результатом, на достижение которого направлено предлагаемое изобретение, является повышение доступности подобных исследований, поскольку способ может быть осуществлен на стандартном известном оборудовании. Также он обеспечивает возможность проводить исследование в одной пробирке, что снижает затраты на исследование.
Использованный нами способ генотипирования является вариантом классического метода «примыкающих проб». При определении замен одиночных нуклеотидов вначале проводили ПЦР с праймерами, общими для обоих вариантов последовательности, затем температуру реакционной смеси снижали для гибридизации полученной матрицы с олигонуклеотидными пробами. Для определения варианта последовательности использовали два типа олигонуклеотидов, гибридизирующихся на матрицу рядом. Один из олигонуклеотидов метили флуорофором, другой - гасителем флуоресценции.
В реакции использовали один общий олигоиуклеотид с гасителем флуоресценции и пару аллель-специфичных (сиквенс-специфичных) олигонуклеотидов, несущих флуорофор. Олигонуклеотидные пробы, соответствующие тому или иному варианту последовательности, метили различными флуорофорами, что позволило определять оба варианта в одной пробирке. Определение генотипа проводили после ПЦР и гибридизации путем измерения уровня флуоресценции в ходе температурной денатурации дуплексов олигонуклеотидов и полученных матриц (или наоборот - гибридизации). Данное измерение проводили в режиме реального времени, его результатом являлись кривые плавления.
Условия реакции подбирали так, чтобы максимизировать разницу в температурах плавления совершенного и несовершенного дуплексов. Таким образом, если анализируемый образец содержал только один вариант последовательности, т.е. был гомозиготен по данному полиморфизму, температура плавления для пробы, образующей совершенный дуплекс, была существенно выше, нежели для пробы, образующей несовершенный дуплекс. Если же анализировали гетерозиготный образец, температуры плавления были практически одинаковы.
Указанный результат достигается путем использования при постановке ПЦР флуоресцентно-меченых аллель-специфичных олигонуклеотидных проб и праймеров:
| GP6_3s | GGGGTCCGTGTACCTCATACGC |
| GP6_3a | GAGGAAACTCAGTCACGGAGATGT |
| GP6_3p1 | GCTACCGGGGAAGGTG-FAM |
| GP6_3p2 | GCTACCGAGGAAGGTG-HEX |
| GP6_3pq | BHQ1-GTTCTGTTGGTAACCGGCT-3'-(P) |
FAM означает флуоресцентный краситель FAM, HEX означает флуоресцентный краситель HEX, BHQ1 означает присоединенный к 5' - концевому нуклеотиду темновой гаситель флуоресценции.
Состав амплификационной смеси (на одну реакцию)
| Компонент | Концентрация | Объем |
| ПЦР - буфер* | 1,25-кратный | 18 мкл |
| смесь dNTP | 0,25 мМ (каждого) | 0,24 мкл |
| Праймеры | 100 пМ/мкл | по 0,14 мкл |
| Олигонуклеотиды, меченные флуорофорами | 100 пМ/мкл | по 0,07 мкл |
| Олигонуклеотид, меченный гасителем флуоресценции | 100 пМ/мкл | 0,14 мкл |
| Taq-полимераза | 10 ед. активности/мкл | 0,5 мкл |
| H2O (деионизированная) | - | до 30 мкл |
| Геномная ДНК | - | 5 мкл |
| *Состав буфера для проведения ПЦР | ||
| 84 мМ Трис-HCl pH 8,6 | ||
| 21 мМ (NH4)2SO4 | ||
| 3,1 мМ MgCl2 | ||
| 0,003% Tween-20 | ||
| 0,003% NP-40 | ||
| 6,25% глицерин |
4. Осуществление изобретения.
В качестве материала для исследования рекомендуется использовать кровь, соскобы буккального эпителия, биоптаты мягких тканей человека или иной стандартный биологический материал. Выделение ДНК из биоматериала производится с использованием комплекта реагентов для выделения ДНК (не является предметом данного патента).
Полимеразную цепную реакцию и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора «ДТпрайм» (ООО «НПО ДНК-Технология», Россия). Использовали следующий температурный режим амплификации: 94°C - 10 с, 64°C - 30 с в течение 50 циклов. По завершении реакции амплификации реакционную смесь остужали до 25°C со скоростью 2°C/сек. Кривые плавления получали следующим образом: температуру реакционной смеси повышали с 25°C до 75°C с шагом 1°C, измеряя уровень флуоресценции на каждом шаге.
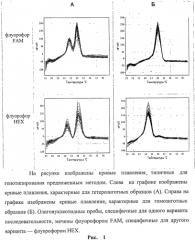
Результаты, т.е. отнесение образца к гомозиготе или гетерозиготе по данному аллелю, оцениваются по форме кривых плавления ДНК (рис. 1).
Источник информации
1. Bezemer ID, Bare LA, Arellano AR, Reitsma PH, Rosendaal FR. Updated analysis of gene variants associated with deep vein thrombosis. JAMA. 2010 Feb 3; 303 (5): 421-2. doi: 10.1001/jama.2010.57.
Способ определения полиморфизма гена GP6 человека, кодирующего гликопротеин VI, по полиморфной позиции rs 1613662, основанный на снятии кривых плавления с флуоресцентно-мечеными аллель-специфичными олигонуклеотидными пробами, отличающийся тем, что используют общую для всех аллелей пару праймеров, отличающиеся для каждого аллеля флуоресцентно-меченые аллель-специфичные олигонуклеотидные пробы и универсальный олигонуклеотид, меченный гасителем флуоресценции, при этом вышеперечисленные праймеры, пробы и универсальный олигонуклеотид имеют следующий состав: где FAM означает флуоресцентный краситель FAM, HEX означает флуоресцентный краситель HEX, BHQ1 означает присоединенный к 5′-концевому нуклеотиду темновой гаситель флуоресценции, а отнесение образца к гомозиготе или гетерозиготе по данному аллелю проводят по форме кривых плавления ДНК (по максимуму первой производной графиков флуоресценции), при этом наличие одного пика на графике свидетельствует о гомозиготности образца по аллелю, соответствующему более тугоплавкой флуоресцентно-меченой аллель-специфичной олигонуклеотидной пробе, а наличие двух пиков на графике свидетельствует о гетерозиготности образца.