Способ получения экзосом из крови
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способу получения экзосом из крови. Кровь разделяют на плазму и клеточную фракцию. Далее клеточную фракцию крови подвергают последовательной двухстадийной обработке сначала буферным раствором PBS, содержащим 5 мМ ЭДТА, с последующим центрифугированием и сбором супернатанта. Обрабатывают клетки равным объемом 0,15-0,35% раствора трипсина в PBS с последующим центрифугированием и сбором супернатанта. Плазму и полученные супернатанты из клеточной фракции объединяют, удаляют клеточный дебрис центрифугированием при 15000-17000 g в течение 10-20 минут. Удаляют примесь частиц неэкзосомального происхождения путем фильтрации через фильтры с диаметром пор 0,1 мкм, а суммарный пул экзосом осаждают ультрацентрифугированием при 100000-160000 g в течение 60-120 минут. Предложенное изобретение позволяет повысить выход и чистоту целевого продукта, а также сократить длительность и снизить трудоемкость способа. 2 з.п. ф-лы, 2 ил., 1 табл., 3 пр.
Реферат
Изобретение относится к области биохимии и диагностической медицины, а именно к способам получения экзосом из крови, являющихся источником опухолеспецифичных маркеров для ранней диагностики и мониторинга онкологических заболеваний.
Экзосомы представляют собой микровезикулы размером 30-100 нм, активно секретируемые через каскад экзоцитоза, обычно используемый для разгрузки рецептора и внутриклеточных перекрестных сигналов. В дополнение к белкам главного комплекса гистосовместимости (МНС I, МНС II) и белкам, вовлеченным в представление антигена, экзосомы могут содержать мембранные и цитозольные белки, вовлеченные во множество клеточных функций. Экзосомы секретируются в определенных физиологических условиях из различных типов клеток, таких как дендритные клетки (DC), лимфоциты, тучные клетки и эпителиальные клетки.
В настоящее время ведутся исследования в области разработки тестов, основанных на использовании циркулирующих в крови экзосом, поскольку кровь непосредственно контактирует со всеми органами/тканями, и ряд процессов, в частности развитие опухолей, сопровождается изменением состава циркулирующих экзосом даже на самых ранних этапах развития этих процессов.
Ранее было показано, что экзосомы, выделенные из плазмы крови, могут быть удобным источником опухолеспецифичных мРНК (1), микроРНК (2) и белков (3).
Известен способ получения экзосом из сыворотки крови (4), включающий: сбор крови с последовательным центрифугированием для осаждения клеток, дебриса, а затем ультрацентрифугирование при 160000 g в течение 1 часа. Для определения концентрации микроРНК суммарную РНК выделяли из экзосом с помощью реагента Trizol (Invitrogen, Carlsbad, СА) по протоколу производителя и проводили обратную транскрипцию (ОТ) с использованием набора TaqManH MicroRNA Reverse Transcription Kit (Applied Biosystems, Foster City, СА). Количественную ПЦР проводили с использованием коммерческих специфических праймеров (TaqMan MicroRNA Assay, Applied Biosystems) и реакционной смеси (TaqMan Universal PCR Master Mix, Applied Biosystems) по протоколу, рекомендованному производителем (4).
Недостатками способа являются высокое содержание в целевом продукте частиц неэкзосомального происхождения (диаметром более 100 нм), ограниченное количество экзосом, выделенных из сыворотки крови, примесь балластных нуклеиновых кислот из разрушенных в процессе формирования тромба форменных элементов крови. Как следствие, полученные результаты о содержании микроРНК в составе экзосом являются недостоверными.
Известен способ получения экзосом из плазмы крови (5), заключающийся в следующем. Образцы плазмы фильтровали через фильтры с диаметром пор 0,220 мкм для удаления клеточного дебриса и более крупных частиц и разделяли компоненты плазмы при помощи белковой жидкостной хроматографии. Фракции объединяли и концентрировали путем центрифугирования с помощью 3 кДа-отсекающих фильтров (Millipore). Затем сконцентрированный препарат наносили на сахарозный градиент (0.2-2.5 М в 20 мМ трис, pH 8.0) и ультрацентрифугировали (175000 g, 16 ч). Частицы, находящиеся в диапазоне концентрации сахарозы 1.08-1.15 г/мл, объединяли, отмывали раствором PBS (10 мМ фосфатный буфер, 0,15 М NaCl, pH 7,5) и осаждали при помощи ультрацентрифугирования (175000 g, 2 ч). Ассоциированные с экзосомами белки разделяли при помощи 4-12% ПАА-SDS-диск электрофореза, гель разрезали на части, трипсинолиз и экстракцию пептидов из геля проводили по стандартной схеме (5). С помощью масс-спектрометрии в составе экзосом было идентифицировано 66 белков.
Недостатками способа являются недостаточная чистота целевого продукта (примесь микрочастиц диаметром 100-220 нм), трудоемкость и длительность выделения экзосом (более 23 ч), ограниченное количество экзосом, выделенных из плазмы крови. Как следствие, не все из идентифицированных белков входят в состав экзосом.
Известен способ получения экзосом из плазмы крови (6), заключающийся в следующем. Клетки и дебрис удаляли путем последовательного центрифугирования периферической крови, супернатант фильтровали через фильтры с диаметром пор 0,2 мкм. Экзосомы плазмы крови выделяли с помощью коммерческого набора ExoQuickтм Exosome Precipitation Solution (System Biosciences Inc., Mountain View, CA, USA). Суммарную РНК из экзосом выделяли с помощью коммерческого набора Qiagen miRNeasy Mini kit (Qiagen, Hilden, Germany) по протоколу производителя и проводили ОТ по стандартной схеме (7). Количественную ПЦР проводили с использованием коммерческой реакционной смеси SYBR® Premix Ex Taqтм II, Perfect Real Time (TaKaRa, Dalian, China) по протоколу, рекомендованному производителем.
Недостатками способа являются недостаточная чистота целевого продукта (примесь микрочастиц диаметром 100-200 нм), длительность выделения экзосом (более 10 ч), высокая стоимость коммерческого набора для выделения экзосом, ограниченное количество экзосом, выделенных из плазмы крови. Как следствие, полученные результаты о содержании микроРНК в составе экзосом являются недостоверными.
Наиболее близким к заявленному способу - прототипом - является способ получения экзосом из крови (8), включающий следующие стадии: (1) получение сыворотки крови путем трех последовательных центрифугирований в течение 20 мин при 300 g, 3000 g и 10000 g; (2) получение фракции экзосом путем ультрацентрифугирования (100000 g, 2,5 ч) сыворотки, разведенной в буферном растворе PBS, через подушку из 40% сахарозы; (3) концентрирование экзосом путем ультрацентрифугирования (100000 g, 2,5 ч) после отмывания PBS-ом от сахарозы. Нуклеиновые кислоты из полученных препаратов экзосом выделяли при помощи коммерческого набора АllРrер DNA/RNA Mini Kit (Qiagen, Hilden, Germany) по протоколу, рекомендованному производителем. ОТ и количественную ПЦР проводили по протоколу, рекомендованному производителем (Applied Biosystems).
Недостатками способа являются длительность выделения экзосом (более 6 часов), ограниченное количество экзосом, выделенных из сыворотки крови, низкий выход экзосом, наличие примеси балластных нуклеиновых кислот из разрушенных в процессе формирования тромба форменных элементов крови. Как следствие, полученные результаты о содержании микроРНК в составе экзосом являются недостоверными.
Задачей изобретения является увеличение выхода экзосом, повышение чистоты целевого продукта и сокращение длительности способа.
Техническим результатом является повышение выхода и чистоты целевого продукта, а также сокращение длительности и снижение трудоемкости способа.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
Проводят сбор периферической крови в вакутейнер или другие пробирки для сбора и консервирования крови (например, Cell-Free DNA ВСТ, Streck, США). Кровь разделяют на плазму и клеточную фракцию путем центрифугирования при 300 g в течение 10 мин. Клеточную фракцию крови подвергают последовательной обработке буферным раствором PBS (10 мМ фосфатный буфер, 0,15 М NaCl, pH 7,5), содержащим 5 мМ ЭДТА (5 мин инкубация с последующим центрифугированием 20 минут при 300 g, сбор супернатанта №1); затем обработке клеток равным объемом 0,15-0,35% раствора трипсина в PBS (5 минут инкубация, добавление ингибитора трипсина, перемешивание с последующим центрифугированием 20 минут при 300 g, сбор супернатанта №2). Плазму и полученные супернатанты (1,2) из клеточной фракции, содержащие экзосомы, связанные с поверхностью форменных элементов, объединяют и используют в качестве исходного материала для получения суммарного пула экзосом крови. Для этого из объединенного образца удаляют клеточный дебрис центрифугированием при 15000-20000 g в течение 10-20 минут, частицы неэкзосомального происхождения удаляют путем фильтрации через фильтры с диаметром пор 0,1 мкм, экзосомы осаждают ультрацентрифугированием при 100000-160000 g в течение 60-120 минут.
В результате получают суммарный пул экзосом крови, который включает экзосомы плазмы и экзосомы, связанные с поверхностью клеток крови, что позволяет повысить выход целевого продукта и в последующем повысить чувствительность диагностических систем путем увеличения количества диагностического материала (мРНК, микроРНК и белков) в анализе.
Для дальнейшего использования в диагностических тестах в препаратах экзосом выявляют белки либо выделяют мРНК или микроРНК любым пригодным методом выделения нуклеиновых кислот, а именно: методом, основанном на экстракции фенол-хлороформом (9); гуанидин-фенольным методом (10); методом выделения нуклеиновых кислот при помощи мелкодисперсного стекла или стекловолокнистых фильтров в присутствии хаотропных солей (11).
Количественный анализ мРНК или микроРНК крови также проводят любым известным методом исследования нуклеиновых кислот, как то: количественная ПЦР и ОТ-ПЦР, метод измерения концентрации нуклеиновых кислот при помощи флуоресцентных красителей (RiboGreen, SYBR Green II и т.д.). Для определения белков используют как исходный препарат экзосом, так и препараты экзосом, обработанные детергентами. Измерения белков выполняют при помощи иммунохимических методов, методов масс-спектрометрического анализа или цитофлуорометрии.
Определяющим отличием предлагаемого способа, по сравнению с прототипом, является то, что после разделения исходного образца крови на плазму и клеточную фракцию последнюю подвергают последовательной обработке буферным раствором PBS, содержащим 5 мМ ЭДТА, затем обрабатывают клетки 0,15-0,35% раствором трипсина, клетки осаждают центрифугированием, а супернатанты используют в качестве дополнительного источника экзосом. Проведение последовательной двухстадийной элюции экзосом, неспецифически связанных с поверхностью клеток крови (нековалентными взаимодействиями), так и находящихся в комплексах с белками клеточной поверхности, позволяет количественно выделять экзосомы, связанные с поверхностью форменных элементов крови и повысить выход суммарного пула экзосом.
Предлагаемый способ имеет следующие преимущества по сравнению с прототипом:
- обеспечивает получение дополнительного количества экзосом из того же объема крови;
- позволяет увеличить количество экзосом как минимум вдвое по сравнению с выделением экзосом исключительно из плазмы крови;
- позволяет почти в 3 раза снизить требуемый для измерения маркерных молекул объем донорской крови, что уменьшает трудозатраты, связанные с забором крови, уменьшает неудобства, доставляемые пациенту;
- уменьшить длительность способа с 6 до 4 часов.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1.
В группе здоровых доноров (n=10) было проведено выделение экзосом способом-прототипом и предлагаемым способом. У всех здоровых доноров-добровольцев было взято по 8 мл периферической крови.
Собранную кровь разделили на плазму и клеточную фракцию крови путем центрифугирования при 300 g в течение 10 мин. Клеточную фракцию, содержащую экзосомы, связанные с поверхностью форменных элементов крови, последовательно обрабатывали буферным раствором PBS, содержащим 5 мМ ЭДТА, с последующим инкубированием в течение 5 минут. Клетки осаждали центрифугированием в течение 20 минут при 300 g и собирали супернатант №1. Затем клетки обрабатывали равным объемом 0,15% раствора трипсина в PBS, добавляли ингибитор трипсина, перемешивали, клетки осаждали центрифугированием в течение 20 минут при 300 g и собирали супернатант №2. Плазму, супернатант №1 и супернатант №2 объединяли и использовали в качестве исходного материала для получения суммарного пула экзосом крови. Для этого из объединенного образца удаляли клеточный дебрис и частицы неэкзосомального происхождения центрифугированием при 20000 g в течение 10 минут с последующей фильтрацией через фильтры с диаметром пор 0,1 мкм, а экзосомы осаждали ультрацентрифугированием при 160000 g в течение 60 минут.
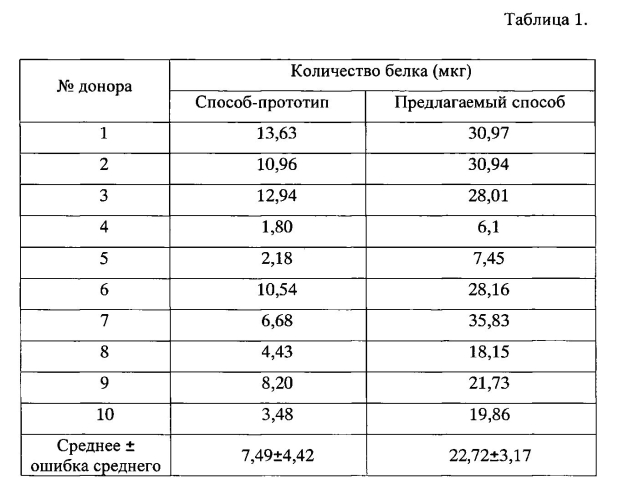
Для оценки количества выделенных экзосом с использованием способа-прототипа и предлагаемого способа была измерена концентрация белка с использованием коммерческого набора NanoOrange Quantification Kit (Invitrogen, США) по протоколу, рекомендованному производителем. Результаты исследования представлены в таблице 1. Как видно из таблицы 1, использование предлагаемого способа позволяет увеличить выход экзосом в среднем в 3 раза.
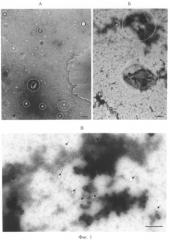
Размер частиц в препаратах оценивали с помощью трансмиссионной электронной микроскопии. Для этого экзосомы фиксировали добавлением глутарового альдегида до 2,5%, сорбировали на медную сетку, покрытую формварной пленкой, в течение 30 с и контрастировали 0,5 М уранилацетатом в течение 20 с, сетки изучали с помощью просвечивающего электронного микроскопа JEM 1400 (Jeol, Япония), снимки делали с помощью цифровой камеры Veleta. Показано, что в препаратах экзосом, полученных по способу-прототипу, 10±4% частиц имеют диаметр более 0,1 мкм, а значит не являются экзосомами. В препаратах экзосом, полученных предлагаемым способом, доля микрочастиц диаметром более 0,1 мкм составляет 0,3±0,05%. На фиг. 1 изображена электронная микрофотография экзосом крови, полученных способом прототипом (А, Б) и предлагаемым способом (В). Длина масштабной линии соответствует 200 нм, стрелками выделены экзосомы, овалами - микрочастицы неэкзосомального происхождения и клеточный дебрис. Из фиг. 1 видно, что использование предлагаемого способа позволяет получать препараты экзосом, свободные от клеточного дебриса и частиц неэкзосомального происхождения (размером более 0,1 мкм).
Таким образом, из примера 1 видно, что предлагаемый способ позволяет получать препараты экзосом без примеси крупных микрочастиц (диаметром более 0,1 мкм) и в 3 раза увеличить количество экзосом, выделяемых из крови по сравнению с экзосомами, выделенными из плазмы/сыворотки крови (прототип).
Пример 2.
В группе здоровых женщин (n=19) и больных раком молочной железы (n=20) на I-II стадиях заболевания была собрана кровь и выделены экзосомы из крови заявляемым способом и из плазмы. В препаратах выделенных экзосом было проведено сравнительное исследование содержания 28S рРНК, концентрация которой является отражением содержания экзосом в препарате.
У всех пациентов была взята кровь во время первичного установления диагноза. Собранную кровь здоровых доноров и онкологических больных разделили на плазму и клеточную фракцию крови при помощи центрифугирования в течение 10 мин при 300 g. Экзосомы крови получали аналогично примеру 1, за исключением того, что клеточную фракцию крови обрабатывали 0,35% раствором трипсина, а из объединенного образца удаляли клеточный дебрис и частицы неэкзосомального происхождения центрифугированием при 15000 g в течение 20 минут с последующей фильтрацией через фильтры с диаметром пор 0,1 мкм, а экзосомы осаждали ультрацентрифугированием при 100000 g в течение 90 минут.
Для выделения экзосом плазмы, из плазмы удаляли клеточный дебрис и частицы неэкзосомального происхождения центрифугированием при 17000 g в течение 20 мин с последующей фильтрацией через фильтры с диаметром пор 0,1 мкм, а экзосомы осаждали ультрацентрифугированием при 100000 g в течение 90 мин.
Выделение РНК из экзосом плазмы и из экзосом крови проводили с помощью набора для выделения РНК («Биосилика», Россия) по протоколу, рекомендованному производителем. Образцы выделенной РНК инкубировали с 2 единицами активности ДНКазы, не содержащей РНКаз (Fermentas, EN0531), в течение 1 ч при 37°С. Реакцию ОТ проводили с использованием набора для обратной транскрипции (Биосан, Россия) по протоколу производителя.
Для оценки концентрации 28S рРНК проводили ПЦР в режиме реального времени с использованием следующих праймеров и флуоресцентной пробы:
Прямой праймер: 5′-AAGCGGGTGGTAAACTCCAT-3′
Обратный праймер: 5′-TTCACGCCCTCTTGAACTCT-3′
Проба: 5′-TAMRA-TACCGGCACGAGACCGATAGTCAA-BHQ-3′
Амплификацию проводили в реакционной смеси объемом 30 мкл, содержащей буфер для Taq-полимеразы (65 мМ трис-HCl pH 8,8, 16 мМ (NH4)2SO4, 0,05% Tween-20), 0,3mM dNTP, 8MM MgCl2, 1 e.a. Taq-полимеразы, пo 0,6 мкМ праймеров, пробы до конечной концентрации 0,3 мкМ, 5 мкл раствора ДНК-матрицы. Измерение образцов проводили в дублях. В качестве негативного контроля использовали воду. Для построения калибровочной кривой использовали ПЦР-продукт длиной 114 п.н. ПЦР в реальном времени проводили на амплификаторе с оптическим модулем iCycler5 (Bio-Rad, США) согласно протоколу: 95°C - 3 мин; затем 40 циклов: 95°C - 15 с, 60°C - 45 с. Данные анализировали при помощи программного обеспечения iQ5 (Bio-Rad, США).
Результаты анализа по концентрации копий 28S рРНК в составе экзосом плазмы и экзосом крови у здоровых женщин и больных раком молочной железы представлены на фиг. 2. На фиг. 2 видно, что средняя концентрация 28S рРНК у здоровых женщин составила в плазме 45·105 копий/мл и в крови 305·105 копий/мл, у больных раком молочной железы - 125·105 копий/мл и 325·105 копий/мл крови соответственно. Данный пример показывает, что использование предлагаемого способа получения экзосом позволяет не менее чем в 3 раза повысить эффективность выделения экзосом из образца крови как здоровых доноров, так и онкологических больных. Увеличение количества выделенных экзосом позволит в дальнейшем повысить эффективность выявления опухолевых маркеров в составе экзосом крови.
Пример 3.
У больного Р., 1935 г.р., поступившего в онкологический диспансер с подозрением на рак предстательной железы, была определена концентрация опухолевых микроРНК (miR-200a и miR-141) в составе экзосом плазмы, полученных аналогично примеру 2 и экзосом крови, полученных аналогично примеру 1, за исключением того, что клеточную фракцию крови обрабатывали 0,25% раствором трипсина.
МикроРНК из экзосом плазмы и экзосом крови были выделены при помощи набора MirVana (США) по протоколу, рекомендованному производителем. ОТ проводили с использованием набора TaqMan MicroRNA Reverse Transcription Kit (США) по протоколу, рекомендованному производителем. Концентрация микроРНК (определенная методом 2-дельта-Ct, нормированная на U6) в составе экзосом была определена при помощи количественного ПЦР с использованием специфических праймеров TaqMan MicroRNA assay (США) и TaqMan Universal PCR Master Mix (США). Измерение образцов проводили в дублях. В качестве негативного контроля использовали воду. ПЦР в реальном времени проводили на амплификаторе с оптическим модулем iCycler5 (Bio-Rad, США), данные анализировали при помощи программного обеспечения iQ5 (Bio-Rad, США). Было обнаружено, что miR-200a в составе экзосом плазмы не детектируется, концентрация miR-141 составила 2 условные единицы. Концентрация микроРНК в составе экзосом крови составила 4 и 8 условных единиц для miR-200a и miR-141 соответственно. Данный пример иллюстрирует повышение вероятности выявления онкологического заболевания с использованием известных опухолевых маркеров за счет использования предложенного способа выделения экзосом крови.
Использование предлагаемого способа позволит повысить выход экзосом из исходного объема крови как минимум в 2 раза, с одновременным снижением трудозатрат и длительности получения экзосом, а также обеспечить возможность уменьшения объема крови для получения того же количества экзосом или повышения количества анализируемых маркеров из одного и того же объема крови.
Источники информации
1. Pant S., Hilton H., Burczynski M.E. The multifaceted exosome: biogenesis, role in normal and aberrant cellular function, and frontiers for pharmacological and biomarker opportunities // Biochemical pharmacology. 2012. V. 83. P. 1484-1494.
2. Salido-Guadarrama I., Romero-Cordoba S., Peralta-Zaragoza O., Hidalgo-Miranda A., Rodriguez-Dorantes M. MicroRNAs transported by exosomes in body fluids as mediators of intercellular communication in cancer // Onco Targets Ther. 2014. V. 7. P. 1327-1338.
3. Choi D.-S., Kim D.-K., Kim Y.-K., Gho Y.S. Proteomics, transcriptomics and lipidomics of exosomes and ectosomes // Proteomics. 2013. V. 13. P. 1554-1571.
4. Gallo A., Tandon M., Alevizos I., Illei G.G. The majority of microRNAs detectable in serum and saliva is concentrated in exosomes // PLoS ONE. 2012. V. 7. P. e30679.
5. Looze C, Yui D., Leung L., Ingham M., Kaler M., Yao X., Wu W.W., Shen R.-F., Daniels M.P., Levine S.J. Proteomic profiling of human plasma exosomes identifies PPAR as an exosome-associated protein // Biochem. Biophys. Res. Commun. 2009. V. 378. P. 433-438.
6. Ge Q., Zhou Y., Lu J., Bai Y., Xie X., Lu Z. miRNA in plasma exosome is stable under different storage conditions // Molecules. 2014. V. 19. P. 1568-1575.
7. Mestdagh P., Feys Т., Bernard N., Guenther S., Chen C, Speleman F., Vandesompele J. High-throughput stem-loop RT-qPCR miRNA expression profiling using minute amounts of input RNA. Nucleic Acids Res. 2008. V. 36. P. el43.
8. Rupp A.-K., Rupp C, Keller S., Brase J.C., Ehehalt R., Fogel M., Moldenhauer G., Marmé F., Sültmann H., Altevogt P. Loss of EpCAM expression in breast cancer derived serum exosomes: role of proteolytic cleavage // Gynecologic Oncology. 2011. V. 122. P. 437-446.
9. Short protocols in molecular biology. Third edition. Wiley, 1995. P. 4-4-4-5.
10. Chomezynski P., Mackey K. Single-step method of total RNA isolation by acid Guanidine-Phenol extraction // Organelles and cellular structures. 1996. V.10. P. 221-224.
11. Boom R., Sol C.J.A. Rapid and simple method for purification nucleic acids // J. Clin. Microbiol. 1990. V. 28. P. 495-503.
1. Способ получения экзосом из крови, включающий разделение крови на бесклеточную и клеточную фракции с помощью центрифугирования с последующим получением экзосом путем ультрацентрифугирования, отличающийся тем, что кровь разделяют на плазму и клеточную фракцию, затем клетки крови последовательно, в две стадии, обрабатывают сначала буферным раствором PBS, содержащим 5 мМ ЭДТА, затем равным объемом 0,15-0,35% раствора трипсина в PBS, далее плазму и полученные супернатанты объединяют, удаляют клеточный дебрис и примеси неэкзосомального происхождения путем центрифугирования при 15000-20000 g в течение 10-20 минут и фильтрации через фильтры с диаметром пор 0,1 мкм, а суммарный пул экзосом осаждают ультрацентрифугированием при 100000-160000 g в течение 60-120 минут.
2. Способ по п.1, отличающийся тем, что обработку буферным раствором PBS, содержащим 5 мМ ЭДТА осуществляют в течение 5 минут с последующим центрифугированием в течение 20 минут при 300 g и сбором супернатанта.
3. Способ по п.1, отличающийся тем, что обработку 0,15-0,35% раствором трипсина в PBS осуществляют в течение 5 минут с последующим добавлением ингибитора фермента, перемешиванием, осаждением клеток крови центрифугированием в течение 20 минут при 300 g и сбором супернатанта.