Пептид, обладающий нейропротекторной и ноотропной активностью, и фармацевтическая композиция на его основе
Иллюстрации
Показать всеИзобретение относится к гексапептиду формулы Thr-Gly-Glu-Asn-His-Arg-NH2, обладающему нейропротекторной и ноотропной активностью. Предложен новый состав фармацевтической композиции на основе пептида, который высокоэффективен в низких дозах и используется в виде капель в нос. Предлагаемая фармацевтическая композиция может найти применение в медицине для профилактики и лечения нейродегенеративных и цереброваскулярных заболеваний. 2 н.п. ф-лы, 3 ил., 6 табл.
Реферат
Изобретение относится к новым биологически активным соединениям, в частности к пептидам с нейропротекторной и ноотропной активностью, конкретно - гексапептиду формулы Thr-Gly-Glu-Asn-His-Arg-NH2. Предложено применение гексапептида Thr-Gly-Glu-Asn-His-Arg-NH2 в качестве нейропротекторного и ноотропного средства, направленного на профилактику и лечение болезни Альцгеймера и ишемического инсульта. Предложен новый состав фармацевтической композиции на основе указанного гексапептида (2,5 г/л): консервант в виде нипагина (1,0 г/л), хлорид натрия (10,0 г/л), карбопол 2020 NF (2,5 г/л), обеспечивающий повышенную способность препарата преодолевать слизистую оболочку носовой полости, и вода дистиллированная - остальное. Состав высокоэффективен в низких дозах и прост в применении: используется в виде капель в нос. Предлагаемая фармацевтическая композиция может найти применение в медицине.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к медицине, а именно к разработке и применению нового нейропротекторного средства. Может быть использовано для внедрения нейропротекции, являющейся особым направлением терапии нейродегенеративных и цереброваскулярных заболеваний.
Несмотря на различную этиологию болезни Альцгеймера и ишемического инсульта, патогенез этих двух заболеваний во многом сходен - это церебральная амилоидная ангиопатия, глутаматная эксайтотоксичность, нарушения кальциевого гомеостаза. И в случае инсульта, и в случае болезни Альцгеймера развивается каскад патологических изменений, приводящих к необратимому повреждению нервной ткани и массовой гибели нейронов по механизму некроза и апоптоза. Нейропротекция направлена на прерывание отсроченных механизмов смерти клеток - оксидантного стресса, дисбаланса цитокинов, локального воспаления, трофической дисфункции и апоптоза. Тесная взаимосвязь всех механизмов гибели нервной ткани позволяет использовать модулирующее влияние через системы регуляторов, особое место среди которых занимают регуляторные пептиды.
Актуальность разработки препарата определяется тем, что заболевания центральной нервной системы являются одной из ведущих причин заболеваемости, смертности и инвалидизации в России и других странах. Одним из серьезнейших цереброваскулярных заболеваний является ишемический инсульт. По данным Всемирной федерации неврологических обществ, ежегодно в мире регистрируется не менее 15 млн инсультов. В России заболеваемость инсультом составляет более 450000 новых инсультов в год. По заключению экспертов ВОЗ, болезнь Альцгеймера является наиболее частой причиной слабоумия в пожилом и старческом возрасте. В последнее десятилетие болезнь Альцгеймера признана одной из четырех главных медико-социальных проблем современного общества. В настоящее время общая численность больных, страдающих болезнью Альцгеймера, в России приближается к 1,4 млн человек. Такой большой контингент страдающих деградацией личности, патологической забывчивостью и неспособных обслуживать себя людей накладывает тяжкое бремя на социальные службы и систему здравоохранения России, так же как и других стран.
Лечение этих заболеваний представляет собой сложную задачу. На сегодняшний день не существует лечения, которое могло бы гарантированно предотвратить или существенно замедлить прогрессирование болезни Альцгеймера, хотя активные исследования в этой области проводятся во всем мире. В лечении ишемического инсульта используются нейропротекторные препараты, предназначенные для уменьшения поражения мозга и обратного развития возникших в нем изменений. Существенными недостатками средств, используемых в настоящее время для лечения инсульта и болезни Альцгеймера, резко ограничивающими область их использования, являются развитие нежелательных побочных эффектов, а также привыкания либо недостаточная эффективность. Все это требуют принятия неотложных мер для разработки и внедрения в практику принципиально новых средств, специфично воздействующих на молекулярные механизмы генерации и развития нейродегенеративных и цереброваскулярных заболеваний.
Новым направлением в области создания эффективных и безопасных лекарственных средств для лечения нейродегенеративных и цереброваскулярных заболеваний, является создание нейропротекторов на основе эндогенных регуляторных пептидов, высокоэффективных и безвредных в силу их принадлежности к родственным организму биологическим структурам.
В отличие от большинства лекарственных средств, применяемых в настоящее время для профилактики и лечения заявленных болезней, заявляемая фармацевтическая композиция на основе пептида обладает комплексным ноотропным и нейропротекторным действием, влияя на ряд узловых патогенетических механизмов этих заболеваний.
Аналогами предлагаемой новой фармацевтической композиции на основе пептида являются ноотроп пирацетам, пептидные препараты семакс и ноопепт, мемантин, ингибиторы холинэстеразы, мексидол нейромедин, мемантин, мексидол, используемые в настоящее время для лечения нейродегенеративных и цереброваскулярных расстройств. К сожалению, ни один из применяемых методов заместительной терапии не обладает установленной способностью надежно стабилизировать или существенно влиять на течение самого нейродегенеративного процесса, они лишь помогают облегчить некоторые симптомы заболевания. Кроме того, по сравнению с используемыми в настоящее время препаратами заявляемый пептид проявляет свое действие в гораздо меньших дозах. Выраженность нейропротекторного и ноотропного действия пептида проявляется в дозах 50-300 мкг/кг, тогда как лечебная доза нейромедина составляет 2 мг/кг, мемантина - 10 мг/кг, мексидола - 200 мг/кг. Все используемые препараты имеют отличный от заявляемого изобретения механизм действия и помимо недостаточной терапевтической эффективности обладают серьезными побочными эффектами и весьма дорогостоящие. В отличие от вышеперечисленных нейропротекторов, увеличение дозы нового заявляемого препарата в 200-500 раз в различных тестах не сопровождается развитием нежелательных побочных эффектов. Преимущества фармацевтической композиции на основе пептида определяются по совокупности таких лечебных свойств, как уникальность, выраженность терапевтического действия, высокий уровень и широкий спектр комбинированной ноотропной и нейропротекторной активности, низкая эффективная доза, низкая токсичность (LD50>5000 мг/кг), эффективный способ введения (интраназальный), относительно высокая устойчивость в организме.
В качестве прототипа заявляемого пептида можно рассматривать гексапептид общей формулы (Thr-Gly-Glu-Asn-His-Arg) обладающий противоопухолевой, протекторной и нормализующей активностью (патент Российской Федерации на изобретение №2213747, 11 марта 1999 г.). Однако возможность использовать его в качестве основы лекарственного препарата нейропротекторного и ноотропного действия ограничивается его быстрой биодеградацией в тканях организма и низкой нейропротекторной и ноотропной активностью.
Заявляемое изобретение решает задачу профилактики и лечения нейродегенеративных и цереброваскулярных заболеваний. Поставленная задача и технический результат достигаются тем, что гексапептид формулы Thr-Gly-Glu-Asn-His-Arg-NH2 применяется в качестве нейропротекторного и ноотропного средства. Основанием для решения задачи и достижения технического результата, достигаемого при реализации изобретения, является обнаружение широкого спектра нейропротекторного и ноотропного лечебного действия амидной формы гексапептида с противоопухолевой, протекторной и нормализующей активностью, что определяет возможность его использования в низких дозах в качестве нейропротекторного и ноотропного средства. Фармацевтическая композиция на основе заявляемого пептида отличается хорошей переносимостью, удобной для применения лекарственной формой и отсутствием нежелательных побочных эффектов, характерных для известных препаратов для лечения болезни Альцгеймера.
В состав фармацевтической композиции с нейропротекторным и ноотропным действием входят: гексапептид Thr-Gly-Glu-Asn-His-Arg-NH2 в качестве активного вещества, добавочные компоненты - нипагин, хлорид натрия и карбопол при следующем соотношении компонентов, г/л:
Гексапептид Thr-Gly-Glu-Asn-His-Arg-NH2 - 2,5;
Нипагин (консервирующее вещество) - 1,00;
Хлорид натрия (создает в получаемом растворе осмотическое и онкотическое давление, близкое к таковым показателям плазмы крови) - 10,00;
Карбопол (облегчает проникновение лекарственного средства через слизистую оболочку) - 2,5;
Вода дистиллированная - остальное.
Установлено, что гексапептид Thr-Gly-Glu-Asn-His-Arg-NH2 обладает широким спектром действия. Наряду с нейропротекторным действием гексапептид оказывает оптимизирующее и активирующее действие на мнестические и когнитивные функции мозга, что составляет важную положительную часть его специфической фармакологической активности. Гексапептид активирует процессы обучения и памяти (фиксацию, консолидацию, воспроизведение у нормальных животных и при экспериментальной патологии этих функций мозга). Эти свойства отличают фармакологическое действие гексапептида от фармакологического действия многих известных нейропротекторов.
Пептид получают с помощью классического синтеза, затем очищают и выделяют в гомогенном состоянии. Пептид имеет следующие свойства: мол. масса 712 Да; изоэлектрическая точка 7,86; pH стабильность в интервале pH от 2,0 до 9,0; термостабильность в интервале температур от 0°C до +60°C; гомогенность 99,7%; растворимость в воде и физиологическом растворе, неиммуногенный, нетоксичный.
Изобретение иллюстрируют рисунки и таблицы.
Рисунок 1. Кинетика биодеградации пептида Thr-Gly-Glu-Asn-His-Arg-NH2 в плазме крови крысы.
Рисунок 2. Кинетика биодеградации пептида Thr-Gly-Glu-Asn-His-Arg в плазме крови крысы.
Рисунок 3. Влияние субхронического системного введения пептида Thr-Gly-Glu-Asn-His-Arg-NH2 (HLDF) на изменение плотности глутаматных (NMDA), серотониновых (5-НТ2А) и никотиновых (нАХ) рецепторов на мембранах префронтальной коры и гиппокампа мозга мышей инбредных линий C57B1/6 и Balb/c.
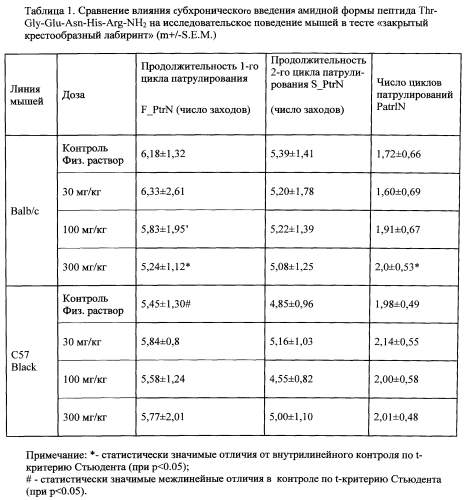
Таблица 1. Сравнение влияния субхронического введения амидной формы пептида Thr-Gly-Glu-Asn-His-Arg-NH2 на исследовательское поведение мышей в тесте «закрытый крестообразный лабиринт» (m+/-S.E.M.)
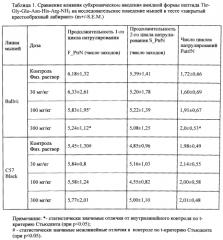
Таблица 2. Сравнение влияния субхронического введения кислотной формы пептида Thr-Gly-Glu-Asn-His-Arg на исследовательское поведение мышей в тесте «закрытый крестообразный лабиринт» (m+/-S.E.M.)
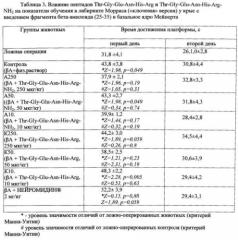
Таблица 3. Влияние пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 на показатели обучения в лабиринте Морриса («ключевая» версия) у крыс с введением фрагмента бета-амилоида (25-35) в базальное ядро Мейнерта.
Таблица 4. Влияние пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 на показатели обучения в модели пассивного избегания у крыс с совместным введением фрагмента бета-амилоида и иботеновой кислоты в гиппокамп.
Таблица 5. Влияние пептида Thr-Gly-Glu-Asn-His-Arg-NH2 на показатели тестирования в лабиринте Морриса трансгенных мышей линии B6C3 (Tg+).
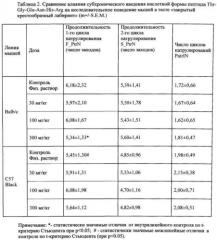
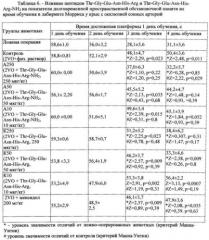
Таблица 6. Влияние пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 на показатели долговременной пространственной обстановочной памяти во время обучения в лабиринте Морриса у крыс с окклюзией сонных артерий.
Изобретение иллюстрируют примеры.
Пример 1. Сравнительное изучение времени жизни в плазме крови крысы пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2
Для анализа биотрансформации пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 используют ВЭЖХ продуктов взаимодействия [3H]Thr-Gly-Glu-Asn-His-Arg и [3H]Thr-Gly-Glu-Asn-His-Arg-NH2 с гепариновой плазмой крови. Для этого исследования используют равномерно меченные тритием пептиды [3H]Thr-Gly-Glu-Asn-His-Arg и [3H]Thr-Gly-Glu-Asn-His-Arg-NH2 с молярной радиоактивностью 60 и 70 Ки/ммоль, полученные в ИМГ РАН. Для хроматографии используют последовательно соединенные УФ-детектор и проточный детектор радиоактивности. Хроматографию проводят на колонке Кромасил C18, 150×4 мм, 4 мкм в градиенте метанола (0-30%) в присутствии 0.1% смеси трифторуксусной и гептафтормасляных кислот (4:1). Для идентификации пептидных фрагментов, образующихся при различных путях биотрансформации пептидов [3H]Thr-Gly-Glu-Asn-His-Arg и [3H]Thr-Gly-Glu-Asn-His-Arg-NH2 в плазме крови крысы, синтезируют 2-5-членные пептидные фрагменты, образующиеся при различных путях биодеградации с N и С конца пептидной цепи. С использованием меченных тритием пептидов [3H]Thr-Gly-Glu-Asn-His-Arg и [3H]Thr-Gly-Glu-Asn-His-Arg-NH2 определяют кинетику биодеградации пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 в гепариновой плазме крови крысы с исходной концентрацией 2.5 мкМ.
В результате проведенных исследований было показано, что гидролиз пептидов происходит по разным схемам. Гидролиз пептида Thr-Gly-Glu-Asn-His-Arg-NH2 происходит с N-конца пептидной цепи, и основной вклад в его гидролиз в плазме крови вносят диаминопептидазы. Гидролиз пептида Thr-Gly-Glu-Asn-His-Arg происходит с C-конца пептидной цепи, и основной вклад в его гидролиз в плазме крови вносят дикарборксипептидазы. Было показано, что пептид Thr-Gly-Glu-Asn-His-Arg-NH2 обладает высокой устойчивостью к гидролизу в плазме крови. Период его полудеградации составляет 21 минуту, что в десять раз больше, чем в случае пептида Thr-Gly-Glu-Asn-His-Arg, не имеющего амидной защиты С-конца пептидной цепи, период полудеградации которого в плазме крови крысы составляет 2 минуты (Рис. 1 и 2).
Пример 2. Сравнительное изучение влияния субхронического введения пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 на поведение мышей инбредных линий Balb/c и C57B1/6
Известно, что ноотропная активность препаратов наиболее специфично проявляется в условиях моделирования когнитивного дефицита. Одним из перспективных подходов этого направления является использование неинвазивных методов оценки дефицита исследовательского поведения в ранее незнакомой обстановке, в частности метод «закрытый крестообразный лабиринт». Другой существенной особенностью препаратов с ноотропной активностью является их способность проявлять специфическое действие после неоднократного системного введения.
Для сравнения влияния пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 на поведение используют инбредных мышей линий C57B1/6 и Balb/c, различающихся как по эффективности исследовательского поведения в лабиринте, так и по уровню тревожности и двигательной активности (Ковалев и соавт., 2013). Мышей Balb/c используют в качестве неинвазивной модели состояния когнитивного дефицита, мышей линии C57B1/6 - в качестве контроля. Пептиды вводят интраназально в 3-х дозах - 30, 100 и 300 мкг/кг в течение 5 суток. Исследования проводят на самцах мышей инбредных линий Balb/c и C57B1/6 массой 23-25 г, полученных из питомника лабораторных животных ФИБХ РАН (г. Пущино).
Для оценки исследовательского поведения животных используют закрытый крестообразный лабиринт, который состоит из 4-х прозрачных пластмассовых закрытых пустых отсеков, соединяющихся с таким же центральным отсеком с помощью входных отверстий (Салимов, 1988; Salimov 1999). Тупиковые отсеки размером 14×14×14 см пронумерованы по часовой стрелке от 1 до 4. Пол лабиринта очищают влажным ватным тампоном перед каждым опытом. Мышь помещают в центральный отсек, после чего лабиринт накрывают прозрачной крышкой. Животное может свободно перемещаться по его отделениям, а экспериментатор синхронно регистрирует номера посещаемых отделений помощью компьютерной программы, которая регистрирует последовательность и продолжительность переходов. Эксперимент продолжается до тех пор, пока животное не совершит 12 переходов из одного бокового отсека в другой.
Определяется длина первого цикла патрулирования (F_PtrN) и число циклов патрулирования (PatrlN), совершенных за время эксперимента. Показатель «длины» первого цикла патрулирования исчисляется числом заходов животного в тупики лабиринта, до момента, когда животное побывает во всех четырех тупиках лабиринта хотя бы один раз. Чем меньше число заходов в тупики при первом патрулировании и чем больше выполнено циклов патрулирования, тем более упорядочено и эффективно исследование лабиринта. Эти показатели могут быть использованы для оценки ноотропного действия вещества. Результаты компьютерной обработки исследовательской поведенческой активности мышей обеих линий представлены в Таблицах 1 и 2. Ими подтверждается, что мыши Balb/c уступают мышам C57BL/6 по эффективности исследовательского поведения в незнакомой обстановке F_PtrN на 12% (p<0.05).
Субхроническое ежедневное введение пептида Thr-Gly-Glu-Asn-His-Arg-NH2 в дозе 30 мкг/кг не оказывает положительного влияния на эффективность исследовательского поведения мышей линии Balb/c. При дозе 100 мкг/кг/день у мышей линии Balb/c наблюдается тенденция к улучшению (p=0,058), тогда как при дозе 300 мг/кг значительное улучшение наступает сразу по двум параметрам поведения. Напротив, у мышей контрольной линии C57B1/6 введение пептида не оказывает положительного влияния на эффективность исследовательского поведения ни в одной из 3-х доз (Табл. 1).
Результаты испытаний кислотной формы пептида Thr-Gly-Glu-Asn-His-Arg представлены в Табл. 2.
Показано, что под действием пептида Thr-Gly-Glu-Asn-His-Arg эффективность исследовательского поведения у «когнитивно-дефицитной» линии Balb/c повышалась лишь по одному параметру в максимальной из использованных доз (300 мкг/кг/день). Как и в случае с амидной формой пептида Thr-Gly-Glu-Asn-His-Arg-NH2, изменений в исследовательском поведении у мышей линии сравнения C57B1/6 не отмечено.
Таким образом, при сопоставлении ноотропной активности пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 при субхроническом интраназальном введении этих пептидов мышам инбредных линий Balb/c и C57B1/6 показано, что пептид Thr-Gly-Glu-Asn-His-Arg-NH2 обладает высокой ноотропной активностью, так как он избирательно улучшает когнитивное поведение мышей линии Balb/c, обладающих исходным дефицитом исследовательской активности, и не изменяет поведение мышей контрольной линии сравнения C57B1/6, а пептид Thr-Gly-Glu-Asn-His-Arg обладает низкой ноотропной активностью.
Пример 3. Влияние субхронического системного введения пептида Thr-Gly-Glu-Asn-His-Arg-NH2 на характеристики рецепторного связывания на мембранах мозга мышей линий C57B1/6 и Balb/c методом ex vivo анализа
Рецепторный компонент механизма действия пептида изучают путем сравнительного анализа изменения плотности NMDA-глутаматных, 5-НТ2а серотониновых и н-АХ никотиновых рецепторов на мембранах префронтальной коры и гиппокампа мозга мышей инбредных линий C57B1/6 и Balb/c.
Выбор лиганда для радиорецепторных исследований ex vivo осуществляют в соответствии с рекомендациями IUPHAR. При радиолигандном анализе NMDA-рецепторов используют [G-3H](+)MK-801, синтезированный реакцией ВТКИО с молярной радиоактивностью 210 Ки/ммоль. Для анализа серотониновых 5-НТ2а и никотиновых н-АХ рецепторов используют полученные реакцией ВТКИО [G-3Н]Кетансерин и (-)[G-3Н]никотин с молярной радиоактивностью 114 и 140 Ки/ммоль, соответственно.
Анализ влияния пептида Thr-Gly-Glu-Asn-His-Arg-NH2 на NMDA-рецепторы гиппокампа мышей линии Balb/c показывает, что 5-кратное системное введение пептида в ежедневной дозе 100 мкг/кг приводит к возрастанию плотности мест связывания [G-3Н]MK-801 с NMDA-рецепторами с 2115+36 фмоль/мг белка в контрольной группе до 2527+43 фмоль/мг белка, т.е. величина плотности рецепторов увеличилась на 21% относительно интактного контроля. При этом величина плотности NMDA-рецепторов в гиппокампе мышей Balb/c приблизилась к соответствующему значению для группы сравнения, представленной мышами линии C57B1/6. В мозге мышей C57B1/6 изменения в рецепторных характеристиках не отмечается: плотность мест связывания лиганда в контрольной группе 2734+44 фмоль/мг, а после субхронического введения препарата эта величина составила 2625+55 фмоль/мг белка.
Субхроническое введение пептида в равной степени уменьшало плотность 5-НТ2а-серотониновых рецепторов у обеих линий и не оказывало влияния на никотиновые н-АХ-рецепторы (Рис 3). Результаты, полученные при исследовании влияния амидной формы пептида HLDF-6 на нейрохимические процессы с помощью радиолигандного анализа, показывают, что в механизм ноотропных фармакологических эффектов с высокой степенью вероятности вовлечена глутаматергическая система гиппокампа, в частности NMDA-тип рецепторов. NMDA-рецепторы являются одной из важнейших мишеней для воздействия ноотропных и нейропротекторных лекарственных препаратов, так как они принимают определяющее участие в регуляции уровня выживаемости и гибели нервной клетки.
Пример 4. Сравнительное изучение нейропротекторной и ноотропной активности пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 на модели болезни Альцгеймера путем введения фрагмента бета-амилоида (25-35) в базальное ядро Мейнерта крыс
Болезнь Альцгеймера - нейродегенеративное заболевание, характеризующееся нарушением когнитивной функции и деменцией. Образование и накопление бета-амилоида является главной особенностью патогенеза болезни Альцгеймера. Токсическое действие фрагментов бета-амилоида при введении в мозг лабораторных животных приводит к нарушению когнитивных функций. Болезнь Альцгеймера моделируют путем введения бета-амилоида (фрагмент 25-35) в базальное гигантоклеточное ядро Мейнерта (Nucleus basalis magnocellularis). Модель характеризуется когнитивными нарушениями, обусловленными нарушением холинергической афферентации коры больших полушарий головного мозга [Harkany Т, O′Mahony S, Kelly JP, Soós K, Тörõ I, Penke В, Luiten PG, Nyakas C, Gulya K, Leonard BE. Beta-amyloid (Phe(SO3H)24)25-35 in rat nucleus basalis induces behavioral dysfunctions, impairs learning and memory and disrupts cortical cholinergic innervation. Behav Brain Res. 1998 Feb; 90(2): 133-45].
В качестве препарата сравнения используют аптечный препарат НЕЙРОМИДИН® (9-Амино-2,3,5,6,7,8-гексагидро-1H-циклопента хинолина гидрохлорид) (ампулы для внутримышечного введения). Для исследования используют здоровых половозрелых крыс-самцов линии Вистар возрастом 180-200 дней, весом 280-300 г, полученных из НПП «Питомник лабораторных животных» Филиала Института биоорганической химии РАН, г. Пущино. Пептиды вводились интраназально в 3-х дозах - 10, 50 и 250 мкг/кг. Препарат сравнения НЕЙРОМИДИН® вводят внутрибрюшинно в дозе 2 мг/кг.
Введение бета-амилоида (25-35) в базальное ядро Мейнерта проводят под общим наркозом (золетил 15 мг/кг + ксилазин 2 мкг/кг вниутрибрюшинно). Введение осуществляют в стереотаксической установке (TSE, Германия) по координатам АР -1.5, DL ±2.7, H 8.1 при помощи микрошприца Hamilton. Экспериментальным животным вводят билатерально фрагмент бета-амилоида (25-35) в дозе 2 мкг на сторону в 1 мкл физиологического раствора. Ложно-оперированным животным контрольной группы вводят билатерально физиологический раствор (1 мкл на сторону). Было прооперировано 100 животных, смертность составила 0%.
Растворы исследуемых пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 вводят интраназально в объеме 48 мкл/кг поровну в обе ноздри. Препарат сравнения НЕЙРОМИДИН® вводят в дозе 2 мг/кг внутрибрюшинно в физиологическом растворе. Животным контрольных групп вводят физиологический раствор. Введение проводят через 1 час и 24 часа, а также на 3, 5 и 7 дни после операции. Тестирование кратковременной пространственной памяти проводят в лабиринте Морриса на 21-22 дни после операции [de Bruin JP, Sánchez-Santed F, Heinsbroek RP, Donker A, Postmes P. A behavioural analysis of rats with damage to the medial prefrontal cortex using the Morris water maze: evidence for behavioural flexibility, but not for impaired spatial navigation. Brain Res. 1994 Aug 1; 652(2): 323-33].
Лабиринт Морриса представляет собой круглый бассейн серого цвета диаметром 165 см с высотой стенок 60 см, наполненный водой на высоту 40 см. Круглая платформа из плексигласа диаметром 9 см располагается в центре одного из секторов на 2 см ниже уровня воды. В ходе обучения животных опускают в воду с 4 различных точек и фиксируют время достижения платформы. После достижения платформы животное оставляют на ней на 15 с, а затем на 2 мин возвращают крысу в домашнюю клетку. Обучение проводят в течение 2-х дней.
В связи с тем, что в использованной модели болезни Альцгеймера поражается преимущественно кора больших полушарий, для тестирования применяют т.н. «ключевую» версию обучения. Над платформой на высоте 20 см располагают черный шар (ключевой сигнал), а расположение ее в каждой пробе изменяют. Данная модель, в которой животное обучается ориентироваться на «ключевой» сигнал, не зависит от целостности функций гиппокампа, однако зависит от функционального состояния коры больших полушарий [Le Pen G, Grottick AJ, Higgins GA, Martin JR, Jenck F, Moreau JL. Spatial and associative learning deficits induced by neonatal excitotoxic hippocampal damage in rats: further evaluation of an animal model of schizophrenia. Behav Pharmacol. 2000 Jun; 11(3-4): 257-68, Save E, Poucet B. Involvement of the hippocampus and associative parietal cortex in the use of proximal and distal landmarks for navigation. Behav Brain Res. 2000 May; 109(2): 195-206]. Статистическую обработку результатов проводят с использованием непараметрических методов: критерия Краскелла-Уоллиса, медианного теста, а также параметров Манна-Уитни и Вилкоксона. Обработку проводят при помощи статистического программного пакета STATISTICA 6.0.
Сравнение групп с использованием теста Манна-Уитни выявило статистически значимое возрастание времени выполнения навыка у животных контрольной группы по сравнению с ложной операцией (Таблица 3). Таким образом, введение бета-амилоида в базальное ядро Мейнерта вызывает избирательное нарушение кратковременной пространственной «ключевой» памяти.
Также обнаружено, что показатели группы животных, получавших амидную форму пептида Thr-Gly-Glu-Asn-His-Arg-NH2 в дозе 250 мкг/кг, а также группы с введением НЕЙРОМИДИНА® в первый день не демонстрируют статистически значимых отличий от уровня ложно-оперированных крыс. В остальных группах наблюдается существенное снижение выполнения навыка по сравнению с ложно-оперированными животными. В то же время ни в одной из экспериментальных групп не выявлено существенных отличий от контроля. Таким образом, частичное восстановление способности к обучению в данной модели происходит только после введения пептида Thr-Gly-Glu-Asn-His-Arg-NH2 в дозе 250 мкг/кг и по силе эффекта сравнимо с эффектом НЕЙРОМИДИНА® в дозе 2 мг/кг.
Таким образом, на модели болезни Альцгеймера, реализуемой при введении фрагмента бета-амилоида (25-35) в базальное ядро Мейнерта крысы, показано, что пептид Thr-Gly-Glu-Asn-His-Arg-NH2 при интраназальном введении в дозе 250 мкг/кг обнаруживает высокие нейропротекторные свойства, значительно превосходя при этом пептид Thr-Gly-Glu-Asn-His-Arg. Активность пептида Thr-Gly-Glu-Asn-His-Arg-NH2 и препарата сравнения Нейромедина соизмерима, при этом действующая доза Нейромедина (2 мг/кг) значительно больше.
Пример 5. Сравнительное изучение нейропротекторной и ноотропной активности пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 на модели болезни Альцгеймера путем совместного введения фрагмента бета-амилоида и иботеновой кислоты в гиппокамп
Симптомы болезни Альцгеймера моделируют совместным введением фрагмента бета-амилоида и иботеновой кислоты (ИК) в гиппокамп крыс. В качестве препарата сравнения используют аптечный препарат мемантина гидрохлорид. Для исследования используют здоровых половозрелых крыс-самцов линии Вистар возрастом 180-200 дней, весом 280-300 г, полученных из питомника «Столбовая» РАМН.
Введение в гиппокамп фрагмента бета-амилоида (25-35) с иботеновой кислотой проводят билатерально в дозах 2 мкг и 0,5 мкг на одну сторону соответственно в объеме 1 мкл. Операцию проводят под общим наркозом (золетил 15 мг/кг + ксилазин 2 мкг/кг внутрибрюшинно). Инъекции осуществляют микрошприцем "Hamilton" в стереотаксической установке TSE (Германия) по координатам: АР -3,5, L±2,0, H 2,7. Животным контрольной группы в тех же условиях вводят по 1,5 мкл физиологического раствора на сторону.
Для тестирования когнитивных функций пептиды Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 вводят интраназально в объеме 48 мкл/кг поровну в обе ноздри в дозе 250 мкг/кг. Препарат сравнения мемантина гидрохлорид вводят в дозе 10 мг/кг подкожно в физиологическом растворе. Животным контрольных групп вводят 1 мл/кг физиологического раствора. Введение проводят через 1 час и 24 часа, а также на 3, 5 и 7 дни после операции. Тестирование в модели пассивного избегания проводят на 18-19 дни после операции.
Тест пассивного избегания проводят в установке Columbus Instruments (USA). Экспериментальная камера состоит из двух одинаковых отсеков размером 25×40×25 см с полом из металлических прутьев. Отсеки соединяются между собой отверстием в общей стенке 8×8 см, снабженным гильотинной дверью. Один из отсеков освещен, другой затемнен. В ходе выработки пассивного избегания животное помещают в освещенный отсек и регистрируют время перехода в темную часть камеры (проявление норкового рефлекса). Сразу после того, как все четыре лапы животного оказываются в темной половине камеры, гильотинная дверь опускается и крысе наносится электрокожное раздражение через прутья пола (0.6 мА, 3 с), после чего ее сразу вынимают из камеры и помещают в домашнюю клетку. Через 48 часов проводят тестирование выработанного навыка. Крысу вновь помещают в светлый отсек и фиксируют время перехода в темную половину. Показателем обучения является возрастание времени перехода в темный отсек в сеансе тестирования по сравнению с сеансом обучения (ΔT).
При сравнении групп по критерию Манна-Уитни обнаружено, что в группе контроля ΔT статистически значимо ниже, чем в группе ложной операции (Таблица 4), что свидетельствует о выраженных нарушениях долговременной памяти оборонительного поведения, вызванного введением βa+ИК. У животных, получавших инъекции амидной формы пептида Thr-Gly-Glu-Asn-His-Arg-NH2, значения ΔT существенно выше, чем в контрольной группе, и почти не отличаются от соответствующего показателя группы ложной операции. Аналогичный эффект оказывает препарат сравнения, однако его действие, как и действие пептида Thr-Gly-Glu-Asn-His-Arg, выражено несколько слабее.
Таким образом, на модели болезни Альцгеймера реализуемой при совместном введении фрагмента бета-амилоида и иботеновой кислоты в гиппокамп крысы показано, что пептид Thr-Gly-Glu-Asn-His-Arg-NH2 при интраназальном введении в дозе 250 мкг/кг обнаруживает высокие нейропротекторные свойства, превосходя при этом пептид Thr-Gly-Glu-Asn-His-Arg и препарат сравнения мемантина гидрохлорид, используемый в значительно большей действующий дозе, составляющей 10 мг/кг.
Пример 6. Влияние системного введения пептида Thr-Gly-Glu-Asn-His-Arg-NH2 на трансгенной модели болезни Альцгеймера (трансгенные мыши линии B6C3-Tg (APP695)85DboTg(PSENI)85Dbo)
Болезнь Альцгеймера - нейродегенеративное заболевание, характеризующееся нарушением когнитивной функции и деменцией. Существуют наследственная и спорадическая формы заболевания. При наследственной болезни Альцгеймера имеет место развитие по аутосомно-доминантному типу наследования. Основным преимуществом трансгенной модели является то, что при введении животному человеческих генов, отвечающих за развитие наследственной формы болезни Альцгеймера (генов АРР и пресенилина), у животных развиваются патогенетические процессы, сходные с таковыми при болезни Альцгеймера у человека (образование амилоидных бляшек, оксидативный стресс, нарушение холинергической передачи, гибель нейронов). Это позволяет предположить, что процессы, проходящие в ЦНС у таких модельных животных, сходны с таковыми при развитии болезни Альцгеймера у человека. Наиболее адекватной моделью для изучения потенциальных лекарственных препаратов являются дабл-трансгенные мыши линии B6C3-Tg (APP695)85DboTg(PSENI)85Dbo. Животные этой линии экспрессируют мутантный человеческий белок пресенилин и химерный мышь/человек амилоидный белок - предшественник (APPSwe). Характерной особенностью этой линии является раннее (в возрасте 6-7 месяцев) развитие патологии альцгеймеровского типа, обусловленное ускоренным отложением в мозге бета-амилоидных образований и нарушением когнитивных функций.
Анализ нейропротекторной и ноотропной активности пептида Thr-Gly-Glu-Asn-His-Arg-NH2 при интраназальном введении в дозе 250 мкг/кг выполняют на трансгенных мышах линии B6C3-Tg (APP695)85DboTg(PSENI)85Dbo. Для исследования используют здоровых мышей-самцов линии B6C3, (Tg+) возрастом 8 месяцев, весом 35-40 г, мышей дикой линии (Tg-) возрастом 8 месяцев, весом 35-40 и мышей C57B16 возрастом 8 месяцев, весом 35-40 г. Введение пептида Thr-Gly-Glu-Asn-His-Arg-NH2 проводят в течение 30 дней через день (всего - 15 инъекций). При проведении исследований формируют четыре группы мышей (по 10 особей в каждой):
- 1 группа (экспериментальная) - мыши Tg+, которым интраназально вводят пептид в дозе 250 мкг/кг;
- 2 группа (активный контроль) - мыши Tg+, которым интраназально вводят физиологический раствор;
- 3 группа (контроль-1) - мыши Tg-, которым интраназально вводят физиологический раствор;
- 4 группа (контроль-2) - мыши линии C57B16, которым интраназально вводят физиологический раствор.
Показателем долговременной пространственной памяти в модели лабиринта Морриса служит среднее время достижения платформы во 2-5 дни обучения. Результаты представлены в таблице 5.
Анализ выявил статистически значимые различия между группами в 4-й и 5-й дни обучения. При этом тест Манна-Уитни не выявил статистически значимых различий между контрольными группами (C57B16 и Tg-) ни в один из дней обучения. Животные Tg+, получавшие физиологический раствор, демонстрировали существенный дефицит пространственной памяти в 4-й и 5-й дни обучения, по сравнению с обеими контрольными группами. Введение пептида приводит к частичному восстановлению пространственной памяти у мышей Tg+ таким образом, что в 4-й день обучения уровень выполнения навыка в этой группе мало отличается как от контрольного, так и от уровня группы Tg+ с введением физиологического раствора, т.е. занимает промежуточное положение. В пятый день обучения мыши Tg+ с введением пептида выполняют задачу существенно лучше, чем группа Tg+ с введением физиологического раствора, и не демонстрируют значимых отличий ни от одной из контрольных групп, что говорит о полном восстановлении пространственной памяти. Итак, обнаружено, что пептид Thr-Gly-Glu-Asn-His-Arg-NH2 эффективно восстанавливает нарушенные когнитивные функции у трансгенных мышей.
Таким образом, совокупность полученных результатов свидетельствует, что пептид Thr-Gly-Glu-Asn-His-Arg-NH2 обладает ноотропным и нейропротекторным действием в отношении нарушенных когнитивных функций в модели наследственной формы болезни Альцгеймера у лабораторных животных. Эффективность пептида Thr-Gly-Glu-Asn-His-Arg-NH2 показана для дозы 250 мкг/кг в условиях интраназальной доставки.
Пример 7. Сравнительное изучение нейропротекторной и ноотропной активности пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 на модели ишемического инсульта
Нарушения мозгового кровообращения - одна из основных причин смертности и инвалидизации, а поиск эффективных нейропротекторов и ноотропов, предотвращающих развитие амнезии в этих условиях, - одна из важнейших задач современной науки.
Проводят сравнительное изучение специфической активности пептидов Thr-Gly-Glu-Asn-His-Arg и Thr-Gly-Glu-Asn-His-Arg-NH2 в условиях интраназальной доставки на модели ишемического инсульта (хроническая окклюзия сонных артерий - 2 VO) у лабораторных животных. В качестве препарата сравнения в данной модели используют аптечный препарат Мексидол (ампулы для внутримышечного введения). Для исследования используют здоровых половозрелых крыс-самцов линии Вистар возрастом 180-200 дней, весом 280-300 г.
При моделировании ишемического инсульта у лабораторных животных (модель 2vo) операцию по двусторонней перевязке (окклюзии) сонных артерий проводят под общим наркозом (золетил 15 мг/кг + ксилазин 2 мкг/кг внутрибрюшинно). В ходе операции животное фиксируют в станке, осуществляют продольный разрез на передней стороне шеи, выделяют сонную артерию, при помощи пинцетов и стеклянных крючков сепарируют сосуд от блуждающего нерва и перевязывают шелковой хирургической нитью. Ложно-оперированным животным нить подводят под артерию, не завязывая.
Исследуемые образцы пептида вводят интраназально в объеме 48 мкл/кг поровну в обе ноздри. Препарат сравнения мексидол вводят в дозе 200 мг/кг внутрибрюшинно в физиологическом растворе. Животным контрольных групп вводят 1 мл\кг физиологического раствора. Введение проводят через 1 час и 24 часа, а также на 3, 5 и 7 дни после операции. Тестирование долговременной обстановочной пространственной памяти в лабиринте Морриса проводят на 18-22 дни после операции.
Статистическую обработку результатов