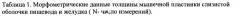Способ лечения химического ожога пищевода и желудка в эксперименте
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и касается разработки тактики лечения химических ожогов пищевода и желудка. Для этого у лабораторных крыс моделируют химический ожог. Начиная с 5-х суток после создания модели осуществляют внутрибрюшное введение лекарственных средств. При этом вводят цефатаксим в дозе 100 мг/кг в течение 7 суток. Преднизолон вводят в дозе 1 мг/кг в течение 3 суток. Введение 3%-ного раствора ксимедона осуществляют в дозе 30 мг/кг 1 раз в течение 40 суток. Способ обеспечивает эффективное лечение ожогов пищевода и желудка за счет быстрого восстановления толщины мышечной пластинки слизистой оболочки и предупреждения образования рубцов. 1 табл., 16 ил.
Реферат
Изобретение откосится к области медицины, а именно к лекарственной терапии и может быть использовано в экспериментальной и клинической медицине.
Острые химические повреждения верхних отделов желудочно-кишечного тракта в России распространены больше, чем в других странах (10-32% от всех пострадавших, поступающих в центры лечения острых отравлений) (Волков С.В., Ермолов А.С., Лужников Е.А. Химические ожоги пищевода и желудка. Эндоскопическая диагностика и лазеротерапия. - М.: Издательский дом «Медпрактика-М», 2005, 120 с.), причем в структуре прижигающих веществ ведущее месте до 40% занимает употребление уксусной кислоты (Рукевич С.Г., Паршиков В.В., Батанов Г.Б., Карпова И.Ю. Применение современной классификации многокомпонентных прижигающих веществ при химических ожогах пищевода и желудка у детей. Электронный сборник научных работ конференции, посвященной 100-летию со дня рождения профессора А.А. Диковой. Кафедра детской хирургии НижГМА, 2013 г.).
Осложнениями химических ожогов верхних отделов пищеварительного тракта являются развитие рубцовых стенозов пищевода и желудка, ранние и поздние кровотечения, перфорации пищевода. Опасность употребления прижигающих веществ заключается также в поражении нервной системы, легких, печени и почек, что в ряде случаев может привести к летальному исходу (Sakineh Fallahi, Seyed M.V. Hosseini Soghra Fallahi, Morteza Salimi, Ali Akbar Hesam, Seydeh Hamideh Hoseini. Extent of Injury of Gastrointestinal tract due to accidental ingestion of chemicals among children at Bandar Abbass Children Hospital 2009-2011. Life Science Journal 2012; 9(4): 2054-2057).
Наибольшее число пострадавших в результате химических ожогов пищевода различной этиологии составляют дети в возрасте от 1 года до 5 лет. У данной возрастной категории детского возраста ожоги пищевода встречаются в 2,5-3 раза чаще, чем у детей от 5 до 10 лет.
Известны способы лечения ожогов пищевода и желудка с помощью хирургических методов (РФ патент №2213591, МПК A61N 5/06, А61К 31/44, А61Р 1/04), в котором на пораженную поверхность слизистой оболочки желудка воздействуют лазерным излучением с длиной волны 0,63 мкм при плотности мощности 10-100 мВт. Предварительно перед облучением в неизмененную часть слизистой оболочки желудка вводят мексидол. Осуществляют введение из двух точек, отступя на 1,0 см от края дефекта. В каждую точку вводят по 1 мл 5%-ного раствора мексидола через день. Курс лечения от 10 до 20 инъекций. Известный способ позволяет усилить медикаментозный эффект мексидола за счет улучшения местного кровотока под воздействием лазерного облучения. Это снижает частоту развития декомпенсированного стеноза желудка.
Известны консервативные методы лечения химических ожогов пищевода у детей (патент РФ №2286781, А61К 31/416, А61К 38/47, А61К 33/00, А61Р 17/02, публ. 10.01.2005).
Способ включает использование композиций лекарственных веществ в виде двух желеобразных составов на основе регенкура перорально или через зонд. При этом в течение одной недели на второй-третьей фазах развития ожогового процесса используют композицию, содержащую, г: метронидазол 0,75, преднизолон 0,05, лидокаина гидрохлорид 0,1, натрия сахаринат 0,24, ароматизатор пищевой, идентичный натуральному, 0,5, регенкур 4,0, глицерин 8,0, воду до 100,0; после чего на четвертой фазе развития ожогового процесса используют в течение не менее 2 недель композицию следующего состава, г: метронидазол 0,75, метилурацил 2,0, лидаза 128 ЕД, натрия сахаринат 0,24, ароматизатор пищевой, идентичный натуральному, ″клубника″ 0,5, регенкур 4,0, глицерин 8,0, вода до 100,0. Способ позволяет сформировать более гладкий рубец и сократить сроки эпителизации слизистой оболочки пищевода за счет обеспечения компонентами составов необходимой вязкости лекарственной формы и длительного контакта веществ с ожоговой поверхностью.
Известен способ лечения и профилактики рубцовых стриктур пищевода после химических ожогов, включающий применение диспергированного биологического материала в комбинации с воздействием лазерного излучения в красном спектре (РФ патент №2269349, А61К 35/00, A61N 5/067, А61Р 1/00, публ. 10.02.2006).
Задачей вышеперечисленных известных способов является сформировать более гладкий рубец, сократить сроки эпителизации слизистой оболочки пищевода, сократить частоту рубцовых стенозов.
Однако поиски и разработка новых технических решений, позволяющих выполнить вышеназванные задачи, продолжаются.
За прототип изобретения выбран известный способ лечения химического ожога пищевода и желудка в эксперименте, включающий моделирование химического ожога пищевода и желудка у лабораторных животных и последующее лечение (Мухаметова З.Р. Экспериментально-морфологическое обоснование применения диспергированного биоматериала в комплексном лечении химических ожогов желудка. Автореферат на соискание ученой степени к.м.н., Уфа, 2010).
Известный способ осуществляют следующим образом.
У взрослых крыс обоего пола весом 200-250 г линии Wistar моделируют химический ожог пищевода 70%-ной уксусной кислотой, вводимой через зонд в количестве 1,5 мл. Затем в опытной группе стенку желудк, через лапаротомный разрез обкалывали стимулятором регенерации. Биоматериал «Стимулятор регенерации» в количестве 50 мг разводился в 10 мл физиологического раствора и вводился по 0,2-0,4 мл в область дефекта в две точки в подслизистой основы до образования практически на всем протяжении желудка инфильтративного депо. Аллогенный биоматериал готовился в тканевом банке ФГУ «ВЦГПХ» в соответствии с требованиями ТУ 42-2-537-2006 (диспергированный биоматериал - «Стимулятор регенерации»). Эффективность лечения оценивали по динамике структурных изменений, которую изучали через час после химического ожога, на 7-е сутки и на 30-е сутки эксперимента. На гистологических препаратах измерялась высота фундальных желез; в собственной пластинке определяли ряд показателей: клеточный состав (макрофаги и фибробласты), толщина волокон коллагена, суммарная площадь просвета капилляров (СППК) на единицу площади (27,8 тыс. мкм2).
Задачей экспериментального лечения являлось создание условий для формирования ограниченного домена, который проявляется в виде инъекционного валика при введении 1,5 мл раствора биоматериала в подслизистый слой стенки желудка.
В своей работе автор доказал, что перифокальное введение ДБА в область химического ожога желудка оптимизирует процессы репаративной регенерации, в эксперименте способствует формированию адекватного регенерата без явлений фиброза в стенке желудка. На основании изложенных экспериментальных данных следует заключить, что инъекции ДБА при ожогах желудка способствуют изменению характера воспалительной реакции и переходу в пролиферативную фазу, которая заканчивается формированием регенерата. Того же добивались и авторы патента №2269349, А61К 35/00, A61N 5/067, А61Р 1/00, публ. 10.02.2006.
Однако способ, выбранный в качестве прототипа, имеет следующие недостатки, а именно:
- недостаточная эффективность. Сам автор указывает на то, что распространение диспергированного биоматериала в интерстициальном пространстве подслизистого слоя определяется регионарными особенностями фиброархитектоники и плотностью коллагеновых волокон;
- травматичность введения (предполагается хирургическая операция);
- трудоемкость выполнения как самого способа лечения, так и оценка его эффективности;
Кроме того, известный способ слишком далек от его внедрения в практику лечения больных с ожогом пищевода и желудка, особенно у детей.
Задачей изобретения является повышение эффективности лечения за счет быстрого восстановления толщины мышечной пластинки слизистой оболочки и предупреждение образования рубцов, уменьшение травматичности лечения.
Поставленная задача решается тем, что в известном способе лечения химического ожога пищевода и желудка у лабораторных животных, включающем моделирование химического ожога и проведение последующего лечения, начиная с 5-х суток после создания модели осуществляют внутрибрюшное введение цефатаксима 100 мг/кг в течение 7 суток, внутрибрюшное введение преднизолона 1 мг/кг в течение 3 суток, и внутрибрюшное введение 3% раствора ксимедона в дозе 30 мг/кг 1 раз в течение 40 суток.
Изобретение отвечает критерию «новизна», т.к. в процессе поведения патентно-информационных исследований не выявлено источников, порочащих новизну изобретения.
Новизна способа заключается в том, что начиная с 5-х суток после создания модели осуществляют внутрибрюшное введение цефатаксима 100 мг/кг в течение 7 суток, внутрибрюшное введение преднизолона 1 мг/кг в течение 3 суток и внутрибрюшное введение 3%-ного раствора ксимедона в дозе 30 мг/кг 1 раз в течение 40 суток.
Изобретение отвечает критерию «изобретательский уровень», т.к. авторы не выявили технических решений с существенными признаками предлагаемого способа,
Известен способ лечения химических ожогов пищевода и желудка с применением антибиотиков и гормонов (Алексеенко С.И. Химические ожоги пищевода у детей: особенности диагностики, лечения и профилактики осложнений. Дис. канд. мед. наук. СПб.; 2006).
Известен препарат ксимедон (гидроксиэтилдиметилдигидропиримидин) - препарат, активизирующий обмен веществ в тканях, улучшающий трофику и стимулирующий процесс регенерации. Ксимедон ускоряет процессы регенерации тканей и сокращает сроки заживления ожоговой поверхности, улучшает приживление кожных трансплантатов при аутодермопластике. Способствует нормализации соотношения между содержанием фибриногена в крови и ее фибринолитической активностью, улучшает регионарное кровообращение. Нормализует иммунную систему, повышает фагоцитарную активность Т-лимфоцитов и неспецифическую резинстентность организма. При перроральном приеме ксимедона происходит быстрое всасывание его в течение 0,5-1 ч. В результате низкого процента связывания с сыворочным альбумином (9%) и отсутствием биотрансформации в организме, препарат не оказывает конкурентного действия при приеме других лекарственных средств. Препарат применяют внутрь, перед едой по 0,5 г 3-4 раза в день. Курс лечения составляет от 1 до 5 недель (инструкция по применению).
Однако авторы изобретения не обнаружили сведений о внутрибрюшном введении ксимедона для лечения химических ожогов пищевода и желудка.
Технический эффект предлагаемого способа заключается в повышении эффективности лечения химических ожогов пищевода и желудка за счет более быстрого (на 13 день эксперимента) восстановления толщины мышечной пластинки слизистой оболочки и предупреждение образования рубцов. Достижение этого эффекта обеспечивается еще и тем, что лечение послеожоговых эзофагита и гастрита осуществляют введением наряду с принятыми в клинической практике антибиотиком и коротким курсом кортикостероидов препарата, усиливающего регенерацию, ксимедон. Применение внутрибрюшного введения ксимедона в комплексном лечении химического ожога пищевода и желудка в эксперименте способствует восстановлению структуры слизистой оболочки, регулирует процессы коллагенеза, препятствует образованию грубых рубцов. Способ позволяет добиться скорейшей эпителизации ожоговой поверхности пищевода и желудка без развития рубцов. Нашими исследованиями установлено, что противовоспалительный и антибактериальные эффекты препарата усиливают действие антибиотиков и подавляют воспаление в поврежденных тканях. Выраженное иммуностимулирующее действие препарата способствует коррекции вторичного иммунодефицита при химических ожогах пищевода и желудка.
Предлагаемый способ малоинвазивен. Для оценки эффективности экспериментального способа лечения авторы изобретения оценивали состояние и толщину мышечной пластинки слизистой оболочки пищевода и желудка, а также наличие соединительной ткани.
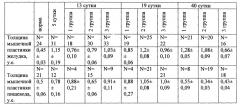
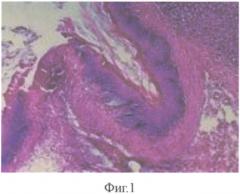
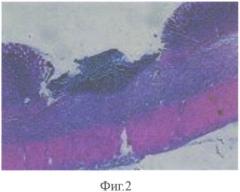
Для подтверждения технического эффекта способа были проведены исследования на трех группах экспериментальных крыс. 1 группа - контрольная (12 крыс) подвергалась затравке уксусной кислотой и в течение всего эксперимента находилась на обычном питании и питьевом режиме без лечения. 2 группа - стандартная (15 крыс) на 5 сутки после затравки начала получать внутрибрюшинно антибиотик цефатаксим в дозе 100 мг/кг 7 суток, преднизолон 1 мг/кг 3 суток. В 3 группе - опытная (19 крыс) вводили внутрибрюшинно антибиотик цефатаксим в дозе 100 мг/кг 7 суток, преднизолон 1 мг/кг 3 суток и ксимедон в дозе 30 мг/кг 1 раз в течение 40 суток. Животные 2 и 3 групп также находились на обычном питании и питьевом режиме. Крысы в каждой группе выводились из эксперимента на 13-е, 19-е и 40-е сутки. Для морфологического исследования у животных забирались фрагменты пищевода, желудка. Материал фиксировался в 10%-ном растворе нейтрального формалина с последующим приготовлением парафиновых блоков. Срезы готовились с соблюдением анатомической ориентации и окрашивались гематоксилином-эозином и по Ван-Гизону. В препаратах, полученных на 5 сутки (все крысы без лечения), в стенке нижнего отдела пищевода и желудка преобладали некротические процессы, в некоторых случаях распространяющиеся на подслизистую основу и мышечную оболочку, лимфо-лейкоцитарная инфильтрация в подслизистой основе и мышечной оболочке, что доказывает эффективность моделирования ожога (фиг. 1, 2). Наиболее выраженные изменения локализовались в области пищеводно-желудочного перехода и на границе железистого и безжелезистого отделов желудка.
На 13 сутки в препаратах контрольной группы (фиг. 3) отмечается отек подслизистой основы, густая нейтрофильная инфильтрация вплоть до мышечного слоя. В стандартной и экспериментальной группах на 13 сутки макро- и микроскопически воспалительные изменения были выражены меньше, а в экспериментальной (3) группе отмечалась усиленная регенерация слизистой оболочки пищевода и желудка в виде увеличения количества клеток базального слоя (фиг. 5).
В препаратах, полученных на 19 сутки в контрольной группе, признаки воспаления сохраняются (лимфоцитарная инфильтрация), появляются признаки фиброза мышечной пластинки, но регенерация слизистой оболочки выраженная (фиг. 6). В препаратах 2 группы (со стандартным лечением) признаки воспаления также сохраняются, но инфильтрация очаговая, представлена лимфоцитами и эозинофилами, отек подслизистой основы. Признаки фиброза также присутствуют (фиг. 7). В 3 группе по сравнению с контрольной и стандартной воспалительные изменения выражены меньше, структура слизистой оболочки полностью восстановилась, признаки фиброза отсутствуют, отмечается гиперактивность базального слоя (фиг. 8).
На 40 сутки у леченых крыс 2 и 3 групп по сравнению с контрольной макроскопически гиперемия слизистой пищевода и желудка менее выражена, у животных отсутствуют признаки вторичных осложнений (у 1 крысы в контрольной группе выявлены множественные абсцессы легких). В препаратах контрольной группы (фиг. 9) отмечены признаки выраженного фиброза подслизистой основы. Волокна соединительной ткани прорастают между гладкомышечными клетками мышечной пластинки слизистой оболочки, в силу этого наблюдается ее фрагментация. За счет фиброза происходит утолщение слизистой оболочки. Подслизистая основа в состоянии умеренно выраженного отека с полнокровием сосудов. Отмечаются единичные эрозии желудка, сохраняющаяся очаговая лимфоцитарная инфильтрация. Микроскопически в группе со стандартным лечением (фиг. 10) воспалительные изменения менее выражены и представлены отеком подслизистой основы, полнокровием сосудов, эозинофильной инфильтрацией собственной пластинки слизистой оболочки и подслизистой основы. Выявляются признаки фиброза собственной пластинки слизистой оболочки. В экспериментальной (фиг. 11) слизистая оболочка практически восстановилась, отсутствует фиброз подслизистой основы.
Морфометрические исследования толщины всей слизистой пищевода и желудка позволили выявить следующие данные (таблица 1).
По результатам проведенного эксперимента провели оценку толщины мышечной пластинки, как основной характеристики, участвующей при формировании послеожоговых стенозов, и проанализирована динамика изменений мышечных пластинок пищевода и желудка в изучаемых группах (таблица 1).
Морфометрические измерения в тканях без ожога показали, что в норме у крыс толщина мышечной пластинки пищевода составляет 0,45±0,03 у.е., желудка 0,5±0,06 у.е. В эксперименте нами установлено, что увеличение толщины данных слоев соответствует на ранних этапах нарастанию отека, в более поздние сроки наряду с отеком наличием склеротических изменений в тканях. Причем при изучении препаратов пищевода не получено достоверно значимых различий толщины мышечной пластики на 40 сутки в контрольной группе (р1=0,361) и в группе с экспериментальной схемой лечения (р3=0,645) по сравнению с нормальными значениями. Также выявлено (фиг. 15) более плавное снижение толщины мышечной пластинки в динамике к указанному сроку, а также тенденция к нормальным значениям в контрольной (0,55±0,09 у.е.) и экспериментальной группах (0,43±0,04 у.е.). В группе со стандартным лечением на 40 сутки толщина мышечной пластинки пищевода статистически достоверно отличается от нормальной (р=0,024) и составляет 0,34±0,03 у.е.
В группе с применением ксимедона отмечается плавное увеличение толщины мышечной пластинки пищевода на ранних этапах за счет нарастания отека и аналогичное уменьшение к 40 суткам в отличие от скачкообразных изменений в других группах (за счет нарастания склеротических процессов в тканях). Наиболее показательные результаты получены в препаратах желудка (фиг. 16), где отмечается плавное снижение толщины мышечной пластинки в экспериментальной группе и морфометрические значения к 40 суткам наиболее близки к нормальным.
Предлагаемый способ осуществляют следующим образом.
Моделируют химический ожог пищевода и желудка у лабораторной крысы путем использования методики затравки 30%-ной уксусной кислоты. На 5-е сутки после затравки начинают лечение: внутрибрюшинно вводят цефатаксим в дозе 100 мг/кг - один раз в сутки 7 дней, внутрибрюшинно вводят преднизолон в дозе 1 мг/кг 1 раз в сутки 3 суток и внутрибрюшинно вводят 3%-ный раствор ксимедона в дозе 30 мг/кг в течение 40 дней один раз в сутки.
Предлагаемый способ позволяет оценить результаты новых способов лечения химических ожогов пищевода и желудка не только в эксперименте, но и позволит рекомендовать применение эффективных способов лечения химических ожогов пищевода и желудка в клинической практике.
Способ лечения химического ожога пищевода и желудка у лабораторных животных, включающий моделирование химического ожога и проведение лечения, отличающийся тем, что, начиная с 5-х суток после создания модели, осуществляют внутрибрюшное введение цефатаксима 100 мг/кг в течение 7 суток, внутрибрюшное введение преднизолона 1 мг/кг в течение 3 суток и внутрибрюшное введение 3%-ного раствора ксимедона в дозе 30 мг/кг 1 раз в течение 40 суток.