Способ получения пробиотического препарата для кормлении крупного рогатого скота мясных пород
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложен способ получения пробиотического препарата иммобилизованных бифидобактерий для кормления крупного рогатого скота мясных пород. Бифидобактерии штамма Bifidobacterium longum выращивают на питательной среде до получения биотитра 108-109 КОЕ/мл. Питательную среду получают с использованием электроактивированной катодной воды с pH 8-9 и редокс потенциалом -400…-500 мВ и с добавлением стабилизатора - серина в количестве не менее 0,01 мас.%. Затем бифидобактерии совместно с компонентами питательной среды иммобилизуют на энтеросорбенте полифепан. Преимуществом способа является улучшение аппетита крупного рогатого скота, переваримости питательных веществ рациона, увеличение среднесуточных привесов, стимулирование рубцового пищеварения, нормализация всех видов обмена веществ, ускорение заселения желудочно-кишечного тракта нормальной микрофлорой, уменьшение выделения с фекалиями патогенных и условно-патогенных бактерий. 4 табл., 2 пр.
Реферат
Изобретение относится к отрасли сельского хозяйства и может быть использовано для повышения продуктивности жвачных животных.
Известен способ применения пробиотического препарата, включающий обработку адсорбента комбинацией живых культур бактерий. В качестве адсорбента используют преддефекационный осадок, содержащий маточную культуру живых пробиотических бактерий родов Ruminococcus, Lactobacillus [1].
Известен комплексный бактериальный препарат, включающий адсорбент - активированный уголь и иммобилизованные на нем микробные клетки в концентрации на 1 мм2 - 2,1*103-1,0*105. Активированный уголь представлен в виде порошка с размером частиц менее 30 мкм, а в качестве микроорганизмов используют лактобактерии и кишечные палочки [2].
Известные способы не позволяют обеспечить достаточную сохранность микроорганизмов в средах с низкими значениями pH. Эти адсорбенты обладают в основном микропорами, в связи с чем работают преимущественно в верхних отделах желудочно-кишечного тракта.
Известен энтеросорбент, представляющий собой биологически активную добавку к пище или лекарственное средство в таблетированной форме, следующего состава компонентов, мас.%: гидролизный лигнин или медицинский лигнин (полифепан) - 50-99; лактоза (молочный сахар) - 1-50, обладающий пребиотическими свойствами [3].
В данном изобретении авторами указывается, что лактоза иммобилизованная на сорбенте, внутри человеческого организма обеспечивает проявление пребиотических свойств данного сорбента, то есть лактоза, гидролизуясь до моносахаров, является лишь субстратом, которым питаются существующие в организме человека полезные бактерии. Но этого недостаточно, так как при дисбактериозе исчезает в первую очередь бифидофлора.
Многолетние исследования в области микробной экологии убедительно показали, что микрофлора хозяина играет важную роль в поддержании его здоровья. Установлено, что на поверхности кожи и слизистых, площадь которых составляет около 500 м2 (400 м2 - приходится на тонкий и толстый кишечник, 80 м2 - на слизистую легких и 2,5 м2 - на кожу), присутствует огромное количество микроорганизмов, образующих биопленку [4, 5].
К представителям микрофлоры желудочно-кишечного тракта жвачных животных относятся бифидобактерии, лактобактерии, бактероиды, энтерококки, эшерихии, дрожжеподобные грибы. При этом основную ее часть у здоровых животных составляют бифидобактерии. В норме в 1 г содержимого толстых кишок животных находят 108-1012 бифидобактерии, снижение их количества менее 107/г свидетельствует о нарушениях в кишечном микробиоценозе [6, 7].
От реакции среды зависит стабильность пробиотического препарата, который может необратимо инактивироваться при ее низких значениях. Известно, что эффективное влияние пробиотики оказывают в кишечном тракте, где pH среды равен 8,0-8,3 единиц, но вначале препарат должен пройти агрессивное воздействие преджелудков животных. Так, в желудке (сычуге) pH находится в пределах 1,4-3,9 единиц, что приводит к деактивации пробиотика и тем самым снижается его эффективность действия на организм животных.
В связи с этим создание комплексных пробиотических препаратов, способных противодействовать разрушительному воздействию пищеварительных соков в желудочно-кишечном тракте жвачных, является актуальным, так как позволяет влиять на использование питательных веществ рационов.
Сущность предлагаемого способа получения пробиотического препарата для кормления крупного рогатого скота заключается в том, что используется энтеросорбент полифепан, обладающий высокой сорбционной активностью (пористость 35,4% по ацитону) и развитой структурой мезопор (размером 20-500 А) и макропор (размером более 500 А) и живая культура Bifidobacterium longum (размером 0,5-1,3 мкм) с титром 5*108 КОЕ/мл с частицами стабилизированной электроактивированной катодной питательной средой на энтеросорбенте полифепан.
Полифепан является природным энтеросорбентом растительного происхождения, получаемым из древесины хвойных пород. Он прошел испытания в российских клиниках различного профиля и является одним из наиболее перспективных неспецифических энтеросорбентов.
Энтеросорбент полифепан не растворим в воде, органических жидкостях и биологических средах, не имеет вкуса и запаха, не токсичен, не претерпевает в организме метаболических превращений и выводится из организма естественным путем. Мезо- и макропористая структура сорбента способствует защите иммобилизованных микробных клеток от негативных факторов внешней среды.
Снимает эффекты местного и общего токсикоза, что способствует выживаемости бактерий препарата и микрофлоры кишечника.
Пример конкретного исполнения
Пример №1. В ходе лабораторных исследований определили пористость сорбентов по ацетону, а также устойчивость исследуемых препаратов по отношению к инактивирующим факторам желудочной среды. Бифидобактерии выращивали в течение 120 ч на жидкой стабилизированной электроактивированной катодной питательной среде МРС в термостате при температуре 30°C, а после на плотной среде МРС 72 ч в чашках Петри при той же температуре до получения биотитра 108-109 КОЕ/мл, это обеспечивает оптимальную биологическую активность препарату. Вместо обычной дистилированной воды использовали стабилизированную электроактивированную воду (католит) с pH 8-9 и редокс потенциалом -400…-500 мВ, что 4 способствовало увеличению адгезионной способности бактерий на сорбенте.
При выращивании бифидобактерии в течение 120 часов на жидкой не электроактивированной (катодной) питательной среде МРС биологическая активность и химическая реакционная способность этой среды полностью самопроизвольно исчезает в срок от 15 мин до 2-3 часов, какой бы первоначально окислительно-восстановительный потенциал она не имела [10, 11, 12].
Поэтому с целью сохранения полезных свойств среды вводили стабилизатор, который представляет аминокислоту из группы, включающей глицин, серин, треанин, цистеин, тирозин, аспаргин, глутамин, или их производные, или пептиды в количестве не менее 0,01 мас.%. Стабилизатор предотвращает окислительную и микробиологическую реакции, при этом повышается активность бифидобактерии в среднем на 10 КОЕ/мл [10].
В нашем опыте стабилизатором служил серин в количестве не менее 0,01 мас.%.
Для получения электроактивированной катодной воды использовали биоэлектроактиватор "ЭСПЕРО-1". Время обработки составляло 7 мин при температуре воды 16°C. Контроль за щелочностью электроактивированной воды осуществляли по изменению pH с помощью pH-метра, а за степенью активности по изменению величины окислительно-восстановительного потенциала с помощью ионометра ЭВ-74.
В результате проведенных исследований было установлено, что пористость (в объеме) по ацетону бентонита составляет 34,3%, угля активного 37,6%, полифепана 35,4%. С помощью этой же методики была определена сорбирующая способность исследуемых сорбентов к штамму Bifidobacterium longum с частицами активированной питательной средой.
Сорбирующую способность полифепана проводили по следующей схеме в трех повторениях. Полифепан, высушенный до постоянного веса, высыпали во взвешенный мерный цилиндр емкостью 100 мл (диаметр 25 мм). Цилиндр наполняли до метки 100 мл порциями с уплотнением. Взвешивали с точностью до 0,01 г и наполняли жидкой стабилизированной активированной (катодной) питательной средой со штаммом Bifidobacterium longum до постоянного уровня над слоем полифепана. Через 30 мин избыток раствора сливали и цилиндр с полифепаном взвешивали. Количество сорбированного раствора вычисляли по формуле:
где М1 - масса цилиндра с полифепаном, г
М2 - масса цилиндра с полифепаном пропитанным раствором, г
Р - плотность раствора при температуре опыта, г/см3
V-100 см3 - объем полифепана.
В результате опыта достоверно установлено, что 100 г бентонита впитывает 34 мл стабилизированной активированной питательной среды с бифидобактериями, также 100 г полифепана соответственно - 35 мл ± 2,06 (Р>0,95) и уголь активированный - 37 мл.
Для разработки нового препарата 100 г сорбента вносят в жидкую питательную среду со штаммом Bifidobacterium longum объемом 34 мл и тщательно перемешивают. По истечении 1 ч образовавшуюся пасту подсушивают в сушильном шкафу до постоянной влажности 15% при, температуре 25-30°C. Клетки эубиотиков используют совместно с компонентами стабилизированной электроактивированной катодной питательной средой с биотитром 108-1010 КОЕ/мл. Полученный препарат в дозе 3 г состоит: сорбент полифепан - 74%, живая культура Bifidobacterium longum с компантами стабилизированной активированной питательной среды - 26%.
С целью изучения защитных свойств изучаемых пористых сорбентов от инактивирующих факторов желудочно-кишечного тракта на биомассу бифидобактерий, содержащихся в них, изучаемые препараты подвергали воздействию искусственного желудочного сока (0,1 н соляная кислота с добавками пепсина) в течение 40 мин с последующей нейтрализацией и определением биотитра стандартным методом серийных разведений на питательной среде МРС [8].
До и после обработки определяли биотитры препаратов.
Анализ полученных данных свидетельствует о различии в устойчивости препаратов к инактивирующим факторам желудочной среды (табл.1).
Так, при воздействии искусственного желудочного сока на жидкий концентрат бифидобактерии его биотитр (концентрация живых клеток) уменьшился в 803 раза. Это означает, что при применении пробиотиков в жидком виде лишь незначительная часть бактерий, содержащихся в нем, будет достигать кишечника в живом активном виде.
Биотитр препарата на активированном угле уменьшился в 106 раз, на полифепане в 52 раза по сравнению со значениями до обработки, что обусловлено буферными свойствами и его структурными характеристиками.
В результате чего предлагаемый препарат обеспечивает более эффективное пролонгированное действие на организм животного, за счет сохранения активности препарата в 15,4 раз по сравнению с жидким концентратом при введении в организм на всех участках желудочно-кишечного тракта.
При использовании пробиотиков на предлагаемом адсорбенте будет достигаться большая степень колонизации кишечника бактериями и тем самым более высокая эффективность препарата.
Пример №2. Были проведены физиологические исследования по изучению процессов пищеварения на трех группах бычков - аналогов казахской белоголовой породы по 3 головы в каждой в возрасте 15 месяцев [9]. Схема исследований предусматривала скармливание контрольной группе основного рациона кормления (OP), I опытной - ОР + пробиотик на подифепане в дозе 2,5 г/гол., II - ОР + пробиотик на полифепане в дозе 3 г/гол.
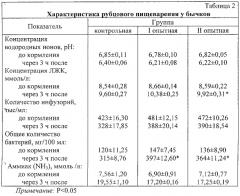
Включение испытуемого пробиотика в состав рационов животных оказало определенное влияние на состав рубцовой микрофлоры и характер брожения кормовых масс в рубце бычков опытных групп (табл.2).
Установлено, что концентрация водородных ионов в рубцовой жидкости снижается через 3 ч после кормления во всех группах. Самая высокая концентрация водородных ионов (pH) была зафиксирована в контрольной группе, превосходившая опытные значения на 3,05% и 2,89% соответственно. Разница по данному показателю между опытными группами была незначительной.
Наименьшая концентрация летучих жирных кислот в рубцовой жидкости бычков всех групп отмечалась перед кормлением, а наивысшее ее значение было через 3 часа после начала кормления. Так содержание ЛЖК (летучие жирные кислоты) у бычков из I и II опытных групп было выше на 7,5 и 3,2% соответственно, чем в контроле. Данное увеличение концентрации ЛЖК в химусе рубца, как и конечных продуктов сбраживания углеводов, обусловлено усилением роста и развития микроорганизмов в опытных вариантах.
У подопытных бычков из контрольной группы до кормления количество инфузорий было ниже, чем у аналогов из I и II опытных групп на 12,5 и 10,4%. Через 3 часа после начала кормления содержание инфузорий в I и II опытных вариантах превышало контроль на 15,4 и 15,9% соответственно.
Введение пробиотика в рационы бычков опытных групп способствовало увеличению общего количества бактерий до кормления на 18,3 и 11,7%, а через 3 часа после начала кормления - на 20,6 и 13,4%, по сравнению с животными из контрольной группы.
У животных всех групп через три часа после кормления уровень аммиака в фубцовой жидкости увеличился по сравнению со значениями до начала кормления. Сравнение содержания аммиака в рубцовой жидкости между группами показало, что разница между контрольной и I опытной группой через 3 часа после кормления составила 12,0%, а между контрольной и II опытной группой 11,8%. По данному показателю различия между опытными группами были незначительны и статистически не достоверны.
Результаты исследований показали, что скармливание пробиотика улучшало поедаемость кормов. Наиболее высокая поедаемость кормов в опыте была отмечена в I и II опытных группах. Пробиотик также оказал положительное влияние на функциональную деятельность желудочно-кишечного тракта, способствовал лучшей обеспеченности микрофлорой преджелудков животных, что в свою очередь повлияло на преобразование корма в питательный субстрат и лучшее переваривание питательных веществ рациона.
Характер рубцового пищеварения у бычков, получавших пробиотик, создавал предпосылки лучшей переваримости питательных веществ рационов (табл.3).
Бычки опытных групп имели достоверное преимущество перед контрольными по переваримости сухого вещества на 1,92-3,13%, сырого протеина 2,84-3,99%, сырой клетчатки 6,70-7,71%.
Наибольшее преимущество имели животные, получавшие пробиотик в дозе 3 г/гол.
Более высокие коэффициенты переваримости протеина корма бычками опытных групп были обусловлены повышением протеолитической активности желудочно-кишечного тракта, за счет выделения микроорганизмами протеаз.
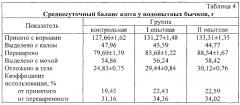
Бычки, получавшие пробиотический препарат, по сравнению с контролем лучше использовали азот рационов и больше усваивали его в организме (табл.4).
Баланс азота в организме животных всех групп был положительным. При этом потребление азота с кормом повышалось в опытных группах, ввиду большего потребления ими кормов.
Контрольные животные меньше усваивали азот по сравнению с бычками I и II опытных групп на 15,7 и 17,6%.
По использованию азотистой части рационов животные опытных групп превосходили аналогов из контрольной соответственно на 2,98 и 3,14%.
Отмеченные повышения переваримости и использования питательных веществ кормов рационов, интенсивности и направленности обменных процессов оказали положительное влияние на интенсивность роста бычков опытных групп.
Так, на начало эксперимента животные всех групп имели практически одинаковую живую массу. За период проведения опыта наибольший среднесуточный прирост живой массы отмечался у животных из опытных групп и составил 833 и 875 г, что по сравнению с контролем было больше на 11,1 и 16,7% соответственно.
Результаты проведенных исследований свидетельствует, о том, что энтеросорбция полифепана и бифидобактерии совместно с стабилизированной электроактивированной (катодной) питательной средой способны пролонгировать и усилить действие комплексного пробиотического препарата.
Использование данного препарата позволяет: улучшить аппетит, переваримость питательных веществ рациона; увеличить среднесуточные привесы; стимулировать рубцовое пищеварение, нормализовать все виды обмена веществ; ускорить заселение желудочно-кишечного тракта нормальной микрофлорой; уменьшить выделение с фекалиями патогенных и условно-патогенных бактерий.
Источники информации
1. Патент РФ №2190332, A23K 1/00, A23K 1/16, опубл. 10.10.2002 г.
2. Патент РФ №2017486, A61K 31/00, опубл. 15.08.94 г.
3. Патент РФ №2279278, A61K 31/70, опубл. 10.07.2006 г.
4. Беляков, Н.А. Альтернативная медицина / Н.А. Беляков. - С. Петербург, Архангельск. - 1994. - 226 с.
5. Шендеров, Б.А. Пробиотики и функциональное питание / Б.А. Шендеров, М.А. Манвелова, Ю.Б. Степанчук, Н.Э. Скиба // Антибиотики и химиотерапия. - 1997. - №7. - С.30-34.
6. Сидоров, М.А. Нормальная микрофлора животных и ее коррекция пробиотиками / М.А. Сидоров, В.В. Субботин, Н.В. Данилевская / Ветеринария. - 2000. - №11. - С.17-21.
7. Мещеряков А.Г. О жизнедеятельности микрофлоры рубца / А.Г. Мещеряков // Сб. мат.региональной науч.-практ. конф. молодых ученых и специалистов Оренбуржья. - Оренбург, 2002. - С.114-115.
8. ГОСТ 10444.11-89 / Продукты пищевые: методы определения молочнокислых микроорганизмов. - 118 с.
9. Овсянников, А.И. Основы опытного дела в животноводстве /А.И. Овсянников. - М.: Колос, 1976. - 304 с.
10. Патент РФ №2234945 С2, опубл. 27.08.2004 г.
11. Патент РФ №2349072, опубл. 20.03.2009 г.
12. Патент РФ 32349071, опубл. 20.03.2009 г.
Способ получения пробиотического препарата иммобилизованных бифидобактерий для кормления крупного рогатого скота мясных пород, включающий иммобилизацию бифидобактерий на сорбенте, отличающийся тем, что выращивают бифидобактерии штамма Bifidobacterium longum до получения биотитра 108-109 КОЕ/мл на питательной среде, полученной с использованием вместо дистилированной воды электроактивированной катодной воды с pH 8-9 и редокс потенциалом -400…-500 мВ с добавлением стабилизатора - серина в количестве не менее 0,01 мас.%, затем бифидобактерии совместно с компонентами питательной среды иммобилизуют на энтеросорбенте полифепан.