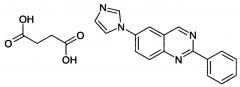
Кристаллические формы 6-(1н-имидазол-1-ил)-2-фенилхиназолина и его солей
Иллюстрации
Показать всеИзобретение относится к новым кристаллическим формам 6-(1Н-имидазол-1-ил)-2-фенилхиназолина формулы (I) в виде соли, выбранной из гидрохлорида, (L)-тартрата и малеата. Соединения обладают сильным анальгезирующим действием и могут найти применение в терапии при лечении боли при таких заболеваниях, как ревматоидный артрит, остеартрит, патологиях воспалительных заболеваний, заболеваниях желудочно-кишечного тракта и др.
Каждая кристаллическая форма соли охарактеризована спектром порошковой дифракции рентгеновских лучей (XRPD). Кристаллическая форма гидрохлорида также охарактеризована точкой плавления с разложением при приблизительно 240°C. Кристаллическая форма (L)-тартрата и кристаллическая форма малеата также характеризуются термограммами ДСК и спектрами ПФ-ИК. Кристаллическая форма малеата дополнительно характеризуется триклинной системой с параметрами кристаллической ячейки a=8,9412 (5) Å, b=9,8081 (5) Å, c=10,5922 (6) Å, α: 90,517° (4), β=101,969° (5), γ=99,132° (4), V=896,34 (8) Å3, пространственной группой P-1. Соли обладают улучшенной растворимостью, биодоступностью и стабильностью. 3 н.п. ф-лы, 66 ил., 19 табл., 65 пр.
Реферат
Настоящее изобретение относится к новым кристаллическим формам 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, CR4056, его фармацевтически приемлемым солям и сольватам и также способам его получения. 6-(1Н-имидазол-1-ил)-2-фенилхиназолин является новым, сильнодействующим анальгезирующим, противовоспалительным и антидепрессивным агентом. Таким образом, настоящее изобретение относится также к фармацевтическим составам кристаллических форм CR4056, соответствующих его солей и сольватов, их получению и применению этих фармацевтических форм в лечении хронической или острой боли, при лечении патологий воспалительной природы и лечении депрессии.
Введение
Авторы изобретения ранее описали в заявке на патент WO 2008/014822 (Получение производных 6-(1Н-имидазо)хиназолина и -хинолина в качестве анальгезирующих средств и противовоспалительных агентов) группу производных 6-(1Н-имидазол-1-ил)-2-арилхиназолина с сильной анальгезирующей и противовоспалительной активностью, при условии, что они являются оптимальными фармакологическими агентами для лечения воспалительных патологий, таких как ревматоидный артрит и остеоартрит, патологий воспалительной природы дыхательного пути, кожных патологий, таких как красная волчанка, экзема и псориаз, а также воспалительных патологий желудочно-кишечного тракта, таких как неспецифический язвенный колит, болезнь Крона и послеоперационные воспалительные осложнения.
Кроме того, вследствие их сильного анальгезирующего действия, эти соединения можно применять при лечении острой и хронической боли, такой как послеоперационная и посттравматическая боль, мышечная боль, включающая фибромиалгию, невропатическую боль и боль, связанную с раком.
В предыдущей заявке на патент РСТ/ЕР 2008/057908 от 20 июня 2008 г. (Производные 6-(1Н-имидазо)хиназолина и -хинолина, новые ингибиторы МАО-А и лиганды рецептора имидазолина) описана такая же группа производных 6-(1Н-имидазол-1-ил)-2-арилхиназолинов со значительной антидепрессивной активностью, которая при сочетании с анальгезирующей активностью, описанной выше, обеспечивает эти продукты подходящим фармакологическим профилем, поскольку депрессия является заметным (существенным) побочным действием при хронических патологиях, обсуждаемых выше.
Оказывается, что среди указанных выше производных 6-(1Н-имидазол-1-ил)-2-арилхиназолина 6-(1Н-имидазол-1-ил)-2-фенилхиназолин, CR4056, обеспечен значительным общим фармакологическим профилем.
Физико-химические характеристики фармацевтически активных компонентов (ингредиентов) (API) в твердом состоянии имеют фундаментальное значение при разработке лекарственного продукта, поскольку они могут оказывать влияние на биологическую доступность, стабильность и способность к обработке как активного компонента, так и соответствующих фармацевтических форм.
Известно, что во многих случаях этот активный компонент может существовать в твердом состоянии в кристаллических и аморфных формах и что в случае кристаллической формы возможны различные сольваты и полиморфы.
Полиморфизм состоит в способности вещества кристаллизоваться в более чем одной форме, причем каждая форма характеризуется различным расположением молекул в кристаллической решетке, тогда как способность образовывать сольваты состоит в возможности включения в определенные положения и согласно определенной стехиометрии молекул воды или растворителя в кристаллическую решетку.
Полиморфизм, таким образом, истолковывается в контексте так, как он описан в ICH Q6A (International Conference on Harmonisation, Topic Q6A, May 2000), и поэтому термин “кристаллическая форма API” означает в контексте конкретную форму твердого состояния, которая является либо полиморфом, либо сольватом. Различные полиморфы и сольваты могут иметь различные растворимости, различные стабильности, различные гигроскопичности и различные механические свойства, например фильтруемость и сыпучесть.
В то время как характеристики растворимости могут быть важными для биологической доступности лекарственного продукта, другие физико-химические и механические характеристики являются важными при определении стабильности и способности к обработке как активного компонента, так и фармацевтической формы и поэтому могут оказывать значительное влияние на качество и стоимость продукта. В зависимости от типа терапевтического применения, пути введения, а также препарата может быть необходимо обеспечить один и тот же активный ингредиент с различными физико-химическими характеристиками, так чтобы придать ему подходящую адаптивность для различных требований составов.
Полиморфизм может быть поэтому благоприятной возможностью для удовлетворения этих требований. Например, в случае пероральных составов или парентеральных составов с немедленным высвобождением растворимость активного ингредиента может быть фундаментальной для определения эффективности лечения или даже возможности применения этого пути введения. 6-(1Н-имидазол-1-ил)-2-фенилхиназолин, CR4056, обнаружил неожиданную способность кристаллизоваться в виде свободного основания в различных кристаллических формах, включающих сольваты и полиморфы, которые, если адекватно не регулируются, могут препятствовать совместимости физико-химических свойств активного ингредиента, создавая обсуждаемые выше проблемы. В частности, кристаллизация продукта согласно способам, указанным в WO 2008/014822 и в PCT/EP 2008/057908, может образовывать смеси полиморфов и сольватов.
Поглощение перорально введенного лекарственного средства определяется двумя фундаментальными факторами, проницаемостью, то есть способностью диффундировать через желудочно-кишечную стенку, и растворимостью, то есть способностью растворяться в желудочно-кишечной жидкости.
Для учета этих двух факторов вводили классификацию лекарственных продуктов, известную как BCS (Biopharmaceutical Classification System) (GL Amidon et al., Pharm. Res. 1995, 12: 413-419). Поскольку 6-(1Н-имидазол-1-ил)-2-фенилхиназолин обладает хорошей проницаемостью и низкой растворимостью, его относят к классу II (высокая проницаемость, низкая растворимость) системы BCS. Для лекарственных продуктов этого класса растворимость является фундаментальной при определении их поглощения. Получение фармацевтически приемлемых солей обычно представляет собой способ повышения растворимости слабо растворимых продуктов, и в случае продуктов, обладающих хорошей проницаемостью, является подходящим способом повышения их биологической доступности.
Однако не всегда возможно получить соли, обладающие подходящими свойствами, такими как растворимость, стабильность и способность к обработке. Поскольку даже соли органических соединений могут образовывать полиморфы и сольваты, иногда можно идентифицировать подходящую кристаллическую форму соли или сольвата, имеющего указанные свойства, которые могут позволить подходящим образом применять их для получения фармацевтических составов, которые удовлетворяют рассматриваемой потребности. Например, стабильность кристаллической формы при различных условиях хранения, которая является необходимой во время цикла изготовления активного ингредиента и соответствующего фармацевтического состава, является важным условием для обеспечения качества, однородности и совместимости свойств лекарственного продукта.
Кроме того, во время цикла изготовления кристаллов исключение применения конкретных известных мер предосторожности против гигроскопичности или низкой стабильности кристаллической формы может в большинстве случаев значительно уменьшить стоимость производства. Стабильность кристаллической формы к механическим воздействиям является важной для всех процессов, обычно применяемых в цикле изготовления фармацевтической композиции, например размалывания, которое необходимо для получения частиц подходящего размера как для требований технологии изготовления (сыпучесть), так и требований растворения, смешивания, которое необходимо для обеспечения однородности активного ингредиента в изготовленном продукте, и прессования, которое является необходимым для получения таблеток.
Идентификацию и характеризацию кристаллической формы часто можно проводить нетривиальным способом (Giron Danielle, Monitoring polymorphism of drugs, an on-going challenge - part 2. American Pharmaceutical Review (2008), 11(3), 86-90). Применение многочисленных дополнительных аналитических способов, например способов дифракции рентгеновских лучей, калориметрии и колебательной спектроскопии, делает возможным однозначную идентификацию и характеризацию в большинстве классов данной кристаллической формы.
Термогравиметрический анализ (ТГА), часто в комбинации с дифференциальной сканирующей калориметрией (ДСК), является очень применимым для демонстрации присутствия гидратов или сольватов. ДСК является также способом, который часто является основным для обнаружения полиморфов и близких термических свойств. Среди способов колебательной спектроскопии инфракрасная спектроскопия (FT-IR) (инфракрасная спектроскопия с преобразованием Фурье) часто делает возможным идентификацию полиморфов и, когда это является невозможным, Раман-спектроскопия может предоставить требуемую информацию.
В случае гидратов и для изучения гигроскопичности соединения способ DVS (дифференциальной паровой сорбции) является важным способом. Выбранным способом для характеризации кристаллической формы, независимо от того, является ли она полиморфом или сольватом, однако, является рентгеновская спектроскопия. Этот относительно простой способ, когда он является сущностью экспериментов порошковой дифракции рентгеновских лучей (XRPD), делает возможным однозначную идентификацию кристаллической формы и определение относительной степени кристалличности в большинстве случаев (Harry G. Brittain, X-ray powder diffraction of pharmaceutical materials, American Pharmaceutical Review 2002, 5(1), 74-76).
Хотя XRPD можно применять после подходящей калибровки, для определения чистоты полиморфной формы с очень высокой чувствительностью (Stephen R. Byrn, Regulatory aspects of X-ray powder diffraction, American Pharmaceutical Review 2005, 8(3), 55-59), при его обычном применении во время способа идентификации и характеризации полиморфов этот способ способен детектировать присутствие других кристаллических форм с чувствительностью обычно порядка 5-10%.
Лучшим способом идентификации и характеризации кристаллической формы является рентгеновская дифракционная спектроскопия монокристалла (SC-XR). Этот способ делает возможным идентификацию типа и размеров элементарной ячейки, характеризующих тип кристаллической формы, и поэтому является наиболее подходящим способом определения полиморфа или сольвата и, как в случае солей, для объяснения их однозначной стехиометрии, и для понимания их свойств.
Несмотря на тот факт, что были достигнуты значительные технологические успехи, основное ограничение этого способа все же лежит в возможности получения кристалла формы, подвергаемой анализу, подходящих размеров и с ограниченным числом нарушений структуры, но это не всегда является легко достижимым или даже возможным.
Описание изобретения
Настоящее изобретение относится к твердому состоянию 6-(1Н-имидазол-1-ил)-2-фенилхиназолина как в виде свободного основания, так и в форме стабильной и фармацевтически приемлемой соли. Посредством подходящего применения различных кристаллических форм свободного основания и его солей, описываемых в контексте, можно не только гарантировать совместимость физико-химических свойств активного ингредиента, но также сделать возможным его введение в различных формах, таких как пероральные и парентеральные формы.
В частности, настоящее изобретение относится к твердому состоянию активного ингредиента, 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (I), CR4056, и более конкретно, кристаллическим формам свободного основания и его фармацевтически приемлемых солей и сольватов, а также способу получения этих полиморфов, солей и сольватов и применению указанных полиморфов и сольватов свободного основания или его солей или соответствующих сольватов для получения фармацевтических составов. Изобретение относится также к применению указанных фармацевтических составов для фармакологического лечения боли и патологий воспалительной природы, обсуждаемых ранее, этим соединением.
В частности, один аспект настоящего изобретения относится к полиморфам 6-(1Н-имидазол-1-ил)-2-фенилхиназолина в виде не превращенного в соль основания и в несольватированной форме.
Более конкретно, этот аспект включает по существу чистые полиморфные кристаллические формы 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, которые можно получить воспроизводимым образом и которые обладают такими характеристиками биологической доступности, стабильности и гигроскопичности и механическими свойствами, чтобы их можно было применять для получения подходящих фармацевтических составов, которые могут удовлетворять нормам в отношении качества (ICH Q10, Pharmaceutical Quality System, June 2008).
Выражение “по существу чистая кристаллическая форма” означает в описании и в нижеследующем тексте кристаллическую форму, характеризующуюся XRPD, которая содержит самое большее только следы сигналов, относящихся к другим кристаллическим формам. Присутствие таких сигналов предпочтительно меньше, чем детектируемый предел системы (XRPD), или равно такому пределу, и поэтому в большинстве описанных в контексте случаев термин “по существу чистая форма” означает кристаллическую форму с чистотой не меньше, чем 90%.
- Кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4) (полиморф А свободного основания) характеризуется спектром порошковой дифракции рентгеновских лучей (XRPD), показанным на фигуре 1 и содержащим основные пики, указанные в таблице 1.
Термин “основные пики” означает в описании и в нижеследующем тексте пики с относительной интенсивностью >5%. Описанную в контексте дифрактограмму XRPD получали облучением посредством Cu Kα и с применением XPERT-PRO для обработки данных.
Более конкретно, спектры порошковой дифракции, приведенные в контексте, получали с применением дифрактометра X'Pert PRO (PANalytical) и с применением следующих параметров для получения и обработки данных.
Анод: Cu (тип: керамическая дифракционная рентгеновская трубка, Long Line Focus, PW3373/00 Cu LFF)
Размер фокуса: 12 мм ×0,4 мм
Качество фокусирования: до COCIR spec.
Диаметр окна: 14 мм, толщина окна: 300 мкм
Фиксация генератора: 40 мА, 40 кВ
Длина волны:
Kα1=1,54060 Е
Kα2=1,54443 Е
Kβ=1,39225 Е
Отношение Kα1/Kα2: 0,50000
Kα=1,541874 Е
Kβ=1,392250 Е
Радиус прохождения падающего пучка (мм): 240,0
Гониометр стандартного разрешения PW3050/60 X'Pert PRO
Радиус гониометра: 240,00 мм (системы X'Pert PRO MPD)
Фокусное расстояние-щелевая расходимость: 91,00 мм
Вращение: 1°/сек
Начальное положение: 2θ°=3,0084
Конечное положение: 2θ°=39,9834
Размер шага: 2θ°=0,0170
Время шага сканирования (сек): 12,9218
Тип сканирования: непрерывный
Способ PSD: сканирование
Длина PSD: 2θ°=2,12
Сдвиг: 2θ°=0,000
Размер щелевой расходимости: 0,2393°
Длина образца: 10,00 мм
Плоскость дифракции на переднем крае кристалла 150 мм
Фильтр: никель (0,020 мм)
Название детектора: X'Celerator
Тип: детектор RTMS
PHD - нижний уровень (%): 39,5
PHD - верхний уровень (%): 80,0
Способ: сканирование
Активная длина (°): 2,122
Все другие дифрактограммы, описанные в настоящем изобретении, получали таким же способом.
| Таблица 1 | |
| Угол дифракции (2θ°) | Относительная интенсивность (%) |
| 10,02 | 29,8 |
| 10,21 | 35,0 |
| 11,48 | 14,4 |
| 15,40 | 100 |
| 16,65 | 37,3 |
| 20,07 | 8,53 |
| 21,48 | 31,7 |
| 21,58 | 33,9 |
| 22,06 | 18,38 |
| 23,27 | 5,74 |
| 24,62 | 75,62 |
| 26,78 | 24,29 |
| 29,20 | 24,36 |
| 29,84 | 6,61 |
Данная кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (полиморф А свободного основания) характеризуется также дифференциальной сканирующей калориметрией (ДСК), указанной на фигуре 2, которая показывает эндотермический эффект, соответствующий плавлению с началом при приблизительно 180°С.
Все спектры ДСК, указанные в контексте, получали при скорости сканирования 10°/мин.
Данная кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (полиморф А свободного основания) охарактеризована также ПФ-ИК-спектром (ATR), (ПФ-ИК-ATR: инфракрасной спектроскопией с преобразованием Фурье по способу затухающего полного отражения), показанным на фигуре 3, на которой имеются характеристические частоты поглощения при 3086, 1587, 1155, 1169, 1185, 851 и 836 см-1.
Кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4) (полиморф А свободного основания) является термодинамически более стабильной формой этого продукта; это очевидно при сравнении спектра ДСК формы А, фигура 2, со спектрами ДСК соответствующих полиморфов D и Е на фигурах 5 и 8 соответственно. Следует отметить, что форма А характеризуется более высокой точкой плавления (приблизительно 180°С), тогда как другие две формы плавятся при более низких температурах (приблизительно при 160°С и приблизительно при 162°С соответственно); кроме того, из спектров ДСК можно отметить, что теплота плавления других форм является более низкой, чем теплота плавления формы А, и что обе формы, D и Е, перекристаллизовываются в форму А. Более высокая стабильность формы А относительно форм D и Е также является очевидной на основании экспериментов, указанных в примерах 21 и 26. Кроме того, эксперимент в примере 3 явно показывает, что смесь форм можно превратить в более стабильную форму А.
При разработке перорального лекарственного продукта выбор подходящей кристаллической формы обычно является основным для оптимизации как свойств эффективности, так и способности к обработке активного ингредиента.
Форма А, хотя и не характеризуется оптимальной растворимостью при нейтральном значении рН, обнаруживает приемлемую растворимость при желудочном значении рН (пример 7) и приемлемую биологическую доступность (пример 8). Поскольку полиморф А является термодинамически более стабильным полиморфом, он имеет более высокую стабильность, как химическую, так и в отношении превращения в другие формы. Кроме того, этот полиморф является особенно стабильным в отношении механических воздействий (пример 6), не подвергаясь превращению в другие формы или образованию аморфного вещества, которое часто ухудшает свойства сыпучести и гигроскопичности продукта, что является нежелательным во время процесса получения состава. Таким образом, форма А является особенно желательной для получения фармацевтических составов 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, таких как таблетки и капсулы с немедленным высвобождением.
При разработке перорального лекарственного продукта безусловно существенным является тот факт, что активный ингредиент вводят в определенной и совместимой кристаллической форме (ICH, Q6A: Test Procedures and Acceptance Criteria for New Drug substances and New Drug products, May 2000), так чтобы обеспечить совместимость биологической доступности, физико-химических и механических свойств, таких как сыпучесть и плотность, а также стабильность активного ингредиента, чтобы в результате обеспечить эти свойства лекарственного продукта.
6-(1Н-имидазол-1-ил)-2-фенилхиназолин проявил неожиданную склонность к кристаллизации в виде смесей полиморфных и гидратных форм, когда процесс кристаллизации не проводят согласно подходящим и определенным процедурам, таким образом образуя активный ингредиент, характеризующийся свойствами, которые отличались в качестве функции композиции полиморфов и гидратов. Это контрастировало с активным ингредиентом, обсуждаемым в контексте выше, и могло привести к значительным проблемам в способности к обработке и совместимости при получении лекарственного продукта.
Кристаллизация 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, описываемая в примерах 1, 2 и 3, делает возможным получение формы А с высокой чистотой и совместимостью. Кроме того, вследствие его термической стабильности способ сушки этого продукта требует меры незначительной предосторожности и поэтому является более легким и менее дорогим, чем способы сушки других описанных форм.
- Кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4) (полиморф D свободного основания) характеризуется спектром XRPD, показанным на фигуре 4 и содержащим основные пики, показанные в таблице 2.
| Таблица 2 | |
| Угол дифракции (2θ°) | Относительная интенсивность (%) |
| 4,18 | 5,0 |
| 5,41 | 37,14 |
| 8,25 | 6,13 |
| 10,83 | 60,0 |
| 14,15 | 7,12 |
| 16,01 | 12,20 |
| 16,44 | 84,42 |
| 16,54 | 100 |
| 16,98 | 30,11 |
| 20,39 | 80,43 |
| 23,24 | 40,81 |
| 25,01 | 30,0 |
| 26,40 | 78,64 |
| 30,26 | 16,87 |
Данная кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (полиморф D свободного основания) характеризуется также спектром ДСК, показанным на фигуре 5, которая имеет эндотермический эффект, соответствующий плавлению с началом при приблизительно 160°С, экзотермический эффект, соответствующий кристаллизации формы А, эндотермический эффект, соответствующий плавлению формы А с началом при приблизительно 180°С.
Данная кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (полиморф D свободного основания) характеризуется также ПФ-ИК-спектром (ATR), показанным на фигуре 6, которая имеет характеристические поглощения при 3096, 1579, 1586, 1556 и 1247 см-1.
Кристаллическая форма А не проявляет хорошую растворимость при значении рН, которое не является сильно кислотным. В некоторых случаях необходимо, чтобы абсорбция лекарственного продукта имела место в кишечнике, в котором рН является нейтральным или основным. Для достижения этого часто применяют энтеросолюбильные препараты. В некоторых случаях растворимость умеренно растворимого активного ингредиента можно увеличить аморфизацией активного ингредиента и диспергированием аморфного продукта в подходящих эксципиентах, которые не повышают смачиваемость и которые обладают диспергирующим и дезинтегрирующим действием. Особенно подходящими являются способы, в которых эта аморфизация имеет место посредством размалывания активного ингредиента с эксципиентами. Рассмотрение ее характеристик стабильности показывает, что полиморфная форма D, среди других форм 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, является формой, которая сама является лучшей для этого типа применения.
- Кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4) (полиморф Е свободного основания) характеризуется спектром XRPD, показанным на фигуре 7 и содержащим основные пики, показанные в таблице 3.
| Таблица 3 | |
| Угол дифракции (2θ°) | Относительная интенсивность (%) |
| 4,18 | 12,87 |
| 8,28 | 59,59 |
| 10,97 | 13,69 |
| 11,90 | 15,24 |
| 13,11 | 11,49 |
| 14,50 | 91,14 |
| 16,04 | 100 |
| 17,69 | 43,42 |
| 19,42 | 20,59 |
| 20,77 | 38,83 |
| 22,84 | 7,75 |
| 23,87 | 9,03 |
| 24,92 | 5,94 |
Данная кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (полиморф Е свободного основания) характеризуется также спектром ДСК, показанным на фигуре 8, которая имеет эндотермический эффект, соответствующий плавлению с началом приблизительно при 162°С, экзотермический эффект, соответствующий кристаллизации формы А, и эндотермический эффект, соответствующий плавлению формы А с началом при приблизительно 181°С.
Данная кристаллическая форма 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (полиморф D свободного основания) характеризуется также ПФ-ИК-спектром (ATR), показанным на фигуре 9, которая имеет характеристические поглощения при 3122, 1577, 1338, 1174, 1146, 1071 и 1057 см-1.
Кристаллическая форма А не проявляет хорошую растворимость при значении рН, которое не является сильно кислотным. В некоторых случаях необходимо, чтобы абсорбция лекарственного продукта имела место в кишечнике, в котором рН является нейтральным или основным. Кристаллическая форма Е при некислотном значении рН обладает растворимостью, которая в два раза больше, чем у формы А, является более стабильной, чем форма D, и поэтому является лучшим кандидатом для фармацевтических составов 6-(1Н-имидазол-1-ил)-2-фенилхиназолина в энтеросолюбильных капсулах.
Кроме того, форму Е вследствие ее более низкой кристалличности и пластичности можно применять при получении фармацевтических составов с медленным высвобождением и, как описано для формы D, при получении фармацевтических форм, в которых аморфизацию активного ингредиента и диспергирование аморфного продукта достигают размалыванием их с эксципиентами.
Полиморф Е можно постоянно получать с высокими выходами согласно способу, указанному в примере 25.
В другом аспекте настоящее изобретение относится к полиморфам 6-(1Н-имидазол-1-ил)-2-фенилхиназолина в виде не превращенного в соль основания и в сольватированной форме. Более конкретно, этот аспект содержит по существу чистые полиморфные кристаллические формы гидрата 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, которые можно получить воспроизводимым способом и которые обладают характеристиками биологической доступности, стабильности и гигроскопичности и механическими свойствами, так что их можно применять для получения подходящих фармацевтических составов, как обсуждалось в контексте ранее.
- Кристаллическая форма моногидрата 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4·Н2О) (форма В свободного основания) характеризуется спектром XRPD, показанным на фигуре 10 и содержащим основные пики, показанные в таблице 4.
| Таблица 4 | |
| Угол дифракции (2θ°) | Относительная интенсивность (%) |
| 6,01 | 100 |
| 6,10 | 88,93 |
| 11,84 | 24,41 |
| 14,54 | 9,53 |
| 17,31 | 12,74 |
| 19,17 | 22,68 |
| 21,46 | 11,95 |
| 25,84 | 14,22 |
| 26,89 | 7,36 |
| 27,89 | 7,89 |
Данная кристаллическая форма моногидрата 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (форма В свободного основания) характеризуется также спектром ДСК, показанным на фигуре 11, которая имеет эндотермический эффект, соответствующий десольватизации в диапазоне при приблизительно 40-100°С, эндотермический эффект, соответствующий плавлению с началом при приблизительно 156°С, экзотермический эффект, соответствующий кристаллизации формы А, и эндотермический эффект, соответствующий плавлению формы А с началом при приблизительно 178°С.
Данная кристаллическая форма моногидрата 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (форма В свободного основания) характеризуется также ПФ-ИК-спектром (ATR), показанным на фигуре 12, которая имеет характеристические поглощения при 1327, 1310, 1174, 1146, 1103, 901 и 878 см-1.
- Кристаллическая форма моногидрата 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4·Н2О) (форма С свободного основания) характеризуется спектром XRPD, показанным на фигуре 13 и содержащим основные пики, показанные в таблице 5.
| Таблица 5 | |
| Угол дифракции (2θ°) | Относительная интенсивность (%) |
| 7,75 | 100 |
| 11,87 | 19,4 |
| 14,21 | 25,46 |
| 17,14 | 32,23 |
| 19,24 | 12,77 |
| 20,08 | 6,48 |
| 25,23 | 10,71 |
| 25,68 | 26,06 |
| 27,61 | 8,24 |
Данная кристаллическая форма моногидрата 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (форма С свободного основания) характеризуется также спектром ДСК, показанным на фигуре 14, которая имеет эндотермический эффект, соответствующий десольватизации в диапазоне при приблизительно 30-80°С, эндотермический эффект, соответствующий плавлению с началом при приблизительно 163°С, экзотермический эффект, соответствующий кристаллизации формы А, и эндотермический эффект, соответствующий плавлению формы А с началом плавления при приблизительно 179°С.
Данная кристаллическая форма моногидрата 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (форма С свободного основания) характеризуется также ПФ-ИК-спектром (ATR), показанным на фигуре 15, которая имеет характеристические поглощения при 1566, 1520, 1323, 1175, 1146 и 1110 см-1.
Хотя разработка гидратированных форм активных ингредиентов обычно не является предпочтительной по причинам стабильности, в случае 6-(1Н-имидазол-1-ил)-2-фенилхиназолина гидратированные формы, и в частности форма С, проявляют неожиданную стабильность в условиях окружающей среды и их можно получить с оптимальными выходами и примесями согласно способам, указанным в примерах 10-14 соответственно.
Хотя гидратированные формы 6-(1Н-имидазол-1-ил)-2-фенилхиназолина охарактеризованы растворимостями, аналогичными растворимостям полиморфов 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, смачиваемость гидратированных форм выше, чем смачиваемость полиморфов, и эти гидратированные формы поэтому являются применимыми при получении фармацевтических составов, которое не включают применение эксципиентов, пригодных для повышения смачиваемости активного ингредиента. Кроме того, поскольку обработка полиморфов 6-(1Н-имидазол-1-ил)-2-фенилхиназолина водой дает эти гидратированные формы, они являются применимыми во всех фармацевтических способах, включающих применение воды либо в процессе грануляции, либо в других операциях.
Спектры XRPD различных кристаллических форм, указанных для 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, включающих полиморфы и гидраты и относящихся к не превращенному в соль основанию, сравнивали на фигуре 16. Сравнение показывает, что даже в этом случае способ XRPD является по существу достаточным для идентификации этих форм, поскольку они всегда являются наиболее интенсивными пиками, и пики хорошо разделяются в различных формах, что является также гарантией подходящей чистоты, которую можно определить по спектрам XRPD индивидуальных форм.
Другой аспект настоящего изобретения относится к кристаллическим формам солей, в безводной или сольватированной форме, 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, которые можно получить образованием соли с органическими или неорганическими кислотами. Более конкретно, этот аспект включает по существу чистые кристаллические формы солей 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, которые можно получить воспроизводимым способом и которые обладают совместимыми характеристиками биологической доступности, стабильности и гигроскопичности и механическими свойствами, так что их можно применять для получения подходящих фармацевтических составов, как описано в контексте ранее.
- Кристаллическая форма моногидрата дигидрохлорида 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4·2HCl·Н2О) (форма А дигидрохлоридной соли) характеризуется спектром XRPD, показанным на фигуре 17 и содержащим основные пики, показанные в таблице 6.
| Таблица 6 | |
| Угол дифракции (2θ°) | Относительная интенсивность (%) |
| 6,63 | 100 |
| 11,31 | 25,0 |
| 12,55 | 11,0 |
| 14,37 | 55,4 |
| 16,88 | 5,9 |
| 19,29 | 28,13 |
| 19,73 | 18,32 |
| 23,09 | 85,31 |
| 23,82 | 11,59 |
| 25,02 | 56,61 |
| 26,34 | 76,96 |
| 26,81 | 93,83 |
| 27,65 | 15,34 |
| 28,55 | 12,13 |
| 29,88 | 19,0 |
| 30,80 | 13,35 |
| 31,44 | 15,87 |
| 33,0 | 19,98 |
| 34,12 | 7,54 |
| 37,8 | 7,78 |
Данная кристаллическая форма моногидрата дигидрохлорида 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (форма А гидрохлоридной соли) характеризуется также спектром ДСК, показанным на фигуре 18, которая имеет эндотермический эффект с началом при приблизительно 144°С и второй эндотермический эффект с началом при приблизительно 226°С.
Данная кристаллическая форма моногидрата дигидрохлорида 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (форма А гидрохлоридной соли) характеризуется также ПФ-ИК-спектром (ATR), показанным на фигуре 19.
Растворимость является основным фактором при определении поглощения лекарственного продукта, обладающего хорошей проницаемостью, такого как 6-(1Н-имидазол-1-ил)-2-фенилхиназолин. Вопреки тому факт, что основание проявляло приемлемую биологическую доступность, слабая растворимость обеспечивает хороший резерв для повышения биологической доступности. Обычно для этой цели применяют получение солей, но часто соли слабых оснований, таких как 6-(1Н-имидазол-1-ил)-2-фенилхиназолина, являются нестабильными, гигроскопическими и имеют слабые механические свойства. В отличие от моногидрохлорида, который, как обнаружено, является гигроскопическим, что приводит к появлению проблем при его выделении, доказано, что моногидрат дигидрохлорида 6-(1Н-имидазол-1-ил)-2-фенилхиназолина является негигроскопическим (пример 32), термически стабильным при подходящих условиях хранения и сушки (пример 30), стабильным в отношении механических воздействий (пример 31) и хорошо растворимым и биологически доступным (примеры 33 и 34).
Эта соль поэтому является подходящей для получения фармацевтических составов в форме таблеток и капсул с немедленным высвобождением. Кроме того, эта соль является подходящей для фармацевтических составов активного ингредиента, таких как сиропы и парентеральные составы, для которых необходимо обеспечить хорошую растворимость активного ингредиента.
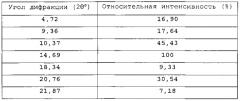
- Кристаллическая форма гидрохлорида 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4·HCl) (форма В гидрохлоридной соли) характеризуется спектром XRPD, показанным на фигуре 20 и содержащим основные пики, показанные в таблице 7.
| Таблица 7 | |
| Угол дифракции (2θ°) | Относительная интенсивность (%) |
| 4,72 | 16,90 |
| 9,36 | 17,64 |
| 10,37 | 45,43 |
| 14,69 | 100 |
| 18,34 | 9,33 |
| 20,76 | 30,54 |
| 21,87 | 7,18 |
Данная кристаллическая форма моногидрохлорида 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (форма В гидрохлоридной соли) характеризуется также плавлением с разложением при приблизительно 240°С.
- Кристаллическая форма сукцината 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4·0,5 С4Н6О4) (форма А сукцинатной соли), характеризующаяся моноклинной системой с параметрами ячейки кристалла a=8,0152 (6) Å, b=5,9038 (4) Å, c=33,127 (3) Å, α: 90°, β=93,280° (8), γ=90°, V=1565,0 (2) Å3, пространственной группой P21/c, спектром XRPD, указанным на фигуре 21 и содержащим основные пики, показанные в таблице 8. Трехмерная структура этой кристаллической формы, полученная посредством SC-XR, показана на фигуре 21а, и сравнение порошковой дифрактограммы, вычисленной на основе полученной структуры, и экспериментального спектра XRPD приводится на фигуре 21b.
| Таблица 8 | |
| Угол дифракции (2θ°) | Относительная интенсивность (%) |
| 5,47 | 17,06 |
| 10,83 | 20,3 |
| 11,07 | 6,73 |
| 15,89 | 100 |
| 20,12 | 6,75 |
| 22,03 | 20,57 |
| 24,39 | 26,52 |
| 26,20 | 22,82 |
| 27,25 | 11,97 |
| 27,79 | 9,62 |
| 28,22 | 9,24 |
| 32,39 | 5,0 |
Данная кристаллическая форма сукцината 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (форма А сукцинатной соли) характеризуется также спектром ДСК, приведенным на фигуре 22, который имеет эндотермический эффект с началом при приблизительно 150°С и второй эндотермический эффект, соответствующий плавлению, с началом при приблизительно 183°С.
Данная кристаллическая форма сукцината 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (форма А сукцинатной соли) характеризуется также спектром ПФ-ИК (ATR), приведенным на фигуре 23.
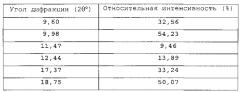
- Кристаллическая форма сукцината 6-(1Н-имидазол-1-ил)-2-фенилхиназолина (C17H12N4·С4Н6О4) (форма В сукцинатной соли) характеризуется спектром XRPD, указанным на фигуре 24 и содержащим основные пики, показанные в таблице 9.
| Таблица 9 | |
| Угол дифракции (2θ°) | Относительная интенсивность (%) |
| 5,05 | 51,45 |
| 5,23 | 75,59 |
| 10,10 | 34,36 |
| 10,26 | 45,36 |
| 11,26 | 7,86 |
| 17,10 | 100 |
| 17,61 | 8,31 |
| 22,03 | 22,41 |
| 24,27 | 16,46 |
| 24,94 | 6,81 |
| 25,66 | 20,75 |
| 27,20 | 7,83 |
| 28,36 | 8,22 |