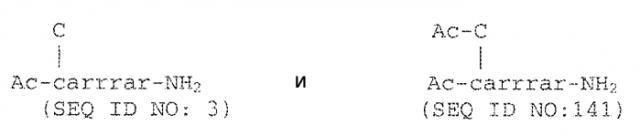Терапевтические агенты для снижения уровней паратиреоидного гормона
Иллюстрации
Показать всеИзобретение относится к соединениям, обладающим активностью, снижающей уровни паратиреоидного гормона. Соединение содержит пептид и конъюгирующую группу, где пептид имеет аминокислотную последовательность формулы: Х1-Х2-Х3-Х4-Х5-X6 _Х7, в которой X1 представляет собой D-цистеин; Х2 представляет собой аминокислоту, выбранную из группы, состоящей из D-аргинина и некатионной аминокислоты; Х3 представляет собой D-аргинин; Х4 представляет собой аминокислоту, выбранную из группы, состоящей из D-аргинина и некатионной аминокислоты; Х5 представляет собой D-аргинин; Х6 представляет собой некатионную аминокислоту; Х7 представляет собой D-аргинин; и где пептид связан с конъюгирующей группой посредством дисульфидной связи. Соединения можно применять для лечения субъектов, страдающих, например, от первичного, вторичного или третичного гиперпаратиреоза, гиперкальциемии злокачественной опухоли, метастатической болезни кости или остеопороза. 12 н. и 48 з.п. ф-лы, 14 ил., 11 табл., 11 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет по предварительной заявке на патент США № 61/229695, поданной 29 июля 2009 г., и предварительной заявке на патент США № 61/255816, поданной 28 октября 2009 г., и предварительной заявке на патент США № 61/313635, поданной 12 марта 2010 г. Каждая из данных заявок включается в настоящее изобретение путем ссылки во всей своей полноте.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ТАБЛИЦУ ИЛИ КОМПЬЮТЕРНУЮ ПРОГРАММУ
Список последовательностей подается в электронном виде через EFS в виде текстового файла, созданного 29 июля 2010 г. и названного "632008017WO00seqlist.txt" (85400 байт), содержание которого включается в настоящее изобретение путем ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящий объект изобретения относится к соединениям с уменьшающей уровни паратиреоидного гормона (PTH) активностью, к фармацевтическим композициям, содержащим данные соединения, и применению данных соединений и композиций в способах лечения, включая, но не ограничиваясь, лечение гиперкальциемии или гиперпаратиреоза или регулирования in vivo PTH уровней.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Гомеостаз кальция является механизмом, с помощью которого тело поддерживает приемлемые уровни кальция. Данный процесс является в высокой степени регулируемым и включает сложную взаимозависимость между поглощением, транспортом, хранением в костях, отложением в других тканях и выведением кальция. PTH представляет собой регулятор циркулирующей в крови концентрации кальция и функционирует, увеличивая концентрацию кальция в крови усилением высвобождения кальция из кости с помощью процесса резорбции кости; увеличивая реабсорбцию кальция из почечных канальцев; и усиливая поглощение кальция в кишечнике увеличением синтеза 1,25-(OH)2 витамин D, активной формы витамина D. PTH также стимулирует выведение фосфора из почек и увеличивает высвобождение из кости.
PTH секреция регулируется кальцийчувствительным рецептором (CaSR), сопряженным с G-белком рецептором, экспрессируемым несколькими типами клеток на поверхности паратиреоидных клеток, который обнаруживает небольшие отклонения концентрации внеклеточных ионов кальция (Ca2+) и реагирует изменением секреции PTH. Активация CaSR Ca2+ ингибирует PTH-секрецию в течение секунд или минут за счет ингибирования везикулярного транспорта, и данный процесс может регулироваться фосфорилированием рецептора протеинкиназой C (PKC). CaSR также экспрессируется на остеобластах и в почках, где он регулирует почечное Ca2+ выведение.
Кроме того, PTH регулирует гомеостаз фосфора, PTH стимулирует рецептор 1 паратиреоидного гормона (PTHR1) и на апикальной (мембрана щеточной каймы) и на базолатеральной мембранах клеток на GI участке. PTHR1 стимулирование приводит к увеличению мочевыделения фосфата (Pi) как следствие снижения интернализации почечного Na+/фосфат (NaPi-IIa) контранспортера на мембране щеточной каймы.
PTH также вовлечен в регуляцию остеобластов и остеокластов в кости. PTH увеличивает циркулирующий Ca2+ увеличением резорбции кости и почечной реабсорбции кальция. PTH стимулирует остеобласты к синтезу RANK лиганда (RANKL), который связывается с RANK рецептором и активирует остеокласты, приводя к увеличению резорбции кости и увеличению Ca2+ в сыворотке. Остеопротегерин (OPG) представляет собой рецептор-ловушку для RANKL, который блокирует резорбцию кости. Остеопороз вызывается нарушением баланса между процессами резорбции кости остеокластами и образования кости остеобластами.
Человеческое тело содержит приблизительно 1 кг кальция, 99% которого находится в костях. В нормальных условиях уровень циркулирующих ионов кальция (Ca2+) строго поддерживается равным приблизительно 9-10 мг/дл (т.е. 2,25-2,5 ммоль/л; ~600 мг). Приблизительно 1 г элементарного кальция (Ca2+) усваивается каждый день. Из данного количества поглощается приблизительно 200 мг/день и 800 мг/день выводится. Кроме того, приблизительно 500 мг/день высвобождается резорбцией кости или откладывается в кости. Приблизительно 10 г Ca2+ фильтруется через почки каждый день, причем приблизительно 200 мг находится в моче, а оставшаяся часть реабсорбируется.
Гиперкальциемия представляет собой повышенный уровень кальция в крови. Острая гиперкальциемия может приводить в результате к желудочно-кишечным (анорексия, тошнота, рвота); почечным (полиурия, полидипсия), нейромышечным (ослабление, помрачнение сознания, оглушение, кома) и сердечным (брадикардия, атриовентрикулярный первой степени) симптомам. Хроническая гиперкальциемия также связана с желудочно-кишечными (диспепсия, констипация, панкреатит); почечными (нефролитиаз, нефрокальциноз), нейромышечными (слабость) и сердечными (блокада сердца в результате гипертензии, дигиталисная чувствительность) симптомами. Нерегулярные сердечные сокращения могут быть результатом этого, EKG данные короткого QT интервала и уширенная T волна предполагают гиперкальциемию. Гиперкальциемия может быть бессимптомной, причем симптомы более обычно проявляются при высоких уровнях кальция (12,0 мг/дл или 3 ммоль/л). Тяжелая гиперкальциемия (выше 15-16 мг/дл или 3,75-4 ммоль/л) считается состоянием, представляющим опасность для жизни и требующим срочной медицинской помощи: при данных уровнях результатом может быть кома и остановка сердца.
Гиперкальциемия часто вызывается гиперпаратиреозом, приводя к избыточной резорбции кости и повышенным уровням кальция в сыворотке крови. При первичном спорадическом гиперпаратиреозе, PTH синтезируется в повышенном количестве единичной паратиреоидной аденомой; менее часто причиной может быть несколько аденом или диффузная гиперплазия паращитовидной железы. Повышенная PTH секреция приводит к суммарному увеличению резорбции кости, с высвобождением Ca2+ и фосфата (Pi). PTH также усиливает почечную реабсорбцию Ca2+ и ингибирует реабсорбцию фосфата (Pi), приводя в результате к суммарному увеличению содержания кальция в сыворотке крови и снижению фосфата.
Вторичный гиперпаратиреоз возникает, когда снижение циркулирующей концентрации Ca2+ стимулирует PTH секрецию. Одной причиной вторичного гиперпаратиреоза является хроническая почечная недостаточность (также называемая хроническая болезнь почек или CKD), такая как хроническая почечная недостаточность при поликистозной болезни почек или хроническом пиелонефрите, или хроническая почечная недостаточность, такая как хроническая почечная недостаточность у пациентов, находящихся на гемодиализе (также называемая болезнь почек последней стадии или ESRD). Избыток PTH может синтезироваться в ответ на гипокальциемию, являющуюся результатом слабого всасывания кальция, GI заболеваний, почечной недостаточности, дефицита витамина D и почечной гиперкальциемии. Третичный гиперпаратиреоз может возникать после долгого периода вторичного гиперпаратиреоза и гиперкальциемии.
Злокачественное образование является типичной причиной гиперкальциемии, не опосредуемой PTH. Гиперкальциемия злокачественного образования является нетипичным, но тяжелым осложнением рака, оказывает действие на 10%-20% пациентов с раком и может возникать и с солидными опухолями и лейкемией. Заболевание имеет бурное начало и очень плохой прогноз, с медианой выживаемости, составляющей только шесть недель. Факторы роста (GF) регулируют синтез белка, связанного с паратиреоидным гормоном (PTHrP) в опухолевых клетках. Опухолевые клетки можно стимулировать аутокринным GF для усиления синтеза PTHrP, приводя в результате к усилению резорбции кости. Опухолевые клетки, метастатические к кости, могут также секретировать PTHrP, который может ресорбироваться костью и высвобождать дополнительное количество GF, который, в свою очередь, действует паракринным образом, дополнительно усиливая синтез PTHrP.
Соответственно, требуются соединения с активностью, например, регулирующей PTH уровни и/или уровни кальция in vivo.
КРАТКОЕ ОПИСАНИЕ
В одном аспекте настоящее изобретение относится к соединению, имеющему формулу
X1-X2-X3-X4-X5-X6-X7,
в котором X1 представляет собой субъединицу, содержащую тиолсодержащую группу; X5 представляет собой катионную субъединицу; X6 представляет собой некатионную субъединицу; X7 представляет собой катионную субъединицу; и, по меньшей мере, одна, предпочтительно две, из X2, X3 и X4 представляет (представляют) собой независимо катионную субъединицу; и в котором соединение обладает увеличивающей концентрацию паратиреоидного гормона активностью. В одном варианте осуществления снижение концентрации паратиреоидного гормона представляет собой снижение концентрации паратиреоидного гормона в крови или в плазме у субъекта, обработанного соединением, относительно концентрации паратиреоидного гормона в крови или плазме у субъекта перед обработкой. В другом варианте осуществления снижение концентрации паратиреоидного гормона достигается в отсутствие гистаминовой реакции.
В другом варианте осуществления X3 и X4 являются некатионными, тогда как X1, X5, X6 и X7 являются катионными.
В одном варианте осуществления X1 субъединица представляет собой тиолсодержащий аминокислотный остаток. В другом варианте осуществления тиольная группа X1 субъединицы представляет собой органический тиолсодержащий фрагмент.
В другом варианте осуществления, когда X1 субъединица представляет собой тиолсодержащий аминокислотный остаток, она выбрана из группы, состоящей из L-цистеина, D-цистеина, глутатиона, N-ацетилированного цистеина, гомоцистеина и пегилированного цистеина.
В еще одном варианте осуществления органический тиолсодержащий фрагмент выбран из тиолалкильного или тиоацильного фрагмента, такого как 3-меркаптопропил или 3-меркаптопропионил, меркаптопропионовая кислота, меркаптоуксусная кислота, тиобензил или тиопропил. В еще другом варианте осуществления органический тиолсодержащий фрагмент представляет собой меркаптопропионовую кислоту.
В еще другом варианте осуществления X1 субъединица модифицирована химически так, что она содержит ацетильную группу, бензоильную группу, бутильную группу или другую аминокислоту, такую как ацетилированный бета-аланин.
В еще другом варианте осуществления, когда X1 субъединица содержит тиольный фрагмент, X1 субъединица соединена ковалентной связью со вторым тиольным фрагментом.
В другом варианте осуществления формула X1-X2-X3-X4-X5-X6-X7 состоит из непрерывной последовательности аминокислотных остатков (обозначенных в настоящем изобретении как (Xaa1)-(Xaa2)-(Xaa3)-(Xaa4)-(Xaa5)-(Xaa6)-(Xaa7) SEQ ID NO:1) или последовательности субъединиц органических соединений (неаминокислотные остатки).
В другом варианте осуществления непрерывная последовательность аминокислотных остатков представляет собой непрерывную последовательность L-аминокислотных остатков, непрерывную последовательность D-аминокислотных остатков, непрерывную последовательность смеси L-аминокислотных остатков и D-аминокислотных остатков, или смеси аминокислотных остатков и неприродных аминокислотных остатков.
В другом варианте осуществления непрерывная последовательность аминокислотных остатков соединена с соединением для облегчения транспорта через клеточную мембрану. В другом варианте осуществления непрерывная последовательность аминокислотных остатков соединена с соединением, которое улучшает доставку последовательности внутрь или через один или более слоев ткани.
В другом варианте осуществления непрерывная последовательность аминокислотных остатков содержится в последовательности аминокислотных остатков из 8-50 аминокислотных остатков, 8-40 аминокислотных остатков, 8-30 аминокислотных остатков или 8-20 аминокислотных остатков в длину. В еще другом варианте осуществления непрерывная последовательность аминокислотных остатков содержится в последовательности аминокислотных остатков из 8-19 аминокислотных остатков, 8-18 аминокислотных остатков, 8-17 аминокислотных остатков, 8-16 аминокислотных остатков, 8-15 аминокислотных остатков, 8-14 аминокислотных остатков, 8-13 аминокислотных остатков, 8-12 аминокислотных остатков, 8-11 аминокислотных остатков, 8-10 аминокислотных остатков или 8-9 аминокислотных остатков в длину.
В другом варианте осуществления X3 субъединица представляет собой катионный аминокислотный остаток.
В другом варианте осуществления X2 субъединица представляет собой некатионный аминокислотный остаток, и в другом варианте осуществления X4 субъединица представляет собой некатионный аминокислотный остаток. В одном варианте осуществления некатионный аминокислотный остаток представляет собой D-аминокислоту.
В другом варианте осуществления X3 и X4 представляют собой катионные D-аминокислотные остатки.
В другом варианте осуществления X5 субъединица представляет собой D-аминокислотный остаток.
В другом аспекте непрерывная последовательность в любом из описанных соединений ковалентно соединена через тиолсодержащую группу в X1 субъединице со второй непрерывной последовательностью. Например, вторая непрерывная последовательность может быть идентичной непрерывной последовательности (для образования димера) или может быть неидентичной, как может быть в случае при присоединении к фрагменту, который облегчает транспорт непрерывной последовательности через клеточную мембрану.
В другом аспекте настоящее изобретение относится к конъюгату, состоящему из пептида carrrar (SEQ ID NO:2), где пептид конъюгируют по его N-концевому остатку с Cys остатком.
В одном варианте осуществления пептид химически модифицируют по N-концу, C-концу или обоим.
В другом варианте осуществления N-конец пептида химически модифицируют ацетилированием и C-конец химически модифицируют амидированием.
В другом варианте осуществления конъюгат представляет собой Ac-c(C)arrrar-NH2 (SEQ ID NO:3).
В другом аспекте предусматривается способ лечения вторичного гиперпаратиреоза (SHPT) у субъекта, в котором соединение, как описано в настоящем изобретении, вводится субъекту. В различных вариантах осуществления субъект может страдать от хронической болезни почек или другого заболевания.
В другом аспекте предусматривается способ снижения концентрации паратиреоидного гормона у субъекта, в котором соединение, как описано в настоящем изобретении, вводится субъекту.
В другом аспекте настоящее изобретение относится к режиму лечения, причем режим включает введение любого соединения из соединений, описанных в настоящем изобретении, в комбинации со вторым агентом.
В одном варианте осуществления второй терапевтический агент представляет собой витамин D, аналог витамина D или гидрохлорид цинакальцета.
В любом из аспектов или вариантов осуществления, описанных в настоящем изобретении, предусматривается, что любая одна или более последовательностей отдельно исключаются или удаляются из объема формулы изобретения. В определенных вариантах осуществления пептиды, указанные любой одной или более из SEQ ID NO:162-182, отдельно или в любой комбинации, исключаются из заявленных соединений, композиций и способов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой график уровня паратиреоидного гормона в виде процентов от исходного значения до введения дозы, как функцию времени, в часах, у крыс с острой почечной недостаточностью (1K1C модель), где крысам вводили дозу Ac-crrrr-NH2 (SEQ ID NO:4, ромбы), Ac-crrrrr-NH2 (SEQ ID NO:5, закрашенные квадраты), Ac-crrrrrr-NH2 (SEQ ID NO:6, треугольники), Ac-crrrrrrr-NH2 (SEQ ID NO:7, пустые квадраты), или солевой раствор в качестве контроля (x символы).
Фигура 2A представляет собой график IP1-концентрации, в нМ, как функции концентрации Ac-carrrar-NH2 (SEQ ID NO:26, квадраты) и Ac-arrrar-NH2 (SEQ ID NO:29, треугольники), в виде величины способности соединения активировать человеческий CaSR в in vitro клеточном анализе, когда человеческий CaSR экспрессируется в стабильно трансфицированной HEK-293 клеточной линии.
Фигура 2B показывает снижение PTH концентрации при in vivo введении пептидов, указанных как SEQ ID NO:26 (Ac-carrrar-NH2) (квадраты) и как SEQ ID NO:29 (Ac-arrrar-NH2) (ромбы), где пептиды вводились в виде IV болюса нормальным крысам Спрага-Доули в дозах 9 мг/кг для SEQ ID NO:29 и при 0,5 мг/кг для SEQ ID NO:26. Внутривенный (IV) болюс солевого раствора применяли в качестве контроля (пунктирная линия). Уровни PTH в плазме оценивали перед введением дозы и через 1, 2, 3 и 4 часа после введения дозы. Результаты представлены как среднее для группы ± стандартное отклонение (SD), и PTH показано в виде процентов от исходного значения до введения дозы.
Фигура 3 представляет собой гистограмму, на которой сравнивается высвобождение гистамина после IV болюсного введения различных соединений нормальным крысам Спрага-Доули, где соединения Ac-crrrr-NH2 (SEQ ID NO:4), Ac-crrrrr-NH2 (SEQ ID NO:5), Ac-crrrrrr-NH2 (SEQ ID NO:6) и Ac-crrrrrrrr-NH2 (SEQ ID NO:41) вводили в эквимолярной IV болюсной дозе 2,1 мкмоль/кг, и гистамин в плазме измеряли перед введением дозы (pre), через 5, 15 и 30 минут после введения дозы.
Фигура 4 представляет собой гистограмму, на которой сравнивается высвобождение гистамина после IV болюсного введения двух соединений нормальным крысам Спрага-Доули, где соединения Ac-c(C)arrrar-NH2 (SEQ ID NO:3, заштрихованные накрест столбцы) и Ac-crrrrrr-NH2 (SEQ ID NO:6, пустые столбцы) вводили с дозой 3 мг/кг, и гистамин в плазме измеряли до введения дозы (нулевой момент времени) и через 5, 15 и 30 минут после введения дозы.
Фигура 5 представляет собой график уровня паратиреоидного гормона в виде процентов от исходного значения до введения дозы, как функции времени, в часах, у нормальных крыс, которым вводили 0,5 мг/кг IV болюсом Ac-crrrrrr-NH2 (SEQ ID NO:6, ромбы), Ac-carrrrr-NH2 (SEQ ID NO:8, квадраты), Ac-crarrrr-NH2 (SEQ ID NO:9, треугольники), Ac-crrarrr-NH2 (SEQ ID NO:10, x символы), Ac-crrrarr-NH2 (SEQ ID NO:11, * символы), Ac-crrrrar-NH2 (SEQ ID NO:12, окружности) или Ac-crrrrra-NH2 (SEQ ID NO:13, + символы).
Фигуры 6A-6B представляют собой графики уровней паратиреоидного гормона в виде процентов от исходного значения до введения дозы, как функцию времени, в часах, у здоровых мышей, которым вводили 0,5 мг/кг IV болюсом Ac-carrrar-NH2 (SEQ ID NO:26, пустые ромбы), Ac-crrarar-NH2 (SEQ ID NO:25, пустые квадраты), Ac-caarrrr-NH2 (SEQ ID NO:22, треугольники), Ac-crraarr-NH2 (SEQ SD NO:17, закрашенные квадраты), Ac-c(C)arrrar-NH2 (SEQ ID NO:3, ромбы, фигура 6B), Ac-craarrr-NH2 (SEQ ID NO:24, x символы на фигуре 6A); Ac-c(C)rrarar-NH2 (SEQ ID NO:28, x символы, фигура 6B).
Фигура 7 показывает снижение уровней паратиреоидного гормона в крови как функции времени, для соединения Ac-c(C)arrrar-NH2 (SEQ ID NO:3), введенного в виде IV болюса нормальным крысам Спрага-Доули с дозами 1 мг/кг (ромбы), 0,5 мг/кг (квадраты), 0,3 мг/кг (треугольники) и 0,1 мг/кг (x символы). Внутривенный (IV) болюс солевого раствора (окружности) применяли в качестве контроля. Уровни PTH в плазме оценивали перед введением дозы и через 1, 2, 3 и 4 часа после введения дозы.
Фигура 8 представляет собой график уровня паратиреоидного гормона в виде процентов от исходного значения до введения дозы, как функции времени, в часах, у крыс с острой почечной недостаточностью (1K1C модель), где крысам вводили дозы с помощью IV болюса соединения Ac-c(C)arrrar-NH2 (SEQ ID NO:3) с дозой 3 мг/кг (ромбы), 1 мг/кг (треугольники), 0,5 мг/кг (квадраты) и 0,3 мг/кг (x символы) или солевой раствор (квадраты); пунктирная линия на фигуре 8 показывает исходный уровень PTH перед введением дозы.
Фигура 9 представляет собой график концентрации паратиреоидного гормона в виде процентов от исходного значения до введения дозы, как функцию времени, в часах, у крыс, которым введен внутривенно солевой раствор (x символы) или соединения Ac-crrrrrr-NH2 (SEQ ID NO:6, пустые ромбы) и Ac-carrrar-NH2 (SEQ ID NO:26, пустые квадраты) при 1 мг/кг с помощью 30-минутного IV вливания, где уровни PTH в плазме оценивали перед введением дозы, через 16 часов и 24 часа после введения дозы.
Фигура 10 представляет собой график уровня паратиреоидного гормона в виде процентов от исходного значения до введения дозы, как функцию времени, в часах, у крыс с острой почечной недостаточностью (1K1C модель), где крысам вводили с помощью IV болюса соединения Ac-c(C)arrrar-NH2 (SEQ ID NO:3, квадраты, * символы) и Ac-c(Ac-C)arrrar-NH2 (SEQ ID NO:146, треугольники, ромбы) с дозами 0,3 мг/кг (квадраты, треугольники) и 0,5 мг/кг (*, ромбы).
Фигура 11 представляет собой график уровня паратиреоидного гормона в виде процентов от исходного значения до введения дозы, как функцию времени, в часах, у крыс, обработанных с помощью облегченной микропорацией трандермальной доставки Ac-crrrrrr-NH2 (SEQ ID NO:6, двое животных, квадраты и треугольники) или солевым раствором с помощью трансдермальной доставки (ромбы).
Фигура 12 представляет собой график уровня паратиреоидного гормона в виде процентов от исходного значения до введения дозы, как функцию времени, в часах, у крыс, обработанных с помощью облегченной микропорацией трандермальной доставки Ac-c(C)arrrar-NH2 (SEQ ID NO:3).
Фигура 13 представляет собой график среднего PTH (в виде процента от исходного значения) в течение и после 6-часового IV вливания Ac-c(C)arrrar-NH2 (SEQ ID NO:3) нормальным крысам Спрага-Доули, где соединение вливали при скорости 1 мкг/кг/час (квадраты), 3 мкг/кг/час (окружности) и 10 мкг/кг/час (треугольники).
Фигура 14A показывает PTH (в виде процента от исходного значения) в течение и после 6-часового IV вливания Ac-c(C)arrrar-NH2 (SEQ ID NO:3) в 1K1C крысиной модели острой почечной недостаточности, где крысам внутривенно вливали при скоростях дозирования 30 мкг/кг/час (ромбы) и 100 мкг/кг/час (квадраты).
Фигура 14B представляет собой гистограмму, показывающую концентрацию кальция в сыворотке крови, в мг/дл, для 1K1C модельных крыс, обработанных, как на фигуре 14A.
Объект настоящего изобретения можно понять более легко со ссылкой на следующее подробное описание предпочтительных вариантов осуществления и примеры, включенные в настоящее описание.
ПОДРОБНОЕ ОПИСАНИЕ
I. Определения
В настоящей заявке, если не указано особо, определения терминов и иллюстрацию способов настоящей заявки можно найти в любом из нескольких хорошо известных источников, таких как: Sambrook, J., et al., Molecular Cloning; A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989); Goeddel, D., ed., Gene Expression Technology, Methods in Enzymology, 185, Academic Press, San Diego, CA (1991); "Guide to Protein Purification" in Deutshcer, M. P., ed., Methods in Enzymology, Academic Press, San Diego, CA (1989); Innis, et al., PCR Protocols: A Guide to Methods and Applications, Academic Press, San Diego, CA (1990); Freshney, R.I., Culture of Animal Cells: A Manual of Basic Technique, 2nd Ed., Alan Liss, Inc. New York, NY (1987); Murray, EJ., ed., Gene Transfer and Expression Protocols, pp. 109-128, The Humana Press Inc., Clifton, N. J. and Lewin, B., Genes VI, Oxford University Press, New York (1997).
Как применяют в настоящем изобретении, формы единственного числа включают множественные формы, если не указано иначе. Например, пептид, являющийся модулятором, включает один или более пептидов, являющихся модуляторами.
Как применяют в настоящем изобретении, соединение обладает "снижающей уровень паратиреоидного гормона активностью" или "PTH-снижающей активностью", когда соединение, при введении субъекту, снижает уровень паратиреоидного гормона (PTH) в плазме по сравнению с PTH-концентрацией в плазме до введения соединения. В одном варианте осуществления снижение уровня PTH составляет величину по меньшей мере на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% меньшую, через один час после введения соединения, уровня PTH до введения соединения.
Как применяют в настоящем изобретении, "отсутствие гистаминовой реакции" или "недостаточная гистаминовая реакция" предполагает дозу соединения, которая производит меньше чем 15-кратное, 14-кратное, 13-кратное, 12-кратное, 11-кратное, 10-кратное, 9-кратное. 8-кратное, 7-кратное, 6-кратное, 5-кратное, 4-кратное или 3-кратное увеличение концентрации гистамина, измеренное в in vitro анализе, как описано в настоящем изобретении, где кратное изменение определяют на основе уровней гистамина до инкубирования с соединением и после 15 минут инкубирования с соединением.
Как применяют в настоящем изобретении, "аминокислота" относится к природным и неприродным аминокислотам. Двадцать встречающихся в природе аминокислот (L-изомеры) обозначаются трехбуквенным кодом с приставкой "L-" (за исключением глицина, который является ахиральным) или однобуквенным кодом в верхнем регистре: аланин ("L-Ala" или "A"), аргинин ("L-Arg" или "R"), аспарагин ("L-Asn" или "N"), аспарагиновая кислота (L-Asp" или "D"), цистеин ("L-Cys" или "C"), глутамин ("L-Gln" или "Q"), глутаминовая кислота ("L-Glu" или "E"), глицин ("Gly" или "G"), гистидин ("L-His" или Η"), изолейцин ("L-Ile" или "I"), лейцин ("L-Leu" или "L"), лизин ("L-Lys" или "K"), метионин ("L-Met" или "M"), фенилаланин ("L-Phe" или "F"), пролин ("L-Pro" или "P"), серин ("L-Ser" или "S"), треонин ("L-Thr или "T"), триптофан ("L-Trp" или "W"), тирозин ("L-Tyr" или "Y") и валин ("L-Val" или "V"). L-норлейцин и L-норвалин могут быть представлены как (NLeu) и (NVal), соответственно. Девятнадцать встречающихся в природе аминокислот, которые являются хиральными, имеют соответствующий D-изомер, который обозначается трехбуквенным кодом с приставкой "D-" или однобуквенным кодом в нижнем регистре: аланин ("D-Ala" или "a"), аргинин ("D-Arg" или "r"), аспарагин ("D-Asn" или "a"), аспарагиновая кислота ("D-Asp" или "d"), цистеин ("D-Cys" или "c"), глутамин ("D-Gln" или "q"), глутаминовая кислота ("D-Glu" или "e"), гистидин ("D-His" или "h"), изолейцин ("D-Ile" или "i"), лейцин ("D-Leu" или "l"), лизин ("D-Lys" или "k"), метионин ("D-Met" или "m"), фенилаланин ("D-Phe" или "f"), пролин ("D-Pro" или "p"), серин ("D-Ser" или "s"), треонин ("D-Thr" или "t"), триптофан ("D-Trp" или "w"), тирозин ("D-Tyr" или "y") и валин ("D-Val" или "v"). D-норлейцин и D-норвалин могут быть представлены в виде (dNLeu) и (dNVal), соответственно. Хотя "аминокислотный остаток" часто применяют со ссылкой на мономерную субъединицу пептида, полипептида или белка и "аминокислоту" часто применяют со ссылкой на свободную молекулу, применение данных терминов в данной области техники перекрывается и заменяется. Термин "аминокислота" и "аминокислотный остаток" применяются взаимозаменяемо, и они могут относиться к свободной молекуле или мономерной субъединице пептида, полипептида или белка, в зависимости от контекста.
Для определения процентной "гомологии" или процентной "идентичности" двух аминокислотных последовательностей последовательности выравнивают для целей оптимального сравнения (например, гэпы можно вводить в последовательность одного полипептида для оптимального сравнения с другим полипептидом). Затем сравнивают аминокислотные остатки в соответствующих положениях аминокислот. Когда положение в одной последовательности занято аналогичным аминокислотным остатком, как и в соответствующем положении в другой последовательности, молекулы являются одинаковыми по данному положению. Как применяют в настоящем изобретении, "гомология" аминокислот или нуклеиновых кислот является эквивалентной "идентичности" аминокислот или нуклеиновых кислот. Соответственно, процентная идентичность последовательности между двумя последовательностями является функцией числа идентичных положений, одинаковых для последовательностей (т.е. процентная идентичность последовательности=число идентичных положений/суммарное число положений×100). Процентная идентичность последовательности между двумя полипептидными последовательностями можно определить, применяя пакет программ Vector NTI (Invitrogen Corporation, 5791 Van Aleen Way, Carlsbad, CA 92008). Штраф за открытие гэпа 10 и штраф за продолжение гэпа 0,1 применяют для определения процентной идентичности двух полипептидов. Все другие параметры настраиваются по умолчанию.
"Катионная аминокислота" подразумевает аминокислотный остаток, который обладает общим положительным зарядом при физиологическом pH (7,4), как в случае, например, аминокислотных остатков, когда боковая цепь или "R группа" содержит аминофункциональную или другую функциональную группу, которая может принимать протон, становясь положительно заряженной при физиологическом pH, такая как гуанидин или имидазольный фрагмент. Катионные аминокислотные остатки включают аргинин, лизин, гистидин, 2,3-диаминопропионовую кислоту (Dap), 2,4-диаминомасляную кислоту (Dab), орнитин и гомоаргинин.
"Катионная субъединица" подразумевает субъединицу, которая имеет общий положительный заряд при физиологическом pH (7,4).
Как применяют в настоящем изобретении, "консервативные аминокислотные замены" представляют собой замены, которые не приводят в результате к значительному изменению активности или третичной структуры выбранного полипептида или белка. Данные замены обычно включают замену выбранного аминокислотного остатка отличным аминокислотным остатком, обладающим аналогичными физико-химическими свойствами. Распределение по группам аминокислот и аминокислотных остатков по физико-химическим свойствам является известным специалистам в данной области техники. Например, среди встречающихся в природе аминокислот, можно определить в данной области техники семейства аминокислотных остатков, имеющих аналогичные боковые цепи, и они включают основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
Как применяют в настоящем изобретении, "химически сшитые" относится к ковалентному присоединению двух или более молекул.
Пептид или пептидный фрагмент "получен из" исходного пептида или полипептида, если он содержит аминокислотную последовательность, которая является идентичной или гомологичной, по меньшей мере, непрерывной последовательности из пяти аминокислотных остатков, более предпочтительно восьми аминокислотных остатков, исходного пептида или полипептида.
Как применяют в настоящем изобретении, термин "гиперпаратиреоз" относится к первичному, вторичному и третичному гиперпаратиреозу, если не указано особо.
Термин "внутрикожный" подразумевает, что в способах лечения, описанных в настоящем изобретении, терапевтически эффективное количество кальциймиметического соединения наносят на кожу для доставки соединения к слоям кожи глубже рогового слоя эпидермиса и, таким образом, достигают требуемого терапевтического эффекта.
Как применяют в настоящем изобретении, "выделенный" или "очищенный" полипептид или его биологически активная часть не содержит никаких клеточных веществ при получении способами рекомбинантной ДНК, или исходные химические вещества или другие химические вещества при химическом синтезе. Формулировка "практически не содержит клеточных веществ" включает препараты полипептидов, в которых полипептид отделяют от некоторых из клеточных компонентов клеток, в которых их получают естественным образом или рекомбинантно. Когда полипептид или его биологически активную часть получают рекомбинантно, он также предпочтительно практически не содержит культуральной среды, т.е. культуральная среда присутствует в количестве менее чем приблизительно 20%, более предпочтительно менее чем приблизительно 10%, и самое предпочтительное менее чем приблизительно 5% объема полипептидного препарата. Формулировка "практически не содержит исходных химических веществ или других химических веществ" включает препараты полипептидов, в которых полипептид отделяют от исходных химических веществ или других химических веществ, которые используются или образуются при синтезе полипептида. В одном варианте осуществления формулировка "практически не содержит исходных химических веществ или других химических веществ" включает препараты полипептида, содержащие менее чем приблизительно 30% (сухой массы) исходных химических веществ или других химических веществ, предпочтительно менее чем приблизительно 20% исходных химических веществ или других химических веществ, более предпочтительно менее чем приблизительно 15% исходных химических веществ или других химических веществ, еще более предпочтительно менее чем приблизительно 10% исходных химических веществ или других химических веществ, и самое предпочтительное менее чем приблизительно 5% исходных химических веществ или других химических веществ. В предпочтительных вариантах осуществления выделенные полипептиды или их биологически активные части не содержат загрязняющих полипептидов из того же организма, из которого получают целевой полипептид.
Как применяют в настоящем изобретении, "макромолекула" относится к молекуле, такой как пептид, полипептид, белок или нуклеиновая кислота, которая обычно имеет молекулярную массу большую чем 900 дальтон.
"Некатионная аминокислота" подразумевает аминокислотный остаток, который не имеет заряда или имеет суммарный отрицательный заряд при физиологическом pH (7,4), как в случае, например, в аминокислотных остатках, когда боковая цепь или "R группа" является нейтральной (нейтральной полярной и нейтральной неполярной) и кислой. Некатионные аминокислоты включают те остатки, содержащие R группу, которая представляет собой углеводородный алкильный или ароматический фрагмент (например, валин, аланин, лейцин, изолейцин, фенилаланин); нейтральную, полярную R группу (аспарагин, цистеин, глутамин, серин, треонин, триптофан, тирозин); или нейтральную, неполярную R группу (глицин, метионин, пролин, валин, изолейцин). Некатионные аминокислоты с кислотной R группой включают аспарагиновую кислоту и глутаминовую кислоту.
"Полимер" относится к линейной цепи двух или более идентичных или неидентичных субъединиц, соединенных ковалентной связью.
Как применяют в настоящем изобретении, "пептид" и "полипептид" относится к любому полимеру, состоящему из цепи аминокислотных остатков, соединенных пептидными связями, независимо от его размера. Хотя "белок" часто применяют со ссылкой на относительно длинные полипептиды, а "пептид" часто применяют со ссылкой на небольшие полипептиды, применение данных терминов в данной области техники перекрывается и заменяется. Таким образом, для простоты, в настоящем изобретении будет применяться термин "пептид", хотя в некоторых случаях в данной области техники он может относиться к тому же полимеру как "полипептид". Если не указано особо, последовательность пептида дается в порядке от аминоконца к карбоксильному концу.
"Тиолсодержащая группа" или "тиолсодержащий фрагмент", как применяют в настоящем изобретении, подразумевает функциональную группу, содержащую связь сера-водород (-SH), и которая способна реагировать с другим тиолом при физиологических условиях, давая дисульфидную связь. Тиол, который способен образовывать дисульфидную связь с другим тиолом, называют "реакционноспособным тиолом". В предпочтительном варианте осуществления тиолсодержащая группа находится на расстоянии менее чем 6 атомов от остова соединения. В более предпочтительном варианте осуществления тиолсодержащая группа имеет структуру (-SH-CH2-CH2-C(O)-O-)-.
Как применяют в настоящем изобретении, "небольшая молекула" относится к молекуле, отличной от макромолекулы, такой как органическая молекула, и обычно имеет молекулярную массу менее чем 1000 дальтон.
Как применяют в настоящем изобретении, "субъект" относится к человеческому субъекту или животному субъекту.
"Субъединица" подразумевает мономерный блок, который соединен более чем с одним другим мономерным блоком, образуя полимерное соединение, где субъединица представляет собой самый короткий повторяющийся фрагмент элементов в полимерном соединении. Примерами субъединиц являются аминокислоты, которые при соединении образуют полимерное соединение, такое как соединение, называемое в данной области техники пептид, полипептид или белок.
Как применяют в настоящем изобретении, "терапевтически эффективное количество" представляет собой количество, требуемое для того, чтобы вызвать требуемый терапевтический эффект. Например, в способах снижения концентрации кальция в сыворотке крови у субъектов с гиперкальциемией, терапевтически эффективное количество представляет собой количество, требуемое для снижения концентрации кальция в сыворотке, по меньшей м