Способ моделирования посттрансплантационных изменений в почке
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к экспериментальной патофизиологии и трансплантологии, и касается моделирования посттрансплантационных изменений почки. Для этого лабораторному животному - крысе выполняют одностороннюю нефрэктомию, денервацию и делимфатизацию второй почки. Затем пережимают почечные артерию и вену на 40-60 минут. После выполнения хирургического вмешательства проводят трехкратную иммунизацию лабораторного животного почечным антигеном, полученным из удаленной почки, адъювантным методом. При этом за 5 недель до хирургического вмешательства у лабораторного животного производят забор клеток костного мозга, получают из них in vitro культуру мультипотентных мезенхимальных стромальных клеток. Денервацию и делимфатизацию оставшейся почки выполняют путем удаления адвентиции и клетчатки, окутывающих мочеточник, почечные артерию и вену, в области ворот почки на протяжении 7-10 мм и декапсуляции почки в области ее медиального края шириной 7-10 мм, протяженностью от одного полюса почки до другого с захватом области ее ворот. Для получения почечного антигена используют целую почку и доводят содержание белка в нем до 70 мг/мл. На 35-40 сутки после выполнения хирургической операции вводят полученную культуру мультипотентных мезенхимальных стромальных клеток тому же животному внутривенно в дозе 1,5-3,0 млн клеток в 1 мл физиологического раствора. Способ позволяет создать адекватную, доступную для выполнения модель хронического отторжения в аутологичных почках у мелких лабораторных животных с ускоренным развитием визуализируемых деструктивных посттрансплантационных процессов. 1 пр., 1 табл., 9 ил.
Реферат
Изобретение относится к медицине, в частности к экспериментальной патофизиологии и трансплантологии.
Известно, что склерозирование почек и их гибель (отторжение) является наиболее частым осложнением трансплантации аллогенных донорских почек. В результате численность реципиентов с длительно функционирующими трансплантатами до сих пор является чрезвычайно низкой.
В настоящее время признается, что хроническое отторжение донорских почек происходит всегда, независимо от степени их иммунной совместимости с реципиентом; однако отмечается, что при трансплантации почек от родственного донора процент длительно функционирующих трансплантатов достоверно выше, чем от неродственного (трупного) донора (Балакирев Э.М. Прогнозирование развития хронической почечной недостаточности и организация трансплантологической помощи нефрологическим больным. Автореферат докт. мед. наук. М., 1990, 56 с.).
Отмечено, что во всех почках как при аллотрансплантации (Блюмкин В.Н., Иванов А.Е. Цитопатология аллотрансплантированных почек человека: нормальная и патологическая пролиферация канальцевого эпителия аллотрансплантата. Вестник АМН СССР. 1983, 11:29-36), так и при аутотрансплантации (Кирпатовский И.Д., Быкова Н.А. Пересадка почки (экспериментальные и биологические основы). М., 1969, 231 с.; Лебедев А.А. Аутотрансплантация почки. Л.: Наука, 1971, 121 с.) происходит их постепенное повреждение, склерозирование и гибель; при длительной иммуносупрессивной терапии, используемой для предотвращения отторжения почек, эффективность ее постепенно снижается, особенно при поздних кризах отторжения, спустя несколько месяцев и лет (Ратнер М.Я. и др. Ренальные дисфункции. М.: Медицина, 1977, 296 с.). Ранние кризы отторжения развиваются независимо от степени иммунной совместимости донора и реципиента (Cochran М et al. Prognosis of cadaver kidney grafts with a rejection episode occurring within 2 weeks of transplantation. Transplantation. 1979, 27(1):67-8.), причем наибольшее число кризов приходится на 3-10 сутки (67%) и на первые 2-3 месяца (86%) после трансплантации (Шумаков В.И. Трансплантология: руководство для врачей. М.: МИА, 2006, 540 с.), то есть на тот период времени, когда в крови появляются и циркулируют почечные аутоантигены и почечные антитела, возникшие в результате ишемической и хирургической травмы почек.
Через 3-6 месяцев после трансплантации количество кризов отторжения снижется (приблизительно до 50%), но постепенно, начиная с 3-4 года в почечных трансплантатах начинают прогрессировать признаки их структурного повреждения и склерозирования (тубуло-интерстициальная нефропатия), возникновение которых, однако, связывают с токсическим воздействием на трансплантат длительно используемой иммуносупрессивной терапии.
Таким образом, развитие посттрансплантационных изменений в почках (хроническое отторжение) происходит всегда независимо от степени иммунной совместимости донора и реципиента (иммуногенетические различия донора и реципиента усиливают выраженность процесса отторжения), и этот факт предполагает наличие каких-то дополнительных патофизиологических механизмов развития хронического отторжения. В результате становится очевидным, что для изучения факторов, индуцирующих развитие посттрансплантационных изменений в почках, и для поиска путей предотвращения их хронического отторжения должна быть создана доступная и адекватная модель посттрансплантационных изменений в почках (хроническое отторжение) у мелких лабораторных животных, воссоздающая весь комплекс факторов, воздействующих на почку.
В качестве наиболее простой модели, имитирующей хроническое отторжение почки у крыс, используют модель ее токсического повреждения, когда после курсового применения иммуносупрессивного препарата в токсической дозе (циклоспорин A в дозе 15 мг/кг в течение 2-4 недель) в почке развивается тубулоинтерстициальный фиброз (Capasso G. et al. In vivo effect of the natural antioxidant hydroxytyrosol on cyclosporine nephrotoxicity in rats. Nephrol Dial Transplant. 2008, 23:1186-1195; Sanchez-Pozos K. et al. Polymerized type I collagen reduces chronic cyclosporine nephrotoxicity. Nephrol Dial Transplant. 2010, 25:2150-2158). Модель имитирует повреждение и гибель почки в посттрансплантационном периоде под воздействием иммуносупрессоров, используемых для предотвращения ее отторжения при аллотрансплантации.
Недостатком этой модели является применение заведомо токсических доз иммуносупрессора, чтобы вызвать повреждение почек; но самое главное иммуносупрессор при этом воздействует на анатомически целые почки, сохраняющие связь с организмом, тогда как при трансплантации - почка становится децентрализованной (денервация, делимфатизация почки и мочеточника) и поэтому сенсибилизированной как к токсическому повреждению, так и к развитию иммунного воспаления, выраженность которых меняется по мере увеличения антигенности трансплантата и срока трансплантации (децентрализации) (Волкова О.В. Нейро дистрофический процесс (морфологические аспекты). М.: Медицина, 1978, 256 с.).
Известны экспериментальные модели хронического отторжения почек у крыс при их аллотрансплантации в гетеропозицию, когда иссеченную почку пересаживают в брюшную полость на нисходящую аорту и нижнюю полую вену, а мочеточник соединяют с мочевым пузырем (Кирпатовский И.Д., Смирнова Э.Д. Основы оперативной техники пересадки органов. М.: Медицина, 1972, 175 с.). К достоинствам исследования хронического отторжения почки на указанной модели относится возможность воссоздания всего комплекса факторов, сопутствующих трансплантации этого органа в клинике.
Недостатком модели хронического отторжения почек у крыс является техническая сложность ее выполнения, так как операция выполняется на сосудах малого калибра и ведет к большой отбраковке экспериментальных животных. Выполнение подобных операций на мышах, что позволило бы осуществлять иммунологический мониторинг, является еще более проблематичным.
Кроме того, на данной модели не представляется возможным изучать отдельно роль главного и постоянно действующего фактора трансплантаций - фактора децентрализации на развитие посттрансплантационных изменений в почках, так как при аллотрансплантации почки требуется постоянное применение иммуносупрессоров, которые при длительном применении (даже в терапевтических дозах) сами по себе оказывают повреждающее воздействие на трансплантат. Данная модель хронического отторжения аллотрансплантированных почек у крыс является аналогом заявляемой модели хронического отторжения гистосовместимой аутологичной почки.
Модель хронического отторжения аутологичных почек на мелких лабораторных животных при их трансплантации в гетеропозицию отсутствует из-за технических проблем, возникающих при осуществлении двойного хирургического вмешательства: сначала - иссечение почек с сосудами с участком стенки брюшной аорты и нижней полой вены, а затем их трансплантация в брюшную полость, что несовместимо с жизнью.
Таким образом, на сегодняшний день адекватная и доступная для выполнения модель хронического отторжения аутологичных почек на мелких лабораторных животных (крысы, мыши) отсутствует.
Известен способ моделирования хирургических посттрансплантационных изменений в аутологичной (гистосовместимой) почке крупных животных (собак), который включает хирургическую нервно-лимфатическую децентрализацию и электрокоогуляцию лимфатических путей оттока в области ворот и капсулы одной почки, удаление парного органа, приготовление из него гомогената мозгового слоя и иммунизацию им животного адъювантным методом (патент на изобретение RU №2012928, автор Кот А.Г. название изобретения «Способ моделирования посттрансплантационных изменений в почке», опубликовано 15.05.1994).
Данная модель хронических посттрансплантационных изменений в аутологичной почке выбрана нами в качестве прототипа.
Известный способ-прототип позволяет воспроизвести функциональные и морфологические признаки только начинающегося и не резко выраженного отторжения (тубуло-интерстициальной нефропатии), так как они развиваются и прогрессируют очень медленно (визиализируемый перитубулярный и интерстициальный склероз), проявляется у собак только через 2-3 года после операции, что требует больших затрат для длительного содержания животных, а поэтому данная модель не пригодна для лабораторных (скрининговых) исследований.
Более того, в настоящее время использование собак в Москве для экспериментальных исследований запрещено (Постановление правительства Москвы №819 ПП от 02.10.2002 «О формировании системы управления и финансирования, комплекса мер по улучшению содержания, использования и охране животных в г. Москве»).
Кроме того, в этой модели не воспроизводится повреждающее воздействие на почку фактора ишемии, который является постоянным сопутствующим фактором трансплантации и, как полагают, вносит наиболее существенный вклад в развитие посттрансплантационных изменений в почке (Ратнер М.Я. «Клиническая патофизиология диффузионных поражений собственных почек и почечного аллотрансплантата», в книге под редакцией В.И. Шумакова «Очерки по патофизиологическим проблемам трансплантологии и применения искусственных органов, Изд. Репроникс 1998 с. 211-240»).
Следует также подчеркнуть, что в прототипе отсутствуют какие-либо мероприятия по устранению тяжелого хирургического стресса у животного (удаление одной почки, децентрализация оставшейся почки и антигенно-адъювантное воздействие на организм исходно здорового животного), который тормозит нормальный темп восстановительных (регенераторных) процессов в организме и тем самым увеличивает сроки появления признаков посттрансплантационных нарушений в почке (тубуло-интерстициальная нефропатия, склерозирование).
Именно выраженное стрессорное воздействие на организм тормозит репаративные процессы в нем и в почке и служит фактором длительного содержания животных в эксперименте при моделировании посттрансплантационных нарушений в почке по способу-прототипу.
В клинике при трансплантации почки, на отдаленных сроках (через 1-2 года) после пересадки, когда минует опасность развития острого отторжения, больной начинает получать поддерживающие (т.е. низкие) дозы иммуносупрессивных препаратов. В результате в его организме начинает восстанавливаться функция клеток костного мозга и других органов иммуногенеза, нормализуется иммунограмма и начинают восстанавливаться процессы физиологической регенерации органов, находящиеся под регулирующем контролем иммунной системы (Бабаева А.Г. Репаративные процессы и иммунитет. Изв. АН. Сер биол. 1999, Т. 128 N11, с. 484-490). В результате на отдаленных сроках после трансплантации в децентрализованном органе активизация регенерационных процессов проявляется формированием отчетливых признаков не восстановления, а его повреждения (развитие интерстициальной и перитубулярной нефропатии с исходом в тубуло-интерстициальный фиброз).
Таким образом, в способе-прототипе совершенно не учтена роль физиологической активизации иммунитета и регенерации на отдаленных сроках как фактора индукции ускоренного повреждения трансплантата в условиях его децентрализации.
Из вышеизложенного следует, что для лабораторного изучения факторов хронического отторжения почки (тубуло-интерстициальная нефропатия, склерозирование) и поиска путей предотвращения его развития должна быть создана доступная и адекватная модель ускоренного развития хронических посттрансплантационных изменений почек у мелких лабораторных животных.
Задачей заявляемого способа является создание адекватной, доступной для выполнения модели хронических посттрансплантационных изменений (хроническое отторжение) в аутологичных почках у мелких лабораторных животных (крысы, мыши) с ускоренным развитием визуализируемых деструктивных посттрансплантационных процессов.
Техническим результатом заявляемого способа является:
- создание адекватной и легко воспроизводимой модели посттрансплантационных изменений в аутологичных почках мелких лабораторных животных с ускоренной визуализацией развития деструктивных процессов, аналогично возникающим на отдаленных сроках после трансплантации в клинике;
- исключение травматизации животного за счет исключения постоянного применения иммуносупрессорных препаратов, приводящих к токсическому повреждению почек;
- поддержание физиологического уровня регенераторных процессов в почке;
- а также обеспечение возможности терапевтического регулирования темпа и выраженности развития хронического повреждения (отторжения).
Предлагаемый способ позволяет упростить способ путем исключения этапа электрокоагуляционного выжигания клетчатки и лимфатических путей в области ворот почки и на ее поверхности, как предлагается по способу-прототипу.
Сущность изобретения заключается в следующем.
Для моделирования посттрансплантационных изменений почки лабораторному животному - крысе выполняют одностороннюю нефрэктомию, денервацию и делимфатизацию второй почки. Затем пережимают почечные артерию и вену на 40-60 минут. После выполнения хирургического вмешательства проводят трехкратную иммунизацию лабораторного животного почечным антигеном, полученным из удаленной почки, адъювантным методом. При этом за 5 недель до хирургического вмешательства у лабораторного животного производят забор клеток костного мозга, получают из них in vitro культуру мультипотентных мезенхимальных стромальных клеток. Денервацию и делимфатизацию оставшейся почки выполняют путем удаления адвентиции и клетчатки, окутывающих мочеточник, почечные артерию и вену, в области ворот почки на протяжении 7-10 мм и декапсуляции почки в области ее медиального края шириной 7-10 мм, протяженностью от одного полюса почки до другого с захватом области ее ворот. Для получения почечного антигена используют целую почку и доводят содержание белка в нем до 70 мг/мл. На 35-40 сутки после выполнения хирургической операции вводят полученную культуру мультипотентных мезенхимальных стромальных клеток тому же животному внутривенно в дозе 1,5-3,0 млн клеток в 1 мл физиологического раствора. Способ осуществляется следующим образом.
1. За 5 недель до хирургического вмешательства на почке у крысы осуществляют заготовку аутологичного костного мозга по Аскарову М.Б. (М.Б. Аскаров. Трансплантация аутологичных клеток костного мозга для лечения длительных незаживающих язв желудка. Автореф. дисс.доктора мед. наук, Москва, 2009, 46 с.). Для этого под эфирным наркозом из костномозгового канала двух бедренных костей крысы получают клетки костного мозга (КМ) путем промывания полости этих костей фосфатно-буферным раствором, содержащим 50 ЕД/мл гепарина и 0,25 мг/л гентамицина, с помощью иглы G 18, насаженной на шприц. Суспензию клеток КМ центрифугируют при 1500 об/мин 3-5 мин, осадок клеток ресуспендируют в растворе для лизиса эритроцитов (114 мМ NH4Cl, 7,5 мМ КНСО3, 100 мкМ EDTA) в течение 5 мин и повторно центрифугируют.
Гемолизированный супернатант удаляют отсасыванием, а клеточный осадок ресуспендируют в среде JMEM (Gibco, USA), содержащей дополнительно 10% бычью эмбриональную сыворотку (Ну Clone, USA), инсулин 0,4 мкМ и 025 мг/л гентамицина. Затем полученные клетки высевают на культуральный пластик в количестве 2,0-2,5 млн клеток/мл ростовой среды JMEM, на чашки Петри (D=100 мм) при 37°C в CO2 инкубаторе, в атмосфере воздуха с 5% CO2 и 95% влажности. На 3-4 сутки культивирования клеток КМ среду полностью заменяют на среду DMEM, содержащую кроме 10% бычьей сыворотки и инсулина 0,4 мкМ/л также дексаметозон 10 нМ/л и основной фактор роста фибробластов (FGFb) 20 нг/мл (Sigma, USA) для стимуляции пролиферативной активности мультипотентных мезенхимальных стромальных клеток (ММСК), содержащихся в суммарной фракции клеток из КМ. Смену среды проводят каждые 3 суток для элиминации неприкрепившихся клеток. На 12-14 сутки культивирования ММСК формируют 80-85% монослой клеток (1,5 млн клеток) с фибробластоподобной морфологией, их снимают с пластика с помощью стандартного раствора Трипсин-Версена, центрифугируют, получают осадок клеток, супернатант удаляют, а клеточный осадок ресуспендируют в среде для криоконсервации (90% бычья фетальная сыворотка и 10% DMCO), чтобы концентрация клеток составляла 1,5 млн в мл. Суспензию клеток переносят в криопробирку и замораживают со скоростью 0,8-1,2°C в 1 мин. По достижению температуры в пробирке -70°C ее переносят в жидкий азот для хранения. За 2 недели до использования криопробирку с суспезией замороженных клеток помещают в водяной термостат при температуре 37°C и в течение 2 мин проводят разморозку. Далее пробирки центрифугируют, супернатант удаляют, осадок клеток - ММСК ресуспендируют теплой ростовой средой и сеют на 3 культуральные чашки Петри (D=100 мм). Через 12-14 суток культивирования в каждой чашке количество клеток достигало до 1,5 млн; их снимают стандартным раствором трипсин-версена, центрифугируют, супернатант удаляюти, а в количестве 3 млн клеток (из 2 чашек) или 1,5 млн клеток (из 1 чашки) ресуспендируют в 1 мл физиологического раствора непосредственно перед использованием (после хирургического вмешательства на почке и антигенно-адъювантной иммунизации крысы).
2. Через 1 неделю после забора клеток костного мозга проводят подготовку крысы к операции. Используют крыс, прошедших санитарно-эпидемиологический контроль. Через 5 недель после забора клеток под эфирным наркозом в положении на спине выполняют срединную лапаротомию, иссекают левую почку, затем правую почку хирургически децентрализуют - денервируют и делимфатизируют. Для этого правую почку выделяют из забрюшинных тканей, тупым и острым путем выполняют прецизионную диссекцию нервных и лимфатических путей в области ворот почки и примыкающих к воротам тканей почки. Диссекция нервных и лимфатических путей при этом достигается не только путем хирургического разрушения и удаления адвентиции и клетчатки, окутывающих почечную артерию, вену и мочеточник в области ворот почки, где проходят нервные стволы и лимфатические сосуды (скелетизация почечной артерии, вены и мочеточника в юкста-лоханочном отделе, протяженностью до 7-10 мм), но и путем частичной хирургической декапсуляции (частичное удаление капсулы) почки: декапсуляции почки в области ее медиального края шириной 7-10 мм, протяженностью от одного полюса почки до другого с захватом области ее ворот. Частичная декапсуляция почки повышает надежность хирургической денервации и делимфатизации почки, так как дополнительно прерываются все макроскопически видимые и невидимые нервные и лимфатические пути.
После завершения этапа денервации и делимфатизации правой почки ее подвергают воздействию ишемии сроком на 40-60 минут. Для этого выделяют сосуды почки (артерия и вена) дистальнее зоны их скелетизации, подводят под них лигатуру, вводят гепарин подкожно, а через 15 минут с помощью турникета пережимают сосуды почки сроком на 40-60 мин.
3. Спустя 7-10 суток после хирургического вмешательства проводят иммунизацию животного путем 3-кратного введения водно-солевого почечного антигена. Для получения почечного антигена используют целую почку и доводят содержание белка в нем до 70 мг/мл. Для иммунизации лабораторного животного готовят экстракт из одной гомогенизированной целой аутологичной почки в 3-4 мл физиологического раствора, смешивают с неполным адъювантом Фрейнда в отношении 1:1, делят на три порции и вводят в подкожную клетчатку 4-х лапок трехкратно через каждые 7-10 дней (по 1,8-2,0 мл смеси водно-солевого раствора антигена с адъювантом Фрейнда в отношении 1:1 с суммарным содержанием белка 35 мг/мл). После подкожного введения раствора почечного антигена и адъюванта Фрейнда место инъекции в течение 30 секунд умеренно прижимают асептическим спиртовым шариком с целью исключения обратного тока жидкости, после чего обрабатывают раствором повидон - йод.
4. Через 35-40 суток после хирургического вмешательства животному под эфирным наркозом внутривенно (в хвостовую вену) вводят заранее выделенные культивированные ММСК аутологичного костного мозга в количестве 1,5-3,0 млн клеток в 1 мл физиологического раствора (для восстановления исходного уровня активности регенераторных процессов в организме).
Приводим доказательства возможности реализации заявленного назначения и достижения указанного технического результата.
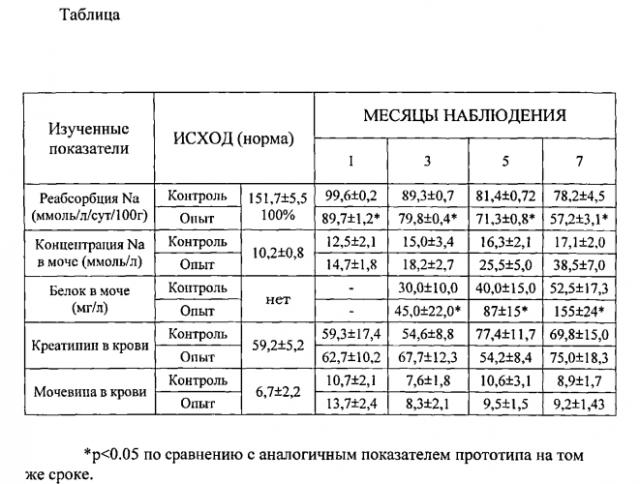
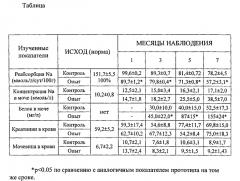
В таблице представлены некоторые показатели функции почек после односторонней нефрэктомии и моделирования хронического отторжения оставшейся почки в контрольной группе - (способ прототип) и в опытной группе (моделирование по заявленному способу).
Пример выполнения способа.
За 5 недель до хирургического вмешательства под эфирным наркозом в положении на спине, после обработки кожи бедра антисептиками с помощью иглы размером G 18 осуществили забор клеток костного мозга последовательно из двух бедренных костей в количестве до 0,5 мл (содержание клеток костного мозга достигает 100×103 клеток). В дальнейшем клетки костного мозга обрабатывали и культивировали в стандартных условиях по методике, описанной М.Б. Аскаровым, 2009, и получили ММСК в количестве до 3 млн клеток на одно животное.
Под эфирным наркозом в положении на спине обрабатывали антисептиками поверхность передней брюшной стенки крысы по Филончикову-Гроссиху. Затем срединным разрезом рассекали кожу и подкожную клетчатку по белой линии живота и проникали в брюшную полость. Легировали артерию и вену левой почки, удалили ее (далее эту почку использовали для приготовления почечного антигена); затем правую почку хирургически денервировали и делимфатизировали (децентрализация почки) путем высвобождения от окружающих тканей и осуществления прецизионной диссекции нервных и лимфатических путей. Выполнили скелетизацию почечной артерии, вены и мочеточника в юкста-лоханочном отделе, протяженностью до 7 мм и частичную хирургической декапсуляцию (частичное удаление капсулы) почки: декапсуляция почки в области ее медиального края шириной 10 мм, протяженностью от одного полюса почки до другого с захватом области ее ворот.
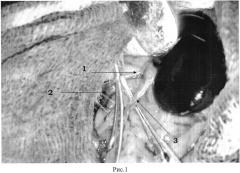
Проводили хирургическое разрушение и удаление адвентиции и клетчатки, окутывающих почечную артерию, вену и мочеточник, в области ворот почки протяженностью до 7 мм, сохраняя кровоток по почечной артерии и вене (рис. 1).
На рис. 1 представлена схема хирургической децентрализации (денервация, делимфатизация) почки, где
1 - почечная артерия, 2 - почечная вена, 3 - мочеточник.
После завершения этапа денервации и делимфатизации правой почки ее подвергали воздействию ишемии сроком на 60 мин.
Для этого выделяли сосуды почки (артерия и вена) дистальнее зоны их скелетизации, проводили под них лигатуру, вводили подкожно гепарин в дозе 0,2 мл на крысу, а через 15 минут с помощью турникета пережимали сосуды почки сроком на один час. После снятия турникета кровоток в почке спонтанно восстанавливался. Операция на животном сопровождалось орошением органов брюшной полости физиологическим раствором с антибиотиками. Завершалась операция послойным ушиванием операционной раны.
Далее из удаленной левой почки готовили гомогенат для 3-кратной иммунизации крысы, у которой уже была проведена хирургическая денервация и делимфатизация правой почки, а также ее ишемизация. Для этого удаленную почку механически измельчали на холоду, суспендировали в 4 мл раствора DMEM (фирмы ПАНЭКО, Россия), проводили фильтрацию гомогената через фильтр системы для переливания крови (стерильная система ПК 21-01-«Синтез»), определяли в растворе содержание белка по Лоури и, при необходимости, добавляли свежую среду ДМЕМ в водно-солевой антиген, доводя в нем содержание белка до 70 мг/мл.
Затем смешивали 1 мл приготовленного водно-солевого антигена с 1 мл неполного адъюванта Фрейнда (фирма Gifco, Usa). Приготовленную смесь (2 мл) вводили оперированной крысе на 7-е сутки в подкожную клетчатку 4-х лапок (по 0,5 мл в каждую лапку). На 17 и 27 сутки после хирургического вмешательства - смесь водно-солевого антигена и адъюванта Фрейнда в количестве 2 мл, приготовленного в объемном отношении 1:1, дополнительно вводили в подкожную клетчатку 4-х лапок той же крысе. После каждого введения смеси почечного антигена и адъюванта место инъекции в течение 30 секунд умеренно прижимали асептическим спиртовым шариком для предотвращения выхода жидкости, после чего лапки обрабатывали раствором повидон - йод.
На 35 сутки после хирургического вмешательства и 3-кратного введения антигена с адъювантом крысе под эфирным наркозом внутривенно (в хвостовую вену) вводили ММСК аутологичного костного мозга в количестве 1,5 млн клеток в 1 мл физиологического раствора.
С этого момента нами проводилось сравнительное изучение функции и морфологического состояния единственной почки, подвергнутой воздействию неспецифических факторов трансплантации по способу-прототипу, а также по предлагаемому способу в течение 7 месяцев.
Для этого на сроках 1, 3, 5 и 7 месяцев после завершения моделирования хронического отторжения почки изучали уровень креатинина и мочевины в крови животных, а также параметры: реабсорбцию натрия, концентрацию натрия в моче и белок в суточной моче в условиях утренней интраперитонеальной водной нагрузки (5% от массы тела). После завершения функциональных исследований под эфирным наркозом животных забивали и исследовали морфологическое состояние почек при их окраске гемотоксилин-эозином или по Маллори.
Результаты функциональных исследований проведенных в опытной (заявленный способ, n=25) и контрольной (способ-прототип n=20) группах представлены в таблице, приведенной выше.
Из таблицы следует, что почки в опытной и контрольной группах на протяжении 7 месяцев сохраняют свою основную гомеостатическую функцию - выведение азотистых шлаков из организма (уровень креатинина и мочевины в крови поддерживается в пределах нормальных значений).
Между тем канальцевые функции реабсорбция Na, экскреция Na и белка нарушены по сравнению с нормой (исходный уровень), причем в достоверно большей степени при моделировании хронической почечной недостаточности по заявленному способу, чем по способу-прототипу (таблица).
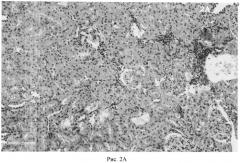
Более выраженные нарушения экскреторной функции почек (канальцевых функций) по заявленному способу были подтверждены путем морфологического исследования почек в 2-х группах опытов (рис. 2 и рис. 3).
На рис. 2 представлено морфологическое состояние почки в динамике развития посттрансплантационных изменений по способу-прототипу. Окраска гемотоксилин-эозин.
А - через 3 месяца после моделирования хронического отторжения.
Б - через 5 месяцев после моделирования хронического отторжения.
В - через 7 месяцев после моделирования хронического отторжения.
Из рис. 2 видно, что клубочки одинакового размера, многочисленные; отмечается незначительно выраженное полнокровие капиллярных петель, повышенная клеточная инфильтрация части клубочков воспалительными клетками (лимфоциты, полиморфноядерные лейкоциты). Эпителий извитых канальцев в состоянии белковой дистрофии; отмечается очаговые перитубулярные и перигломерулярные лимфоцитарные инфильтраты.
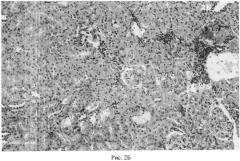
На рис. 3 представлено морфологическое состояние почки коркового слоя в динамике развития посттрансплантационных изменений по заявленному способу. Окраска гемотоксилин-эозином.
А - через 3 мес. после моделирования.
Б - через 5 мес. после моделирования.
В - через 7 мес. после моделирования хронического отторжения.
На рис. 4 представлена динамика посттрансплантационных изменений в мозговом слое почки через 7 месяцев после моделирования хронического повреждения по заявленному способу, А и Б различные поля зрения.
Из рис. 3 и 4 видно, что клубочки одинакового размера и многочисленные; отмечается незначительно выраженное полнокровие капиллярных петель; в части клубочков определяются клетки воспалительного инфильтрата (лимфоциты, полиморфноядерные лейкоциты). Эпителий извитых канальцев в корковом слое и собирательные трубочки в мозговом слое в состоянии белковой дистрофии, часть канальцев расширена, выстлана уплощенным эпителием и заполнена гомогенной белковой эозинофильной жидкостью. Количество таких канальцев и собирательных трубочек увеличивается по мере увеличения сроков наблюдения; отмечаются также очаговые умеренно выраженные перитубулярные, перигломерулярные и периваскулярные лимфоцитарные инфильтраты.
Сравнивая результаты морфологического исследования почек, можно прейти к заключению, что моделирование посттрансплантационных нарушений в почке по заявленному способу усиливает дистрофические процессы в извитых канальцах коркового слоя, нарушает отток мочи, вызывает расширение канальцев и появление кист, способствует повышению содержания белка в ультрафильтрате (первичной моче) и в моче собирательных трубочек; ведет к ускоренной атрофии канальцевой системы, которая ответственна за обеспечение экскреторных процессов в почке. Усиление дистрофических и атрофических процессов в канальцевом аппарате коркового и мозгового слоя почки, возникшее при моделировании по заявленному способу, сопровождает обычно более тяжелое течение хронического отторжения трансплантированной почки, которое клинически характеризуется появлением (нарастанием) белка в моче (протеинурия).
Таким образом, заявленный способ позволяет в укороченные сроки (уже через 3 и 5 месяцев) воспроизвести тяжелую тубуло-интерстициальную нефропатию с выраженными функциональными (белок в моче) и структурными проявлениями в канальцах коркового и мозгового слоя почек. Способ-прототип не позволяет в указанные сроки воспроизвести отчетливо выраженную протеинурию и накопление белка в канальцах почек.
Изобретение целесообразно использовать в патофизиологии и трансплантологии при изучении патогенетических механизмов посттрансплантационного повреждения гистосовместимого нефротрансплантата и для разработки эффективных методов защиты трансплантированной почки от действия неспецифических факторов ее повреждения.
Способ моделирования посттрансплантационных изменений в почке, включающий выполнение лабораторному животному односторонней нефрэктомии, денервации, делимфатизации второй почки и трехкратной иммунизации почечным антигеном, полученным из удаленной почки, адъювантным методом, отличающийся тем, что в качестве лабораторного животного используют крысу, у которой за 5 недель до хирургического вмешательства производят забор клеток костного мозга, получают из них in vitro культуру мультипотентных мезенхимальных стромальных клеток, денервацию и делимфатизацию оставшейся почки выполняют путем удаления адвентиции и клетчатки, окутывающих мочеточник, почечные артерию и вену, в области ворот почки на протяжении 7-10 мм и декапсуляции почки в области ее медиального края шириной 7-10 мм, протяженностью от одного полюса почки до другого с захватом области ее ворот, затем пережимают почечные артерию и вену на 40-60 минут; для получения почечного антигена используют целую почку и доводят содержание белка в нем до 70 мг/мл, на 35-40 сутки после выполнения хирургической операции вводят полученную культуру мультипотентных мезенхимальных стромальных клеток тому же животному внутривенно в дозе 1,5-3,0 млн клеток в 1 мл физиологического раствора.