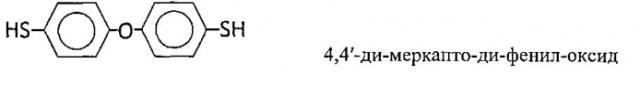Состав для стабилизации липидов к окислению
Иллюстрации
Показать всеИзобретение относится к области пищевой технологии, а именно к способам защиты липидов, масел, жиров от окисления и окислительной деструкции. К липидам добавляют в качестве антиоксиданта 4,4′-ди-меркапто-ди-фенил-оксид или 4,4′-ди-меркапто-ди-фенил-метан в количестве 0,03-0,4% от массы липидов. Изобретение позволяет получить состав для стабилизации липидов к окислению с помощью антиоксиданта, обладающего высокой эффективностью и низкой токсичностью. 3 табл., 3 пр.
Реферат
Изобретение относится к области пищевой технологии, а именно к способам защиты липидов, масел, жиров от окисления и окислительной деструкции, и может быть использовано в пищевой, косметической и химико-фармацевтической промышленности для получения стабильных липидосодержащих пищевых добавок (нутрицевтиков), лечебно-косметических средств и лекарственных препаратов.
Для торможения процессов окисления применяют антиоксиданты (ингибиторы окисления), которые находят все более широкое применение для предотвращения окислительных превращений липидов и содержащих их препаратов in vitro, а также in vivo, в комплексной терапии широкого круга заболеваний /Герчук М.П. Антиокислители в пищевой промышленности // Журн. Всесоюз. хим. общества им. Д.И. Менделеева. - 1960. - N.4. - С.395-402; Авакумов В.М., Ковлер М.А., Кругликова-Львова Р.П. Лекарственные средства метаболической терапии на основе витаминов и ферментов (Обзор) // Вопросы мед. химии. - 1992. - Т.38. - N4. - С.14-21; Дурнев А.Д., Середенин С. В. Антиоксиданты как средства защиты генетического аппарата // Хим.-фарм. журн. - 1990. - N2. - С.92-100/. Таким образом, антиоксиданты, присутствующие в лекарственном или косметическом препарате, являются не только действующим началом этих средств, но могут значительно тормозить их окисление в процессе длительного хранения, способствуя сохранению в нативном состоянии легкоокисляемых биологически активных компонентов. Известны составы для стабилизации липидов к окислению различного происхождения путем введения антиоксидантов токоферолов /US 2564106, опубл. 14.08.1951/, нафтолов и фенолов /Эмануэль Н.М., Лясковская Ю.Н. Торможение процессов окисления жиров. М.: Пищепромиздат, 1961. - 360 с./.
В качестве прототипа выбран состав для стабилизации липидов к окислению с помощью введения токоферолов /US 2564106, опубл. 14.08.1951/. Указанный состав тормозит процесс окисления липидов за счет антиоксидантного действия ингибитора природного происхождения α-токоферола (6-гидрокси-2,5,7,8-тетраметил-2-фитил-хромана, витамина E). Известно, что α-токоферол характеризуется чрезвычайно высокой константой скорости реакции с пероксильными радикалами k7=(3,3-3,5)×106 M-1×c-1 /Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. Кинетические особенности токоферолов как антиоксидантов. Черноголовка, 1992. - 56 с./.
Недостатком этого состава является сложный механизм действия α-токоферола в липидных субстратах, его участие не только в реакциях обрыва цепей, но и реакциях продолжения цепей, что приводит к снижению антиоксидантной активности α-токоферола и промотированию процесса окисления.
Серосодержащим соединениям принадлежат важные физиологические функции во всех живых организмах. Сера входит в состав аминокислот, активных центров ферментов, гормонов. Все серосодержащие соединения клетки рассматриваются как эндогенные антиоксиданты /Губский Ю.А. Регуляция перекисного окисления липидов в биологических мембранах // Биохимия животных и человека. - 1978. - N2. - С.72-76; Хьюз М. Неорганическая химия биологических процессов / [Под ред. Г.Н. Новодаровой]. - М.: Мир, 1983. - 414 с./.
В результате направленного синтеза в Ярославском государственном техническом университете (ЯГТУ) группой профессора, д.х.н. Москвичева Ю.А. получены малотоксичные тиолы, имеющие в своей структуре меркапто-группы /Москвичев Ю.А., Тарасов А.В., Алов Е.М., Герасимова Н.П. Синтез органических соединений серы на основе производных ароматических сульфокислот // Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева). - 1995. - Т.49. - №.6. - С.21-34/.
Предлагаемые соединения 4,4′-ди-меркапто-ди-фенил-оксид и 4,4′-ди-меркапто-ди-фенил-метан являются бис-фенилтиолами. Химические формулы соединений представлены ниже:
Заявляемые соединения способны непосредственно взаимодействовать с гидропероксидами, разрушая их без образования свободных радикалов, что не наблюдается в присутствии α-токоферола. Разрушение гидропероксидов под влиянием 4,4′-ди-меркапто-ди-фенил-оксида и 4,4′-ди-меркапто-ди-фенил-метана, в свою очередь, является причиной выигрыша в периодах индукции.
Задачей заявляемого изобретения является разработать состав для стабилизации липидов к окислению с помощью антиоксиданта, обладающего высокой эффективностью и низкой токсичностью.
Технический результат - простой состав, не требующий больших материальных затрат, основанный на способности низкотоксичного антиоксиданта 4,4′-ди-меркапто-ди-фенил-оксида или 4,4′-ди-меркапто-ди-фенил-метана разрушать продукты окислительной деструкции липидов (гидропероксиды) нерадикальным путем.
Технический результат достигается тем, что к липидам добавляют в качестве антиоксиданта 4,4′-ди-меркапто-ди-фенил-оксид или 4,4′-ди-меркапто-ди-фенил-метан в количестве 0,03-0,4% от массы липидов.
Сущность изобретения заключается в использовании в качестве антиоксиданта 4,4′-ди-меркапто-ди-фенил-оксида или 4,4′-ди-меркапто-ди-фенил-метана.
Антиоксидантную активность (АОА) тестировали волюмометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении метиллинолеата (МЛ) в присутствии водного раствора триметилцетиламмоний бромида (ЦТМАБ) в качестве поверхностно-активного вещества (ПАВ) в концентрации 1×10-3 М, с добавками водного раствора хлорида меди (II) в концентрации 2×10-3 М при t=(60±0,2)°C. Соотношение воды и липидов составляло 3:1, общий объем пробы 4 мл /Ушкалова В.Н., Перевозкина М.Г., Барышников Э.В. Разработка способа тестирования средств антиоксидантотерапии // В сб.: Свободно-радикальное окисление липидов в эксперименте и клинике. Тюмень, Изд-во Тюм. ГУ. - 1997. - С.77-82. Патент 2322658 RU, МПК8 G01N 7/18, опубл. 20.04.2008 г. Бюл. №11/. Кинетику окисления метилолеата (МО) кислородом изучали в среде инертного растворителя хлорбензола, процесс инициировали за счет термического разложения азо-бис-изобутиронитрила (АИБН) в концентрации 6×10-3 М. В качестве критериев оценки антиоксидантных свойств соединений использовали периоды индукции, начальные и максимальные скорости окисления. Графическим методом определяли величину периода индукции (τi), представляющей собой отрезок оси абсцисс, отсекаемый перпендикуляром, опущенным из точки пересечения касательных, проведенных к кинетической кривой. Эффективность торможения процесса окисления липидного субстрата определяется совокупностью реакций ингибитора и обозначает его антиоксидантную активность, количественно определяемой по формуле АОА=τi-τS/τS, где τS и τi - периоды индукции окисления субстрата в отсутствии и в присутствии исследуемого антиоксиданта (АО), соответственно. Критерием антиоксидантного действия служили начальная (Wo2нач) и максимальная (Wo2max) скорости процесса окисления в присутствии и в отсутствии антиоксиданта. Скорость инициирования определяли уравнением Wi=f[InH]/τi, где f - стехиометрический коэффициент ингибирования, [InH] - концентрация реперного ингибитора, τi - период индукции. По наклону прямой в координатах τ, [InH] была рассчитана скорость инициирования в обеих системах, получены значения 4,8×10-8 и 1,9×10-5 М×с-1 в безводной и водно-липидной среде, соответственно. Сравнение максимальных скоростей окисления липидных субстратов в безводной и водно-липидной средах, равных 1,4×10-7 и 2,6×10-4 М×с-1, соответствует различию скоростей инициирования в 1000 раз.
Кинетику накопления гидропероксидов в модельном субстрате исследовали в условиях аутоокисления методом обратного йодометрического титрования в среде хлорбензола при t=(60±0,2)°C. Навеску окисляемого модельного субстрата растворяли в смеси ледяной уксусной кислоты и хлороформа в соотношении 3:2, добавляли иодид калия, смесь перемешивали и оставляли в темноте. Через равные промежутки времени отбирали пробы и определяли в них перекисное число: П Ч = 0,1269 × ( a − b ) d , где a - объем Na2S2O3, пошедший на титрование пробы; b - объем Na2S2O3, пошедший на титрование контрольного опыта; d - масса навески субстрата окисления.
Сущность изобретения иллюстрируется следующими примерами.
Пример 1.
Берут 1 г (точная навеска) метилолеата и помещают в манометрическую ячейку, добавляют 4,4′-ди-меркапто-ди-фенил-оксид или 4,4′-ди-меркапто-ди-фенил-метан в количестве 0,03% от массы липидов, 6×10-3 М в конечной концентрации инициатора окисления АИБН, доводят хлорбензолом до общего объема пробы 2 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах dV/dt. Графическим методом из кинетических кривых определяют величину периода индукции (τi). Из наклона кинетических кривых определяют начальную (WO2нач) и максимальную (WO2 мах) скорости окисления липидного субстрата в контрольном опыте и с добавками антиоксидантов. Показатели сравнивают с прототипом (Табл.1).
Кинетические параметры окисления метилолеата в безводной среде в присутствии 6×10-3 М АИБН в зависимости от концентрации тиолов и α-токоферола (прототип), Wi=4,8×10-8 M×c-1, t=60°С.
| Таблица 1 | ||||
| № п/п | Содержание АО*, мас.% | τ, мин | WO2нач×10-8, M×c-1 | WO2max×10-7, M×c-1 |
| I | Субстрат окисления - метилолеат (контроль) | |||
| 1 | 0 | 20 | 6,7 | 1,4 |
| II | α-токоферола (прототип) | |||
| 2 | 0,03 | 80 | 1,1 | 1,3 |
| 3 | 0,05 | 110 | 1,0 | 1,4 |
| 4 | 0,08 | 140 | 0,9 | 1,4 |
| III | 4,4′-ди-меркапто-ди-фенил-оксид | |||
| 5 | 0,03 | 45 | 0,2 | 1,0 |
| 6 | 0,05 | 140 | 0,1 | 0,8 |
| 7 | 0,08 | 200 | 0,1 | 0,6 |
| IV | 4,4′-ди-меркапто-ди-фенил-метан | |||
| 8 | 0,03 | 50 | 0,2 | 0,9 |
| 9 | 0,05 | 150 | 0,1 | 0,7 |
| 10 | 0,08 | 210 | 0,1 | 0,5 |
Пример 2.
Берут 1 г (точная навеска) метиллинолеата и помещают в манометрическую ячейку, добавляют 4,4′-ди-меркапто-ди-фенил-оксид или 4,4′-ди-меркапто-ди-фенил-метан в количестве 0,3% от массы липидов, добавляют водный раствор хлорида меди (II) в конечной концентрации в пробе 2×10-3 М, водный раствор цетилтриметиламмония бромида (ЦТМАБ) в конечной концентрации в пробе 1×10-3 M, доводят водой до общего объема пробы 4 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах dV/dt. Графическим методом из кинетических кривых определяют величину периода индукции (τi). Из наклона кинетических кривых определяют начальную (WO2нач) и максимальную (WO2 мах) скорости окисления липидного субстрата в контрольном опыте и с добавками антиоксидантов. Показатели сравнивают с прототипом.
Кинетические параметры окисления метиллинолеата в водно-липидной среде в присутствии 2×10-3 М CuCl2 в зависимости от концентрации тиолов и α-токоферола (прототип), Wi=1,9×10-5 M×c-1, t=60°C (Табл.2).
| Таблица 2 | ||||
| № п/п | Содержание АО*, мас.% | τ, мин | WO2нач×10-5, M×c-1 | WO2max×10-5, M×c-1 |
| I | Субстрат окисления - метиллинолеат (контроль) | |||
| 1 | 0 | 5 | 14,4 | 2,6 |
| α-токоферола (прототип) | ||||
| 2 | 0,01 | 35 | 5,2 | 1,4 |
| 3 | 0,11 | 40 | 5,0 | 1,4 |
| 4 | 0,14 | 15 | 14,6 | 3,2 |
| 5 | 0,30 | 12 | 14,8 | 3,3 |
| 6 | 0,41 | 10 | 15,1 | 3,3 |
| II | 4,4′-ди-меркапто-ди-фенил-оксид | |||
| 7 | 0,11 | 45 | 1,2 | 1,6 |
| 8 | 0,14 | 65 | 1,1 | 1,6 |
| 9 | 0,30 | 70 | 0,7 | 3,5 |
| 10 | 0,34 | 110 | 0,8 | 3,5 |
| 11 | 0,41 | 135 | 0,9 | 3,5 |
| 12 | 0,50 | 180 | 0,9 | 3,6 |
| III | 4,4′-ди-меркапто-ди-фенил-метан | |||
| 13 | 0,30 | 42 | 0,6 | 1,9 |
| 14 | 0,34 | 45 | 0,6 | 1,9 |
| 15 | 0,43 | 150 | 0,6 | 2,0 |
| 16 | 0,46 | 180 | 0,5 | 2,2 |
Пример 3.
Берут 10 г (точная навеска) метилолеата, добавляют 4,4′-ди-меркапто-ди-фенил-оксид или 4,4′-ди-меркапто-ди-фенил-метан в количестве 0,03% от массы липидов, перемешивают магнитной мешалкой в светонепроницаемой термостатированной ячейке при температуре t=(60±0,2)°C. Через равные промежутки времени отбирают пробы и определяют в них перекисное число (ПЧ).
Кинетика разрушения гидропероксидов при аутоокислении метилолеата в присутствии 4,4′-ди-меркапто-ди-фенил-оксида, 4,4′-ди-меркапто-ди-фенил-метана и α-токоферола (прототип), t=60°C (Табл.3).
| Таблица 3 | |||
| Состав смеси | Аутоокисление метилолеата | Процент разрушения ROOH за 7 часов | |
| Wнакопления ROOH ×10-4; г I2/100 г лип.*×с-1 | Wразрушения ROOH ×10-4, г I2/100 г лип.*×с-1 | ||
| МО (контроль) | 5,83 | - | - |
| МО + α-токоферол (0,03 мас.%) (прототип) | 5,83 | ||
| МО + 4,4′-ди-меркапто-ди-фенил-оксид (0,03 мас.%) | - | 4,16 | 71,4 |
| МО + 4,4′-ди-меркапто-ди-фенил-метан (0,03 мас.%) | - | 4,52 | 77,5 |
Состав для стабилизации липидов, включающий антиоксидант, отличающийся тем, что в качестве антиоксиданта используют 4,4′-ди-меркапто-ди-фенил-оксид или 4,4′-ди-меркапто-ди-фенил-метан, добавляемый в количестве 0,03-0,4% от массы липидов.