Способ мониторинга фиброзного процесса в печени у больных хроническим гепатитом с
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности гепатологии и инфекционным болезням, и может использоваться для определения стадии фиброзного процесса при мониторинге больных хроническим гепатитом C.
Для осуществления способа у больных хроническим гепатитом C с установленной в результате биопсии или другим неинвазивным методом стадией фиброзного процесса 2 раза в год определяют уровни цитокинов сыворотки крови и на их основе рассчитывают интегральный показатель цитокинового профиля (ИПЦП), далее при исходной стадии F0 рост ИПЦП выше -8 свидетельствует о дебюте фиброзных изменений в печени (переход на стадию F1), при исходной стадии F1 падение ИПЦП ниже -10 свидетельствует о переходе на стадию F2, при исходной стадии F2 рост ИПЦП выше -3 свидетельствует о переходе фиброза на стадию F3, при исходной стадии F3 падение ИПЦП ниже -3 свидетельствует о развитии цирроза печени. 3 пр., 1 табл., 5 ил.
Реферат
Изобретение относится к области медицины, в частности гепатологии и инфекционным болезням, и может использоваться для определения стадии фиброзного процесса при мониторинге больных хроническим гепатитом С. Для осуществления способа у больных хроническим гепатитом С с установленной в результате биопсии или другим неинвазивным методом стадией фиброзного процесса 2 раза в год определяют интегральный показатель цитокинового профиля (ИПЦП), далее при исходной стадии F0 рост ИПЦП выше -8 свидетельствует о дебюте фиброзных изменений в печени (переход на стадию F1), при исходной стадии F1 падение ИПЦП ниже -10 свидетельствует о переходе на стадию F2, при исходной стадии F2 рост ИПЦП выше -3 свидетельствует о переходе фиброза на стадию F3, при исходной стадии F3 падение ИПЦП ниже -3 свидетельствует о развитии цирроза печени METAVIR.
Инфицирование вирусом гепатита С (ВГС) характеризуется очень широкой распространенностью во всем мире (около 200 миллионов человек), высоким уровнем хронизации процесса с неблагоприятными исходами в цирроз или рак печени [1, 2, 3]. С социально-экономической точки зрения хронический гепатит С требует значительных затрат на диспансерное наблюдение за больными при дорогостоящем диагностическом сопровождении их мониторинга [3, 4]. С клинических позиций «золотой стандарт» диагностики фиброзного процесса в виде биопсии печени небезопасен для больного [5, 6], а многочисленные способы неинвазивной диагностики фиброза печени не всегда точны, требуют сочетания нескольких тестов [7, 8, 9, 10] и нуждаются в пополнении новыми эффективными диагностическими приемами, наиболее полно отражающими патогенез фиброзных изменений в печени и вполне доступными для мониторинга больных как с методической, так и с экономической точек зрения.
Известно, что фиброзные процессы в печени очень тесно связаны с иммунологическими сдвигами у больных хроническим гепатитом С и во многом зависят от соотношения в организме больного цитокинов профиброзного и противофиброзного действия. В частности, было показано, что прогрессированию фиброза печени в немалой степени способствуют цитокины, связанные с CD4+ Tx2 иммунным ответом (ИЛ-4, ИЛ-5, ИЛ-13, ИЛ-21), в то время как противофиброзными свойствами обладают Tx1-ассоциированные цитокины ИФНγ и ИЛ-12 [11]. Особенно выраженным профиброзным действием характеризуется трансформирующий фактор роста β (ТФРβ), который через рецепторы на мембране миофибробластов в значительной мере влияет на транскрипцию генов, отвечающих за синтез проколлагена I и III [11, 12]. В свою очередь, секреция ТФРβ макрофагами эффективно индуцируется ИЛ-13 [13]. Очень важную функцию блокады фиброзных изменений в печени выполняет ИЛ-10, действие которого показано на многочисленных моделях, в том числе и при ХГС [14].
В связи с этим целью настоящего изобретения была разработка нового способа мониторинга фиброзного процесса в печени у больных хроническим гепатитом С на основе интегральной оценки цитокинового профиля сыворотки крови при данном заболевании.
В настоящее время существуют способы оценки фиброзного процесса на основе цитокинового статуса больных хроническим гепатитом С. Так, известны способы прогнозирования цирроза печени на фоне ХГС с использованием генетических методов исследований, в частности, по анализу ДНК пациентов на наличие полиморфизма генов цитокинов [15, 16]. Анализ уровня цитокинов при диагностике фиброза печени может входить в состав комплекса иммунологических тестов, предназначенных для неинвазивной диагностики фиброза печени у больных хроническим гепатитом C [17].
Оба указанных метода по своей доступности значительно уступают способу мониторинга тяжести течения и прогноза цирротических изменений в печени при ХГС на основе определения в сыворотке крови уровней различных цитокинов [18], который может служить аналогом заявляемого изобретения. Для осуществления способа в сыворотке крови определяют содержание цитокинов ИЛ-4, ИЛ-10, ИЛ-12р70, ФНОα. При ИЛ-4 выше 5,6 пг/мл, ИЛ-10 выше 35 пг/мл, ФНОα выше 14 пг/мл и ИЛ-12р70 выше 8,5 пг/мл устанавливают наличие выраженного фиброза печени. Общность аналога и заявляемого изобретения заключается в методах иммунологического тестирования, основанного на определении уровня сывороточных цитокинов методом твердофазного иммуноферментного анализа, а также в проведении исследований под контролем пункционной биопсии печени.
Достоинством обоих способов можно считать их экономическую целесообразность и доступность, поскольку определение уровней цитокинов входит в категорию рутинных методов иммунодиагностики на основе иммуноферментного анализа и в принципе может осуществляться на основе отечественных тест-систем, что значительно снижает их себестоимость.
Наряду с этим, у аналога имеются определенные недостатки, один из которых - возможность разового определения выраженного фиброза печени у пациента при отсутствии перспектив его использования для длительного мониторинга состояния больного ХГС и, следовательно, определения показаний к проведению противовирусной терапии на основании выраженности и степени прогрессирования фиброзного процесса. Кроме того, с помощью способа устанавливается только выраженный фиброз без возможности четкой идентификации каждой стадии фиброзного процесса. Этот недостаток способа связан с методическим подходом к его решению, поскольку он основан на определении уровня отдельных цитокинов в сыворотке крови без учета вклада («весового коэффициента») каждого цитокина в развитие отдельных этапов фиброзных изменений в печени.
В связи с этим особенностью данного изобретения является то, что для достижения технического результата используется другой набор тестируемых цитокинов в сыворотке крови с расчетом на его основе особого коэффициента - интегрального показателя цитокинового профиля (ИПЦП), который учитывает «вклад» каждого цитокина в развитие фиброзного процесса в печени на каждой стадии его развития у больных хроническим гепатитом C.
Объектом исследования служили 66 человек с верифицированным диагнозом хронического гепатита C, которым предварительно была проведена пункционная биопсия печени и гистологически установлена стадия фиброза печени по шкале METAVIR [19]. В результате все обследованные пациенты в соответствии со стадиями фиброза печени была подразделена на 5 подгрупп: на стадии F0 (отсутствие фиброза) - 4 человека, на стадии F1 (начало фиброзных изменений) - 25 человек, на стадии F2 (выраженный фиброз) - 7 человек, на стадии F3 (значимый фиброз) - 9 человек, на стадии F4 (цирроз печени) - 21 человек. Контролем служила группа из 17 здоровых человек (доноры).
У каждого обследуемого определялся уровень следующих цитокинов сыворотки крови: интерферона α (ИФНα), интерферона γ (ИФНγ), интерлейкина-10 (ИЛ-10), интерлейкина-12 (ИЛ-12), интерлейкина-13 (ИЛ-13), фактора некроза опухолей α (ФНОα), трансформирующего фактора роста β (ТФРβ).
Материалом для исследования являлась венозная кровь больных в количестве 5 мл, которую забирали шприцем из локтевой вены, центрифугировали при 3000 об/мин на холоде в течение 10 минут, сыворотку разливали по 0,5 мл в эпендорфы, замораживали и хранили до использования при -70°C. Иммуноферментный анализ (ИФА) проводился из проб сыворотки крови с использованием планшетного фотометра «OPSYS MR» (ридер) фирмы «THERMOLABSYSTEMS» (Финляндия) в соответствии с инструкцией по применению аппаратуры и комплекта моноклональных антител. Последний включал: anti-IFNα MKAT (Вектор Бест, Россия) для определения уровня ИФНα; anti-IFNγ MKAT (Вектор Бест, Россия) для определения уровня ИФНγ; anti-IL-10 MKAT (Вектор Бест, Россия) для определения уровня ИЛ-10; anti-IL-12 MKAT (Вектор Бест, Россия) для определения уровня ИЛ-12; anti-IL-13 MKAT (Вектор Бест, Россия) для определения уровня ИЛ-13; anti-TNFα MKAT (Вектор Бест, Россия) для определения уровня ФНОα; anti-TGFβ MKAT (Biosource, Канада) для определения уровня ТФРβ.
Статистическую обработку данных проводили на основе пакета статистических программ SPSS 17.0. Сравнительный анализ осуществлялся методом непараметрической статистики с использованием критерия Манна-Уитни в соответствии с распределением данных. Статистическое определение формулы для расчета ИПЦП проводилось путем составления уравнения линейной регрессии. Проверка положения о соответствии полученных данных разработанным критериям диагностики осуществлялась на основе расчета 95% доверительных интервалов в соответствии со стадиями фиброза печени METAVIR, определенных по результатам биопсии. Соотношения чувствительности и специфичности разработанных тестов по определению отдельных стадий фиброза печени устанавливались методом линейной регрессии с построением ROC-кривой и расчетом площади под кривой - AUROC [20, 21, 22].
Основные различия между цитокиновыми профилями у больных ХГС на разных стадиях фиброзного процесса выявлялись, в основном, при сопоставлении с группой здоровых лиц (таблица 1). В этом случае каждая стадия характеризовалась своими достоверными сдвигами, в которые были вовлечены практически все тестированные цитокины. Однако различия между самими стадиями были единичными и не позволяли идентифицировать отдельные стадии.
Все полученные данные были использованы для проведения регрессионного анализа с построением уравнения линейной регрессии. В результате был получен интегральный коэффициент цитокинового профиля (ИПЦП), который рассчитывался по формуле 1.
Формула 1
ИПЦП=5,052-0,192*[ИФНα]-0,006*[ИФНγ]+0,169*[ИЛ-10]+0,044*[ИЛ-12]-0,146*[ИЛ-13]-0,145*[ФНОα]-0,050*[ТФРβ],
где [ИФНα] - уровень ИФНα в пг/л в сыворотке крови больного, [ИФНγ] - уровень ИФНγ в пг/л в сыворотке крови больного, [ИЛ-10] - уровень ИЛ-10 в пг/л в сыворотке крови больного, [ИЛ-12] - уровень ИЛ-12 в пг/л в сыворотке крови больного, [ИЛ-13] - уровень ИЛ-13 в пг/л в сыворотке крови больного, [ФНОα] - уровень ФНОα в пг/мл в сыворотке крови больного, [ТФРβ] - уровень ТФРβ в пг/л в сыворотке крови больного.
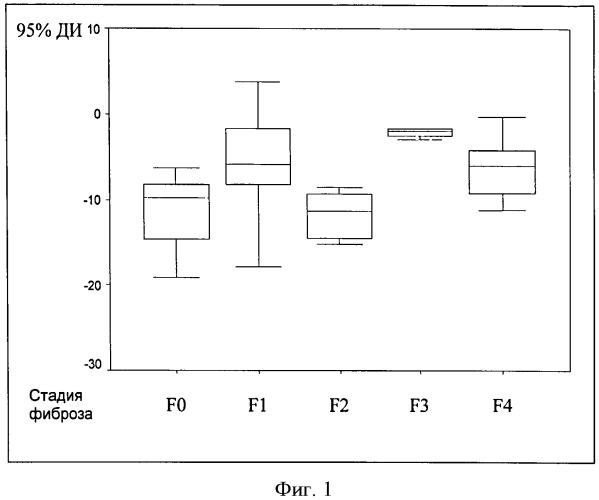
Результаты соответствующих расчетов ИПЦП по каждому пациенту, выраженные в диапазонах значения 95% доверительных интервалов этого коэффициента, представлены на фиг.1.
Как следует из фигуры, если бы исследование проводилось однократно при первичном обследовании больного, определить стадию фиброза печени было бы довольно затруднительно, поскольку данные на разных стадиях могут «наслаиваться» друг на друга. Однако при мониторинге больного и знании исходной стадии фиброза печени использование ИПЦП для оценки стадий является диагностически высоко эффективным.
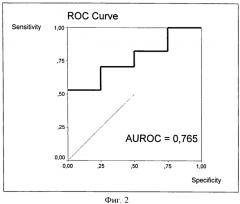
Так, в случае исходной стадии F0 рост ИПЦП выше -8 свидетельствует о дебюте фиброзных изменений в печени, то есть переходе фиброзного процесса на стадию F1. Диагностическое значение этого теста, оцененное путем построения ROC-кривой и вычисления площади под кривой (AUROC), довольно высоко, поскольку AUROC=0,765, как об этом свидетельствует фиг.2.
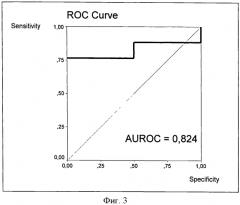
При исходной стадии F1 падение ИПЦП ниже -10 свидетельствует о переходе процесса на стадию выраженного фиброза печени F2, а диагностическое значение теста, судя по ROC-кривой, характеризующей этот переход по величине ИПЦП, выражается еще большей величиной AUROC=0,824 (фиг. 3).
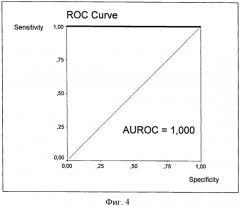
При исходной стадии F2 рост ИПЦП выше -3 свидетельствует о переходе фиброза на стадию значимого фиброза F3, как это видно на фиг. 4. Этот переход, оцененный по величине ИПЦП, также является диагностически значимым, при этом диагностическая точность теста приближается к абсолютной, поскольку AUROC=1 (переход из одного диапазона значений в другой наблюдается в 100% случаев).
При исходной стадии F3, наоборот, падение ИПЦП ниже -3 свидетельствует о развитии цирроза печени - F4 (фиг. 5) при довольно высоком AUROC=0,824.
Способ иллюстрируется следующими фигурами.
Фиг.1. 95% доверительные интервалы (95% ДИ) значений ИПЦП у больных ХГС на разных стадиях фиброза печени.
Фиг.2. ROC-кривая ИПЦП для перехода больных ХГС со стадии F0 на стадию F1.
Фиг.3. ROC-кривая ИПЦП для перехода больных ХГС со стадии F1 на стадию F2.
Фиг.4. ROC-кривая ИПЦП для перехода больных ХГС со стадии F2 на стадию F3.
Фиг.5. ROC-кривая ИПЦП для перехода больных ХГС со стадии F3 на стадию F4.
Способ иллюстрируется следующими клиническими примерами.
Пример 1.
Пациент А., 37 лет, наблюдается амбулаторно в гепатологическом центре на базе Инфекционной клинической больницы №1 с диагнозом «Хронический гепатит С выраженной активности, минимальный фиброз (стадия 1 по шкале METAVIR)».
По данным анамнеза впервые антитела к вирусу гепатита С выявлены в апреле 2011 г. при диспансеризации в поликлинике №49. Далее результат был подтвержден исследованием в мае 2011 г. на анти-ВГС и выявлением РНК ВГС. Пациент обратился в ИКБ №1, диагностирован генотип 1b ВГС. При биохимическом исследовании крови выявлен уровень активности АЛТ 47 ЕД/л. Лечения препаратами интерферона, пегилированного интерферона, рибавирина в течение жизни пациент не получал.
Сопутствующие другие хронические заболевания отрицает. Со слов пациента аллергии на лекарственные препараты нет. Из перенесенных заболеваний по данным анамнеза: сепсис в возрасте 2-х лет, (переливание плазмы крови), тонзилэктомия в 1983 г., ревматизм в возрасте 10 лет. Работает юристом.
Больному было рекомендовано выполнение биопсии печени 16.06.2011 г. По результатам биопсии диагностирован хронический гепатит С выраженной активности, минимальный фиброз (стадия 1 по шкале METAVIR).
Результаты исследования цитокинового статуса за 3 дня до выполнения биопсии печени (13.06.2011 г.): ИФНα - 4,75 пг/л, ИФНγ - 40 пг/л, ИЛ-10 - 11,67 пг/л, ИЛ-12 - 8,25 пг/л, ИЛ-13 - 74,5 пг/л, ФНОα - 0, ТФРβ - 8,72 пг/л. ИПЦП=-7,24, что соответствует стадии F1 и было подтверждено результатами последующей биопсии печени.
С января 2012 г. у больного отмечался подъем уровня АлАТ: 31.01.2012 г. - 163 ЕД/л и было рекомендовано проведение противовирусной терапии. Перед началом терапии в январе 2012 года пациент проходил всестороннее обследование. При физикальном обследовании - без особенностей. По данным УЗИ брюшной полости эхографическая картина соответствует диффузным изменениям печени по типу хронического гепатита вне обострения, КВР увеличен до 162 мм.
Результаты исследования цитокинового статуса: ИФНα - 8,93 пг/л, ИФНγ - 110 пг/л, ИЛ-10 - 14,11 пг/л, ИЛ-12 - 11,57 пг/л, ИЛ-13 - 83,8 пг/л, ФНОα - 5,04 пг/мл, ТФРβ - 11,0 пг/л. ИПЦП=-13,89, что свидетельствует в пользу перехода фиброза печени на стадию F2. Больному была назначена процедура транзиентной эластографии, на которой был установлен средний показатель плотности печени - 8,8 кПа, что подтверждало наличие у пациента стадии F2, свидетельствовало о прогрессировании фиброзного процесса за последние полгода и подтверждало диагностическое значение мониторирования пациента путем исследования его цитокинового профиля.
Пример 2.
Пациентка П., 31 год, наблюдается амбулаторно в гепатологическом центре на базе Инфекционной клинической больницы №1 с диагнозом «Хронический гепатит С умеренной активности». По данным анамнеза и выписки из стационара впервые антитела к вирусу гепатита С выявлены в августе 2010 г. в процессе обследования в гинекологическом отделении ГКБ №70. В сентябре 2010 г. выявлена РНК ВГС, генотип 1b. При углубленном обследовании в сентябре 2011 г. по результатам фиброэластографии печени диагностирована вторая стадия фиброза печени (7,8 кПА). Лечения препаратами интерферона, пегилированного интерферона, рибавирина в течение жизни пациентка не получала, не принимает никаких препаратов постоянно. За последние 6 мес. отмечается подъем уровня АлАТ: 16.08.2011 г. - 46 ЕД/Л, 05.01.2012 г. - 49 ЕД/Л. Сопутствующие, другие хронические заболевания отрицает. Со слов пациентки аллергии на лекарственные препараты нет. В течение жизни болела ОРВИ и гриппом, стационарное лечение проходила по поводу неполного самопроизвольного выкидыша при беременности малого срока. Работает менеджером.
Перед началом противовирусной терапии в августе 2011 года пациентка проходила всестороннее обследование. При физикальном обследовании - без особенностей. По данным УЗИ брюшной полости: эхопризнаки диффузных изменений печени по типу гепатоза-гепатита.
Результаты исследования цитокинового статуса (11.08.2011 г.): ИФНα - 2,66 пг/л, ИФНγ - 214 пг/л, ИЛ-10 - 7,70 пг/л, ИЛ-12 - 16,34 пг/л, ИЛ-13 - 8,1 пг/л, ФНОα - 6,8 пг/мл, ТФРβ - 7,2 пг/л. ИПЦП=-8,81, что соответствует стадии F2.
Через несколько месяцев пациентка стала получать терапию пегилированным ИФНα2b 1 раз в неделю подкожно и рибавирином в дозе, рассчитанной по массе тела. Вирусная нагрузка до лечения составляла 1,09×106 МЕ/мл РНК ВГС, через месяц терапии определялась вирусная нагрузка 7,14×102 МЕ/мл РНК ВГС. Таким образом, быстрый вирусологический ответ достигнут не был.
В феврале 2012 г. пациентке проводилась биопсия печени, была установлена стадия F2 по шкале METAVIR и параллельно было выполнено повторное исследование цитокинового статуса.
Результаты исследования цитокинового статуса (03.01.2012 г.): ИФНα - 10,23 пг/л, ИФНγ - 30 пг/л, ИЛ-10 - 10,56 пг/л, ИЛ-12 - 8,40 пг/л, ИЛ-13 - 78,5 пг/л, ФНОα - 0, ТФРβ - 11,04 пг/л. ИПЦП=-8,57, что соответствует стадии F2. Как видно, уровни отдельных цитокинов, будучи лабильными показателями, у данной больной через 6 месяцев довольно изменились, но величина ИПЦП, несмотря на это, оставалась стабильной и по-прежнему свидетельствовала о наличии у больной стадии F2.
Пример 3.
Пациент К., 43 года, наблюдается амбулаторно в гепатологическом центре на базе Инфекционной клинической больницы №1 с диагнозом «Хронический гепатит С выраженной активности, выраженный фиброз (стадия 3 по шкале METAVIR)». По данным анамнеза впервые антитела к вирусу гепатита С выявлены в ноябре 2010 г. при обследовании в ГКБ №57, где пациент проходил лечение по поводу токсико-аллергического дерматита. При биохимическом исследовании крови выявлен высокий уровень активности АЛТ - более 600 мкмоль/мин.л. В январе 2011 г. выявлена РНК ВГС, генотип 1b.
Данные определения стадии фиброза печени были противоречивыми. При углубленном обследовании по данным транзиентной эластографии выявлен фиброз 4 стадии (16,3 кПа). По результатам биопсии печени диагностирован хронический гепатит С, значительный фиброз (стадия 3 по шкале METAVIR).
Для решения спорного вопроса было проведено определение цитокинового статуса и получен следующий результат: ИФНα - 12,5 пг/л, ИФНγ - 55,0 пг/л, ИЛ-10 - 18,2 пг/л, ИЛ-12 - 6,0 пг/л, ИЛ-13 - 21,3 пг/л, ФНОα - 7,3 пг/мл, ТФРβ - 5,0 пг/л. ИПЦП=-1,73, что соответствует стадии F3 и подтверждает данные биопсии, но не транзиентной эластографии.
Результаты определения уровней цитокинов на разных стадиях фиброза печени в сопоставлении с контролем представлены в таблице 1.
| Таблица 1 | |||||
| Средние значения показателей уровней цитокинов в крови больных ХГС на разных стадиях фиброза печени и у здоровых лиц | |||||
| Стадия фиброза печени | Тестированные цитокины | Больные ХГС | Здоровые люди, n2=17 | p1 | p2 |
| ИФНα, пг/л | 5,60±4,63 | 7,70±3,87 | 0,531 | - | |
| ИФНγ, пг/л | 45,0±90,0 | 85,6±56,0 | 0,136 | - | |
| F0 | ИЛ-10, пг/л | 8,16±1,62 | 12,3±3,87 | 0,066 | - |
| n1=4 | ИЛ-12, пг/л | 10,6±1,59 | 12,7±6,69 | 0,964 | - |
| ФНОα, пг/мл | 5,34±4,05 | 2,45±3,36 | 0,209 | - | |
| ИЛ-13, пг/л | 98,8±29,6 | 64,6±40,2 | 0,044 | - | |
| ТФРβ, пг/л | 5,90±0,84 | 7,06±2,08 | 0,234 | - | |
| ИФНα, пг/л | 8,08±4,03 | 7,70±3,87 | 0,547 | 0,363 | |
| ИФНγ, пг/л | 27,4±35,7 | 85,6±56,0 | 0,001 | 0,870 | |
| F1 | ИЛ-10, пг/л | 10,9±5,08 | 12,3±3,87 | 0,178 | 0,442 |
| n1=25 | ИЛ-12, пг/л | 10,1±5,10 | 12,7±6,69 | 0,095 | 0,617 |
| ФНОα, пг/мл | 3,33±5,39 | 2,45±3,36 | 0,984 | 0,735 | |
| ИЛ-13, пг/л | 57,0±47,1 | 64,6±40,2 | 0,890 | 0,158 | |
| ТФРβ, пг/л | 10,6±2,25 | 7,06±2,08 | <0,00 | 0,520 | |
| ИФНα, пг/л | 8,62±4,27 | 7,70±3,87 | 0,591 | 0,427 | |
| ИФНγ, пг/л | 92,0±67,7 | 85,6±56,0 | 0,941 | 0,221 | |
| F2 | ИЛ-10, пг/л | 12,0±3,41 | 12,3±3,87 | 0,924 | 0,958 |
| n1=7 | ИЛ-12, пг/л | 12,6±3,43 | 12,7±6,69 | 0,531 | 0,634 |
| ФНОα, пг/мл | 2,96±3,49 | 2,45±3,36 | 0,921 | 0,777 | |
| ИЛ-13, пг/л | 65,0±38,2 | 64,6±40,2 | 0,530 | 0,751 | |
| ТФРβ, пг/л | 10,5±1,46 | 7,06±2,08 | 0,002 | 0,610 | |
| ИФНα, пг/л | 10,4±2,54 | 7,70±3,87 | 0,035 | 0,999 | |
| F3 | ИФНγ, пг/л | 52,4±4,45 | 85,6±56,0 | 0,082 | 0,564 |
| n1=9 | ИЛ-10, пг/л | 18,8±14,4 | 12,3±3,87 | 0,178 | 0,564 |
| ИЛ-12, пг/л | 8,93±2,80 | 12,7±6,69 | 0,049 | 0,564 | |
| ФНОα, пг/мл | 7,17±3,44 | 2,45±3,36 | 0,011 | 0,999 | |
| ИЛ-13, пг/л | 41,1±44,3 | 64,6±40,2 | 0,145 | 0,999 | |
| ТФРβ, пг/л | 5,77±2,56 | 7,06±2,08 | 0,124 | 0,043 | |
| ИФНα, пг/л | 10,1±4,40 | 7,70±3,87 | 0,210 | 0,621 | |
| ИФНγ, пг/л | 10,6±24,8 | 85,6±56,0 | 0,001 | 0,348 | |
| F4 | ИЛ-10, пг/л | 11,8±3,31 | 12,3±3,87 | 0,607 | 0,399 |
| n1=21 | ИЛ-12, пг/л | 13,0±7,76 | 12,7±6,69 | 0,999 | 0,999 |
| ФНОα, пг/мл | 3,28±4,56 | 2,45±3,36 | 0,714 | 0,939 | |
| ИЛ-13, пг/л | 55,6±36,0 | 64,6±40,2 | 0,934 | 0,573 | |
| ТФРβ, пг/л | 10,7±3,42 | 7,06±2,08 | 0,001 | 0,505 | |
| Примечание: p1 - вероятность различий между показателями у больных и здоровых людей, p2 - вероятность различий между показателями у больных людей на разных стадиях фиброза с предыдущей стадией, n1 - число больных, n2 - число здоровых, серым цветом обозначена достоверность различий по критерию Манна-Уитни при p<0,05 |
Литература
1) Fung J, Lai CL, Yuen MF (2009) Hepatitis В and С virus-related carcinogenesis. Clin Microbiol Infect 15: 964-970.
2) Pham TN, Michalak TI (2008) Occult persistence and lymphotropism of hepatitis С virus infection. World J Gastroenterol 14: 2789-2793.
3) Craxi A (2011) EASL Clinical Practice Guidelines: management of hepatitis С virus infection. J Hepatol 55: 245-264.
4) Stauber RE, Lackner С (2007) Noninvasive diagnosis of hepatic fibrosis in chronic hepatitis C. World J Gastroenterol 13: 4287-4294.
5) Mysorekar VV, Rao SG, Mahadeva КС. Liver histology in patients on hemodialysis with chronic hepatitis С viral infection // Indian J Pathol Microbiol. 2008 Apr-Jun; 51(2): 182-5.
6) Yeshua H, Oren R. Non invasive assessment of liver fibrosis // Ann Transplant. 2008; 13(2): 5-11.
7) Stauber, R.E. Noninvasive diagnosis of hepatic fibrosis in chronic hepatitis С / R.E. Stauber, C. Lackner // World J. Gastroenterol. - 2007. - Vol.13, N32. - P.4287-4294.
8) Zhang, Y. X. Noninvasive assessment of liver fibrosis with combined serum aminotransferase/platelet ratio index and hyaluronic acid in patients with chronic hepatitis В / Y.X. Zhang, W.J. Wu, Y.Z. Zhang et al. // World J. Gastroenterol. - 2008. - Vol.14, N46. - P.7117-7121.
9) Castéra, L. Prospective comparison of two algorithms combining non-invasive methods for staging liver fibrosis in chronic hepatitis С / L. Castéra, G. Sebastiani. B. Le Bail et al. // J. Hepatol. - 2010. - Vol.52, N2. - P.191-198.
10) Dascalu, D. N. Non-invasive methods for hepatic fibrosis evaluation / D.N. Dascalu, M. Deac // Acta Medica Transilvanica. - 2010. - Vol.2, N3. - P.244-246.
11) Галимова С.Ф., Надинская М.Ю., Маевская М.В., Ивашкин В.Т. Новые данные о диагностике и течении фиброза печени. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2001. - Т.11. - N4. - C.22-28.
12) Пинцани M. Эволюция фиброза печени: от гепатита к циррозу. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2002. - Т.12. - №5. - С.4-9.
13) Weng HL, Liu Y, Chen JL et al. The etiology of liver damage imparts cytokines transforming growth factor betal or interleukin-13 as driving forces in fibrogenesis // Hepatology. 2009 Jul; 50(1): 230-43.
14) Wynn T.A. Cellular and molecular mechanisms of fibrosis // J. Pathol. - 2008. - Vol.214, N2. - P.199-210.
15) Самоходская Л.М. Способ прогнозирования прогрессирующего течения хронического гепатита С (развития цирроза печени) путем анализа комбинации полиморфизмов генов цитокинов / Л.М. Самоходская, С.М. Абдуллаев, Ю.И. Целищева и соавт. // Патент РФ 2317335, 2008.
16) Wright, M. Bayesian model for the prognosis of hepatitis С virus infectionark / M. Wright, M. Thursz // Patent GB WO 2004086031 (A2), publ. 2004-10-07.
17) Ющук Н.Д. Способ оценки фиброза печени у больных хроническим вирусным гепатитом С / Н.Д. Ющук, И.П. Балмасова, О.О. Знойко и соавт. // Патент РФ №2416794, 2011.
18) Скляр Л.Ф. Способ мониторинга фиброза печени у больных хроническим гепатитом С (ХГС) / Л.Ф. Скляр, Е.В. Маркелова, О.Г. Полушин, Е.В. Алейникова // Патент РФ 2309406, 2007.
19) Bedossa, P. An algorithm for the grading of activity in chronic hepatitis С / P. Bedossa, T. Poynard. The METAVIR Cooperative Study Group / P. Bedossa // Hepatology, 1996; 24(2): 289-293.
20) Петри А. Наглядная медицинская статистика. 2-е издание / А. Летри, К. Сэбин // М.: ГЭОТАР-МЕДИА, 2009; 168 с.
21) Altman, D.G. Statistics Notes: Diagnostic tests 1: sensitivity and specificity / D.G. Altman, J.M. Bland // BMJ, 1994; 308 (6043): 1552.
22) Long, E.R., De Long D.M., Clarke-Pearson D.L. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach / E.R. Long, D.M, De Long, D.L. Clarke-Pearson // Biometrics, 1988; 44(3): 837-845.
Способ мониторинга фиброзного процесса в печени у больных хроническим гепатитом С, включающий исследование содержания в сыворотке крови интерферонов α и γ, интерлейкинов-10, -12, -13, фактора некроза опухолей α, трансформирующего фактора роста β, отличающийся тем, что рассчитывают Интегральный Показатель Цитокинового Профиля (ИПЦП) по формуле: ИПЦП=5,052-0,192*[ИФНα]-0,006*[ИФНγ]+0,169*[ИЛ-10]+0,044*[ИЛ-12]-0,146*[ИЛ-13]-0,145*[ФНОα]-0,050*[ТФРР], где [ИФНα] - уровень ИФНα в пг/л в сыворотке крови больного, [ИФНγ] - уровень ИФНγ в пг/л в сыворотке крови больного, [ИЛ-10] - уровень ИЛ-10 в пг/л в сыворотке крови больного, [ИЛ-12] - уровень ИЛ-12 в пг/л в сыворотке крови больного, [ИЛ-13] - уровень ИЛ-13 в пг/л в сыворотке крови больного, [ФНОα] - уровень ФНОα в пг/мл в сыворотке крови больного, [ТФРβ] - уровень ТФРβ в пг/л в сыворотке крови больного; и при при исходной стадии F0 рост ИПЦП>-8 оценивают как переход на стадию F1, при исходной стадии F1 падение ИПЦП<-10 - как переход на стадию F2, при исходной стадии F2 рост ИГЩП>-3 - как переход фиброза на стадию F3, при исходной стадии F3 падение ИПЦП<-3 - как развитие цирроза печени, при этом стадии фиброза печени оценивают по шкале METAVIR.