Способ дополнительного электронноплотного контрастирования нуклеиновых кислот в ядре и цитоплазме при гистохимическом выявлении катионов натрия в ультраструктурах клеток и тканей
Иллюстрации
Показать всеИзобретение относится к области медицины и биологии, а именно к способу дополнительного электронноплотного контрастирования кислых групп биомолекул при гистохимическом выявлении катионов натрия в ультраструктурах клеток и тканей легких и трахеи. Сущность способа состоит в том, что кусочки тканей фиксируют, проводят отмывку поверхности в бидистиллированной воде, далее помещают в раствор реагента, который содержит 1 мл 4% тетраоксида осмия и 8 мл 2% гексагидроксоантимоната калия. В течение 4 часов кусочки тканей окрашивают при энергичном встряхивании, промывают в бидистиллированной воде. Далее кусочки тканей препарируют путем разрезания на более тонкие, обезвоживают, изготовляют полутонкие и ультратонкие срезы, которые исследуют с помощью трансмиссионного электронного микроскопа, с последующей компьютерной обработкой с обнаружением диффузного избирательного окрашивания кислых клеточных ультраструктур и межклеточного вещества. Использование заявленного способа позволяет эффективно проводить дополнительное электронноплотное контрастирование кислых групп биомолекул при гистохимическом выявлении катионов натрия в ультраструктурах клеток и тканей легких и трахеи. 5 ил., 1пр.
Реферат
Изобретение относится к области медицины и биологии, гистологического, цитологического, физиологического исследования тканей и клеток органов человека и животных, а так же к цитологическим и гистологическим методам исследования.
Известны способы гистохимического окрашивания натрия хлорида тканей и клеток органов, которое осуществляется с помощью насыщенного водного раствора гексагидроксоантимоната калия (K[Sb(OH)6]), а также 2% водного раствора OsO4 /Г. Гайер. Электронная гистохимия. - М.: Мир. - 1974. - 488 с./. Способы окрашивания клеток водным раствором антимоната и осмиевой кислоты необходимы для исследования биологических объектов с помощью электронного микроскопа, так как продукты окрашивания биологических структур, содержащих ионы натрия, в этих способах становятся электронно-плотными.
Избыток тетраоксида осмия препятствует этой гистохимической реакции, так как фосфолипиды, содержащие полиненасыщенные жирные кислоты, приобретают высокую электронную плотность. Дополнительное контрастирование нуклеиновых кислот, содержащихся в ядре и цитоплазме клеток уранилацетатом, цитратом свинца или др., так же препятствует гистохимическому выявлению ионов натрия с помощью антимоната. Поэтому основным недостатком данных способов является то, что они осуществляются без синтеза координационных соединений OsO4 (осмиевая кислота) с гексагидроксоантимонатом калия, которое происходит при нагревании водного раствора этих веществ в водяной бане, а так же последующей очистки растворенных при нагревании координационных соединений OsO4 в воде, ацетоном от избытка тетраоксида осмия, который плохо растворим в воде и в органических растворителях.
Близким по существу являются способы гистохимического выявления натрия хлорида и ионов кальция в клетках и тканях, которые осуществляются с помощью антимоната /Komnik H. Electron mikroscopische Lokalisation von Na+ and CI - in Zellen and Geweben // Protoplasma. - 1962. - V.55. - P.414-418. Mariani P., Tolomio C, Baldan B., and Braghetta P. Cell wall ultrastructure and cation localization in some benthic marine algae // Phycologia. - 1990. - Vol.29. - No. 2. - P.253-262/.
Существенным отличием заявленного способа от этого является то, что в нем осуществляется синтез и очистка: 1) основных координационных соединений тетраоксида осмия, которые необходимы для гистохимического окрашивания клеток и тканей и 2) K2CO3, который необходим для нейтрализации красящего раствора. Для этого используется в восьмикратном молярном отношении к осмиевой кислоте 0,1 M раствор гексагидроксоантимоната калия (K[Sb(OH)6]). При этом наличествует отсутствие осмиофилии цитоплазматических мембран, при продолжительности окрашивания в течение 4 и более часов.
Близкими по техническому результату являются способы гистохимического окрашивания основных координационных соединений тетраоксида осмия с тиохолинхлоридом, диметиламиноэтилтиолом, несимметричным диметилэтилендиамином, тетраметилэтилендиамином, тетраметилэтелиндиамин, которые используются для гистохимического выявления веществ с кислой реакцией (ядерный хроматин, ядрышки, рибосомы, гликозаминогликаны и др.) в тканях и клетках /Гайер Г. Электронная гистохимия. - М. Мир. 1974. - 488 с./.
Существенным отличием заявленного способа от этого является то, что в качестве лиганда используется насыщенный водный раствор гексагидроксоантимоната калия (K[Sb(OH)6]), в результате чего синтезируется Os[Sb(OH)6]4 и K2CO3, а так же то, что для гистохимического выявления натрия хлорида, ионов кальция, ионов неорганического железа используется K[Sb(OH)6].
Близким по способу осуществления является способ получения пироантимоната ртути (II) /Ширвинский А.Е. RU 2036149 C1/, который используется в неорганической химии при получении соединений сурьмы и ртути. Сущность способа: растворы уксуснокислой ртути (II) и гидроксида калия добавляют к раствору гексагидроксоантимоната калия. Молярное соотношение K[Sb(OH)6]:Hg(CH3COO)2:KOH=2:(2-3):(6-8). Перемешивают и нагревают в течение 10-15 мин. Осадок отделяют, промывают его горячей водой и сушат на воздухе при 100-120°C. Время сушки 15-60 мин. Существенным отличием заявленного способа от этого является то, что образование основного координационными соединениями тетраоксида осмия - Os[Sb(OH)6]4 и K2CO3, окончательно образуются в присутствии NaCl и ионов натрия (Na+), кальция (Ca+), которые содержатся в исследуемых органах и тканях организма.
Задачей заявленного способа является дополнительное докрашивание нуклеиновых кислот в ядре и цитоплазме, которое осуществляется путем электронноплотного контрастирования клеток, необходимое для гистохимического выявления катионов натрия в ультраструктурах.
Существо заявленного способа заключается в том, что с помощью трансмиссионного электронного микроскопа изучаются ультратонкие срезы тканей и клеток, фиксированных в гистологическом фиксаторе в течение 1 часа, содержащем 2% водный раствор гексагидроксоантимоната калия, а затем с целью гистохимического обнаружения фосфатных групп, содержащихся в нуклеиновых кислотах, окрашиваются водным раствором основного координационного соединения тетраоксида осмия - Os[Sb(OH)6]4, содержащего K2CO3, которые окончательно образуются в присутствии NaCl и ионов натрия (Na+), кальция (Ca+), которые содержатся в исследуемых органах и тканях организма. Реакция гистохимического окрашивания происходит при молярном отношении реагентов внутри кусочков тканей органов, содержащих натрий хлорид др. и реагентов в инкубационной среде K[Sb(OH)6]:OsO4, которое равно 1:(1-8):(1-10).
Предложенный нами способ включает синтез основного координационного соединения осмия взаимодействия OsO4 и осмиевой кислоты с гексагидроксоантимонатом калия, который окончательно происходит в тканях, органах, в клетках которых содержится при обеспечении доступа атмосферного воздуха CO2, который поглощается K2O. После фиксации кусочков органов в гистологическом фиксаторе, содержащем гексагидроксоантимонат калия, проводится окрашивание кусочков органов основным координационным соединением осмия, отмывка в дистиллированной воде, обезвоживание в спирте или ацетоне, заключение кусочков в аралдит-эпон, изготовление ультратонких срезов, исследование тканей и клеток с помощью трансмиссионного электронного микроскопа, компьютерной обработкой электроннограмм.
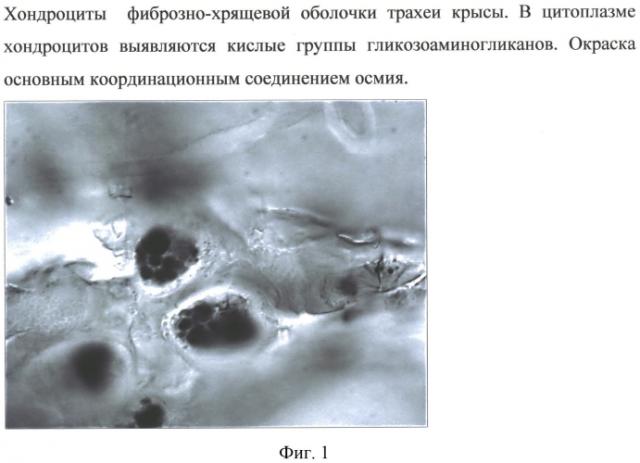
Изобретение иллюстрировано: на фиг. №1 - Хондроциты фиброзно-хрящевой оболочки трахеи крысы. В цитоплазме хондроцитов выявляются кислые группы гликозоаминогликанов. Окраска основным координационным соединением осмия, фиг.2 - Респираторный отдел легких крысы. Клеточные элементы межальвеолярной перегородки, избирательное окрашивание гетерохроматина, эухроматина, ядрышка, перихроматиновых, интерхроматиновых гранул основным координационным соединением осмия, фиг.3 - Стенка альвеолы легких крыс. В альвеолоцитах обнаруживаются электронно-плотные гранулы кальций дигидрофосфата. В межклеточном пространстве - отложение диффузного электронноплотного материала натрий дигидрофосфата, фиг.4 - Интенсивное контрастирование координационным соединением осмия цитоплазмы и ядра клеток соединительной ткани межальвеолярной перегородки. В межклеточном пространстве наблюдается мелкозернистый преципитат антимоната натрия, фиг.5 - Отложения натрия дигидрофосфата в резервном сурфактанте. Ультратонкий срез легких крыс.
Способ осуществляется в три этапа, следующих друг за другом:
1. В начале способа к 2% водному раствору OsO4, в восьмикратном молярном отношении добавляют насыщенный 2% (0,1 М) водный раствор гексагидроксоантимоната калия K[Sb(OH)6]. Предварительно смешиваемые растворы каждый в отдельности в течение 30 минут нагревают на водяной бане при 100°C. Затем растворы смешивают, а затем постепенно охлаждают при постоянном энергичном встряхивании для обеспечения доступа атмосферного воздуха, богатого CO2, который поглощается K2O.
2. С целью химической коагуляции белков, маленькие (5 мм толщиной, 5 мм длиной) кусочки ткани органов человека или животного фиксируются в гистологическом фиксаторе (глутаральдегид) в течение 1 часа, затем с помощью 2% водного раствора гексагидроксоантимоната калия доводят значения фиксатора до pH 7,4 (добавляют по каплям). После этого поверхность кусочков органов быстро отмывается от фиксатора сначала в бидистиллированной воде, а затем в 2% водном растворе гексагидроксоантимоната калия. Затем в течение 4 часов и более, кусочки тканей органов окрашиваются в 4% растворе основного координационного соединения осмия и K2CO3 на бидистиллированной воде. Окрашивание производится при постоянном энергичном встряхивании для обеспечения доступа атмосферного воздуха, богатого CO2, который поглощается K2O. После окрашивания кусочки тканей препарируются путем разрезания на более тонкие (1-2 мм толщиной, 2-2,5 мм длиной), затем промываются в бидистиллированной воде, обезвоживаются в этиловом спирте или ацетоне и заливаются в аралдит-аралдит.
3. На этом этапе, на ультрамикротоме изготавливаются ультратонкие срезы тканей, которые изучаются с помощью трансмиссионного электронного микроскопа с последующей компьютерной обработкой электроннограмм с помощью 3D графики.
Пример использования.
Предложенный способ дополнительного электронноплотного контрастирования кислых групп в биомолекулах при гистохимическом выявления катионов натрия в ультраструктурах клеток и тканей был использован для гистохимического исследования респираторного отдела легких, а также трахеи интактных крыс. Маленькие (5 мм толщиной и 10 мм длиной) кусочки тканей легких и трахеи фиксировали в течение 1 часа в 4% растворе глутаральдегида, в который по каплям добавляли 2% гексагидроксоантимонатом калия в целях достижения физиологических значений pH раствора, равного 7,4. Быстро промывают сначала в бидистиллированной воде, а затем в 2% водном растворе гексагидроксоантимоната калия. Два кусочка (5 мм толщиной и 5 мм длиной) помещались в раствор реагента, который содержал 1 мл 4% тетраоксида осмия и 8 мл 2% гексагидроксоантимонатом калия. Объем кусочков органов эмпирически определяется тем, что концентрация натрия хлорида и катионов натрия, кальция и др. в органе приблизительно равна в 0,1 M. В течение 4 часов кусочки тканей органов окрашиваются при энергичном встряхивании в 2% растворе основного координационного соединения осмия с гексагидрооксоантимоната калия на бидистиллированной воде. После окрашивания кусочки быстро промываются в бидистиллированной воде. Затем кусочки тканей препарируются путем разрезания на более тонкие (1-2 мм толщиной, 2-2,5 мм длиной). С целью обезвоживания кусочки тканей проводятся через серию спиртов, ацетон и затем заливаются в аралдит-эпон. Затем на ультрамикротоме LKB NOVA были изготовлены полутонкие и ультратонкие срезы.
В случае изучения полутонких срезов волокнисто (фиброзно)-хрящевой оболочки трахеи и легких обнаруживается высокоинтенсивное гранулярное окрашивание цитоплазмы хондроцитов и хондробластов, клеток альвеол и межальвеолярных перегородок, которые богаты гликозаминогликанами (Фиг.1).
При исследовании ультратонких срезов легких с помощью трансмиссионного электронного микроскопа FEI Tecnai G2 Spirit было обнаружено диффузное избирательное окрашивание кислых клеточных ультраструктур и межклеточного вещества, а так же отсутствие осмиофилии цитоплазматических мембран. В ядрах клеток обнаруживается избирательное окрашивание гетерохроматина, эухроматина, ядрышка, перихроматиновых, интерхроматиновых гранул, для которых характерно повышенное содержание ионов фосфорной кислоты
В цитоплазме клеток альвеол обнаруживается слабоокрашенный или умеренно электронноплотный диффузный материал, слабоконтрастный гранулярный материал 0,01-0,05 мкм и единичные электронноплотные гранулы кальция дигидроортофосфата Ca(H2PO4)2 размером 0,09-0,3 мкм (Фиг.3). В цитоплазме эритроцитов, которые содержатся в капиллярах легких, отмечается слабое окрашивание цитоплазмы, обнаруживаются очень маленькие электронно-плотные гранулы размером 0,01-0,02 мкм (Фиг.2).
Заключение о наличии включений кальция дигидроортофосфата Ca(H2PO4)2 в клетках легких и эритроцитов сделано на основании ранее проведенного гистохимического исследования легких крыс, которое осуществлялось с помощью ализаринового красного C /Зиновьев С.В. Гистохимическая характеристика венозного русла респираторного отдела легких экспериментальных животных, подвергнутых хроническому переохлаждению, после введения в организм дигидрокверцетина // Бюллетень физиологии патологии дыхания. - №45. С.57-61/. В межклеточном веществе и в цитоплазме стенки аэрогематического барьера обнаруживаются скопления нейтральных липидов, к которым прилегают диффузные скопления электронноплотного материала размером 1-4 мкм (Фиг.2, 3).
На поверхности альвеолоцитов первого типа присутствует диффузно окрашенный слой сурфактанта, который имеет низкую электронную плотность. В сурфактанте различается два слоя гипофазы. На поверхности сурфактанта обнаруживаются единичные очень мелкие гранулы осмиофильного материала (Фиг.2, 3).
В альвеолах обнаруживаются окрашенный координационным соединением осмия материал, неупорядоченно расположенный между субклеточных структур в межклеточном веществе, в резервном сурфактанте, в скоплениях нейтральных липидов, который содержит молекулы натрия дегидроортофосфата (NaH2PO4), обладающий умеренной электронной плотностью, представленный гранулами размером 0,05-0,3 мкм. Края этих гранул размытые, с нечеткими контурами, при этом часть из них имеют округлую или звездчатую форму (Фиг.5).
Программное обеспечение трансмиссионного электронного микроскопа FEI Tecnai G2 Spirit позволяет провести компьютерную обработку электроннограмм. При предобработке электроннограмм с помощью 3D графики обнаруживаются кристаллы преципитата антимоната, который содержат натрий хлорид и имеет сложный план строения. При увеличении электронного микроскопа более 30000 раз, в случае компьютерной обработки электроннограмм наблюдается, что в составе цитоплазматических вакуолей и в межклеточном пространстве обнаруживаются мелкозернистый преципитат гексагидроксоантимоната калия (0,0001-0,005 мкм) с низкой или умеренной электронной плотностью, который образуется в результате взаимодействия с натрием хлоридом (Фиг.3, 4).
Способ позволяет синтезировать, очистить ацетоном основные координационные соединения осмия - Os[Sb(OH)6]4 от избытка тетраоксида осмия, которые используются для гистохимического выявления нуклеиновых кислот в присутствии NaCl и ионов натрия (Na+), кальция (Ca+), которые содержатся в исследуемых органах и тканях организма.
Технический результат использования способа состоит в том, что достигается качественное окрашивание тканей, клеток за счет подавления окрашивания тетраоксидом осмия фосфолипидов, с целью выявления нуклеиновых кислот (ДНК и РНК), а так же натрия хлорида, катионов кальция, железа и др., что позволяет провести достоверное ультраструктурное исследование ультратонких срезов с помощью трансмиссионного электронного микроскопа.
Таким образом, предложенный нами способ можно использовать для электронно-микроскопического исследования ультраструктур клеток и межклеточного вещества органов и тканей человека и животных, которые имеют кислые значения pH среды, обловленные присутствием ионов фосфорной кислоты, серной кислоты, а также молекул натрия хлорида, или катионов натрия.
Способ дополнительного электронноплотного контрастирования кислых групп биомолекул при гистохимическом выявлении катионов натрия в ультраструктурах клеток и тканей легких и трахеи, характеризующийся тем, что кусочки 5 мм толщиной и 10 мм длиной тканей легкого и трахеи фиксируют в течение 1 часа в 4% растворе глутаральдегида, в который по каплям добавляли 2% гексагидроксоантимонат калия для достижения pH 7,4, проводят отмывку поверхности от фиксатора в бидистиллированной воде, а затем в 2% водном растворе гексагидроксоантимоната калия, кусочки 5 мм толщиной и 5 мм длиной помещают в раствор реагента, который содержит 1 мл 4% тетраоксида осмия и 8 мл 2% гексагидроксоантимоната калия, в течение 4 часов кусочки тканей окрашивают при энергичном встряхивании в 2% растворе основного координационного соединения осмия с гексагидроксоантимонатом калия на бидистиллированной воде, промывают в бидистиллированной воде, затем кусочки тканей препарируют путем разрезания на более тонкие 1-2 мм толщиной 2-2,5 мм длиной, обезвоживают, проводят через серию спиртов, ацетон и затем заливают в аралдит-эпон, затем на ультрамикротоме изготовляют полутонкие и ультратонкие срезы, которые исследуют с помощью трансмиссионного электронного микроскопа, с последующей компьютерной обработкой электроннограмм с помощью 3D графики с обнаружением диффузного избирательного окрашивания кислых клеточных ультраструктур и межклеточного вещества.