Способ определения чувствительности клеток рака легкого к цисплатину на основании уровней экспрессии маркерных генов и набор для его осуществления
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины, молекулярной биологии и биотехнологии. Предложен способ определения чувствительности клеток рака легкого к цисплатину, включающий определение уровня экспрессии генов MLH1, ERCC1, DDB2, AKR1B1, FTL в зависимости от IC50 цисплатина для известных клеточных линий, построение градуировочной прямой зависимости IC50 цисплатина для этих клеточных линий от полученного уровня экспрессии указанных генов и гибридизацию на микрочипе. Предложен также набор олигонуклеотидных зондов, представленных SEQ ID NO: 9-13. Предложенная группа изобретений обеспечивает эффективные средства и методы для определения чувствительности клеток рака легкого к цисплатину. 2 н.п. ф-лы, 1 ил., 2 табл., 3 пр.
Реферат
Область техники
Изобретение относится к области молекулярной медицины, молекулярной биологии и биотехнологии, а именно к определению лекарственной устойчивости клеток и опухолей, к способам обнаружения специфических РНК-мишеней и биологическим микрочипам.
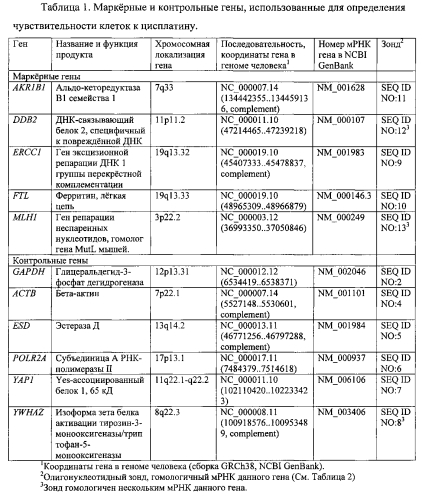
Рак легкого занимает одно из первых мест в мире по заболеваемости и смертности среди всех онкологических заболеваний. В ряде регионов России смертность от РЛ превышает самые высокие мировые показатели, местами достигая 44 случаев у женщин и 81 у мужчин на 100000 населения в год [Мукерия, А.Ф. и Д.Г. Заридзе, Эпидемиология и профилактика рака легкого. Вестник РОНЦ им. Н.Н. Блохина РАМН, 2010. 21(3): 3-13]. К основным способам лечения рака наряду с хирургическими и лучевыми способами относится химиотерапия. Известно, что клетки опухоли часто проявляют устойчивость к лекарственным препаратам (например, к цисплатину), что препятствует эффективному лечению. Поэтому актуальной задачей современной экспериментальной онкологии является создание новых молекулярно-биологических тестов, которые позволяли бы изучать отдельные механизмы хеморезистентности опухолевой клетки и на этой основе разрабатывать оптимальные режимы химиотерапии для больных раковыми заболеваниями и, в частности, рака легкого. Существуют данные о корреляции устойчивости клеток к цисплатину с уровнем экспрессии (количеством мРНК) ряда генов [Dan, S., М. Shirakawa, Y. Mukai, et al., Identification of candidate predictive markers of anticancer drug sensitivity using a panel of human cancer cell lines. Cancer Sci, 2003. 94(12): 1074-82, Dan, S., T. Tsunoda, O. Kitahara, et al., An integrated database of chemosensitivity to 55 anticancer drugs and gene expression profiles of 39 human cancer cell lines. Cancer Res, 2002. 62(4): 1139-47]. Одним из наиболее употребимых способов определения уровней экспрессии генов являются способы, основанные на микрочипах - твердых подложках, на которых в определенном порядке ковалентно иммобилизованы фрагменты ДНК или химически синтезированные олигонуклеотиды. Настоящее изобретение представляет собой способ определения чувствительности клеток рака легкого к цисплатину на основании уровней экспрессии маркерных генов AKR1B1, DDB2, ERCC1, FTL, MLH1.
Уровень техники
Известен способ прямого определения чувствительности клеток к цитостатикам способом МТТ [Alley, М.С., D.A. Scudiero, A. Monks, et al., Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Res, 1988. 48(3): 589-601], в котором чувствительность клеток определяют по дозе цитостатика, при которой в живых остается 50% клеток в культуре (IC50). Для использования этого способа необходимо специальное оборудование (стерильные боксы, одноразовые стерильные планшеты и матрасы, оборудование для стерилизации многоразовых инструментов, СО2-инкубаторы, микроскопы, культуральные среды и другое) для культивирования эукариотических клеток. Такое оборудование есть не в каждой лаборатории.
Известно, что чувствительность клеток к цисплатину коррелирует с уровнем экспрессии (количеством мРНК) целого ряда генов. В частности, были показаны корреляции для генов AKR1B1, DDB2, ERCC1, FTL, MLH1 (Таблица 1) [Almeida, G.M., T.L. Duarte, Р.В. Farmer, et al., Multiple end-point analysis reveals cisplatin damage tolerance to be a chemoresistance mechanism in a NSCLC model: implications for predictive testing. Int J Cancer, 2008. 122(8): 1810-9, Dan, S., M. Shirakawa, Y. Mukai, et al., Identification of candidate predictive markers of anticancer drug sensitivity using a panel of human cancer cell lines. Cancer Sci, 2003. 94(12): 1074-82, Dan, S., T. Tsunoda, O. Kitahara, et al., An integrated database of chemosensitivity to 55 anticancer drugs and gene expression profiles of 39 human cancer cell lines. Cancer Res, 2002. 62(4): 1139-47, Gyorffy, В., P. Surowiak, O. Kiesslich, et al., Gene expression profiling of 30 cancer cell lines predicts resistance towards 11 anticancer drugs at clinically achieved concentrations. Int J Cancer, 2006. 118(7): 1699-712, Seve, P. and C. Dumontet, Chemoresistance in non-small cell lung cancer. Curr Med Chem Anticancer Agents, 2005. 5(1): 73-88].
Однако в литературе не описаны способы расчета показателя IC50 цисплатина в зависимости от уровня экспрессии генов AKR1B1, DDB2, ERCC1, FTL, MLH1 (Таблица 1). В настоящее время для определения количества мРНК в клетках используют ПЦР в реальном времени (ПЦР-РВ) и гибридизацию на микрочипах.
Известен способ определения экспрессии генов полимеразной цепной реакцией в реальном времени, сопряженной с обратной транскрипцией (ПЦР-РВ), в котором уровень экспрессии генов определяют по изменению флуоресценции в ходе накопления продукта реакции [Livak, K.J., S.J. Flood, J. Marmaro, et al., Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization. PCR Methods Appl, 1995. 4(6): 357-62]. В зависимости от разновидности способа ПЦР-РВ (SYBR Green® I, TaqMan®, молекулярные биконсы, «скорпионные» пробы и др.) в нем используется два или более олигонуклеотидов с определенной структурой на каждый ген [Vanguilder, H.D., К.Е. Vrana and W.M. Freeman, Twenty-five years of quantitative PCR for gene expression analysis. Biotechniques, 2008. 44(5): 619-26]. Показана корреляция чувствительности клеток к цисплатину с уровнями экспрессии радя генов, определяемыми с помощью ПЦР-РВ [Боярских, У.А., Ю.В. Кондрахин, И.С. Евшин, и др., Прогнозирование чувствительности клеток немелкоклеточного рака легких к действию цисплатина и паклитаксела на основании уровня экспрессии маркерных генов. Молекулярная Биология, 2011. 45(4): 652-661]. Общим существенным недостатком способов на основе ПЦР-РВ по сравнению с ДНК-микрочипами является ограниченная мультиплексность, то есть количество генов, тестируемых в одной реакции. Кроме того, для определения экспрессии одного гена требуется два или более специфических олигонуклеотида в зависимости от варианта ПЦР-РВ. Новые способы ПЦР-РВ, основанные на молекулярных биконсах и «скорпионных» пробах, требуют значительно более изощренного дизайна олигонуклеотидных проб и менее распространены.
Известен способ прогноза чувствительности клеток к цитостатикам на основе уровней экспрессии различных генов, определяемых с помощью полнотранскриптомных микрочипов [Gyorffy, В., P. Surowiak, О. Kiesslich, et al., Gene expression profiling of 30 cancer cell lines predicts resistance towards 11 anticancer drugs at clinically achieved concentrations. Int J Cancer, 2006. 118(7): 1699-712] [Yatomi, M., Y. Takiguchi, Y. Asaka-Amano, et al., Altered gene expression by cisplatin in a human squamous cell lung carcinoma cell line. Anticancer Res, 2007. 27(5A): 3235-43, Кашкин, K.H., E.A. Мусаткина, A.B. Комельков, и др., Гены, потенциально ассоциированные с устойчивостью клеток рака легкого к цисплатину. Доклады Академии Наук, 2011. 438(6): 829-833]. Один экспрессионный микрочип может содержать множество различных зондов, перекрывающих весь транскриптом (совокупность всех РНК) организма. Так, микрочип Human Gene 1.1 ST Array фирмы Affymetrix (Santa Clara, CA) содержит более 750000 различных олигонуклеотидных зондов. Главными недостатками этого способа являются дороговизна, необходимость в высокотехнологичном оборудовании для изготовления и обработки микрочипов, сложность анализа результата и избыточность получаемой информации. Эти недостатки ограничивают практическое применение полнотранскриптомных микрочипов разных производителей, например, фирм Affymetrix и Agilent. Фактически число генов, для которых экспериментально подтверждена корреляция экспрессии с лекарственной устойчивостью опухолей, исчисляется десятками. Для анализа такого числа генов используют микрочипы низкой плотности. Их преимущество перед полнотранскриптомными чипами состоит в том, что они могут быть изготовлены и проанализированы в небольшой диагностической лаборатории. Микрочипы низкой плотности позволяют исследовать экспрессию минимального и достаточного набора генов, соответствующего конкретной задаче. Несмотря на то что корреляция экспрессии ряда генов с чувствительностью к цисплатину известна, в литературе не описаны способы расчета показателя IC50 цисплатина в зависимости от уровня экспрессии генов, определяемого с помощью микрочипов низкой плотности.
Известны узкоспециализированные биочипы низкой плотности на основе гидрогеля, производимые в ИМБ РАН и компанией Биочип-ИМБ (патент 2157385 RU). Эти чипы используются для детекции нескольких клинически важных мутаций и полиморфизмов в геноме различных организмов, включая человека (см. патенты 2458131 RU, 2453606 RU, 2453605 RU), а также для определения ряда антигенов иммунологическими способами [Gryadunov, D., Е. Dementieva, V. Mikhailovich, et al., Gel-based microarrays in clinical diagnostics in Russia. Expert Rev Mol Diagn, 2011. 11(8): 839-53]. Однако для количественного исследования экспрессии нормальных генов гелевые биочипы не применяют. Принципиальный недостаток гелевых микрочипов состоит в том, что размер гелевых пор накладывает ограничения как на длину иммобилизованных олигонуклеотидных зондов, так и на способ подготовки анализируемого препарата. Все системы анализа нуклеиновых кислот на гелевых чипах требуют предварительной амплификации с помощью ПНР строго ограниченных участков ДНК или РНК. Этот способ требует синтеза не менее трех олигонуклеотидов на каждый ген или мутацию: праймеров для ПЦР и зондов для гибридизации продукта ПЦР. Введение в систему анализа каждого дополнительного гена требует расчета не менее трех олигонуклеотидов, а в варианте с мультиплексной ПЦР - перерасчета всех олигонуклеотидов, задействованных в анализе. Все это лишает гелевые микрочипы преимуществ перед способами с использованием только ПЦР в различных вариациях. Кроме того, микрочипы, в которых олигонуклеотидные зонды иммобилизованы на поверхности твердой подложки (поверхностные микрочипы), позволяют использовать олигонуклеотидные зонды длиной 50-80 и более нуклеотидов с последовательностью, уникальной для генома человека. Таким образом, для анализа экспрессии любого гена может использоваться всего один олигонуклеотидный зонд.
Наиболее близкими аналогами способа подготовки материала, используемыми в настоящее время, являются два способа. Первый способ применяется в наборе Amino Allyl cDNA Labelling Kit (Ambion; США, патенты США 5256555, 6586218, 6586219), который основан на способе двойной амплификации [Van Gelder, R.N., М.Е. Von Zastrow, A. Yool, et al., Amplified RNA synthesized from limited quantities of heterogeneous cDNA. Proc Natl Acad Sci USA, 1990. 87(5): 1663-7]. Этот способ не предусматривает этапа амплификации кДНК: в нем отдельно синтезируют кДНК, затем вторую цепь кДНК, после этого проводят амплификацию РНК с помощью Т7 РНК-полимеразы, получая аРНК. Для одного эксперимента требуется не менее 10 мкг РНК каждой линии клеток или ткани. Для меньших количеств мРНК применяют повторный цикл двойной амплификации с помощью того же набора, что вносит значительные отклонения в репрезентативность исходных молекул мРНК в конечном препарате. Второй способ, применяемый в MiniAmp mRNA amplification kit (Arrayit, США, патент US 8343721 B2), использует SMART-технологию для синтеза кДНК [Chenchik, A., Y.Y. Zhu, L. Diatchenko, et al., Gene Cloning and Analysis by RT-PCR, 1998. 305-319, Zhu, Y.Y., E.M. Machleder, A. Chenchik, et al., Reverse transcriptase template switching: a SMART approach for full-length cDNA library construction. Biotechniques, 2001. 30(4): 892-7], промежуточную амплификацию кДНК с помощью ограниченной ПЦР, синтез с помощью Т7 РНК-полимеразы аРНК, которая потом еще раз переводится в кДНК с введением аминоаллил-дНТФ. Главный недостаток такого подхода состоит в лишнем этапе ферментативного копирования материала, который нарушает репрезентативность исходных молекул мРНК в конечном препарате.
Настоящее изобретение решает задачу определения чувствительности (расчета IC50) человеческих клеток рака легкого к цисплатину - лекарственному препарату, применяемому в практической онкологии для лечения больных раком легкого. Изобретение может быть использовано в тех случаях, когда нет возможности определить чувствительность клеток к цисплатину другими известными способами, например способом МТТ [Alley, М.С., D.A. Scudiero, A. Monks, et al., Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Res, 1988. 48(3): 589-601], в частности, в лабораториях, не имеющих оборудования для культивирования животных клеток. Поставленная задача решается за счет определения уровней экспрессии маркерных генов AKR1B1, DDB2, ERCC1, FTL, MLH1 (Таблица 1) при условии их экспрессии на уровне не ниже десяти молекул маркерного гена мРНК на клетку. Способ включает получение биологического материала (клеток в культуре), выделение суммарной РНК из клеток, SMART-синтез кДНК с последующей амплификацией РНК (аРНК) и включением в нее флуоресцентной метки, гибридизацию их с набором уникальных олигонуклеотидных зондов к указанным генам (Таблица 1, Таблица 2), которые иммобилизованы на твердой подложке, отмывку несвязавшегося препарата меченой аРНК, сканирование подложки лазерным сканером, обработку полученного изображения и проведение количественного анализа результата, а также набор олигонуклеотидов SEQ ID NO: 1-13 (Таблица 2) для осуществления предлагаемого способа. В предлагаемом способе применяют SMART-синтез кДНК и ее ограниченную амплификацию (ПЦР) с использованием недорогого набора для амплификации кДНК фирмы Евроген (Россия) с последующей линейной амплификацией РНК с помощью Т7 РНК-полимеразы. Такой подход, с одной стороны, обеспечивает эффективный синтез полноразмерных кДНК, а с другой - позволяет сократить стадии ферментативного копирования исходной мРНК при сохранении репрезентативности транскриптов. Еще одно преимущество данного способа состоит в том, что необходимости можно неограниченно копировать промежуточный материал (кДНК) с помощью ПЦР. Для постановки экспериментов на микрочипах используется стандартное оборудование, имеющееся в каждой молекулярно-биологической лаборатории. Сами подложки с олигонуклеотидными зондами (микрочипы) могут быть изготовлены и проанализированы либо в той же лаборатории с использованием бюджетных принтеров (Xact Xpress Line) и сканеров (DITABIS MaRS), либо на оборудовании для массовой печати микрочипов в специализированных технопарках - например, с использованием станций для печати ArrayIt NanoPrint™ Workstations и сканеров GenePix 4400А Microarray Scanner с автоматическим загрузчиком GenePix SL50. После обработки изображений и нормирования значений флуоресценции по результатам гибридизации и известным IC50 цисплатина для других клеток рака легкого рассчитывают уравнения регрессии и/или строят градуировочные прямые для предсказания IC50 цисплатина в зависимости от сигналов флуоресценции зондов AKR1B1 (SEQ ID NO: 11), DDB2 (SEQ ID NO: 12), ERCC1 (SEQ ID NO: 9), FTL (SEQ ID NO: 10), MLH1 (SEQ ID NO: 13) с помощью программы Statistica (Statsoft, Inc.) или другого математического аппарата. Таким же способом определяют уровни экспрессии указанных генов для исследуемых клеток, результаты усредняют и сравнивают с градуировочной прямой, тем самым определяя IC50 цисплатина для исследуемых клеток.
Таким образом, предлагаемый способ определения чувствительности клеток к цисплатину на основе измерения уровней экспрессии (количества мРНК) маркерных генов объединяет следующие достоинства ПЦР-РВ, поверхностных полнотранскриптомных микрочипов и микрочипов низкой плотности:
1) минимальное количество стартового материала - 1-2 мкг суммарной РНК;
2) универсальный способ подготовки меченого материала из суммарной РНК, основанный на недорогом отечественном наборе для амплификации кДНК фирмы Евроген. Способ подготовки не зависит от набора генов, подлежащих исследованию;
3) возможность неограниченного воспроизводства промежуточного материала для анализа путем амплификации кДНК;
4) использование всего одного олигонуклеотидного зонда на каждый ген;
5) использование ограниченного набора олигонуклеотидных зондов, иммобилизованных на твердой подложке, достаточного для решения поставленной задачи, при необходимости набор может быть расширен;
6) относительно невысокая стоимость микрочипов из-за небольшого количества иммобилизованных зондов;
7) возможность печати, обработки и анализа микрочипов как на бюджетном оборудовании в исследовательской лаборатории, так и на оборудовании для массовой печати микрочипов в условиях специализированных технопарков;
8) удешевление анализа при массовом производстве микрочипов.
Сочетание используемых в данном изобретении генов, конкретных последовательностей олигонуклеотидов, способа подготовки материала для гибридизации и экспериментального подхода с использованием микрочипов низкой плотности для определения IC50 цисплатина для клеток рака легкого в литературе не встречается и в практике не используется.
Технический результат
Техническим результатом изобретения является определяемый в эксперименте показатель IC50 цисплатина для клеток рака легкого на основе анализа экспрессии маркерных генов AKR1B1, DDB2, ERCC1, FTL, MLH1 (Таблица 1), повышение достоверности определения чувствительности к цисплатину клеток рака легкого и дополнительное подтверждение IC50 цисплатина для клеток рака легкого, определенных другими методами.
Осуществление изобретения
Для осуществления изобретения выделяют суммарную РНК из клеток рака легкого, выращенных в культуре. РНК выделяют с использованием различных способов, например с помощью хаотропных агентов [Chomczynski, P. and N. Sacchi, Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987.162(1): 156-9], с использованием реагента Trizol (Gibco/Life Technologies, США) либо коммерческих наборов для выделения РНК типа RNAEasy Kit (Quiagen, США) или ExtracrRNA (Евроген, Россия). Необходимое качество препарата РНК оценивают по соотношению фракций 28S к 18S рибосомным РНК, близкому к 2, определяемому по электрофорезу суммарной РНК [Sambrook, J. and D.W. Russell, Molecular cloning: a laboratory manual. 3d Ed. 2001], либо по индексу RIN, близкому к 10, определяемому приборами, аналогичными биоанализатору Agilent Bioanalyzer 2100. Из суммарной РНК клеток при помощи обратной транскрипции с помощью фермента обратной транскриптазы и SMART-технологии готовят суммарные препараты кДНК. Данную кДНК амплифицируют с помощью ограниченной полимеразной цепной реакции. Из препаратов амплифицированной кДНК с помощью РНК-полимеразы готовят препараты амплифицированной РНК (аРНК), которую метят флуоресцентными красителями, различающимися спектрами поглощения и эмиссии - например, Су3 (контрольный препарат) и Су5 (исследуемый препарат). Для получения контрольного препарата аРНК используют клетки аденокарциномы легкого А549 или другие клетки. Меченные двумя разными красителями контрольный и исследуемый препараты аРНК смешивают в равных соотношениях и проводят гибридизацию с олигонуклеотидными зондами, гомологичными мРНК генов AKR1B1 (олигонуклеотидный зонд SEQ ID NO: 11), DDB2 (SEQ ID NO: 12), ERCC1 (SEQ ID NO: 9), FTL (SEQ ID NO: 10), MLH1 (SEQ ID NO: 13), которые иммобилизованы на твердом носителе (ДНК-микрочипе) вместе с контрольными олигонуклеотидными зондами, предназначенными для нормирования результатов (Таблица 1, Таблица 2). Несвязавшуюся часть препаратов аРНК отмывают солевым раствором. После гибридизации и отмывки подложки сканируют с помощью сканера для микрочипов (Perkin Elmer ScanArray GL Plus, DITABIS MaRS или другого аналогичного) в двух длинах волн, соответствующих максимуму эмиссии флуоресцентных красителей. Полученные изображения совмещают и обрабатывают с помощью программ для обработки изображений (Perkin Elmer ScanArray Express, Imaging Research ArrayVision 7.0, Axon GenePix Pro или других). По соотношению сигналов флуоресценции двух красителей для каждого зонда определяют уровни экспрессии генов в исследуемых клетках относительно контрольных. При использовании клеток А549 в качестве контрольных и программы Imaging Research ArrayVision 7.0 для обработки изображений IC50 цисплатина определяют по следующим уравнениям:
IC50 (мкМ)=2,30+11,33*«MLH1» (р<0,004);
IC50 (мкМ)=2,66+2,81*«ERCC1» (р<0,011);
IC50 (мкМ)=2,81+3,20*«DDB2» (р<0,05);
IC50 (мкМ)=4,10+4,01*«AKR1B1» (р<0,05);
IC50 (мкМ)=1,79-3,01*«FTL» (р<0,03)
IC50 (мкМ)=3,16+0,89*«DDB2»+1,77*«ERCC1»+1,46*«AKR1B1» (р=0,013).
В уравнениях используют нормированные показатели Су3/Су5 для соответствующих зондов «Ratio (cnLogARMDens): Ctrl:Data» (приведены в кавычках); более точные коэффициенты указаны на Фиг. 1. По этим уравнениям строят градуировочные прямые зависимости IC50 цисплатина от уровней экспрессии соответствующих генов. Наиболее близкое значение IC50 получают в виде средней величины из значений, полученных по данным уравнениям.
В случае использования других контрольных клеток, другой программы обработки изображений или других параметров гибридизации и нормирования по результатам гибридизации и известным IC50 цисплатина для других клеток рака легкого рассчитывают уравнения регрессии и строят градуировочные прямые для предсказания IC50 цисплатина в зависимости от сигналов флуоресценции зондов AKR1B1 (SEQ ID NO: 11), DDB2 (SEQ ID NO: 12), ERCC1 (SEQ ID NO: 9), FTL (SEQ ID NO: 10), MLH1 (SEQ ID NO: 13) с помощью программы Statistica (Statsoft, Inc.) или другого математического аппарата. Таким же способом определяют уровни экспрессии указанных генов для исследуемых клеток, результаты усредняют и сравнивают с градуировочной прямой, тем самым определяя IC50 цисплатина для исследуемых клеток.
Способ иллюстрируют следующие примеры.
Пример 1.
а) Синтез олигонуклеотидов SEQ ID NO: 1-13 проводят с использованием стандартной фосфоамитидной процедуры на автоматическом синтезаторе ABI 3900 ("Applied Biosystems", США). На 3′-конце олигонуклеотидов SEQ ID NO: 2-13 при синтезе вводят спейсер со свободной аминогруппой с помощью 3′-Amino-Link ("Glen Reseach", США).
б) Для иммобилизации олигонуклеотидных зондов на твердых подложках используют принтер для контактной печати Xact Xpress Lane и подложки VALS-25 с активированной поверхностью (CEL Associates, Inc, США) в условиях, рекомендованных изготовителями подложки и принтера. Зонды наносят в определенном порядке в трех повторах.
в) Клетки рака легкого линий А549, NCI-H23, NCI-H292, NCI-H322, NCI-Н358, NCI-H1299 и NCI-H460 выращивают в 25 см2 флаконах в среде DMEM/F12 (1:1), содержащей 10% фетальной коровьей сыворотки с добавлением стрептомицина до концентрации 10 мкг/мл и пенициллина до концентрации 10 ед./мл при температуре 37°С в CO2-инкубаторе при относительной влажности 96%.
г) Суммарную РНК из клеток выделяют стандартным способом с использованием гуанидин изотиоцианата и фенола [Chomczynski, P. and N. Sacchi, Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem, 1987. 162(1): 156-9], дополнительно очищают с помощью набора RNeasy Mini RNA Kit (Qiagen, Valencia, CA, USA) и обрабатывают ДНКазой I. Качество РНК оценивают с помощью электрофореза в агарозном геле с бромистым этидием [Sambrook, J. and D.W. Russell, Molecular cloning: a laboratory manual. 3d Ed. 2001]. Соотношение фракций 28S:18S рибосомной РНК, близкое к 2, свидетельствует о высоком качестве препарата РНК, что является необходимым условием для определения экспрессии генов. Более надежным показателем хорошего качества является индекс RIN (RNA Integrity Number), близкий к 10. Индекс RIN определяют с помощью Agilent Bioanalyser 2100.
д) Синтез меченых препаратов аРНК проводят следующим способом. кДНК синтезируют из 2 мкг суммарной РНК с помощью набора Mint (Евроген, Россия) по рекомендациям изготовителя, используя модифицированный праймирующий олигонуклеотид SEQ ID NO: 1 и стандартный Plug-олигонуклеотид для переключения цепи. Праймирующий олигонуклеотид SEQ ID NO: 1 представляет собой модификацию стандартного 3′-праймера Mint (Евроген) и содержит дополнительно промотор РНК-полимеразы фага Т7. Далее проводят 18-21 цикл ПЦР с праймером M1 для амплификации кДНК в условиях, рекомендованных Евроген. Препарат кДНК очищают на спин-колонках Clean-up (Евроген, Россия) или аналогичных по инструкции изготовителя. 100 нг амплифицированной кДНК используют для синтеза аРНК РНК с помощью РНК-полимеразы бактериофага Т7 (Ambion, Austin, ТХ, США или Fermentas, Литва) в объеме 40 мкл в присутствии АТФ, ГТФ, ЦТФ (7,5 мМ), УТФ и аминоаллил-УТФ (Fermentas, Литва; 3,75 мМ). Реакцию проводят при 37°С в течение 4-8 часов, после чего останавливают разбавлением безнуклеазной водой до 100 мкл. Продукт синтеза (аРНК) очищают на спин-колонках RNAEasy Kit (Quiagen, США) или аналогичных по инструкции изготовителя. Полученную аРНК метят реакцией с сукцинимидными эфирами флуоресцентных красителей красителями Су3 или Су5. Для этого используют Amino Allyl MessageAmp II aRNA Amplification kit (Ambion, США, #1797) либо Су-Dye Post-Labelling Reactive Dye Pack (Amersham/GE Healthcare, США, #RPN 5661) или аналогичные препараты других производителей. Один флакон красителя в расчете на 1 реакцию разводят в 11 мкл ДМСО. 10-20 мкг аРНК лиофилизируют и растворяют в 9 мкл буфера для конъюгации (Coupling buffer, Ambion, США), после чего смешивают с раствором красителя в ДМСО и осторожно перемешивают. Смесь инкубируют 30 минут в темноте, затем добавляют 4,5 мкл 4М гидроксиламина, перемешивают и инкубируют еще 15 минут в темноте. Объем реакции доводят до 30 мкл. Меченую аминоаллил-аРНК очищают на спин-колонках для очистки от красителя Ambion из набора #1797 или с помощью RNAEasy Kit (Quiagen, США) либо аналогичных по инструкции изготовителя.
е) В качестве контрольного препарата используют аРНК из клеток А549. Опытный (меченый Су5) и контрольный (меченый Су3) препараты аРНК смешивают в весовом соотношении 1:1, фрагментируют с помощью буфера для фрагментации (АМ8740, Ambion) по рекомендациям изготовителя, добавляют буфер для гибридизации (RPK0325, GE Healthcare) и наносят на ДНК-микрочипы для гибридизации. Микрочипы инкубируют в течение ночи при 37°С, после чего отмывают цитратным буфером с понижающимися концентрациями соли и высушивают. Отмывку проводят в следующем режиме: 2×SSC, 2×15 мин при 20°, 1×SSC, 15 мин при 50°, 0,1×SSC, 5 мин при 20° с добавлением 0,1% Tween 20, ополаскивают 0,1×SSC без Tween 20 и высушивают в беспылевых условиях.
ж) Микрочипы сканируют с помощью сканера ScanArray GL Plus (Perkin Elmer, США). Изображения анализируют с помощью программы ArrayVision 7.0 (Imaging Research, США). Коррекцию фона проводят по флуоресценции свободной от олигонуклеотидов области чипа, а остаточной флуоресценции (контроль отмывки) - по зонду SEQ ID NO: 3. Результаты нормируют по сигналам контрольных зондов, гомологичных мРНК генов «домашнего хозяйства» (SEQ ID NO: 4-8). Дифференциальную экспрессию фиксируют в случаях не менее чем двукратного различия отношения нормированных сигналов Су3/Су5 (показатель cnLogARMDens >0,3) при соотношении сигнал/шум S/N ≥3. Для контроля результата проводят гибридизацию микрочипов с противоположно меченными матрицами (Су5/Су3), результаты усредняют.
з) При использовании клеток А549 в качестве контрольных IC50 цисплатина для исследуемой линии клеток рака легкого определяют на основании ее прямой корреляции с сигналами зондов «MLH1» (SEQ NO: 13), «ERCC1» (SEQ NO: 9), «DDB2» (SEQ NO: 12) и «AKR1B1» (SEQ NO: 11) и обратной корреляции с сигналом зонда «FTL» (SEQ NO: 10) в соответствии со следующими уравнениями (более точные коэффициенты приведены на Фиг. 1):
IC50 (мкМ)=2,30+11,33*«MLH1» (р<0,004);
IC50 (мкМ)=2,66+2,81*«ERCC1» (р<0,011);
IC50 (мкМ)=2,81+3,20*«DDB2» (р<0,05);
IC50 (мкМ)=4,10+4,01*«AKR1B1» (р<0.05);
IC50 (мкМ)=1,79-3,01*«FTL» (р<0,03)
IC50 (мкМ)=3,16+0,89*«DDB2»+1,77*«ERCC1»+1,46*«AKR1B1» (р=0,013).
В уравнениях используют нормированные показатели Су3/Су5 для соответствующих зондов «Ratio (cnLogARMDens): Ctrl:Data» (приведены в кавычках), определенные так, как описано в Примере 1ж. Наиболее близкое значение IC50 цисплатина для исследуемых клеток получают в виде средней величины из значений, полученных по данным уравнениям. По этим уравнениям строят градуировочные прямые зависимости IC50 цисплатина от уровней экспрессии соответствующих генов.
В случае использования других контрольных клеток, другой программы обработки изображений или других параметров гибридизации и нормирования по результатам гибридизации и известным IC50 цисплатина для других клеток рака легкого рассчитывают уравнения регрессии и строят градуировочные прямые для предсказания IC50 цисплатина в зависимости от сигналов флуоресценции зондов AKR1B1 (SEQ ID NO: 11), DDB2 (SEQ ID NO: 12), ERCC1 (SEQ ID NO: 9), FTL (SEQ ID NO: 10), MLH1 (SEQ ID NO: 13). Таким же способом определяют уровни экспрессии указанных генов для исследуемых клеток, результаты усредняют и сравнивают с градуировочной прямой, тем самым определяя IC50 цисплатина для исследуемых клеток.
Пример 2. Определение IC50 цисплатина для клеток линии NCI-H460 при использовании в качестве контрольной линии клеток А549 (значения округлены до двух разрядов после запятой)
Среднее значение расчетной IC50 равно 2,30 мкМ, что близко к величине, полученной в прямом эксперименте (2,07 мкМ) способом МТТ [Боярских, У.А., Ю.В. Кондрахин, И.С. Евшин, и др., Прогнозирование чувствительности клеток немелкоклеточного рака легких к действию цисплатина и паклитаксела на основании уровня экспрессии маркерных генов. Молекулярная Биология, 2011. 45(4): 652-661, Кашкин, К.Н., Е.А. Мусаткина, А.В. Комельков, и др., Гены, потенциально ассоциированные с устойчивостью клеток рака легкого к цисплатину. Доклады Академии Наук, 2011. 438(6): 829-833]. Еще более точную величину IC50 дает усреднение расчетных IC50 после отбрасывания крайних значений (2,19 мкМ), что отличается от IC50, определенной методом МТТ, всего на 5,8%. Аналогично могут быть определены IC50 цисплатина для других клеток (Фиг. 1).
Пример 3. В случае использования других контрольных клеток, другой программы обработки изображений или других параметров гибридизации и нормирования по результатам гибридизации и известным IC50 цисплатина для других клеток рака легкого рассчитывают уравнения регрессии и на их основе строят градуировочные прямые для предсказания IC50 цисплатина в зависимости от сигналов флуоресценции зондов AKR1B1 (SEQ ID NO: 11), DDB2 (SEQ ID NO: 12), ERCC1 (SEQ ID NO: 9), FTL (SEQ ID NO: 10), MLH1 (SEQ ID NO: 13) с использованием программы Статистика 8.0 (Statsoft Inc., OK, USA) или другого математического аппарата. Таким же способом определяют уровни экспрессии указанных генов для исследуемых клеток, результаты усредняют и сравнивают с градуировочной прямой, тем самым определяя IC50 цисплатина для исследуемых клеток.
Изобретение иллюстрируют графические материалы.
Фиг. 1 демонстрирует соответствие между IC50 цисплатина для клеток рака легкого, определенных методом МТТ (наблюдаемые IC50, по горизонтали), и IC50, рассчитанных на основе экспрессии маркерных генов AKR1B1, DDB2, ERCC1, FTL, MLH1 (по вертикали) при использовании в качестве контрольной линии клеток А549.
Промышленная применимость
Предлагаемый способ позволяет определять IC50 цисплатина для клеток рака легкого в тех случаях, когда другие методы определения чувствительности к данному цитостатику неприменимы. IC50 цисплатина для клеток рака легкого определяют на основании уровней экспрессии маркерных генов AKR1B1, DDB2, ERCC1, FTL, MLH1 (Таблица 1) при условии их экспрессии на уровне не ниже десяти молекул мРНК каждого гена на клетку. Способ может быть использован как альтернатива существующим методам определения IC50 цисплатина или дополнение к ним.
1. Способ определения чувствительности клеток рака легкого к цисплатину, включающий определение уровня экспрессии генов MLH1, ERCC1, DDB2, AKR1B1, FTL в зависимости от IC50 цисплатина для известных клеточных линий, далее осуществляют построение градуировочной прямой зависимости IC50 цисплатина для этих клеточных линий от полученного уровня экспрессии указанных генов, потом проводят выделение исследуемых клеток рака легкого с последующим выделением суммарной РНК этих клеток, SMART-синтез кДНК с последующей амплификацией РНК, осуществляют введение флуоресцентно-меченых зондов и проводят гибридизацию на микрочипе, содержащем набор олигонуклеотидных зондов к генам MLH1 (SEQ ID NO: 13), ERCC1 (SEQ ID NO: 9), DDB2 (SEQ ID NO: 12), AKR1B1 (SEQ ID NO: 11), FTL (SEQ ID NO: 10) с последующим определением уровня экспрессии указанных генов относительно контроля, полученные уровни усредняют и сравнивают с градуировочной прямой, тем самым определяя IC50 цисплатина для исследуемых клеток.
2. Набор олигонуклеотидных зондов, представленных SEQ ID NO: 9-13, предназначенных для определения чувствительности клеток рака легкого к цисплатину по п.1.