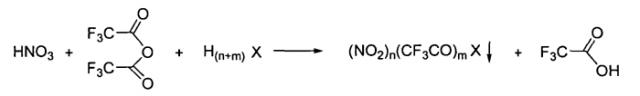
Способ получения солей нитрония
Иллюстрации
Показать всеИзобретение относится к неорганической химии, в частности к способу получения солей нитрония, которые находят широкое применение в органическом синтезе в качестве нитрующих агентов. Способ получения солей нитрония общей формулы (NO2 +)n(CF3CO+)mX(n+m)-, где X(n+m)- - анион сильной кислоты формулы Y(SO3)k (n+m)-, где Y=CF3, F (n=1, m=0, k=1); Y=НО (n=1, m=0, k≥1); Y=О (n=1, m=1, k≥1), Y=О (n=2, m=0, k≥1), или анион формулы HalO4 (n+m)-, где Hal=Cl, I (n=1, m=0), заключающийся в том, что соответствующую сильную кислоту Бренстеда общей формулы H(n+m)X, где X, n и m имеют вышеуказанные значения, подвергают взаимодействию с азотной кислотой и трифторуксусным ангидридом. Процесс предпочтительно ведут при температуре 0-35°С и мольном соотношении H(n+m)X:HNO3:(CF3CO)2O равном 1:0.5-12:1.5-7. Техническим результатом предлагаемого способа является его технологичность и безопасность, поскольку он не требует предварительного получения легколетучих, малостабильных соединений (NO2Hal, N2O5, CF3COONO2) и применения безводных кислот H(n+m)X. Изобретение позволяет получать значительное количество разнообразных кристаллических солей нитрония с хорошим выходом. 2 з.п. ф-лы, 11 пр.
Реферат
Изобретение относится к неорганической химии, в частности к способу получения солей нитрония, которые находят широкое применение в органическом синтезе в качестве нитрующих агентов.
Одним из общих способов получения солей нитрония является взаимодействие азотной кислоты (или ее солей) с ангидридом сильной кислоты. Так, например, были получены NO2CF3SO3 - из (CF3SO2)2O и Bu4NO3 [С.М. Adams et al, Electrophilic tetraalkylammonium nitrate nitration. I. Convenient new anhydrous nitronium triflate synthesis and in-situ heterocyclic N-nitration, Tetrahedron Lett., 1993, 34, 6669-6672] или NH4NO3 [D. Dolphin et al, X-ray Crystallographic and 13С NMR Investigations of the Effects of Electron-Withdrawing Groups on a Series of Pyrroles, Organic Letters, 2000, 2 (23), 3587-3590]; NO2ClO4 - из Cl2O6 и HNO3 (или KNO3) [J.-L. Pascal et al, Reaction du trioxyde de chlore avec le nitrate de potassium et avec l′acide nitrique (absolu ou fumant): De nouvelles voies d′acces au perchlorate de nitryl, Compt. Rend., Ser. II, 1986, 302, 817-820], из HNO3 и Cl2O7 [Pat. US 3244474, 1966], из HNO3 и ClO2 (с окислением озоном) [W.Е. Gordon, J.W.Т. Spinks, Canadian J. Res., Section B: Chem. Sciences, 1940, 18, 358-362]; NO2HSO4, NO2HS2O7 [M.M. Dode, Sur un complexe des anhydrides sulfurique et azotique qui se dissocie en liberant de l′acide azotique, Compt. rend., 1943, 217, 153-155] и (NO2)2S2O7 [Pat. US 5316749. 1994] - из HNO3 и SO3. Отметим, что в синтезе NO2HSO4 полученная соль нитрония содержала следы азотной кислоты, от которой не удавалось избавиться сушкой. В результате гидросульфат нитрония быстро превращался в кислый пиросульфат нитрония. Синтез NO2HSO4 данным методом в растворе нитрометана приводил к аналогичному результату: гидросульфат нитрония был нестабильным, выделял HNO3 и превращался в NO2HS2O7. Используемые в методе ангидриды сильных кислот - крайне реакционноспособные летучие (Cl2O6, Cl2O7) или газообразные (SO3) при обычных условиях вещества, для работы с которыми требуется специальное оборудование, предотвращающее их контакт с атмосферной влагой. Известен пример получения комплексной соли нитрония растворением Sn(NO3)4 в (CF3CO)2O, при этом образуется структура (NO2)2[Sn(CF3CO2)6], где в состав молекулы входит анион трифторуксусной кислоты [М.I. Khalil, Nitronium (Trifluoroacetato)metalates. 1. Nitronium Hexakis (trifluoroacetato)-stannate (IV), Inorg. Chem., 1990, 29, 5131-5133]. Следует заметить, что реакция (CF3CO)2O с другими солями азотной кислоты не приводит к получению солей нитрония: например, взаимодействие с нитратом аммония дает, по-видимому, ковалентное малостабильное соединение - нитроэфир CF3COONO2, который не был выделен в индивидуальном виде [P. Romea et al, Improved Methods for the N-Nitration of Amides, J. Org. Chem. 1991, 56, 7038-7042].
Другим общим способом получения солей нитрония является реакция нитрилгалогенидов NO2Hal (Hal=Cl, F) с сильной кислотой Бренстеда, с ее ангидридом или с ее солью. Таким образом были получены NO2CF3SO3 - из NO2Cl и CF3SO3H [S.K. Yarbro, R.Е. Noftle, The Reaction of Nitryl Chloride with Trifluoromethanesulfonic Acid, J. Fluorine Chem., 1975, 6, 187], NO2FSO3 - из NO2F и SO3 [E.E. Ansley et al, The Preparation and Some Reactions of Nitryl Fluoride, J. Chem. Soc., 1954, 1119-1124], из NO2F и H2SO4 [G. Hetherington et al, Recent aspects of the inorganic chemistry of nitrogen, London, 1957, P.23-32], а также NO2ClO4 - из NO2F и Cl2O6 [M. Schmeisser, W. Fink, Über Reaktionen des Chlorylfluorids und seiner Derivate Zur Kenntnis anorganischer Säurefluoride (VII), Angew. Chem., 1957, 69, 780], из NO2Cl и Cl2O6, из NO2Cl и AgClO4 [M. Schmeisser, Die Chemie der anorganischen Acylnitrate (ein Problem des Nitrylchlorids) und Acylperhlorate (ein Problem des Dichlorhexoxyds), Angew. Chem., 1955, 67, p.493-501]. Однако получение и использование газообразных при нормальных условиях коррозионно-активных нитрилгалогенидов требует специального оборудования, что создает определенные трудности в реализации данных методов. Получение NO2HSO4 данным методом не описано.
Известен также способ получения солей нитрония взаимодействием азотного ангидрида с сильной кислотой или с ее ангидридом. Данным способом получены соли: NO2HalSO3 (Hal=Cl, F) - из HalSO3H; NO2CF3SO3 - из CF3SO3H [F. Effenberg, J. Geke, Herstelung von Nitrionium-trifluoromethansulfonate; Vergleichende Nitrierung mit Nitroniumsalzen, Synthesis, 1975, p.40-41], из (CF3SO2)2O [Pat. US 4615842, 1986]; NO2ClO4 - из Cl2O7 (в присутствии O2) [A. Potier et al, Comp. Rend., 1965, 261, 4115-4118], из HClO4 (в присутствии HNO3). Из N2O5, Cl2O7 и H2O (или 2 моля HClO4) получена структура состава (NO2ClO4)3·H2O [И.И. Скороходов, Г.М. Курбатов, О твердых фазах тройной системы N2O5-Cl2O7-H2O. Ж. неорг. химии, 1967, 12, 1711], из N2O5, SO3 и H2O получен ряд смесевых солей нитрония серной кислоты и некоторые полисульфаты: 4(NO2HSO4)·7(H2SO4), NO2HSO4·H2SO4, NO2HS2O7·NO2HSO4, NO2HS2O7, NO2HS3O10, (NO2)2S2O7, (NO2)2S3O10, (NO2)2S4O13, (NO2)2S5O16, и (NO2)2S2O7·4NO2HS2O7·10NO2HSO4 [P. Vitse, Sur la composition particulaire de sept sels sulfonitriques cristallises, Compt. Rend., Ser. C: Scienc. Chim., 1967, 265 (12), 634-637]. Недостаток способа - в силу специфических свойств N2O5 (высокая летучесть, способность легко взаимодействовать с водой, разлагаться при комнатной температуре на свету) азотный ангидрид не является продуктом, предлагаемым поставщиками реактивов, его необходимо предварительно синтезировать перед получением соли нитрония.
Большинство других способов получения солей нитрония носит частный характер, в них, как правило, используются газообразные реагенты: О3 и (или) N2O4, а также, например, SO3 [Н.В. Зык и др., Этилсульфат нитрония - новый электрофильный реагент. Стереохимические аспекты присоединения по двойной углерод-углеродной связи. Ж. орг. хим., 1995, 31 (6), 840-851].
В литературе описан способ взаимодействия азотной кислоты с сильной кислотой Бренстеда, который при использовании избытка сильной кислоты приводит к получению комплексных солей нитрония-гидроксония, а именно NO2CF3SO3·H3OCF3SO3 [Pat. US 3714272, 1973] и NO2ClO4·H3OClO4 [D.R. Goddard et al, Chemistry of Nitronium Salts. Part I. Isolation of Some Nitronium Salts, J. Chem. Soc, 1950, 2559-2575], выделить из которых индивидуальную соль нитрония не представляется возможным. Данная реакция обратима [C.K. Ingold et al, Vibrational Spectra of Ionic Forms of Oxides and Oxy-acids of Nitrogen. Part I. Raman-spectral Evidence of the Ionisation of Nitric Acid by Perchloric, Sulphuric, and Selenic Acids. Spectroscopic Identification of the Nitronium Ion, NO2 +, J. Chem. Soc, 1950, 2576-2589]:
Задача настоящего изобретения состояла в создании простого в технологическом исполнении универсального способа получения солей нитрония в кристаллическом виде как новых, не описанных в литературе, так и известных.
Поставленная задача достигается предлагаемым способом получения солей нитрония общей формулы (NO2 +)n(CF3CO+)mX(n+m)-,
где X(n+m)- - анион сильной кислоты формулы Y(SO3)k (n+m)-, где Y=CF3, F (n=1, m=0, k=1); Y=HO (n=1, m=0, k≥1); Y=O (n=1, m=1, k≥1), Y=О (n=2, m=0, k≥1), или анион формулы HalO4 (n+m)-, где Hal=Cl, I (n=1, m=0),
заключающимся в том, что соответствующую сильную кислоту Бренстеда общей формулы H(n+m)X, где X, n и m имеют вышеуказанные значения, подвергают взаимодействию с азотной кислотой и трифторуксусным ангидридом.
Процесс предпочтительно ведут при температуре 0-35°С и мольном соотношении H(n+m)X:HNO3:(CF3CO)2O равном 1:0.5-12:1.5-7.
Предлагаемый способ позволяет получать как описанные в литературе, так и новые соли нитрония, например (NO2)(CF3CO)SO4, (NO2)(CF3CO)S2O7, NO2IO4. Предлагаемый способ получения солей нитрония позволяет получать их в кристаллическом виде, и способ основан на методе химического связывания воды, образующейся при смешивании HNO3 и сильной кислоты Бренстеда, и воды, содержащейся в водных кислотах.
Для получения кристаллических солей нитрония в предлагаемом изобретении использован ангидрид трифторуксусной кислоты. Его взаимодействие с азотной кислотой дает смешанный ангидрид CF3COONO2 и трифторуксусную кислоту. Было неочевидно, что реакция сильной кислоты с азотной кислотой и (CF3CO)2O даст соль нитрония сильной кислоты и при этом ее удастся выделить из раствора. Альтернативными путями реакции могли быть образование соли трифторацетилия сильной кислоты (см., например: [Th. E. Tiobeka et al, The interaction of hexafluoroacetic anhydride with methane sulfonic acid and sulfuric acid, Tetrahedron, 1988, 44 (7), 1971-1978]) или смешанной соли нитрония-гидроксония.
Ангидрид трифторуксусной кислоты - промышленно производимый реагент, обладающий низкой температурой кипения (при необходимости легко удаляется избыток), устойчивый к окислению, а также смешивающийся с органическими веществами и с неорганическими кислотами. Его избыток служит дегидратирующим агентом, предохраняет от атмосферной влаги, а в ряде случаев выступает в качестве растворителя. С его использованием разработан предлагаемый способ получения солей нитрония, в которых анионом служит остаток кислоты Бренстеда, более сильной, чем CF3COOH. Таким образом, ангидрид трифторуксусной кислоты играет роль активатора азотной кислоты, с помощью которого происходит образование соли нитрония. Впервые ангидрид трифторуксусной кислоты использован в роли медиатора процесса образования соли нитрония. Проведение синтеза в его присутствии при повышенной температуре (25-35°C) позволяет замещать один из протонов двухосновной кислоты Бренстеда на CF3CO-остаток и таким образом получать новые соли нитрония, обладающие высокой растворимостью в полярных органических растворителях (EtOAc, MeCN). Процесс протекает по следующей схеме:
Способ заключается в следующем. Смешивали кислоту Бренстеда (или ее водный раствор), HNO3 и избыток (CF3CO)2O. Реакционную массу перемешивали 0.3-1 ч в диапазоне температур 5-35°C, охлаждали. Для понижения растворимости соли (для увеличения выхода) иногда добавляли органический растворитель (CH2Cl2, CCl4, ClCH2CH2Cl и т.п.), устойчивый к соли нитрония и обладающий слабой растворяющей способностью по отношению к ней. Чтобы избежать расслаивания реакционной массы, в растворитель при необходимости вводили солюбилизирующую добавку, например ацетонитрил. Осадок соли отфильтровывали, промывали и сушили на фильтре Шотта при подаче вакуума и одновременно в токе сухого газа (аргона или азота). При необходимости следы растворителей удаляли сушкой соли в вакууме. Выход солей нитрония составил 57-98%.
При смешивании серной кислоты с азотной кислотой без добавления (CF3CO)2O образуется нитрующая смесь, из которой кристаллические соли нитрония никогда ранее не были выделены. Наиболее вероятной причиной невозможности получения кристаллической соли нитрония является наличие в реакционной массе воды, образующейся из компонентов смеси, а также содержащейся в кислотах. Совокупность предлагаемых признаков изобретения позволила получать различные соли нитрония серной (NO2HSO4, (NO2)(CF3CO)SO4) и полисерных кислот (NO2HS2O7, (NO2)2S2O7, (NO2)(CF3CO)S2O7), а также их смеси. Состав смеси, например NO2HS2O7 с (NO2)2S2O7, может варьироваться в широком диапазоне, однако для практического применения солей нитрония в качестве нитрующего агента соотношение данных компонентов существенного значения не имеет. В процессе синтеза солей нитрония, имеющих свободную гидроксильную группу (NO2HSO4, NO2HS2O7), для осаждения кристаллической соли в реакционную массу вводили органический растворитель, содержащий солюбилизирующий компонент. Растворитель мог быть добавлен как в самом начале синтеза, так и перед выделением соли. При получении NO2IO4 роль растворителя играл избыток HNO3. При использовании водных растворов кислот Бренстеда в качестве растворителя выступает CF3COOH, образующаяся при добавлении избытка (CF3CO)2O. При получении солей нитрония из безводных кислот вместо использования в качестве растворителя значительного избытка (CF3CO)2O с целью его экономии допустима частичная замена на органический растворитель (CH2Cl2, CCl4, ClCH2CH2Cl и т.п.), устойчивый к соли нитрония.
Техническим результатом предлагаемого способа является его технологичность и безопасность, поскольку он не требует предварительного получения легколетучих, малостабильных соединений (NO2Hal, N2O5, CF3COONO2) и применения безводных кислот H(n+m)X, получение проводится в удобном интервале температур (0-35°C). Способ универсален, позволяет получать значительное количество разнообразных кристаллических солей нитрония с хорошим выходом. Впервые получены новые кристаллические соли нитрония: NO2IO4, (NO2)(CF3CO)SO4, (NO2)(CF3CO)S2O7). Установлено, что фактический выход большинства солей нитрония близок к количественному, в приведенных примерах указан выход с учетом механических потерь на используемом оборудовании. Впервые получен стабильный гидросульфат нитрония.
Высокая нитрующая активность солей нитрония вместе с доступностью получения создают предпосылки для их широкого использования в органической и неорганической химии. Способ пригоден для лабораторного применения.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1
К раствору HNO3 (1.38 г, d20=1.5 г·см-3, 22 ммоля) прибавили (CF3CO)2O (4.5 мл) при температуре 10°С и перемешивали при температуре 10-15°С 15 мин. Затем охладили до 0-5°С и прибавляли в течение 3-5 мин по каплям H2SO4 (2.10 г, d20=1.83 г·см-3, 20 ммолей) при охлаждении таким образом, чтобы температура не превышала 15°С. Реакционную массу перемешивали при температуре 8-10°С в течение 1 ч, добавили смесь сухих MeCN (2 мл) и CH2Cl2 (10 мл), охладили до 0°С, осадок соли отфильтровали, промыли сухим CH2Cl2 (4×5 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона (азота), затем в вакууме в течение 10 мин. Получили соль NO2HSO4 (1.99 г, 70%) в виде кристаллов белого цвета. Найдено (%): Н, 0.45; N, 8.54; S, 22.99. HNO6S. Вычислено (%): Н, 0.70; N, 9.79; S, 22.41. ИК-спектр (вазелиновое масло), ν/см-1: 3751 с., 2376 с. (NO2 +); 1193 с., 1042 с.(HSO4 -). КР-спектр, ν/см-1: 1400 с. (NO2 +); 1037 с, 895 с, 595 сл. (HSO4 -).
Пример 2
К H2SO4 (2.09 г, d20=1.83 г·см-3, 20 ммолей) в смеси сухих MeCN (2 мл) CH2Cl2 (10 мл) при перемешивании при температуре 20-25°С прибавляли (CF3CO)2O (2.2 мл) и перемешивали 10 мин. Затем добавили HNO3 (0.63 г, d20=1.5 г·см-3, 10 ммолей), охладили до 10-15°С, и добавили по каплям еще (CF3CO)2O (7.7 мл), перемешивали 0.5 ч, охладили до 0°С. Осадок соли отфильтровали, промыли сухим CH2Cl2 (4×8 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона (азота). Получили смесь солей NO2HS2O7:(NO2)2S2O7 = 3:2 (2.01 г) в виде кристаллов белого цвета. Найдено (%): Н, 0.32; N, 7.68; S, 26.21. H3N7O49S10. Вычислено (%): Н, 0.25; N, 8.13; S, 26.59. ИК-спектр (вазелиновое масло), v/см-1: 3770 с., 3751 с., 2393 с., 2377 с. ( N O 2 + ) . КР-спектр, v/см-1: 1408 с., 1401 с. ( N O 2 + ) , 1092 с. ( S 2 O 7 2 − ) , 1086 с. ( H S 2 O 7 − ) .
Пример 3
К HNO3 (1.89 г, d20=1.5 г·см-3, 30 ммолей) прибавили (CF3CO)2O (7 мл) при температуре 5-10°C, перемешивали 10 мин, затем при температуре 0-15°C прибавляли 60%-ный олеум (1.90 г). По окончании прибавления олеума в реакционную массу добавили CH2Cl2 (20 мл), реакционную массу перемешивали при температуре 20-30°C в течение 0.5 ч, охладили до 5°C. Осадок соли отфильтровали, промыли сухим CH2Cl2 (2×8 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона (азота). Получили соль NO2(CF3CO)SO4 (4.58 г, 87%) в виде бесцветных кристаллов. Найдено (%): N, 6.48; S, 14.42. C2F3NO7S. Вычислено (%): N, 5.86; S, 13.41. ИК-спектр (вазелиновое масло), v/см-1: 3756 ср., 2386 о.с. ( N O 2 + ) ; 1790 о.с. (CO); 1224 с., 1170 с. (CF3). КР-спектр, v/см-1: 1792 ср. (CO); 1408 о.с. ( N O 2 + ) ; 1322 сл., 1134 сл., 1056 о.с., 863 ср., 680 с., 575 с., 347 ср., 253 сл., 216 сл.
Пример 4
К раствору HNO3 (1.27 г, d20=1.5 г·см-3, 20 ммолей) в (CF3CO)2O (7 мл) при перемешивании прибавляли по каплям 60%-ный олеум (3.50 г) при температуре 8-10°C (вначале - до 25°C). По окончании прибавления олеума в реакционную массу добавили (CF3CO)2O (4 мл), перемешивали при температуре 8-12°C в течение 30 мин, добавили смесь сухого CH2Cl2 (10 мл) и MeCN (2 мл), охладили до -20°C, осадок соли отфильтровали, промыли сухим CH2Cl2 (4×8 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона. Получили смесь NO2HS2O7 : (NO2)2S2O7 ≈ 3:2 в виде кристаллов белого цвета (3.20 г). Смесь идентична полученной в примере 2.
Пример 5
К 70%-ной HClO4 (1.44 г, 10 ммолей) при перемешивании и при температуре 20-30°C прибавили (CF3CO)2O (4 мл) в течение 10-15 мин, после чего прибавили HNO3 (0.64 г, d20=1.5 г·см-3, 10 ммолей) и затем при температуре 20-25°С добавляли (CF3CO)2O (4 мл). Реакционную массу перемешивали при температуре 15-20°С в течение 0.5 ч, добавили 10 мл сухого CH2Cl2, охладили до 0°С, осадок соли отфильтровали, промыли сухим CH2Cl2 (3×5 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона. Получили NO2ClO4 (1.10 г, 76%) в виде сыпучего порошка белого цвета, дымящего на воздухе. Найдено (%): N, 9.45. ClNO6. Вычислено (%): N, 9.63. ИК-спектр (вазелиновое масло), ν/см-1: 3742 с, 2372 с. (NO2 +). КР-спектр, ν/см-1: 1398 о.с. (NO2 +); 1141 сл., 1098 сл., 1080 сл., 947 сл., 938 с, 902 о.сл., 639 сл., 627 сл., 571 о.сл., 473 ср., 449 ср., 139 ср. уш. Соединение идентично известному по ИК- и КР-спектрам [J.W. Nebgen et al, Raman and Infrared Spectra of Nitronium Perchlorate, Inorg. Chem., 1965, 4 (12), 1796-1799].
Пример 6
К HNO3 (0.70 г, d20=1.5 г·см-3, 11 ммолей) прибавили (CF3CO)2O (7 мл) при температуре 10°С и перемешивали при температуре 5-10°С 10 мин, затем прибавили 70%-ной HClO4 (1.43 г, 10 ммолей) при температуре 10-20°С. Реакционную массу перемешивали при температуре 20°С в течение 0.5 ч, охладили до 5°С, осадок соли отфильтровали, промыли сухим CH2Cl2 (3×5 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона. Получили NO2ClO4 (1.24 г, 86%). Соединение идентично вышеописанному в примере 5.
Пример 7
К раствору HNO3 (0.76 г, d20=1.5 г·см-3, 12 ммолей) прибавили (CF3CO)2O (5 мл, 36 ммолей) при температуре 5-10°С и перемешивали при этой температуре 10 мин. Затем при 5°С прибавляли по каплям CF3SO3H (1.68 г, 11 ммолей) таким образом, чтобы температура не превышала 15°С. Реакционную массу перемешивали при температуре 10-15°С в течение 15 мин, охладили до 5°С, добавили сухой CH2Cl2 (5 мл), осадок соли отфильтровали, промыли сухим холодным CH2Cl2 (2×5 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона (азота). Получили NO2CF3SO3 (1.81 г, 83%) в виде сыпучего порошка белого цвета. Найдено (%): С, 6.40; N, 6.62. CF3NO5S. Вычислено (%): С, 6.16; N, 7.18. ИК-спектр (вазелиновое масло), ν/см-1: 3781 с, 2394 с. (NO2 +); 1224 с, 1170 с. (CF3). КР-спектр, v/см-1: 1410 с. (NO2 +); 1325 сл., 1246 сл., 1227 сл., 1182 сл., 1159 сл., 1039 с., 761 с., 586 ср., 571 сл., 513 сл., 350 с., 318 с., 216 сл., 138 с.уш. Соединение соответствует известному по ИК- [Л.М. Ягупольский и др., Нитронийтрифторметансульфонат - новый нитрующий агент. Ж. орг. хим., 1974, 10, 2240-2241] и КР-спектрам [С.L. Coon et al, Aromatic Nitration with Nitric Acid and Trifluoromethanesulfonic Acid, J. Org. Chem., 1978, 38 (25), 4243-4248].
Пример 8
К раствору HNO3 (0.71 г, d20=1.5 г·см-3, 11 ммолей) прибавили (CF3CO)2O (10 мл) при температуре 10°С и перемешивали при температуре 5-10°С 10 мин. Затем при 5°С начали прибавлять порциями кристаллогидрат CF3SO3H·H2O (1.80 г, 11 ммолей) таким образом, чтобы температура не превышала 15°С. Реакционную массу перемешивали при температуре 20-25°С в течение 0.5 ч, добавили сухой CH2Cl2 (10 мл), охладили до 5°С, осадок соли отфильтровали, промыли сухим CH2Cl2 (3×5 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона (азота). Получили NO2CF3SO3 (1.48 г, 71%). Соединение идентично вышеописанному в примере 7.
Пример 9
К HNO3 (1.49 г, d20=1.5 г·см-3, 23.7 ммоля) прибавили (CF3CO)2O (5 мл) при температуре 10°С и перемешивали при температуре 5-10°С 10 мин, затем прибавили FSO3H (2.35 г, 23.5 ммоля) при температуре 5-20°С, затем сухой CH2Cl2 (10 мл). Реакционную массу перемешивали при температуре 5-10°С в течение 0.25 ч, охладили до 5°С, осадок соли отфильтровали, промыли сухим CH2Cl2 (3×7 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона. Получили NO2FSO3 (2.95 г, 87%) в виде сыпучего порошка белого цвета. Найдено (%): N, 8.97. FNO5S. Вычислено (%): N, 9.66. ИК-спектр (вазелиновое масло), ν/см-1: 3759 ср., 2380 с. (NO2 +). КР-спектр, ν/см-1: 1404 о.с. (NO2+); 1300 сл., 1280 сл., 1136 сл., 1080 о.с., 784 сл., 756 сл., 735 ср., 598 ср., 586 ср., 564 с., 413 с., 397 с., 153 ср. уш. Соединение идентично известному по КР-спектру [P. Vast, М. Deporcq-Stratmains, Raman spectrum of nitryl fluorosulfonate, Compt. Rend., Ser. C: Sc. Chim., 1968, 267(6), 487-489].
Пример 10
К HNO3 (7.5 г, 5 мл, d20=1.5 г·см-3, 120 ммолей) прибавили HIO4·2H2O (2.28 г, 10 ммолей) и при перемешивании добавляли по каплям при температуре 30-32°С (CF3CO)2O (10 мл, 70 ммолей). Реакционная масса по завершении прибавления становится гомогенной, далее перемешивали при температуре 25°С в течение 20 мин, добавили сухой CH2Cl2 (20 мл), охладили до 5°С, осадок соли отфильтровали, промыли сухим CH2Cl2 (3×5 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона (азота). Получили NO2IO4 (2.09 г, 88%) в виде сыпучего порошка слегка желтого цвета. Найдено (%): N, 5.33. INO6. Вычислено (%): N, 5.91. ИК-спектр (вазелиновое масло), ν/см-1: 3736 с., 2366 с. (NO2 +). КР-спектр, ν/см-1: 1393 с. (NO2 +); 1101 сл., 897 сл., 858 с., 854 с., 842 с., 795 о.с., 775 ср., 718 сл., 678 сл., 564 ср., 551 сл., 475 сл., 338 ср., 324 с., 287 ср., 260 сл., 239 сл., 196 сл., 157 сл., 137 сл. уш.
Пример 11
К раствору смеси HNO3 (1.26 г, d20=1.5 г·см-3, 20 ммолей) и H2SO4 (2.09 г, d20=1.83 г·см-3, 20 ммолей) в сухом MeCN (5 мл) при перемешивании при температуре 15°С прибавляли (CF3CO)2O (13 мл) без охлаждения при самопроизвольном повышении температуры до 30-32°С в течение 5 мин. Реакционную массу перемешивали при температуре 25-30°С в течение 1 ч, затем добавили сухой CH2Cl2 (25 мл), охладили до 5°С, осадок соли отфильтровали, промыли сухим CH2Cl2 (4×8 мл), сушили на воронке Шотта при подаче вакуума, направляя на воронку сверху ток сухого аргона. Получили соль NO2(CF3CO)S2O7 (2.71 г, 85%) в виде бесцветных кристаллов. Найдено (%): С, 7.95; N, 5.08; S, 21.66. C2F3NO10S2. Вычислено (%): С, 7.53; N, 4.39; S, 20.09. ИК-спектр (вазелиновое масло), v/см-1: 3756 с., 2381 с. ( N O 2 + ) ; 1779 o.c. (CO); 1229 с., 1172 с. (CF3). КР-спектр, v/см-1: 1793 сл. (CO); 1405 с. ( N O 2 + ) ; 1069 o.c., 864 ср., 701 ср., 575 сл., 558 сл., 427 сл., 348 сл., 312 ср., 249 сл., 212 ср., 138 ср. уш.
1. Способ получения солей нитрония общей формулы:(NO2 +)n(CF3CO+)mX(n+m)-,где X(n+m)- - анион сильной кислоты формулы Y(SO3)k (n+m)-, где Y=CF3, F (n=1, m=0, k=1); Y=HO (n=1, m=0, k≥1); Y=О (n=1, m=1, k≥1,), Y=О (n=2, m=0, k≥1), или анион формулы HalO4 (n+m)-, где Hal=Cl, I (n=1, m=0),заключающийся в том, что соответствующую сильную кислоту Бренстеда общей формулы Н(n+m)Х, где X, n и m имеют вышеуказанные значения, подвергают взаимодействию с азотной кислотой и трифторуксусным ангидридом.
2. Способ по п.1, отличающийся тем, что процесс ведут при мольном соотношении H(n+m)X:HNO3:(CF3CO)2O равном 1:0,5-12:1,5-7.
3. Способ по п.1, отличающийся тем, что процесс ведут при температуре 0-35°С.