Способ получения динитрометил-onn-азоксисоединений
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к способу получения динитрометил-ONN-азоксисоединений общей формулы (I), которые могут найти применение в качестве полупродуктов в синтезе высокоэнергоемких производных. Способ осуществляют путем обработки нитрометил-ONN-азоксисоединений общей формулы (II) нитрующим агентом. При этом в качестве нитрующего агента используют смесь концентрированной азотной кислоты (HNO3) и тетраоксида диазота (N2O4). В формулах (I) и (II) Z представляет собой алкильный или N,O-содержащий гетероциклический радикал. Предлагаемый способ позволяет повысить выход целевых продуктов до 85% и сократить продолжительность реакции. 1 з.п. ф-лы, 6 пр.
Реферат
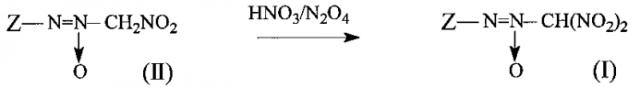
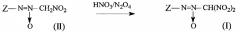
Предлагаемое изобретение относится к области органической химии, а именно, к химии производных полинитросоединений, конкретно, к способу получения динитрометил-ONN-азоксисоединений общей формулы:
,
где Z представляет собой алкильный или N,O-содержащий гетероциклический заместитель. Атом водорода в указанных соединениях может быть заменен на различные функциональные группы, в том числе эксплозофорные. Соединения формулы I предлагаются в качестве полупродуктов для синтеза высокоэнергоемких функциональных производных, которые могут найти применение в качестве окислителей, мощных взрывчатых веществ или компонентов взрывчатых составов, порохов и твердых ракетных топлив. (О.А. Лукьянов, Г.В. Похвиснева, Т.В. Терникова, "Бис(нитро- и полинитрометил-ONN-азокси)азоксифуразаны и некоторые их производные", Изв. АН, Сер. хим., 2012, 1767-1770).
В литературе описаны способы получения динитрометил-ONN-азоксисоединений общей формулы I. Соединения формулы I получают преимущественно из нитрометил-ONN-азоксисоединений общей формулы:
,
где Z представляет собой алкильный или N,O-содержащий гетероциклический заместитель, в том числе функционально замещенный.
Известен способ получения соединений формулы I путем нитрования нитрометил-ONN-азоксисоединений формулы II тетранитрометаном в присутствии KON (О.А. Лукьянов, Г.В. Похвиснева, Т.В. Терникова, Н.И. Шлыкова, Ю.Б. Саламонов, "Алифатические α-нитроалкил-ONN-азоксисоединения и их производные", Изв. АН, Сер. хим., 2009, 2000-2006). Однако этот метод имеет ряд существенных недостатков. Необходимый для указанных целей тетранитрометан является труднодоступным реагентом. Он опасен в обращении (смеси его с органическими веществами взрывоопасны, причем по мощности взрыва и чувствительности к механическим воздействиям они могут находиться на уровне нитроглицерина). Пары тетранитрометана чрезвычайно ядовиты. Помимо этого наряду с солью целевого продукта в ходе реакций указанного типа образуется калиевая соль нитроформа, которая является взрывчатым соединением и, кроме того, способна во время длительной сушки самовоспламеняться. Нейтрализация солей приводит к образованию в качестве побочного продукта нитроформа, отделение которого от целевых продуктов бывает затруднительно. Способ не универсален, так как для ряда нитрометильных производных указанного типа нитрование тетранитрометаном в щелочной среде вообще неприемлемо, так как приводит к разложению продуктов в ходе реакции. В остальных случаях выход целевых продуктов при нитровании таким методом невысок и составляет обычно не более 25-30%.
Известен также и принятый за прототип способ получения соединений формулы I путем нитрования нитрометил-ONN-азоксисоединений формулы II концентрированной азотной кислотой. О.А. Лукьянов, Г.В. Похвиснева, Т.В. Терникова, Н.И. Шлыкова, ("3,4-Бис(α-нитроалкил-ONN-азокси)фуразаны и некоторые их производные", Изв. АН, Сер. хим, 2012, 358-363). Выход целевых продуктов не превышал 30-35%. Кроме того, способ требовал длительного нагревания в течение 25-35 часов.
Задачей настоящего изобретения является повышение выхода целевого продукта и упрощения технологии его получения за счет сокращения времени реакции процесса.
Поставленная задача достигается предлагаемым способом получения динитрометил-ONN-азоксисоединений общей формулы:
,
где Z представляет собой алкильный или N,O-содержащий гетероциклический радикал, путем обработки нитрометил-ONN-азоксисоединений общей формулы:
, где Z имеет вышеуказанные значения, нитрующим агентом, отличающийся тем, что в качестве нитрующего агента используют смесь концентрированной азотной кислоты (HNO3) и тетраоксида диазота (N2O4).
HNO3 и N2O4 используют, преимущественно, в объемном соотношении 2÷4:1, соответственно.
Использование других соотношений азотной кислоты и тетраоксида диазота нецелесообразно, так как уменьшение содержания тетраоксида азота (<20%) приводит к замедлению скорости реакции, а дальнейшее увеличение (>50%) уже не приводит к повышению выхода целевого продукта и увеличению скорости реакции.
Процесс проводят в отсутствие растворителя, в плотно закрытом сосуде, в течение нескольких часов(от 2 до 15 часов) при температуре 20-55°C.
Процесс протекает по следующей схеме:
Исходные соединения общей формулы II получены на основе определенной последовательности реакций, состоящей в конденсации 2,2-диметил-5-нитро-5-нитрозо-1,3-диоксана с алифатическими или гетероциклическими аминами в присутствии дибромизоцианурата, последующем ацидолизе, щелочном гидролизе гидроксиметильных групп с одновременным бромированием и восстановлении дибромнитрометильных соединений до соответствующих нитрометильных соединений формулы II, согласно опубликованным способам (О.А. Лукьянов, Г.В. Похвиснева, Т.В. Терникова, Н.И. Шлыкова, Ю.Б. Саламонов, "Алифатические α-нитроалкил-ONN-азоксисоединения и их производные", Изв. АН, Сер. хим., 2009, 2000-2006); (О.А. Лукьянов, Г.В. Похвиснева, Т.В. Терникова, Н.И. Шлыкова, М.Е. Шагаева, "α-Нитроалкил-ONN-азоксифуразаны и некоторые их производные", Изв. АН. Сер. хим., 2011, 1678-1685); (О.А. Лукьянов, Г.В. Похвиснева, Т.В. Терникова, "Бис(нитро- и полинитрометил-ONN-азокси)азоксифуразаны и некоторые их производные", Изв. АН, Сер. хим., 2012, 1767-1770).
Техническим результатом предлагаемого изобретения является повышение выхода целевого продукта до 85% и упрощение технологии процесса за счет сокращениям времени его проведения. Кроме того, предлагаемый способ отличается от других известных ранее простотой и доступностью реагентов, а также повышенной безопасностью.
Настоящее изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1. Смесь 0.054 г (0.45 ммоль) (метил-NNO-азокси)нитрометана, 1.5 мл 95% HNO3 и 0.45 мл N2O4 перемешивали 2 ч при 20°C, в герметично закрытой колбе, затем реакционную массу вылили на лед, проэкстрагировали CH2Cl2 (3×5 мл), промыли водой (2×3 мл) и высушили над MgSO4. После вакуумной отгонки растворителя выделили 0.055 г (74%) (метил-NNO-азокси)динитрометана в виде масла. Найдено: C 14.82, H 2.38, N 33.52. C2H4N4O5. Вычислено: C 14.64, H 2.46, N 34.15. ИК-спектр (ν, см-1): 1596, 1520, 1320, 1290. Спектр ЯМР 1H (CDCl3, δ, м.д.): 3.52 (c, 3H, CH3), 7.40 (c, 1H, CH).
Пример 2. Смесь 0.05 г (0.307 ммоль) (трет-бутил-NNO-азокси)нитрометана, 1.6 мл 95% ΗΝΟ3 и 0.8 мл Ν2Ο4 перемешивали 3 ч при 20°C, в герметично закрытой колбе, затем реакционную массу вылили на лед, проэкстрагировали CH2Cl2 (3×5 мл), промыли водой (2×3 мл) и высушили над MgSO4. После вакуумной отгонки растворителя выделили 0.047 г (75%) (трет-бутил-NNO-азокси)динитрометана в виде масла. Найдено: C 29.54, H 5.10, N 27.29. C5H10N4O5. Вычислено: C 29.13, H 4.89, N 27.18. ИК-спектр (ν, см-1): 1600, 1508, 1316, 1240. Спектр ЯМР 1H (CDCl3, δ, м.д.): 1.42 (c, 9H, 3CH3), 7.37 (c, 1H, CH).
Пример 3. Смесь 0.049 г (0.26 ммоль) 3-(нитрометил-ONN-азокси)-4-метилфуразана, 1.4 мл 95% HNO3 и 0.7 мл N2O4 нагревали в герметично закрытой колбе 10 ч при 50-55°C и оставили на ночь при комнатной температуре. Реакционную массу вылили на лед, проэкстрагировали CH2Cl2 (3×5 мл), промыли водой (2×3 мл) и высушили над MgSO4. После упаривания растворителя выделили 0.045 г (75%) 3-(динитрометил-ONN-азокси)-4-метилфуразана в виде масла. Спектр ЯМР 1H (CDCl3, δ, м.д.): 2.48 (c, 3H, CH3), 7.88 (c, 1H, CH). Масс-спектр (ESI), m/z: 231.0120 [M-H]+, вычислено для C4H4N6O6, m/z: 231.01 [М-Н]+.
Пример 4. Смесь 0.1 г (0.45 ммоль) 3-(нитрометил-ONN-азокси)-4-нитрофуразана, 1.5 мл 95% HNO3 и 0.45 мл N2O4 нагревали в герметично закрытой колбе 4 ч при 40-45°C и оставили на ночь при комнатной температуре. Реакционную массу вылили на лед, проэкстрагировали CH2Cl2 (3×5 мл), промыли водой (2×3 мл), высушили над MgSO4 и упарили в вакууме. Полученный маслообразный остаток закристаллизовался после обработки гексаном. Выделили 0.1 г (83%) 3-(динитрометил-ONN-азокси)-4-нитрофуразана, т. пл. 70-71.5°C (из гексана). Найдено: C 13.72, H 0.35, N 37.18. C3HN7O8. Вычислено: C 13.69, H 0.38, N 37.26. Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.86 (c, 1H, CH). Спектр ЯМР 14N (CDCl3, δ, м.д.): -39.67 (c, 2NO2), -39.60 (c, NO2), -64.90 (уш. c, NO).
Пример 5. Смесь 0.199 г (0.65 ммоль) 3-(нитрометил-ONN-азокси)-4-(1-метил-1-нитроэтил-1-ONN-азокси)фуразана, 2 мл 95% HNO3 и 0.5 мл N2O4 нагревали в герметично закрытой колбе 8 ч при 50-53°C и оставили на ночь при комнатной температуре. Реакционную массу вылили на лед, проэкстрагировали CH2Cl2 (3×5 мл), промыли водой (2×3 мл), высушили над MgSO4 и упарили в вакууме. Полученный маслообразный остаток закристаллизовался после обработки гексаном. Выход 0.168 г (73%) 3-(динитрометил-ONN-азокси)-4-(1-метил-1-нитроэтил-1-ONN-азокси)фуразана, т. пл. 82-84°C (из смеси гексан-эфир). Найдено: C 20.80, H 1.38, N 35.94. C6H7N9O9. Вычислено: C 20.68, H 2.0, N 36.10. Спектр ЯМР 1H (CDCl3, δ, м.д.): 2.25 (с, 6H, 2CH). 7.75 (c, 1H, CH). Спектр ЯМР 13C (CDCl3, δ, м.д.): 25.05 (CH3), 113.03 (CH(NO2)2(CH3)2), 113.13 (CH(NO2)2), 149.43, 150.30 (оба-фуразан). Спектр ЯМР 14N (CDCl3, δ, м.д.): -4.55 (уш., NO2), -38.27 (NO2), -34.1 (уш., NO).
Пример 6. Смесь 0.1 г (0.26 ммоль) 3,3′-бис(нитрометил-ONN-азокси)азоксифуразана, 1.5 мл 95% HNO3 и 0.6 мл N2O4 нагревали в герметично закрытой колбе 12.5 ч при 45-48°C. Реакционную массу охладили, вылили на лед, отфильтровали выпавший осадок, промыли водой, высушили на воздухе. Выделили 0.092 г (75%) 3,3′-бис(динитрометил-ONN-азокси)азоксифуразана. Из водного раствора экстракцией CH2Cl2 выделили дополнительно 0.013 г продукта. Суммарный выход составил 0.105 г (85%), т. пл. 136-138°C (с разложением, из смеси гексана и эфира). Найдено: C 15.40; H 0.48; N 40.73. C6H2N14O7. Вычислено: C 15.06; H 0.42; N 41.00. ИК-спектр (ν, см-1): 1607, 1591, 1522, 1487, 1310. Спектр ЯМР 1H (ацетон d-6, δ, м.д.): 9.50 (с, 2H, 2CH). Спектр ЯМР 13C (ацетон d-6, δ, м.д.): 115.0 (CH(NO2)2), 148.99, 150.75, 150.87, 155.20. Спектр ЯМР 14N (ацетон d-6, δ, м.д.): -47.4 (NO), -34.1 (NO2).
1. Способ получения динитрометил-ONN-азоксисоединений общей формулы: ,где Z - алкильный или N,O-содержащий гетероциклический радикал, путем обработки нитрометил-ONN-азоксисоединений общей формулы: ,где Z имеет вышеуказанные значения, нитрующим агентом, отличающийся тем, что в качестве нитрующего агента используют смесь концентрированной азотной кислоты (HNO3) и тетраоксида диазота (N2O4).
2. Способ по п.1, отличающийся тем, что используют смесь концентрированной HNO3 и N2O4, взятых в объемном соотношении 2÷4:1, соответственно.