Способ, тест-система и праймеры для определения гаплогрупп y-хромосомы человека
Иллюстрации
Показать всеИзобретения относятся к области ДНК-генеалогии и касаются способа определения гаплогрупп Y-хромосомы человека, тест-системы и олигонулкотидных праймеров. Охарактеризованный способ осуществляют в два этапа. На первом этапе производят генотипирование по основным гаплогруппам R,N,J,I,Q,C,E,D,G,O Y-хромосомного древа путем мультиплексной ПЦР с использованием специфичных олигонуклеотидных праймеров первого и второго наборов тест-системы. На втором этапе, если мутация выявлена, проводят дополнительную мультиплексную ПЦР для типирования по субгаплогруппам. Если на первом этапе мутация не выявлена, проводят мультиплексную ПЦР для типирования по редким гаплогруппам A,C3,F,H,K,L,O3 и Т. Последовательностям из первого набора тест-системы соответствует область отжига праймеров вне зон мутаций в пределах видовой специфичности. Последовательностям из второго набора тест-системы соответствует область отжига олигонуклеотидных праймеров, непосредственно примыкающая к зоне мутации в пределах видовой специфичности. Изобретения могут быть использованы для установления гаплогрупп Y-хромосомы человека. 3 н.п.ф-лы, 2 ил.,7 табл., 2 пр.
Реферат
Изобретение относится к области ДНК-генеалогии, молекулярной биологии и биотехнологии и может быть использовано для установления гаплогрупп Y-хромосомы и этнической принадлежности человека. Изобретение будет представлять интерес для этнографов, антропологов, популяционных генетиков, людей, интересующихся историей своих предков или занимающихся поиском своих родственников среди однофамильцев, а также в криминалистике.
В ДНК-генеалогии, чтобы определить гаплогруппу Y-хромосомы нужно последовательно протипировать примерно около 300 SNP полиморфизмов, т.к. протипировав только один SNP полиморфизм, исследователь не сможет определить к какой этнической принадлежности относится человек, что связано с последовательным накоплением мутаций на Y-хромосоме. Традиционно для генотипирования однонуклеотидных полиморфизмов (SNP) Y-хромосомы используется иерархический алгоритм, согласно установленной последовательности накопления мутаций на Y-хромосоме [Cinnioglu С, King R., Kivisild Т. et al. Excavating Y-chromosome haplotype strata in Anatolia // Hum. Genet. - 2004 - V. 114. - P. 127-148.; Cruciani F., Santolamazza P., Shen P., et al. A Back Migration from Asia to Sub-Saharan Africa Is Supported by High-Resolution Analysis of Human Y-Chromosome Haplotypes // Am. J. Hum. Genet. - 2002. - V. 70. - P. 1197-1214.; Hammer M.F. A recent common ancestry for human Y-chromosomes // Nature. - 1995a. - V. 378. - P. 376-378.; Karafet Т. M., Mendez F. L., Meilerman M. В., et al. New binary polymorphisms reshape and increase resolution of the human Y chromosomal haplogroup tree. // Genome Res. 2008 18:830-838 originally published online April 2, 2008. - P. 830-838.; Karafet T.M., Osipova L.P., Gubina M.A. et al. High Levels of Y-chromosome differentiation among Native Siberian Populations and the Genetic Signature of a Doreal-Galherer Way of Life // Human Biology. - 2002. - V. 74. - №6. - P. 761-789.; Underhill P. A., Passarino G., Lin A. A. et al. The phylogeography of Y chromosome binary haplotypes and the origins of modern human populations // Ann. Hum. Genet. - 2001. - V. 65. P. 43-62.; Underhill P.A., Shen P., Lin A.A. et al. Y chromosome sequence variation and the history of human populations // Nat. Genet. - 2000. - V. 26. - 358-361]. Однако данный алгоритм очень трудоемок и подходит больше для рутинного использования в научно-исследовательских лабораториях и совершенно не пригоден для коммерческой ДНК-генеалогии.В настоящее время для определения гаплогрупп Y-хромосомы известны такие способы типирования однонуклеотидных полиморфизмов, как ПДРФ-анализ и TaqMan метод [Браун Т.А. Геномы. - М. - Ижевск: Институт компьютерных исследований. - 2011. - 944 с.; Ребриков Д.В. и др. ПЦР в реальном времени. - М.: БИНОМ. Лаборатория знаний, 2009. - 223 с., Luo Ziyi, Wu Yumei. Real-time fluorescence quantification PCR (Polymerase Chain Reaction) kit and method for detecting Y-chromosome micro-deletion. CN102876776 (A) 2013-01-16.]. Суть ПДРФ-анализа сводится к следующему: фермент - эндонуклеаза рестрикции связывается с молекулой ДНК в области определенной последовательности и делает двунитевой разрез в этой последовательности или около нее. После обработки ДНК эндонуклеазами рестрикции полученные фрагменты могут быть исследованы электрофорезом в агарозном геле [Браун Т.А. Геномы. - М. - Ижевск: Институт компьютерных исследований. - 2011. - 944 с]. Суть метода TaqMan состоит в том, что в данном подходе олигонуклеотид, комплементарный продукту ПЦР, метят флуорофором и гасителем флуоресценции. В отсутствии мишени флуорофор и гаситель сближены и флуоресценция подавлена. При накоплении соответствующего продукта реакции, проба гибридизуется на ампликон, что ведет к ее разрушению за счет 5′-эндонуклеазной активности Taq-полимеразы. Интенсивность сигнала возрастает с каждым циклом ПЦР пропорционально накоплению ампликонов [Ребриков Д.В. и др. ПЦР в реальном времени. - М.: БИНОМ. Лаборатория знаний, 2009. - 223 с.].
Существенными недостатками вышеуказанных способов является то, что за одну реакцию можно определить лишь один однонуклеотидный полиморфизм (SNP), что делает эти методы дорогими, требующими значительных затрат времени и человеческого труда.
Известны способы на основе чиповых технологий зарубежного производства, которые позволяют типировать большое количество одноноклеотидных полиморфизмов одновременно. Суть метода сводится к тому, что олигонуклеотиды синтезируются in situ на поверхности пластинки из стекла, кремния или полимера, в результате чего получается чип ДНК. При этом удается достичь плотности до 300000 олигонуклеотидов на см. кв., так что при использовании ДНК-чипов для типизации SNP в одном эксперименте могут быть типизированы 150000 полиморфизмов (при условии, что в наличии имеются олигонуклеотиды для обеих аллелей каждого SNP [Браун Т.А. Геномы. - М. - Ижевск: Институт компьютерных исследований. - 2011. - 944 с]. Однако данные технологии для определения этнической принадлежности очень дорогостоящи, требуют соответствующих технологических платформ для анализа чипов, расходные материалы очень дороги и, соответственно, дороги услуги, оказываемые на основе данных технологий.
Известен способ по патенту США № US 20030225530 А1, опубл. 04.12.2003, предназначенный для судебной медицины и идентификации личности, позволяющий получить дополнительную информацию о этнических характеристиках личности по образцу ДНК, сущность которого заключается в использовании базы данных, содержащей информацию о наличии и/или идентичности одной или более вариаций в одном или нескольких локусах ДНК (HUMVWFA31, HUMTH01, HUMFIBRA, D8S1179, D21S11, D18S51, D3S1358, D2S1338, D16S539 или D19S433) для множества эталонных образцов с известной физической характеристикой, образующих группировки, имеющие общие признаки по частоте встречаемости конкретного локуса.
Недостатком способа является то, что его использование не позволяет определить этническую принадлежность человека по гаплогруппе Y-хромосомы.
Известен способ определения детекции микроделеций Y-хромосомы [Luo Ziyi, Wu Yumei. Real-time fluorescence quantification PCR (Polymerase Chain Reaction) kit and method for detecting Y-chromosome micro-deletion. CN102876776 (A) 2013-01-16]. Изобретение реализуется с помощью флуоресцентной количественной полимеразной цепной реакции в реальном времени методом детекции микроделеций Y-хромосомы, в котором проведение ПЦР основано на том, что праймер-зонд подбирается для детекции определенного локуса: комбинация праймер-зонд для детекции локуса SY84, комбинация праймер-зонд для детекции локуса SY127, комбинация праймер-зонд для детекции локуса SY134, комбинация праймер-зонд для детекции локуса SY254, комбинация праймер-зонд для детекции локуса SY255. Микродилеции в локусах Y-хромосомы могут быть обнаружены посредством сочетания флуоресцентной количественной ПЦР в реальном времени и Taqman зондов с помощью флуоресцентной количественной ПЦР в реальном времени. Флуоресцентные сигналы каждого цикла ПЦР увеличиваются пропорционально накоплению продукта.
Основным недостатком данного способа также является длительность определения полиморфизмов Y-хромосомы, так как для определения каждого SNP локуса необходимо последовательное проведение ПЦР реакции с каждым праймером.
Этого недостатка лишен способ определения чистопородности животных - объектов сельскохозяйственного назначения, принятый за прототип, по патенту РФ №2477607, опубл. 20.03.2013, включающий выделение ДНК из биологического материала, проведение мультиплексной ПЦР реакции 13 локусов микросателлитов (TGLA126, ILSTS005, ЕТН185, TGLA122, INRA023, ILSTS006, TGLA227, ЕТН225, ЕТН10, ВМ1818, ВМ1824, SPS115), с использованием тест-системы для ДНК-экспертизы животных и анализ образующихся продуктов на ДНК-анализаторе.
Недостатком данного технического решения является то, что он предназначен для ДНК-экспертизы животных и не может быть использован для определения гаплогруппы Y-хромосомы и этнической принадлежности человека по образцу ДНК.
В настоящее время из уровня техники не известен экспресс-способ на основе мультиплексного определения гаплогрупп Y-хромосомы и установления этнической принадлежности человека с помощью тест-системы, который мог быть использован в ДНК-генеалогических исследованиях, поэтому внедрение на рынок такого способа представляется очень актуальным.
Известна тест-система «Набор для детекции микроделеций Y-хромосомы», которая включает в себя: 1) реагенты для ПЦР реакции; 2) праймеры для амплификации последовательности SY84 области AZFa Y-хромосомы; праймеры для амплификации последовательности SY86 области AZFa региона Y-хромосомы; праймеры для амплификации последовательность SY127 AZFb области Y-хромосомы; праймеры для амплификации последовательности SY134 AZFb области Y-хромосомы; праймеры для амплификации последовательности SY254 AZFc области Y-хромосомы; праймеры для амплификации последовательности SY255 AZFc области Y-хромосомы, и праймеры для амплификации гена SRY, описанная в источнике [Kun Song; Jiancheng Xu; Shuyi Wang; Cuilian Sun. Nanchang adicon clinical tersting inst со ltd. Kit for detecting microdeletion of Y chromosome CN102796819 (A) 2012-11-28.]. Данная тест-система, выбранная за прототип предлагаемой тест-системы, предусматривает последовательное проведение ПЦР реакции с каждым праймером. Недостатком является невозможность проведения мультиплексного анализа, что определяет длительность определения полиморфизмов Y-хромосомы человека.
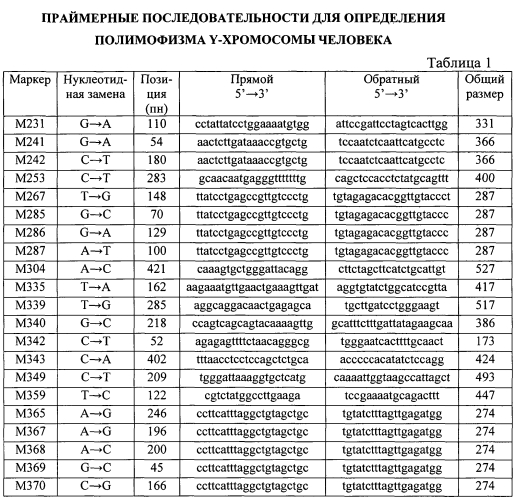
Известны праймерные последовательности для определения полимофизма Y-хромосомы человека, приведенные в публикациях [Cinnioglu С., King R., Kivisild Т. et al. Excavating Y-chromosome haplotype strata in Anatolia // Hum. Genet. - 2004. - V.114. - P.127-148; Underhill P. A., Passarino G., Lin A. A. et al. The phylogeography of Y chromosome binary haplotypes and the origins of modern human populations // Ann. Hum. Genet. - 2001. - V.65. P.43-62]. Однако данные праймерные последовательности (Табл.1) не отвечают требованиям для мультиплексного анализа SNP полиморфизмов Y-хромосомы, т.к. имеют различные физические характеристики.
Задачей предлагаемой группы изобретений является создание способа, тест-системы и праймеров для определения гаплогрупп Y-хромосомы и этнической принадлежности человека, которые путем мультиплексного анализа позволят определить одновременно несколько однонуклеотидных полиморфизмов Y-хромосомы человека.
Техническим результатом предложенной группы изобретений является то, что при генотипировании SNP полиморфизмов Y-хромосомы человека путем мультиплексного анализа за два этапа можно протипировать сразу около 20 SNP маркеров для одного образца ДНК, т.е. быстро, абсолютно точно и надежно определить гаплогруппу, субгаплогруппу и этническую принадлежность человека по образцу ДНК.
Для достижения поставленной задачи предложен способ, включающий выделение ДНК из биологического материала, проведение мультиплексной ПЦР реакции с использованием тест-системы, анализ образующихся продуктов на ДНК-анализаторе, в который внесены следующие новые признаки: способ осуществляют в два этапа с использованием тест-системы, содержащей два набора: при этом на первом этапе производят генотипирование путем мультиплексной ПЦР реакции с использованием мультиплексов 20-ти специфичных олигонуклеотидных праймеров для генотипирования по основным гаплогруппам N, J, I, Q, С, Е, D, G, О Y-хромосомного древа из первого набора тест-системы, затем очищают ПЦР-амплификат на колонках и путем мультиплексного анализа осуществляют SNaPshot реакцию с использованием мультиплексов 10-ти специфичных олигонуклеотидных праймеров для генотипирования по основным гаплогруппам из второго набора тест-системы, затем на втором этапе по результатам анализа, если на первом этапе мутация выявлена, проводят генотипирование путем мультиплексной ПЦР реакции по субгаплогруппам с использованием мультиплексов 62-х специфичных олигонуклеотидных праймеров для генотипирования по субгаплогруппам из первого набора тест-системы и затем после очистки амплификата помощью колонок проводят SNaPshot реакцию путем мультиплексного анализа с использованием мультиплексов 28-ми специфичных олигонуклеотидных праймеров для генотипирования по субгаплогруппам из второго набора тест-системы, либо, если на первом этапе мутация не выявлена, проводят генотипирование по редким гаплогруппам: А, С3, F, Н, K, L, O3, Т с использованием мультиплексов 16-ти специфичных олигонуклеотидных праймеров для генотипирования по редким гаплогруппам из первого набора тест-системы, после очистки амплификата помощью колонок проводят SNaPshot реакцию путем мультиплексного анализа с использованием мультиплексов 8-ми специфичных олигонуклеотидных праймеров для генотипирования по редким гаплогруппам из второго набора тест-системы, очищают образующиеся продукты ферментом TSAP, после чего осуществляют анализ.
В результате, как при наличии мутации, так и без нее за два этапа будет генотипировано сразу около 20 SNP маркеров для одного образца ДНК и со 100% точностью будет определена субгаплогруппа, что значительно удешевляет и ускоряет само исследование. Нет необходимости последовательно генотипировать образец ДНК на все известные SNP маркеры Y-хромосомы, которых около 300, чтобы установить субгаплогруппу и этническую принадлежность человека.
На фиг. 1 представлена схема генотипирования SNP Y-хромосомы соответственно предложенному способу.
На фиг. 2 представлена схема определения субгаплогрупп Y-хромосомы с указанием соответствующих маркеров соответственно предложенному способу.
Для осуществления заявленного способа предложена тест-система, содержащая набор, в который входят смесь для ПЦР реакции и наборы праймеров для амплификации последовательности ДНК, в которую внесены следующие новые признаки: в состав тест-системы дополнительно входит второй набор для проведения SNaPshot реакции, при этом первый набор включает:
1. Смесь для ПЦР реакции - 1,5 мл.
2. Мультиплексные наборы специфичных олигонуклеотидных праймеров каждый по 1,5 мл.
2.1. Мультиплексы 20 специфичных олигонуклеотидных праймеров для генотипирования по основным гаплогруппам R, N, J, I, Q, С, Е, D, G, О Y-хромосомного древа, SNP маркеры: М207, М231, М304, M170, М242, М216, М96, M174, M201, P186, последовательности которых и соответствующие им SNP маркеры представлены в Таблице 2;
2.2. Мультиплексы 62 специфичных олигонуклеотидных праймеров для генотипирования по субгаплогруппам, последовательности которых и соответствующие им SNP маркеры представлены в Таблице 3;
2.3. Мультиплексы 10 специфичных олигонуклеотидных праймеров для генотипирования редких гаплогрупп - А, С3, F, Н, K, L, O3, Т, последовательности которых и соответствующие им SNP маркеры представлены в Таблице 4.
Второй набор для проведения SNaPshot реакции содержит мультиплексные наборы специфичных олигонуклеотидных праймеров каждый по 1,5 мл:
1. Мультиплексы 10 специфичных олигонуклеотидных праймеров для генотипирования по основньм гаплогруппам Y-хромосомы, последовательности которых и соответствующие им SNP маркеры представлены в Таблице 5;
2. Мультиплексы 28 специфичных олигонуклеотидных праймеров для генотипирования по субгаплогруппам, последовательности которых и соответствующие им SNP маркеры представлены в Таблице 6;
3. Мультиплексы 8 специфичных олигонуклеотидных праймеров для генотипирования редких гаплогрупп, последовательности которых и соответствующие им SNP маркеры представлены в Таблице 7.
Для осуществления способа определения гаплогрупп Y-хромосомы и этнической принадлежности человека разработаны специфичные олигонуклеотидные праймеры, используемые в качестве мультиплексных наборов тест-системы для амплификации участков нерекомбинирующей части Y-хромосомы.
Дизайн специфичных олигонуклеотидных праймеров (таблицы 2, 3 и 4) для первого набора осуществлялся на основе следующих принципов: область отжига олигонуклеотидных праймеров должна быть вне зон мутаций в пределах видовой специфичности в диапазоне 55-64°С; GC-состав в диапазоне 40-60%; в последовательности праймера должны отсутствовать стабильные вторичные структуры - шпильки и димеры.
Дизайн специфичных олигонуклеотидных праймеров (таблицы 5, 6 и 7) для второго набора осуществлялся на основе следующих принципов: область отжига олигонуклеотидных праймеров должна непосредственно примыкать к зоне мутации в пределах видовой специфичности в диапазоне 50°С±2°С; в последовательности праймера должны отсутствовать стабильные вторичные структуры - шпильки и димеры; к 5′ концам каждого праймера необходимо присоединить GACT-хвосты в соответствии с заданной длиной олигонуклеотидного праймера.
Чтобы исключить амплификацию нецелевых локусов, уникальность каждого праймера была подтверждена поиском по базе данных секвенированных геномов http://www.ensembl.org.
Заявленный способ на основе предложенной тест-системы, содержащей разработанные специфичные олигонуклеотидные праймеры, осуществляют следующим образом.
ДНК выделяют из любого биологического материала (буккальный эпителий, волосы, ногти или кровь), любым способом, подходящим для выделения ДНК из конкретного вида биоматериала.
Сначала на первом этапе выделенную ДНК подвергают мультиплексной полимеразной цепной реакции синтеза SNP локусов Y-хромосомы для геногенотипирования по основным гаплогруппам - R, N, J, I, Q, С, Е, D, G, О Y-хромосомного древа с использованием мультиплексов 20 специфичных олигонуклеотидных праймерных смесей из первого набора тест-системы (табл.2). Амплификат, наработанный при ПЦР, подвергают очистке с помощью колонок. Далее проводят SNaPshot реакцию с использованием мультиплексов 10 специфичных олигонуклеотидных праймеров (табл.5) из второго набора тест-системы, очищают продукты SNaPshot реакции ферментом TSAP, осуществляют анализ на ДНК анализаторе методом капиллярного гель-электрофореза. На втором этапе, в случае если на первом этапе выявлена мутация, проводят генотипирование по субгаплогруппам с использованием мультиплексов 62 специфичных олигонуклеотидных праймеров (табл.3) для генотипирования по субгаплогруппам из первого набора тест-системы, после очистки амплификата помощью колонок проводят SNaPshot реакцию путем мультиплексного анализа с использованием мультиплексов специфичных олигонуклеотидных праймеров (табл.6) для типирования по субгаплогруппам из второго набора тест-системы, а если на первом этапе мутация не выявлена, проводят генотипирование по редким гаплогруппам: А, С3, F, Н, K, L, O3, Т с использованием мультиплексов специфичных олигонуклеотидных праймеров (табл.4) для типирования по редким гаплогруппам из первого набора тест-системы, после очистки амплификата помощью колонок проводят SNaPshot реакцию с использованием мультиплексов специфичных олигонуклеотидных праймеров (табл.7) для типирования по редким гаплогруппам из второго набора тест-системы, очищают образующиеся на втором этапе продукты ферментом TSAP, после чего осуществляют анализ на ДНК анализаторе методом капиллярного гель-электрофореза.
Полимеразную цепную реакцию (ПЦР) синтеза SNP локусов Y-хромосомы выполняют в реакционной смеси объемом 25 мкл, 67 мМ трис-HCl (рН=8,8), 2,5 мМ MgCl2, 1 нг геномной ДНК, по 10 пМ каждого праймера, по 200 мкМ dATP, dGTP, dCTP, dTTP и 1 единицу активной Taq-полимеразы. Режим проведения ПЦР следующий: 1) денатурация 94°С - 3 мин. 30 сек.; 40 циклов: 2) денатурация 94°С - 30 сек.; отжиг праймеров: 55°С-64°С - 30 сек.; элонгация 72°С - 1 мин.; 3) финальная элонгация 72°С -10 мин.
SNaPshot реакцию осуществляют по протоколу фирмы производителя: реакционная смесь - 5 мкл.; специфичные праймеры - 1 мкл.; деонизованная вода - 1 мкл; амплификат - 3 мкл. по следующему режиму: 25 циклов 1) денатурация 96°С - 10 сек.; 2) отжиг праймеров: 50°С - 5 сек.; 3) элонгация 60°С - 30 сек.
Для очистки продукта SNaPshot реакции ферментом TSAP: добавляют 1 мкл. фермента TSAP; схема проведения очистки: 37°С - 60 мин.; 75°С - 15 мин. Затем осуществляют детекцию на ДНК анализаторе методом капиллярного гель-электрофореза.
Примеры осуществления группы заявленных изобретений.
1). У гражданина М. взят образец биологического материала - буккальный эпителий. Произведено выделение ДНК стандартным методом. Далее проведена ПЦР реакция по следующему протоколу: деонизованная вода - 12,8; буфер - 2,5; MgCl2 - 2,5 мкл; мультиплексы специфичных олигонуклеотидных праймеров для генотипирования по основным гаплогруппам (табл.2) из первого набора тест-системы - 5,5 мкл.; dNTP - 0,2 мкл.; Taq-полимераза - 0,5 мкл.; ДНК - 1 мкл. Режим ПЦР: 1) денатурация 94°С - 3 мин. 30 сек.; 40 циклов: 2) денатурация 94°С - 30 сек.; отжиг праймеров: 64°С - 30 сек.; элонгация 72°С - 1 мин.; 3) финальная элонгация 72°С - 10 мин. Амплификат очищен на колонках согласно инструкции фирмы производителя. Далее проведена SNaPshot реакция по протоколу фирмы производителя: реакционная смесь - 5 мкл; мультиплексы специфичных олигонуклеотидных праймеров (табл.5) для генотипирования по основным гаплогруппам из второго набора тест-системы - 1 мкл.; деонизованная вода - 1 мкл; амплификат - 3 мкл. по следующему режиму: 25 циклов 1) денатурация 96°С - 10 сек.; 2) отжиг праймеров: 50°С - 5 сек.; 3) элонгация 60°С - 30 сек. Проведена очистка SNaPshot продукта ферментом TSAP путем добавления 1 мкл. фермента TSAP; схема проведения очистки: 37°С - 60 мин.; 75°С - 15 мин. Проведен анализ на ДНК анализаторе методом капиллярного гель-электрофореза по следующему протоколу фирмы производителя: Hi-Di формамид - 9 мкл.; LIZ120 - 0,5 мкл.; продукт - 0,5 мкл. Результат оценивался по следующим признакам: аллель А - зеленый сигнал; аллель Т - красный сигнал; аллель G - синий сигнал; аллель С - черный сигнал. Каждому локусу должен соответствовать один из нижеприведенных вариантов:
М96 - С→А (38-41 bp) гаплогруппа Е
М231 - G→A (42-45 bp) гаплогруппа N
M216 - G→A (48-51 bp) гаплогруппа С
M170 - A→G (54-57 bp) гаплогруппа I
M174 - T→C (60-63 bp) гаплогруппа D
M201 - C→A (66-69 bp) гаплогруппа G
M207 - A→G (72-75 bp) гаплогруппа R
M304 - A→ (78-81 bp) гаплогруппа J
P186 - C→A (90-93 bp) гаплогруппа О
M242 - G→A (96-99 bp) гаплогруппа Q
Получен следующий результат:
М96 - С (38-41 bp)
M231 - G (42-45 bp)
M216 - G (48-51 bp)
M170 - A (54-57 bp)
M174 - Т (60-63 bp)
M201 - С (66-69 bp)
M207 - G (72-75 bp)
M304 - A (78-81 bp)
P186 - С (90-93 bp)
M242 - G (96-99 bp)
Результат анализа по основным гаплогруппам показал выявление европейской гаплогруппы R, поэтому на втором этапе определения субгаплогруппы использовали специфичные праймеры (табл.3) для генотипирования по субгаплогруппам из первого набора тест-системы.
ПЦР реакция на втором этапе проведена по следующему протоколу: деонизованная вода - 12,8; буфер - 2,5; MgCl2 - 2,5 мкл; мультиплексы специфичных олигонуклеотидных праймеров (табл.3) для генотипирования по субгаплогруппам - 5,5 мкл; dNTP - 0,2 мкл; Taq-полимераза - 0.5 мкл; ДНК - 1 мкл. Режим ПЦР: 1) денатурация 94°С - 3 мин. 30 сек.; 40 циклов: 2) денатурация 94°С - 30 сек.; отжиг праймеров: 64°С - 30 сек.; элонгация 72°С - 1 мин.; 3) финальная элонгация 72°С - 10 мин. Амплификат очищен на колонках согласно инструкции фирмы производителя. Далее проведена SNaPshot реакция по протоколу фирмы производителя: реакционная смесь - 5 мкл; мультиплексы специфичных олигонуклеотидных праймеров (табл.6) для генотипирования по субгаплогруппам из второго набора тест-системы - 1 мкл; деонизованная вода - 1 мкл; амплификат - 3 мкл, по следующему режиму: 25 циклов 1) денатурация 96°С - 10 сек.; 2) отжиг праймеров: 50°С - 5 сек.; 3) элонгация 60°С - 30 сек. Проведена очистка SNaPshot продукта ферментом TSAP путем добавления 1 мкл. фермента TSAP по схеме проведения очистки: 37°С - 60 мин.; 75°С - 15 мин. Проведен анализ на ДНК анализаторе методом капиллярного гель-электрофореза по следующему протоколу фирмы производителя: Hi-Di формамид - 9 мкл.; LIZ120 - 0,5 мкл.; продукт - 0,5 мкл. Результат оценивался по следующим признакам: аллель А - зеленый сигнал; аллель Т - красный сигнал; аллель G - синий сигнал; аллель С - черный сигнал. Каждому локусу должен соответствовать один из нижеприведенных вариантов:
М173 - Т→С (80-83 bp) гаплогруппа R1
М343 - А→С (56-59 bp) гаплогруппа R1b
M17 - del G (44-47 bp) - при выявлении del G будет выявляться аллель Т соответствующий гаплогруппе R1a1, отсутствие del G соответствует отсутствию мутации
М417 - G→A (68-71 bp) гаплогруппа R1a1a1
М73 - del AC (38-41 bp) гаплогруппа R1b1b1
M269 - T→C (50-53 bp) гаплогруппа R1b1b2
M124 - G→A (62-65 bp) гаплогруппа R2
Получен следующий результат:
М173 - С (80-83 bp) гаплогруппа R1
М343 - А (56-59 bp) гаплогруппа R1b
M17 - del G (44-47 bp) - выявлен аллель Т
М417 - G (68-71 bp) гаплогруппа R1a1a1
М73 - nondel AC (38-41 bp) гаплогруппа R1b1b1
M269 - Т (50-53 bp) гаплогруппа R1b1b2
M124 - G (62-65 bp) гаплогруппа R2
Результат анализа по субгаплогруппам выявил субгаплогруппу R1a1.
Следовательно, этническая принадлежность гражданина М. - европейская, а конкретнее - восточно-европейская.
2). У гражданина N. взят образец биологического материала - буккальный эпителий. Произведено выделение ДНК стандартным методом. На первом этапе проведена ПЦР реакция по следующему протоколу: деонизованная вода - 12,8; буфер - 2,5; MgCl2 - 2,5 мкл; мультиплексы специфичных олигонуклеотидных праймеров (табл.2) для генотипирования по основным гаплогруппам из первого набора тест-системы - 5,5 мкл.; dNTP - 0,2 мкл.; Taq-полимераза - 0,5 мкл.; ДНК - 1 мкл. Режим ПЦР: 1) денатурация 94°С - 3 мин. 30 сек.; 40 циклов: 2) денатурация 94°С - 30 сек.; отжиг праймеров: 64°С - 30 сек.; элонгация 72°С - 1 мин.; 3) финальная элонгация 72°С - 10 мин. Амплификат очищен на колонках согласно инструкции фирмы производителя. Далее проведена SNaPshot реакция по протоколу фирмы производителя: реакционная смесь - 5 мкл; мультиплексы специфичных олигонуклеотидных праймеров (табл.5) для генотипирования по основным гаплогруппам из второго набора тест-системы - 1 мкл.; деонизованная вода - 1 мкл; амплификат - 3 мкл. по следующему режиму: 25 циклов 1) денатурация 96°С - 10 сек.; 2) отжиг праймеров: 50°С - 5 сек.; 3) элонгация 60°С - 30 сек. Проведена очистка SNaPshot продукта ферментом TSAP путем добавления 1 мкл. фермента TSAP.; схема проведения очистки: 37°С - 60 мин.; 75°С - 15 мин. Проведен анализ на ДНК анализаторе методом капиллярного гель-электрофореза по следующему протоколу фирмы производителя: Hi-Di формамид - 9 мкл; LIZ120 - 0,5 мкл.; продукт - 0,5 мкл. Результат оценивался по следующим признакам: аллель А - зеленый сигнал; аллель Т - красный сигнал; аллель G - синий сигнал; аллель С - черный сигнал. Каждому локусу должен соответствовать один из нижеприведенных вариантов:
М96 - С→А (38-41 bp) гаплогруппа Е
М231 - G→A (42-45 bp) гаплогруппа N
M216 - G→A (48-51 bp) гаплогруппа С
M170 - А→G (54-57 bp) гаплогруппа I
M174 - T→C (60-63 bp) гаплогруппа D
M201 - C→A (66-69 bp) гаплогруппа G
M207 - А→G (72-75 bp) гаплогруппа R
M304 - A→C (78-81 bp) гаплогруппа J
P186 - C→A (90-93 bp) гаплогруппа О
M242 - G→A (96-99 bp) гаплогруппа Q
Получен следующий результат:
М96 - С (38-41 bp)
М231 - G (42-45 bp)
M216 - G (48-51 bp)
M170 - A (54-57 bp)
M174 - Т (60-63 bp)
M201 - С (66-69 bp)
M207 - A (72-75 bp)
M304 - A (78-81 bp)
P186 - С (90-93 bp)
M242 - G (96-99 bp)
Результат анализа по основным гаплогруппам показал отсутствие мутаций, ни одна гаплогруппа не определилась, поэтому на втором этапе использованы мультиплексы специфичных олигонуклеотидных праймеров (табл.4) для генотипирования по редким гаплогруппам из первого набора тест-системы.
На втором этапе для определения редких гаплогрупп проведена ПЦР реакция для определения редких гаплогрупп по следующему протоколу: деонизованная вода - 12,8; буфер - 2,5; MgCl2 - 2,5 мкл; мультиплексы специфичных олигонуклеотидных праймеров (табл.4) для генотипирования по редким гаплогруппам - 5,5 мкл.; dNTP - 0,2 мкл; Taq-полимераза - 0,5 мкл; ДНК - 1 мкл. Режим ПЦР: 1) денатурация 94°С - 3 мин. 30 сек.; 40 циклов: 2) денатурация 94°С - 30 сек.; отжиг праймеров: 64°С - 30 сек.; элонгация 72°С - 1 мин.; 3) финальная элонгация 72°С - 10 мин. Амплификат очищен на колонках согласно инструкции фирмы производителя. Далее проведена SNaPshot реакция по протоколу фирмы производителя: реакционная смесь - 5 мкл; мультиплексы специфичных олигонуклеотидных праймеров (табл.7) для генотипирования по редким гаплогруппам - 1 мкл; деонизованная вода - 1 мкл; амплификат - 3 мкл по следующему режиму: 25 циклов 1) денатурация 96°С - 10 сек.; 2) отжиг праймеров: 50°С - 5 сек.; 3) элонгация 60°С - 30 сек. Проведена очистка SNaPshot продукта ферментом TSAP путем добавления 1 мкл фермента TSAP; схема проведения очистки: 37°С - 60 мин.; 75°С - 15 мин. Проведен анализ на ДНК анализаторе методом капиллярного гель-электрофореза по следующему протоколу фирмы производителя: Hi-Di формамид - 9 мкл.; LIZ120 - 0,5 мкл; продукт - 0,5 мкл Результат оценивался по следующим признакам: аллель А - зеленый сигнал; аллель Т - красный сигнал; аллель G - синий сигнал; аллель С - черный сигнал. Каждому локусу должен соответствовать один из нижеприведенных вариантов:
М91 - А→G (50-54 bp) гаплогруппа А
М217 - А→С (68-70 bp) гаплогруппа С3
М89 - С→T (56-59 bp) гаплогруппа F
М69 - А→G (62-65 bp) гаплогруппа Н
М9 - С→G (84-87 bp) гаплогруппа K
M11 - A→G (38-42 bp) гаплогруппа L
M122 - A→G (50-54 bp) гаплогруппа O3
М70 - Т→G (44-47 bp) гаплогруппа Т
Получен следующий результат:
М91 - А (50-54 bp) гаплогруппа А
М217 - А (68-70 bp) гаплогруппа С3
М89 - С (56-59 bp) гаплогруппа F
М69 - A (62-65 bp) гаплогруппа Н
М9 - G (84-87 bp) гаплогруппа K
M11 - G (38-42 bp) гаплогруппа L
M122 - A (50-54 bp) гаплогруппа O3
M70 - Т (44-47 bp) гаплогруппа Т
Результат анализа по редким гаплогруппам выявил гаплогруппу L, следовательно этническая принадлежность гражданина N - южно-азиатская.
Таким образом, приведенные примеры подтверждают, что заявленный способ, который осуществляется предложенной тест-системой, содержащей разработанные специфичные олигонуклеотидные праймеры, позволяет всего за два этапа генотипировать сразу около 20 SNP маркеров для одного образца ДНК и со 100% точностью определить гаплогруппу и этническую принадлежность человека, что значительно удешевляет и ускоряет само исследование.
Список литературы
1. Bosch Е., Calafell F., Comas D. et al. High-resolution analysis of human Y-chromosome variation shows a sharp discontinuity and limited gene flow between northwestern Africa and the Iberian Peninsula // Am. J. Hum. Genet. - 2001. - V. 68. - P. 1019-1029.
2. Cruciani F., La Fratta R., Santolamazza P. et al. Phylogeographic Analysis of Haplogroup ЕЗЬ (E-M215) Y Chromosomes Reveals Multiple Migratory Events Within and Out Of Africa // Am. J. Hum. Genet. - 2004. - V. 74. - P. 1014-1022.
3. Cruciani F., La Fratta R., Torroni A. et al. Molecular Dissection of the Y Chromosome Haplogroup E-M78 (E3bla): A Posteriori Evaluation of a Microsatellite-Network-Based Approach Through Six New Biallelic Markers // Human mutation Mutation in Brief. - 2006. - P. 1-10.
4. Di Giacomo F., Luca F., Popa L. O. et al. Y chromosomal haplogroup J as a signature of the post-neolithic colonization of Europe // Hum. Genet. - 2004. - V. 115. - P. 357-371.
5. Hammer M.F., Karafet Т., Rasanayagam A. et al. Out of Africa and back again: nested cladistic analysis of human Y chromosome variation // Mol. Biol. Evol. - 1998. - V. 15. - P. 427-441.
6. Hammer M. F., Chamberlain V. F, Kearney V. F. et al. Population structure of Y chromosome SNP haplogroups in the United States and forensic implications for constructing Y chromosome STR databases // Forensic Science International. - 2005. - P. 1-11.
7. Karafet T.M., Zegura S.L., Posukh O. et al. Ancestral Asian source of New World Y-chromosome founder haplotypes // Am. J. Hum. Genet. - 1999. - V. 64. - P.817-831.
8. Karafet T.M., Mendez F. L., Meilerman M. В., et al. New binary polymorphisms reshape and increase resolution of the human Y chromosomal haplogroup tree // Genome Res. - 2008. - P. 830-838.
9. Rootsi S, Magri C, Kivisild T. et. al. Phylogeography of Y-Chromosome Haplogroup I Reveals Distinct Domains of Prehistoric Gene Flow in Europe // Am. J. Hum. Genet. - 2004. - V. 75. - P. 128-137.
10. Rootsi S., Zhivotovsky L.A., Baldovic M. et al. A counter-clockwise northern route of the Y-chromosome haplogroup N from Southeast Asia towards Europe // European Journal of Human Genetics. - 2006. - P. 1-8.
11. Semino O., Passarino G., Brega A. et al. A view of the Neolithic demic diffusion in Europe through two Y chromosome-specific markers // Am. J. Hum. Genet. - 1996 - V. 59. - P. 964-968.
12. Semino O., Passarino G., Oefner P. J. et al. The Genetic Legacy of Paleolithic Homo sapiens sapiens in Extant Europeans: A Y Chromosome Perspective // Science. - 2000. - V. 290. - P. 1155-1159.
13. The Y Chromosome Consortium 1. A Nomenclature System for the Tree of Human Y-Chromosomal Binary Haplogroups // Genome Research. - 2002. - V. 12. - P. 339-348.
14. Underhill P.A., Jin, L. Zemans R. et al. A pre-Columbian Y chromosome-specific transition and its implications for human evolutionary history // Proc. Natl. Acad. Sci. - 1996. - V. 93. - P. 196-200.
15. Underhill P.A., Jin L., Lin A. A. et al. Detection of numerous Y chromosome biallelic polymorphisms by denaturing high-performance liquid chromatography // Genome Res. - 1997. - V. 7. - P. 996-1005.
16. Underhill P.A., Shen P., Lin A.A. et al. Y chromosome sequence variation and the history of human populations // Nat. Genet. - 2000. - V. 26. - 358-361.
17. Underhill P. A., Passarino G., Lin A. A. et al. The phylogeography of Y chromosome binary haplotypes and the origins of modern human populations // Ann. Hum. Genet. - 2001. - V. 65. P. 43-62.
18. Wells R. S., Yuldasheva N., R. Ruzibakiev et al. The Eurasian Heartland: A continental perspective on Y-chromosome diversity // PNAS. - 2001. - V. 98, №18. - P. 10244-10249.
19. Whit Athey T. and Nordtvedt K. Resolving the Placement of Haplogroup I-M223 in the YChromosome Phylogenetic Tree // Journal of Genetic Genealogy. - 2005. - P. 54-55.
20. Zegura S.L., Karafet T.M., Zhivotovsky L.A. et al. High-Resolution SNPs and Microsatellite Haplotipes Point to a Single, Recent Entry of Native American Y-Chromosomes into the Americas // Moi. Biol. Evol. - 2004. - V. 21. - P. 164-175.
21. Zerjal Т., Dashnyman В., Pandya A et al. Genetic relationship of Asians and Northern European, revealed by Y-chromocomal DNA analysis // Am. J. Hum. Genet. - 1997. - V. 60. - P. 1174-1183.
22. 1. Степанов В.А., Харьков B.H., Пузырев B.H. Эволюция и филогения линий Y-хромосомы человека // Вестник ВОГиС. - 2006. - т. 10, №1. - С. 57-73.
1. Способ для определения гаплогрупп Y-хромосомы человека, включающий проведение мультиплексной полимеразной цепной реакции с использованием тест-системы, и анализ образующихся продуктов на ДНК-анализаторе, отличающийся тем, что способ осуществляют за два этапа с использованием тест-системы, содержащей два набора: при этом на первом этапе производят генотипирование путем мультиплексной ПЦР реакции с использованием мультиплексов 20-ти специфичных олигонуклеотидных праймеров, представленных в Таблице 2, для генотипирования по основным гаплогруппам R, N, J, I, Q, С, Е, D, G, О Y-хромосомного древа из первого набора тест-системы, очищают ПЦР-амплификат на колонках, затем путем мультиплексного анализа осуществляют SNaPshot реакцию с использованием мультиплексов 10-ти специфичных олигонуклеотидных праймеров, представленных в Таблице 5, для генотипирования по основным гаплогруппам из второго набора тест-системы и очищают образующиеся продукты ферментом TSAP, затем на втором этапе, если на первом этапе мутация выявлена, проводят мультиплексную ПЦР реакцию с использованием мультиплексов 62-х специфичных олигонуклеотидных праймеров, представленных в Таблице 3, для типирования по субгаплогруппам из первого набора тест-системы и после очистки амплификата с помощью колонок проводят SNaPshot реакцию путем мультиплексного анализа с использованием мультиплексов 28-ми специфичных олигонуклеотидных праймеров, представленных в Таблице 6, для типирования по субгаплогруппам из второго набора тест-системы, а если на первом этапе мутация не выявлена, проводят мультиплексную ПЦР реакцию с использованием мультиплексов 16-ти специфичных олигонуклеотидных праймеров, представленных в Таблице 5, для типирования по редким гаплогруппам А, С3, F, Н, K, L, O3, Т из первого набора тест-системы, после очистки амплификата с помощью колонок проводят SNaPshot реакцию путем мультиплексного анализа с использованием мультиплексов 8-ми специфичных олигонуклеотидных праймеров, представленных в Таблице 7, для типирования по редким гаплогруппам из второго набора тест-системы, очищают образующиеся продукты ферментом TSAP, после чего осуществляют анализ на ДНК анализаторе методом капиллярного гель-электрофореза.
2. Тест-система для определения гаплогрупп Y-хромосомы человека, содержащая набор реагентов для проведения ПЦР и мультиплексный набор праймеров, отличающаяся тем, что для осуществления способа по п. 1, в состав тест-системы дополнительно входит второй набор для проведения SNaPshot реакции, при этом, первый набор для проведения ПЦР включает смесь для ПЦР реакции - 1,5 мл и три мультиплексных набора специфичных олигонуклеотидных праймеров, каждый по 1,5 мл: мультиплексы 20-ти специфичных олигонуклеотидных праймеров для генотипирования по основным гаплогруппам Y-хромосомы, представленные в Таблице 2, мультиплексы 62-х специфичных олигонуклеотидных праймеров для генотипирования по субгаплогруппам, представленные в Таблице 3, и мультиплексы 16-ти специфичных олигонуклеотидных праймеров для генотипирования редких гаплогрупп, представленные в Таблице 4, а второй набор для проведения SNaPshot реакции включает три мультиплексных набора специфичных олигонуклеотидных праймеров каждый по 1,5 мл: мультиплексы 10-ти специфичных олигонуклеотидных праймеров для генотипирования по основным гаплогруппам Y-хромосомы, представленные в Таблице 5, мультиплексы 28-ми специфичных олигонуклеотидных праймеров для генотипирования по субгаплогруппам, представленные в Таблице 6, и мультиплексы 8-ми специфичных олигонуклеотидных праймеров для генотипирования редких гаплогрупп, представленные в Таблице 7.
3. Специфичные олигонуклеотидные праймеры для определения гаплогрупп Y-хромосомы человека для осуществления способа по п. 1, представляющие собой два набора последовательностей, где в первом наборе последовательностям, приведенным в Таблицах 2,3 и 4, соответствует область отжига праймеров вне зон мутаций в пределах видовой специфичности с температурой плавления в диапазоне 55-64°C, GC-состав 40-60%; в последовательностях праймеров отсутствуют стабильные вторичные структуры - шпильки и димеры, а во втором наборе последовательностям, приведенным в Таблицах 5, 6 и 7, соответствует область отжига олигонуклеотидных праймеров непосредственно примыкающая к зоне мутации в пределах видовой специфичности; в последовательностях праймеров отсутствуют стабильные вторичные структуры - шпильки и димеры; расчетная температура плавления для всех праймеров составляет 50°C±2°C, к 5′ концам праймеров присоединены GACT-хвосты в соответстви