Диагностика паразитарного заболевания, такого как лейшманиоз, с использованием экстракта рибосомальных белков (rpe)
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Применяют экстракт рибосомального белка (RPE) вида Leishmania для диагностики лейшманиоза у индивидуума, причем RPE содержит, по меньшей мере, два рибосомальных белка. Применение экстракта рибосомальных белков позволяет проводить досимптоматическую диагностику лейшманиоза. 3 н. и 3 з.п. ф-лы, 3 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к способу диагностики паразитарного заболевания, такого как лейшманиоз, с использованием RPE.
Предшествующий уровень техники
Висцеральный лейшманиоз собак (CVL) представляет собой значимый острый зооноз в странах средиземноморского бассейна, на Ближнем Востоке и в Латинской Америке (20). Это тяжелое заболевание вызывается Leishmania infantum в средиземноморском регионе, на Ближнем Востоке и азиатских странах и L. chagasi в Латинской Америке (20, 21). Оба вида, вызывающих CVL на различных континентах, можно считать идентичными из-за их генетического родства (26).
При заражении у собак могут развиваться различные формы заболевания: бессимптомная, малосимптомная или симптоматическая (4). Симптоматическая инфекция приводит к смерти, и ее клинические проявления включают кожные изменения, такие как алопеция, дерматит, онихогрифоз (3, 11), а также висцеральные проявления с изменениями почек, печени и головного мозга (18, 28). Некоторые из зараженных собак остаются бессимптомными или обнаруживают несколько слабых симптомов и классифицируются как малосимптомные (4). CVL не может рассматриваться только в качестве ветеринарного заболевания, поскольку зараженные собаки (даже без симптомов) являются основным внутренним резервуаром паразита для заражения человека (1). Таким образом, для того чтобы снизить передачу лейшманий от собак к людям, необходимо диагностировать лейшманиоз собак как можно раньше.
Наличие специфических антител против лейшманий у бессимптомных, малосимптомных и симптоматических зараженных собак (4, 9, 34) позволило разработать серологические тесты, включая иммунофлуоресцентный анализ антител (IFAT), вестерн-блоттинг, иммунохроматографический тест и твердофазный иммуноферментный анализ (ELISA) (рассмотрены в (23)). Диагностика CVL с использованием тестов ELISA, основанных на неочищенных растворимых антигенах лейшманий (SLA), демонстрирует высокую чувствительность, но низкую специфичность из-за родства между антигенами лейшманий и другими патогенными простейшими (16). В качестве стратегии для разработки специфических тестов для серодиагностики CVL различные паразитарные антигены получали в виде рекомбинантных белков (5, 10, 24). Однако из-за высокой вариабельности наблюдаемого гуморального ответа по отношению к различным паразитарным антигенам у отдельных зараженных собак (19, 31) для эффективной диагностики, основанной на рекомбинантных белках, может потребоваться смесь рекомбинантных белков или использование химерных белков, содержащих отдельные неродственные паразитарные антигены (6, 31, 36). Специфическая диагностика CVL может быть также разработана с использованием неочищенных фракций паразита, исследованных посредством вестерн-блоттинга, или очищенных препаратов из паразита (8, 17). Например, уже разработан анализ ELISA, основанный на растворимом антигене лейшманий (SLA) (27, 31). Однако этот анализ, основанный на SLA, недостаточно специфичен для диагностики бессимптомного лейшманиоза. Кроме того, сыворотка от индивидуумов с другими паразитарными заболеваниями, отличными от лейшманиоза, будет давать ложноположительную реакцию в анализе, основанном на SLA.
Таким образом, все еще существует необходимость в улучшенном способе диагностики паразитарного заболевания, такого как лейшманиоз, у которого отсутствуют недостатки существующих способов.
Описание изобретения
В этой работе авторы показывают, что RPE, в частности RPE лейшманий (LRPE), может быть с успехом использован для диагностики паразитарного заболевания, такого как лейшманиоз; этот новый способ диагностики является более специфическим, чем известные способы диагностики, такие как способ, основанный на SLA, как показано в примере. Этот новый способ дает возможность проводить досимптоматическую диагностику лейшманиоза, которая имеет решающее значение для предупреждения или снижения передачи лейшманий от собак к людям.
Изобретение далее описано ниже.
Применение
В первом аспекте предлагается применение экстракта рибосомального белка (RPE) для диагностики паразитарного заболевания у индивидуума.
Как определено в настоящем описании, экстракт рибосомального белка можно получить путем выполнения следующих стадий с использованием клетки паразита, вызывающего паразитарное заболевание, когда он присутствует у индивидуума:
a. смешивание клетки паразита с лизирующим буфером,
b. центрифугирование полученной смеси для получения цитоплазматического экстракта,
c. приготовление экстракта рибосомального белка из полученного цитоплазматического экстракта.
На стадии a паразит предпочтительно означает простейшее. Предпочтительные паразиты будут определены позднее в настоящем описании. Более предпочтительно, простейшее находится на стадии промастиготы. Специалисту в данной области известно количество клеток паразита, приблизительно необходимое для получения желаемого количества RPE. Как правило, для получения 500 микрограмм RPE используют 3×109 клеток паразита. Лизирующий буфер представляет собой буфер, который разрушает, по меньшей мере, некоторые из клеток паразита. По меньшей мере, часть предпочтительно означает, по меньшей мере, 50% клеток или, по меньшей мере, 60%, 70%, 80%, 90% или 100%. Предпочтительный лизирующий буфер содержит неионное поверхностно-активное вещество. Хорошие результаты получали при использовании в качестве неионного поверхностно-активного вещества Нонидет P40 (NP40). Однако можно использовать другие неионные поверхностно-активные вещества. Предпочтительным для использования лизирующим буфером является следующий (буфер A): 10 мМ Трис HCl, pH 8,0, 150 мМ NaCl, 1,5 мМ MgCl2 и 0,5% NP40 (Roche) и, предпочтительно, дополненный ингибиторами протеаз, такими как 1 мМ PMSF, 8 мкг/мл леупептина, 4 мкг/мл апротинина и 8 мкг/мл пентатина. Подходящее количество клеток паразита (109 клеток/мл буфера A), как правило, осторожно смешивают с лизирующим буфером при помощи пипетки Эппендорфа.
На стадии b смесь, полученную на стадии a, по меньшей мере, один раз центрифугируют при 4°C; как правило, первую стадию центрифугирования проводят при 3000 g в течение 2 минут. Полученный супернатант предпочтительно центрифугируют снова один или два раза при 13000 g в течение 15 минут при 4°C.
На стадии c полученный супернатант используют для приготовления RPE, как описано в (45). В кратком изложении, полученный супернатант подвергают высокоскоростному центрифугированию при 90000 об/мин в течение 30 мин при 4°C. Предпочтительно используют ротор Beckman TL100.3. Полученный осадок представляет собой неочищенный рибосомальный осадок, который ресуспендируют в подходящем буфере, таком как буфер B (20 мМ Трис-HCl, pH 7,4, 500 мМ AcNH4, 100 мм MgCL2, 5 мМ β-меркаптоэтанол) и центрифугируют при ступенчатом градиенте сахарозы (20/40%) в подходящем буфере, таком как буфер A, при 90000 об/мин при 4°C. Здесь снова предпочтительным ротором является ротор TL100.3. Полученный осадок содержит рибосомы. Этот осадок предпочтительно растворяют в PBS (забуференный фосфатом солевой раствор), обрабатывают ультразвуком и хранят при -70°C.
Рибосомальные белки представляют собой высококонсервативные цитоплазматические белки. Таким образом, RPE, как определено в настоящем описании, могут быть получены из любого эукариотического организма, будь это растение или животное, млекопитающие, пресмыкающиеся, рыбы, насекомые или любой другой организм, содержащий хромосому, такой как простейшие. Предпочтительно RPE получают из организма, который на эволюционном древе близок к организму, вызывающему заболевание, предпочтительно паразитарное заболевание. Таким образом, особый интерес в качестве источника RPE для использования в лечении паразитарного заболевания представляют простейшие, такие как Plasmodium, и, в частности, члены семейства трипаносом, более конкретно, различные виды трипаносомных простейших Leishmania или Trypanosoma. Существует более 20 известных видов лейшманий, включая виды подрода Leishmania, содержащие комплекс L. major, в том числе L. major, комплекс L. Donovani, в том числе L. chagasi, L. donovani и L. infantum, комплекс L. Mexicana, в том числе L. amazonensis и L. mexicana, а также подвиды Viannia, содержащие комплекс L. braziliensis, в том числе L. braziliensis и L. Peruviana, и комплекс L. guyanensis, в том числе L. guyanensis и L. panamensis. Виды плазмодия, представляющие интерес, включают Plasmodium falciparum и Plasmodium vivax. В предпочтительном варианте осуществления RPE получают из видов Leishmania, предпочтительно Leishmania major и/или Leishmania infantum. В другом предпочтительном варианте осуществления RPE получают из видов Plasmodium. Специалисту в данной области будет понятно, что RPE можно также получить путем смешивания RPE от нескольких различных организмов, как определено в настоящем описании. Применение RPE в способе диагностики по изобретению вместо применения определенного белка является крайне привлекательным, поскольку RPE содержит большое количество различных антигенов. Каждый из этих антигенов потенциально может диагностировать наличие иммунного ответа у индивидуума. Кроме того, существуют индивидуумы, которые отвечают на антиген A и не отвечают на антиген B, и наоборот. Таким образом, RPE, как использовано в настоящем описании, предполагается применять для широких слоев населения, поскольку он содержит большое количество различных антигенов. В предпочтительном варианте осуществления RPE содержит, по меньшей мере, один рибосомальный белок, и/или, по меньшей мере, один антиген рибосомального белка, и/или, по меньшей мере, один белковый фрагмент рибосомального белка. В более предпочтительном варианте осуществления RPE содержит, по меньшей мере, два рибосомальных белка, и/или, по меньшей мере, два антигена рибосомального белка, и/или, по меньшей мере, два белковых фрагмента рибосомального белка. Белковый фрагмент, как определено в настоящем описании, представляет собой предпочтительно фрагмент, который содержит, по меньшей мере, 2, 3, 5, 7, 10, 15, 20, 25, 30 или более смежных аминокислот соответствующего рибосомального белка. В одном варианте осуществления RPE, как определено в настоящем описании, не содержит или не состоит из кислого рибосомального белка P0 из Leishmania infantum и/или рибосомального антигена LbeF4A из Leishmania braziliensis. В другом варианте осуществления RPE, как определено в настоящем описании, не содержит или не состоит из эпитопа, полученного из кислого рибосомального антигена LcPo из Leishmania chagasi, как описано в EP 824699. Более предпочтительно, RPE не содержит или не состоит из 17 аминокислот, расположенных на C-конце LcPo: аминокислоты 306-322 LcPo, представленные SEQ ID NO:2 в EP 824699, который также определен как SEQ ID NO:1 в списке последовательностей.
Одним из преимуществ настоящего изобретения является то, что оно дает возможность проводить специфическую и раннюю диагностику широкого спектра паразитарных заболеваний. Одним из примеров паразитарного заболевания, при котором это имеет место, является лейшманиоз. В предпочтительном варианте осуществления паразитарное заболевание представляет собой лейшманиоз или малярию. Более предпочтительно, паразитарное заболевание вызвано видами Leishmania или Plasmodium. В дополнительном, предпочтительном варианте осуществления паразитарное заболевание вызвано видами, отличными от видов, из которых получен RPE. В частности, лейшманиоз, вызванный одним видом из рода Leishmania, может быть диагностирован при помощи композиции на основании RPE из других видов Leishmania. В одном из вариантов осуществления лейшманиоз, вызванный L. major, успешно диагностируется при помощи композиции, содержащей RPE из L. infantum. Альтернативно, другие паразитарные заболевания, такие как малярия, могут быть успешно диагностированы при помощи композиции на основании RPE из других видов, например на основании RPE из L. infantum.
В контексте изобретения индивидуум означает человека или животное. Животное, которое охватывается объемом изобретения, включает млекопитающее, предпочтительно человека или собаку. В принципе, любой индивидуум может быть диагностирован при помощи изобретения. Способ диагностики можно применять так часто, как это необходимо индивидууму. Предпочтительно, диагностируемый индивидуум представляет собой индивидуума с подозрением на риск заражения указанным паразитом, вызывающим указанное паразитарное заболевание. Индивидуум с подозрением на риск заражения указанным паразитом может проживать в эндемической области или посещать эндемическую область. Эндемическая область включает Северную Африку от Алжира до Саудовской Аравии, Кению, Судан, Эфиопию. Она далее включает Южную Европу: средиземноморские страны - Испанию, Францию, Грецию и т.д. Она также включает Центральную (все страны) и Южную Америку: Бразилию, Венесуэлу, Перу, Боливию, Колумбию, север Аргентины, Парагвай, Уругвай, область от Центральной до Юго-Восточной Азии: Индию, Иран, Ирак, Монголию, Непал, Бангладеш.
В контексте изобретения применение, как определено в настоящем описании, предпочтительно является применением in vitro или ex vivo. Предпочтительно означает, что указанное применение проводят на образце от указанного индивидуума. Предпочтительные образцы включают кровь, сыворотку, плазму, слюну, цереброспинальную жидкость или мочу. Более предпочтительно, образец представляет собой кровь или образец сыворотки, полученные от индивидуума.
В предпочтительном варианте осуществления диагностику проводят до появления симптома указанного паразитарного заболевания, так называемая досимптоматическая диагностика или диагностика у бессимптомного индивидуума. В данном контексте "досимптоматическая" предпочтительно означает, по меньшей мере, одни сутки, по меньшей мере, двое суток, по меньшей мере, трое суток, по меньшей мере, четверо суток, по меньшей мере, пять суток, по меньшей мере, шесть суток, по меньшей мере, семь суток, по меньшей мере, восемь суток, по меньшей мере, девять суток, по меньшей мере, десять суток, по меньшей мере, 15 суток, по меньшей мере, 20 суток, по меньшей мере, 25 суток, по меньшей мере, 30 суток или более до появления первого симптома. Первый симптом или первый клинический признак, связанный с паразитарным заболеванием, таким как лейшманиоз, можно выбрать из следующего списка: лихорадка, спленомегалия, гепатомегалия, лимфоаденопатия, конъюнктивит, дерматит, онихогрифоз, кератоконъюктивит, апатия и кахексия. Большинство из них можно просто обнаружить при внешнем медицинском обследовании. Конъюнктивит, дерматит, онихогрифоз, кератоконъюктивит представляют собой формы кожного поражения.
Предпочтительным первым симптомом, связанным с лейшманиозом, является лимфоаденопатия. Ее можно выявить при внешнем медицинском обследовании, таком как пальпация.
В другом предпочтительном варианте осуществления диагностику проводят до появления некоторых симптомов указанного паразитарного заболевания, так называемая диагностика у малосимптомного индивидуума. В этом контексте, "малосимптомный" предпочтительно означает индивидуума, у которого присутствуют максимум три из симптомов, как определено выше.
В другом предпочтительном варианте осуществления диагностику проводят до появления всех симптомов указанного паразитарного заболевания, так называемая диагностика у симптоматического индивидуума. В этом контексте, "симптоматический" предпочтительно означает индивидуума, у которого присутствуют, по меньшей мере, четыре из симптомов, как определено выше, в том числе форма кожного поражения, как определено выше.
Специалисту будет понятно, что наиболее важным типом диагностики является диагностика бессимптомных индивидуумов, поскольку это помогает предотвращать дальнейшее распространение заболевания, и бессимптомным индивидуумам можно помочь и подвергнуть их лечению более эффективно, если они будут диагностированы на такой стадии.
Способ
Во втором аспекте предлагается способ диагностики паразитарного заболевания у индивидуума с использованием RPE; способ, включающий определение того, присутствует ли распознавание RPE антителом в образце, полученном от индивидуума. Предпочтительный способ по изобретению, как и предпочтительное применение по изобретению, предпочтительно осуществляют in vitro или ex vivo. Определение было дано выше в настоящем описании.
В предпочтительном способе RPE присутствует в композиции. Определение RPE было дано выше в настоящем описании. В предпочтительном варианте осуществления другое соединение присутствует в указанной композиции. Альтернативно, каких-либо других соединений в указанной композиции нет.
В предпочтительном варианте осуществления другие соединения применяют последовательно или одновременно с RPE для того, чтобы улучшить специфичность способа. Полезно, например, использовать другие соединения, которые способны различать бессимптомного, малосимптомного или симптоматического индивидуума и привитого индивидуума. Более предпочтительно, такие соединения не присутствуют в одной композиции вместе с RPE. Например, можно использовать другой неродственный антиген паразита, вызывающего указанное паразитарное заболевание (31), такое как лейшманиоз. Другим примером является использование полибелков, которые содержат несколько паразитарных антигенов (6, 36). Предпочтительные антигены включают гистоновый белок, или его фрагмент, или молекулу нуклеиновой кислоты, кодирующую указанный гистон. Более предпочтительно, гистоновым белком является H2A, H2B, H3 и/или H4, как определено в EP 1687023. Гистоны H2A, H2B, H3 и H4 представляют собой высококонсервативные ядерные белки, и их последовательность хорошо известна в данной области, см., например, Requena et al., Trends in Parasitol. (2000) 16:246. Предпочтительно гистоны получают из организма, который на эволюционном древе близок к организму, вызывающему заболевание. Таким образом, особый интерес в качестве источника гистонов для применения в лечении паразитарных заболеваний, таких как лейшманиоз, представляют простейшие, и, в частности, члены семейства трипаносом, как, например, Plasmodium, более конкретно, различные виды трипаносомных простейших Leishmania.
В более предпочтительном способе диагностики паразитарное заболевание диагностируют, когда присутствует выявляемое количество антитела, распознающего RPE, и/или присутствует повышенное количество указанного антитела. У контрольного или здорового индивидуума указанное антитело, как правило, не выявляется.
Выявление наличия указанного антитела проводят при помощи способов, известных специалисту в данной области, таких как твердофазный иммуноферментный анализ (ELISA). Предпочтительные способы детекции описаны в разделе, озаглавленном Анализ.
Антитело, распознающее RPE, предпочтительно означает, что, по меньшей мере, присутствует одно антитело, которое способно распознать, по меньшей мере, одно соединение, присутствующее в RPE. Указанное соединение может быть рибосомальным белком, или рибосомальным белковым фрагментом, или рибосомальным антигеном рибосомального белка.
Анализ
В третьем аспекте предлагается устройство для анализа или анализ для диагностики паразитарного заболевания у индивидуума, где устройство или анализ содержат RPE. Присутствие антитела, специфически распознающего RPE, может быть обнаружено любыми стандартными способами, известными специалистам в данной области (см., например, Harlow и Lane, Antybodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988, включенный в настоящее описание посредством ссылки). Подходящие способы включают электрофорез, совмещенный с аффинной хроматографией (ACE) и (фермент-связанный иммуносорбентный анализ) ELISA. Предпочтительно, анализ включает ELISA. Некоторые виды анализа более подробно описаны ниже.
В предпочтительном варианте осуществления анализ включает использование RPE, иммобилизованного на твердой подложке, для связывания и удаления антитела из образца. Указанное связавшееся антитело можно затем обнаружить при помощи реагента для детекции, который связывается с комплексом антитело/RPE и содержит детектируемую репортерную группу. Подходящие реагенты для детекции включают антитела, которые связываются с комплексом антитело/RPE и свободный полипептид, меченный репортерной группой (например, в полуконкурентном анализе). Альтернативно, можно использовать конкурентный анализ, в котором антитело, связывающееся с RPE, мечено репортерной группой и связывается с иммобилизованным RPE после инкубации RPE с образцом. Степень, в которой компоненты образца ингибируют связывание меченого антитела с RPE, иммобилизованным на подложке, является показателем реактивности образца с иммобилизованным RPE.
Твердая подложка может быть из любого материала, известного специалистам в данной области, к которому можно присоединить RPE. Например, подложка может представлять собой тест-лунку в планшете для микротитрования или нитроцеллюлозную или другую подходящую мембрану. Альтернативно, подложка может представлять собой гранулу или диск из стекла, стекловолокна, латекса или из пластика, такого как полистирол или поливинилхлорид. Подложка может представлять собой магнитную частицу или оптико-волоконный сенсор, такой как раскрытые, например, в патенте США 5359681.
RPE можно связать с твердой подложкой при помощи ряда техник, известных специалистам в данной области. В контексте настоящего изобретения термин "связанный" относится как к нековалентной связи, такой как адсорбция, так и к ковалентному прикреплению (которое может представлять собой непосредственную связь антигена и функциональных групп на подложке или может представлять собой связь посредством перекрестно связывающего агента). Предпочтительным является связывание посредством адсорбции в лунке планшета для микротитрования или на мембране. В таких случаях, адсорбции можно достичь за счет контакта RPE в подходящем буфере с твердой подложкой в течение подходящего количества времени. Время контакта зависит от температуры, но, как правило, составляет от 1 часа до 1 суток. В основном, контакта лунки пластикового планшета для микротитрования (такого как полистирол или поливинилхлорид) с количеством RPE в диапазоне от 10 нг до 1 г, и предпочтительно 100 нг, достаточно для связывания необходимого количества RPE.
Ковалентного присоединения RPE к твердой подложке можно, как правило, достичь за счет начального взаимодействия подложки с бифункциональным реагентом, который реагирует как с подложкой, так и с функциональной группой на полипептиде, такой как гидроксильная или аминогруппа. Например, RPE может связываться с подложкой с подходящим полимерным покрытием при помощи бензохинона или за счет конденсации альдегидной группы на подложке с амином и активным водородом на полипептиде (см., например, Pierce Immunotechnology Catalog и Handbook (1991) at A12-A13).
В определенных вариантах осуществления анализ представляет собой твердофазный иммуноферментный анализ (ELISA). Данный анализ можно проводить путем начального контакта RPE, иммобилизованного на твердой подложке, обычно лунке планшета для микротитрования, с образцом таким образом, что антитела в образце, специфичные к RPE, могут связаться с иммобилизованным RPE. Несвязавшийся образец затем удаляют с иммобилизованного RPE и добавляют реагент для детекции, способный связываться с иммобилизованным комплексом антитело-RPE. Количество реагента для детекции, которое осталось связанным с твердой подложкой, затем определяют при помощи метода, подходящего для конкретного реагента для детекции.
Как только RPE иммобилизован на подложке, оставшиеся участки связывания белка на подложке, как правило, блокируют. Можно использовать любые подходящие блокирующие вещества, известные специалистам в данной области, такие как бычий сывороточный альбумин (BSA) или Tween 20 (Sigma Chemical Co., St. Louis, MO). Иммобилизованный RPE затем инкубируют с образцом, и антитело (если оно присутствует в образце) может связаться с RPE. Перед инкубацией образец можно развести подходящим разбавителем, таким как забуференный фосфатом солевой раствор (PBS). Как правило, подходящее время контакта (т.е. время инкубации) представляет собой такой период времени, который достаточен для того, чтобы обнаружить присутствие антитела в образце. Предпочтительно, время контакта является достаточным для достижения уровня связывания, когда, по меньшей мере, 95% связывания достигается при равновесии между связавшимися и несвязавшимися антителами. Специалистам в данной области будет понятно, что время, необходимое для достижения равновесия, легко определить, анализируя уровень связывания, который происходит в течение периода времени. При комнатной температуре, как правило, достаточным является время инкубации приблизительно 30 минут.
Несвязавшийся образец можно затем удалить промыванием твердой подложки подходящим буфером, таким как PBS, содержащим 0,1% Tween 20. Затем к твердой подложке можно добавлять реагент для детекции. Подходящий реагент для детекции представляет собой любое соединение, которое связывается с иммобилизованным комплексом антитело-RPE и затем может быть обнаружено при помощи ряда способов, известных специалистам в данной области. Предпочтительно, реагент для детекции содержит связующее вещество (такое как, например, белок A, белок G, иммуноглобулин, лектин или свободный антиген), конъюгированное с репортерной группой. Предпочтительные репортерные группы включают ферменты (такие как пероксидаза хрена), субстраты, кофакторы, ингибиторы, красители, радионуклиды, люминисцентные группы, флуоресцентные группы и биотин. Конъюгацию связующего агента с репортерной группой можно осуществить при помощи стандартных способов, известных специалистам в данной области. Распространенные связующие агенты также могут быть приобретены конъгированными с рядом репортерных групп у многих поставщиков (например, Zymed Laboratories, San Francisco, CA и Pierce, Rockford, IL).
Реагент для детекции затем инкубируют вместе с иммобилизованным комплексом антитело-RPE в течение времени, достаточного для выявления связавшегося антитела. Подходящий период времени можно, как правило, определить по инструкции производителя или анализируя уровень связывания, которое происходит за период времени. Несвязавшийся реагент для детекции затем удаляют, и связавшийся реагент для детекции определяют с помощью репортерной группы.
Способ, который используется для выявления репортерной группы, зависит от природы репортерной группы. Для радиоактивных групп подходит, как правило, измерение активности сцинтилляционным методом или авторадиографические способы. Для выявления красителей, люминисцентных групп и флуоресцентных групп можно использовать спектроскопические методы. Биотин можно обнаружить при помощи авидина, связанного с другой репортерной группой (обычно радиоактивная или флуоресцентная группа или фермент). Ферментные репортерные группы, как правило, выявляют путем добавления субстрата (как правило, в течение конкретного периода времени) с последующим спектроскопическим или другим анализом продуктов реакции.
Для того чтобы определить наличие или отсутствие в образце антитела, специфичного для паразитарного заболевания, такого как лейшманиоз, сигнал, полученный от репортерной группы, которая осталась связанной с твердой подложкой, как правило, сравнивают с сигналом, который соответствует предопределенному пороговому значению. В одном из предпочтительных вариантов осуществления пороговое значение предпочтительно представляет собой среднее значение сигнала, полученного при инкубировании иммобилизованного RPE с образцом от неинфицированного индивидуума. Как правило, образец считается положительным, если он генерирует сигнал, который составляет три стандартных отклонения выше предопределенного порогового значения (т.е. реагирует с RPE). В альтернативном, предпочтительном варианте осуществления пороговое значение определяют при помощи ROC-кривой, согласно способу Sackett et al., Clinical Epidemiology: A Basic Science for Clinical Medicine, p. 106-7 (Little Brown and Co., 1985). В кратком изложении, в данном варианте осуществления пороговое значение можно определять из графика с парами положительных уровней (т.е. чувствительность) и ложноположительных уровней (100% специфичность), которые соответствуют каждому возможному пороговому значению для результата диагностического теста.
Пороговое значение на графике, ближайшее к верхнему левому углу (т.е. значение, которое охватывает самую большую площадь), является наиболее точным пороговым значением, и образец, генерирующий сигнал выше, чем пороговое значение, определенное данным способом, может считаться положительным. Альтернативно, пороговое значение можно сдвигать вдоль графика влево, чтобы минимизировать ложноположительный уровень, или вправо, чтобы минимизировать ложноотрицательный уровень.
В связанном варианте осуществления анализ проводят в проточном формате или формате теста-полоски, где RPE иммобилизован на мембране, такой как нитроцеллюлоза. В проточном тесте антитела в образце связываются с иммобилизованным RPE, в то время как образец проходит через мембрану. Затем реагент для детекции (например, белок A с коллоидным золотом) связывается с комплексом антитело-RPE, в то время как раствор, содержащий реагент для детекции, протекает через мембрану. После этого можно проводить выявление связавшегося реагента для детекции, как описано выше. В формате теста-полоски один конец мембраны, с которой связан RPE, смачивают раствором, содержащим образец. Образец мигрирует по мембране через область, содержащую реагент для детекции, к области с иммобилизованным полипептидом. Концентрация реагента для детекции на RPE указывает на присутствие в образце антитела, специфичного к антигену паразита, вызывающего паразитарное заболевание, такое как лейшманиоз. Как правило, концентрация реагента для детекции в этом месте создает картину в виде линии, которую можно увидеть визуально. Отсутствие такой картины указывает на отрицательный результат. Как правило, количество RPE, иммобилизованного на мембране, выбирают для того, чтобы создавать визуально различимую картину, когда образец содержит уровень антитела, достаточный для создания положительного сигнала на ELISA, как указано выше. Предпочтительно, количество RPE, иммобилизованного на мембране, находится в диапазоне от 25 нг до 500 нг. Такие тесты, как правило, можно проводить с очень небольшим количеством сыворотки или крови индивидуума (например, одна капля).
Любой индивидуум или терапевт может использовать это устройство в офисе/дома, используя такое устройство или анализ повторно по мере необходимости.
Как правило, дополнительные молекулы применяют в анализе в качестве положительного или отрицательного контроля. Обычный положительный контроль может представлять собой антитело, распознающее молекулу, которая, как известно, присутствует в исследуемом образце. Обычный отрицательный контроль может представлять собой антитело, распознающее молекулу, которая, как известно, отсутствует в исследуемом образце.
В настоящем описании и формуле изобретения глагол "содержать" и его спряжения применяют в неограничивающем смысле, подразумевая, что пункты, следующие за словом, включены в состав, но не исключая пунктов, не приведенных отдельно. Кроме того, глагол "состоять" может быть заменен на "по существу состоять из", означая, что продукт, устройство для анализа, соответственно способ или применение, как определено в настоящем описании, могут содержать дополнительный компонент(ы), соответственно дополнительную стадию(и), кроме тех, которые конкретно определены; указанный дополнительный компонент(ы), соответственно стадию(и) не изменяют уникальные характеристики изобретения.
Кроме того, ссылка на элемент в единственном числе не исключает возможности, что присутствует более чем один элемент, за исключением случаев, когда контекст ясно указывает на наличие одного и только одного элемента. Единственное число, таким образом, как правило, означает "по меньшей мере, один".
Все патенты и ссылки на литературу, процитированные в настоящем описании, таким образом, включены посредством ссылки во всей их полноте.
Изобретение далее иллюстрируется следующим примером, который не должен рассматриваться как ограничивающий объем настоящего изобретения.
Описание фигур
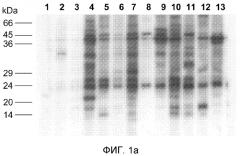
Фиг.1. (A) Рибосомальные белки L. infantum подвергали электрофорезу на линейном 10-14% градиенте SDS-PAGE геля, переносили на нитроцеллюлозную мембрану и инкубировали с сывороткой здоровых собак (дорожки 1-3) и сывороткой собак, инфицированных естественным путем L. infantum, с симптоматическим CVL (дорожки 4-13). Использовали отдельные сыворотки в разведении 1:200. (B) Двумерный электрофорез на полиакриламидном геле (2D-PAGE) рибосомальных белков L. infantum. Левая панель показывает репрезентативный гель, окрашенный серебром. Такой же гель переносили на нитроцеллюлозную мембрану и инкубировали с совокупностью сывороток с CVL (1:200), использованных в (A). В качестве вторичного реагента использовали антитело против IgG собак, конъюгированное с пероксидазой хрена.
Фиг.2. Сравнительная оценка диагностической чувствительности LRP и SLA. (A) Данные ELISA по реактивности сыворотки собак с симптоматическим CVL и контрольной сыворотки с LRP и SLA. (B) Данные ELISA по реактивности сыворотки собак с малосимптомным и бессимптомным CVL с LRP и SLA. Показано среднее значение сыворотки с CVL.
Прерывистые полосы показывают пороговое значение, которое определяли как среднюю оптическую плотность плюс три стандартных отклонения от величин, полученных на сыворотке от здоровых контролей.
Фиг.3. Сравнительная оценка диагностической специфичности LRP и SLA. (A) Данные ELISA по реактивности сыворотки собак, инфицированных T. gondii или T. Cruzi, с LRP и SLA. (B) Данные ELISA по реактивности сыворотки собак, вакцинированных Leishmune® или Leishtec®, с LRP и SLA. Показано среднее значение сыворотки CVL. Прерывистые полосы показывают пороговое значение, которое определяли как среднюю оптическую плотность плюс три стандартных отклонения от величин, полученных на сыворотке от здоровых контролей.
Примеры
МАТЕРИАЛЫ И СПОСОБЫ
Паразиты. Leishmania chagasi (MOM/BR/1970/BH46) и L. infantum (MCAN/ES/1996/BCN/150, MON-1) выращивали при 24°C в среде Шнайдера (Sigma, St. Louis, MO, USA), дополненной 20% фетальной телячьей сывороткой, инактивированной нагреванием (Sigma, St. Louis, MO, USA), 20 мМ L-глутамином, 200 Ед/мл пенициллина, 100 мкг/мл стрептомицина и 50 мкг/мл гентамицина при pH 7,4.
Получение антигена. SLA получали из промастигот L. chagasi и L. infantum в неподвижной фазе после нескольких пересевов в жидкой культуре, как описано ранее (12). В кратком изложении, 2×108 промастигот на мл, в объеме 5 мл, промывали 3 раза в стерильном забуференном фосфатом солевом растворе (PBS). После шести циклов заморозки-оттаивания и последующей обработки ультразвуком (Ultrasonic processor, GEX600) в течение 5 циклов по 30 сек при 38 МГц суспензию центрифугировали при 8000 g в течение 30 мин при 4°C и собирали супернатант, содержащий SLA. Концентрацию белка определяли по способу Брэдфорда (7) и хранили аликвоты по 500 мкл при -70°C.
LRP получали из логарифмической фазы промастигот L. Infantum, как описано ранее (22). В кратком изложении, собирали 1×109 промастигот, промывали дважды охлажденным PBS, ресуспендировали в 1 мл лизирующего буфера NP40 (10 мМ Трис HCl, pH 8,0, 150 мМ NaCl, 1,5 мМ MgCl2 и 0,5% NP40) и пипетировали 10 раз. После лизиса образцы центрифугировали при 3000×g в течение 2 мин при 4°C для осаждения ядер. Супернатант центрифугировали дважды при 13000×g в течение 15 мин при 4°C. Очищенный цитоплазматический супернатант подвергали высокоскоростному центрифугированию 90000 об/мин в течение 30 мин при 4°C на роторе Beckman TL100.3. Неочищенный рибосомальный осадок ресуспендировали в буфере A (20 мМ Трис-HCl, pH 7,4, 500 мМ AcNH4, 100 мМ MgCl2, 5 мМ β-меркаптоэтанол) и центрифугировали в ступенчатом градиенте сахарозы (20/40%) в буфере A при 90000 об/мин при 4°C на роторе TL 100.3.
Образцы сыворотки. Образцы сыворотки собирали в Испании и Бразилии. Образцы сыворотки с CVL из Испании собирали у 28 собак с клиническими симптомами в регионе Эстремадура. Животных, инфицированных L. infantum, оценивали клинически и с помощью лабораторных методов в Департаменте Паразитологии Ветеринарной школы Университета Эстремадуры, Касерес, Испания. Животных считали симптоматическими при наличии трех и более следующих симптомов: потеря массы, алопеция, аденопатия, онихогрифоз, гепатомегалия, конъюнктивит и эксфолиативный дерматит на носу, хвос