Способ обнаружения провируса лейкоза крупного рогатого скота
Иллюстрации
Показать всеПредставленное изобретение относится к области биотехнологии и касается способа обнаружения провируса лейкоза крупного рогатого скота. Охарактеризованный способ включает выявление фрагмента LTR (Long Terminal Repeat) - последовательности провируса лейкоза. Определение размера амплифицированного фрагмента нуклеотидной последовательности путем электрофоретического разделения в агарозном геле. В качестве праймеров используются олигонуклеотиды: BL1.F 5-GAGTTAGCGGCACCAGAAGC-3 и BL1.R 5-ATAGAGCTCGCGGTGGTCTC-3. Продукт синтеза составляет 175 пар нуклеотидов. Геномную ДНК выделяют сорбентным методом с последующим элюированием в буфере ТЕ, а амплификацию проводят в режиме: 95°С - 3 минуты 1 раз, 94°С - 20 секунд денатурация, 66°С - 20 секунд - отжиг праймеров, 74°С - 25 секунд элонгация, 45 раз, 74°С - 3 минуты - достраивание цепей. В качестве положительного контроля прохождения реакции используют препарат положительного контроля антигена ВЛКРС. Изобретение может быть использовано в молекулярно-генетической диагностике болезней животных и научных исследованиях в ветеринарии. 2 ил., 1 табл.
Реферат
СПОСОБ ОБНАРУЖЕНИЯ ДНК ПРОВИРУСА ЛЕЙКОЗА
Предлагаемое изобретение относится к области биотехнологии, молекулярно-генетической диагностики болезней животных, научных исследований в ветеринарии, молекулярной биологии.
Лейкоз крупного рогатого скота является инфекционным хроническим заболеванием, распространенным по всему миру. Вызывается заболевание вирусом BLV (Bovine Leukemia Virus) и принадлежит к роду Deltaretrovirus. По своей природе он сходен с вирусом HTLV и поражает в основной своей массе B-лимфоциты. Вирус лейкоза крупного рогатого скота наносит существенный экономический ущерб животноводческим хозяйствам РФ.
В комплекс мероприятий по оздоровлению стад КРС от лейкоза ведущее место принадлежит диагностике. Проблема своевременной эффективной диагностики ВЛКРС в связи с крайней неблагополучной эпизоотической ситуацией по данному заболеванию и отсутствию средств специфической профилактики стоит по-прежнему остро.
Одним из первых и основных форм диагностики являются традиционные методы серологической диагностики ВЛКРС (РИД, ИФА), которые не всегда позволяют выявить инфицированных животных, а в некоторых случаях являются недопустимыми, например при ранней диагностике молодняка от сероположительных родителей, что требует использования их в комплексе с методами молекулярно-генетическими, в частности ПЦР, с помощью которой возможно раннее выявление ВЛКРС в неблагополучных по лейкозу хозяйствах, а также повышению эффективности и сокращению сроков противолейкозных мероприятий.
Полимеразная цепная реакция (ПЦР) является эффективным и высокочувствительным методом, в основе которого лежит многократное увеличение (амплификация) исследуемого фрагмента последовательностей ДНК (ДНК-мишень) до возможности ее идентификации в гелях или при помощи флуоресцирующих красителей в реальном времени.
Специфика методов (ПНР) заключается в подборе олигонуклеотидных затравок-праймеров, прямого F и обратного R праймеров, образующих область элонгации термофильной полимеразы. Немаловажна также область выбора амплифицируемого фрагмента провирусной ДНК лейкоза КРС.
Известен способ (Патент - US 6646116 В1, 11.11.2003, C07/Н 21/04) дифференциации варианта гена TAX вируса лейоза КРС, заключающийся в проведении ПНР с использованием праймеров, способных выявить полную последовательность гена с целью дальнейшего выявления мутаций в кодируемом этим геном аминокислотных последовательностях и определения вариантов TAX гена ВЛКРС. В частности использовались следующие праймеры:
В tax2:5 AG ТСТ AGA GCT GAC GTC ТСТ GTC TG 3
В tax3:5 АСС TCG AGA TGG САА GTG TTG TTG GTT GG 3.
Известен также способ выявления ДНК провируса лейкоза КРС методом ПНР в режиме рального времени (RT-PCR) и « гнездовой» ПНР (nested PCR) (Журнал - Journal of Veterinary Diagnostic Investigation (J Vet Diagn Invest). 2003, Vol.15, 72-76. USA).
Предлагаемые праймеры комплиментарны области гена POL имеют следующую структуру:
Для использования метода ПНР в режиме реального времени необходимо вместе с праймерами добавлять в реакционную смесь дополнительно синтезированный зонд POL (molecular beacon) 5 - (FAM)-
флюоресцирующей меткой, благодаря чему и происходит детекция сигнала.
Метод «гнездовой ПЦР» (nested PCR) подразумевает использование двух пар праймеров - outer (1 раунд) и nested (2 раунд). При постановке ПЦР обоими методами размер продукта составляет 202 пар нуклеотид. Однако известные способы выявления ДНК провируса ВЛКРС: в аналоге не обеспечивали детекцию участка консервативного гена Pol провируса.
Известен способ обнаружения ДНК провируса лейкоза КРС по гену Pol где используются праймеры: Ра 2: 5- TGA ACG GAC AAA TGG ACT GCT C-3, P r2 5- CCG АСА GAG AGC GAG GAG AG -3, дающие на выходе продукт размером 438 пар нуклеотид с последующей визуализаций в 1,5% агарозном геле в присутствии бромистого этидия в качестве красителя (patent-2445370).
Недостаток всех этих методов заключается в необходимости наличия минимального количества копийности последовательностей в анализируемом объеме, равном 10 копиям. Недостатком является также тот факт, что находясь на стадии персистентного лимфоцитоза титр вируса в крови падает и возможно снижение количество копий провируса ниже заявленной аналитической чувствительности, что приводит к ложноотрицательным результатам.
Задачей изобретения является разработка эффективного способа обнаружения ДНК провируса лейкоза крупного рогатого скота методом ПЦР, позволяющего за счет повышения чувствительности по выбранному участку ДНК выявлять наличие провируса при диагностировании уральского типа ВЛКРС, с возможностью обнаружения ДНК провируса лейкоза крупного рогатого скота при наличии минимального количества копий последовательностей в анализируемом объеме (менее 10 копий), а также возможностью проведения анализа на стадии персистентного лимфоцитоза, при пониженном титре вируса в крови.
Задача решается тем, что используя прямой F и обратный R праймеры для выявления фрагмента LTR (Long Termal Repeat) - последовательности провируса лейкоза крупного рогатого скота, проводят амплификацию (наращивание) искомого фрагмента, а определение размера амплифицированного фрагмента нуклеотидной последовательности проводят электрофоретическим разделением в агарозном геле, при этом в качестве праймеров используются олигонуклеотиды следующей структуры: BL1.F 5-GAG ТТА GCG GCA CCA GAA GC-3; BL1.R 5-АТА GAG СТС GCG GTG GTC ТС 3, а продукт синтеза праймеров составляет 175 пар нуклеотид, причем геномную ДНК выделяют сорбентным методом с последующим элюированием в буфере ТЕ (простой экспресс метод выделения ДНК), а амплификацию проводят в растворе: 80 мМ трис-HCL (pH 8.0), 0,1% тритона Х-100, 24 мМ (NH4)2SO4, 0,5 мМ ЭДТА, по 0,2 мМ каждого из трифосфатов, 0,5 мМ каждого праймера и 1 единицу TAG полимеразы и 40 нг анализируемой геномной ДНК инфицированного животного, при конечном объеме раствора 20 мкл, при этом амплификацию проводят в режиме: 95°С - 3 минуты 1 раз (процесс денатурации), 94°С - 20 секунд - денатурация, 66°С - 20 секунд - отжиг праймеров, 74°С - 25 секунд - элонгация, 45 раз, достраивание цепей 74°С - 3 минуты, причем детекция амплифицированных фрагментов проводится в 2% агарозном геле в буфере ТБЕ, 0,5 мМ бромистым этидием, а в качестве положительного контроля прохождения полимеразной цепной реакции используют препарат положительного контроля антигена ВЛКРС.
Положительный анализ подтверждают тест системами отечественных производителей.
В процессе проведенных работ в качестве ДНК-мишени выбрана область LTR (Long Terminal Repeat). Область LTR содержится во всех ретровирусах и необходима для интеграции провируса в геном хозяина область фланкирует геном провируса, таким образом увеличивают копийность ДНК-мишени 5 два раза, соответственно увеличивается чувствительность способа, что показывает неочевидный эффект предложенного способа.
Далее с помощью компьютерной программы Clustal W2 multi sequence alignment на основе информации представленной в базе данных Интернет ресурсов GenBank NCBI было отобрано и проанализировано 50, на наш взгляд, наиболее дискордантных генотипа ВЛКРС на предмет определения консервативных областей вируса. Отбор праймеров проводился с использованием программы Lasergene V7.1 (США). При проведении компьютерного анализа к выбранному участку LTR определяют основные критерии: а) степень гомологии праймеров; б) отсутствие самокомплементарных участков; в) близость температуры плавления праймеров. Нами были подобраны следующие праймеры:
для детекции LTR последовательности провируса лейкоза КРС с выходом продукта длиной 175 пар нуклеотид. Синтез олигонуклеотидных праймеров заказывался в коммерческом центре.
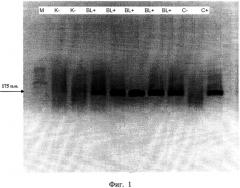
На фиг. 1. представлена электрофореграмма продуктов амплификации М - маркер шагом 50 пар нуклеотид (50-500), К «-» - здоровые животные, BL «+» - инфицированные вирусом лейкоза животные, С «-» и С «+» - отрицательный и положительный контроли.
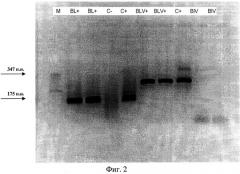
На фиг. 2. представлена электрофореграмма продуктов амплификации; М - маркер шагом 50 п.н. (50-500), BL «+» инфицированные животные, диагностированные разработанным способом, BLV «+» инфицированные животные, диагностированные с применением диагностической системы российского производителя, BIV испытание специфичности праймеров в присутствии ДНК вируса иммунодифицита КРС, С «-» и С «+» отрицательный и положительный контроли.
Для технического подтверждения возможности раннего обнаружения провируса лейкоза КРС в крови инфицированных животных были отобраны группы.
А. Животные с острой формой лейкоза выявленные гематологическим методом 28 голов.
Выбраны в качестве положительной группы.
Б. Группа молодняка в возрасте 2-3 месяца после рождения и диагностированных на предмет инфицированности ВЛКРС методом РИД (реакция иммунодифузии), показавших положительный результат.
Животные подбирались на фермах хозяйства «Ишимагропродукт» Ишимского района Тюменской области.
Обе группы исследовались испытуемым методом ГПДР, данные представлены в таблице 1.
Животные группы Б в количестве 4, показавшие отрицательный результат по ПЦР диагностике, были изолированы и содержались отдельно от остального стада. Последующий испытуемый анализ через 6 месяцев подтвердил предшествующий и был отрицательным. Наличие РИД + результата у молодняка являлся результатом влияния колострального иммунитета и дважды подтвержденный испытуемый результат ПНР анализа рассматривается в данном случае как наиболее точный и информативный метод ранней диагностики провируса лейкоза КРС у телят.
Данный способ является достоверным, высокочувствительным, при помощи которого можно более точно в ранние сроки выявлять фрагмент провирусной ДНК вируса лейкоза крупного рогатого скота в биологическом материале, при наличии минимального количества копий последовательность в анализируемом объеме на стадии персистентного лимфоцетоза, при пониженном титре вируса в крови.
Способ обнаружения провируса лейкоза крупного рогатого скота, включающий выявление фрагмента LTR (Long Terminal Repeat) - последовательности провируса лейкоза, определение размера амплифицированного фрагмента нуклеотидной последовательности путем электрофоретического разделения в агарозном геле, при этом в качестве праймеров используются олигонуклеотиды следующей структуры: BL1.F 5-GAGTTAGCGGCACCAGAAGC-3; BL1.R 5-ATAGAGCTCGCGGTGGTCTC-3, а продукт синтеза составляет 175 пар нуклеотидов, причем геномную ДНК выделяют сорбентным методом с последующим элюированием в буфере ТЕ, а амплификацию проводят в растворе 80 мМ трис-HCL (рН 8.0), 0,1% тритона Х-100, 24 мМ (NH4)2SO4, 0,5 мМ ЭДТА, по 0,2 мМ каждого из трифосфатов, 0,5 мМ каждого праймера, 1 единицу TAG полимеразы и 40 нг анализируемой геномной ДНК инфицированного животного, при конечном объеме раствора 20 мкл, амплификацию проводят в режиме: 95°С - 3 минуты 1 раз, 94°С - 20 секунд денатурация, 66°С - 20 секунд - отжиг праймеров, 74°С - 25 секунд элонгация, 45 раз, 74°С - 3 минуты - достраивание цепей, причем детекцию амплифицированных фрагментов проводят в 2% агарозном геле в буфере ТБЕ, 0,5 мМ бромистым этидием, а в качестве положительного контроля прохождения полимеразной цепной реакции используют препарат положительного контроля антигена ВЛКРС.