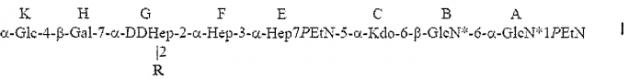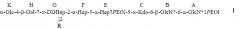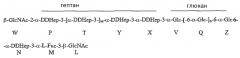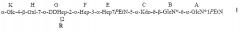Внешний коровой эпитоп липополисахарида н. pylori
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии и представляет собой α1,6-глюкан-содержащее соединение Helicobacter pylori. Настоящее изобретение также раскрывает конъюгат для индукции иммунного ответа против H.pylori, содержащий указанное соединение, конъюгированное с белком-носителем. Также настоящее изобретение раскрывает иммуногенную композицию, применение указанной композиции и способ индукции иммунного ответа против H.pylori с использованием указанной композиции. Настоящее изобретение раскрывает также иммунную антисыворотку для нейтрализации H.pylori у млекопитающего, которую получают путем иммунизации указанного млекопитающего иммуногенной композицией, содержащей указанную иммуногенную композицию. Настоящее изобретение раскрывает антитело, распознающее указанное α1,6-глюкан-содержащее соединение H.pylori, применение указанного антитела и способ индукции комплемент-опосредованного бактериолиза штаммов H.pylori, экспрессирующих α1,6-глюкан с использованием указанного антитела. Настоящее изобретение позволяет повысить эффективность иммуногенных композиций против H.pylori. 9 н. и 18 з.п. ф-лы, 8 ил., 21 табл., 11 пр.
Реферат
ИНФОРМАЦИЯ О ПРЕДШЕСТВУЮЩЕЙ ЗАЯВКЕ
По настоящей заявке испрашивается приоритет предварительной заявки на патент США 61/230315, поданной 31 июля 2009, которая включена в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новому внешнему коровому эпитопу LPS Helicobacter pylori. Более конкретно, настоящее изобретение относится к новому внешнему коровому эпитопу H. pylori, к его синтезу, описанию и конъюгированию.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Helicobacter pylori считается наиболее распространенной бактериальной инфекцией, связанной с хроническим гастритом, пептической язвой и карциномой желудка у человека. Распространенность инфекции H. pylori оценивается как приблизительно половина популяции всего мира, достигая до 70% в развивающихся странах и 20-30% в промышленно развитых странах (Dunn et al., 1997). Подавляющее большинство индивидов приобретает H. pylori в детстве; распространенность инфекции среди детей в развивающихся странах связывают с низким социально-экономическим статусом и плохим санитарным состоянием (Castillo-Rojas et al., 2004). H. pylori определяется Всемирной Организацией Здравоохранения (WHO) как канцероген класса I, поскольку она повышает относительный риск возникновения рака желудка по меньшей мере в шесть раз. Рак желудка является второй наиболее частой причиной смертности во всем мире и составляет 700000 случаев в год (Parkin et al., 2002).
Современные стратегии уничтожения H. pylori основаны на использовании ингибиторов протонной помпы и антибиотиков. Однако эффективность химиотерапевтического воздействия ограничена устойчивостью к антибиотикам, что часто встречается среди изолятов H. pylori и недостаточностью иммунного ответа при повторной инфекции. Таким образом, необходимы новые виды терапевтических средств, обеспечивающих глобальную стратегию профилактики и устранения инфекций H. pylori.
Несмотря на то, что в недавно проведенных исследованиях внимание было сосредоточено на роли белковых компонентов в патогенезе H. pylori и их роли в защитном иммунитете (Ruggiero et al., 2003; Rossi et al., 2004), сравнительно небольшое число исследований было осуществлено для оценки возможности включения антигенов, отличных от белков, в составы вакцин (Angelakopoulos and Hohmann, 2000). Например, известно, что конъюгированные вакцины на основе полисахаридов препятствуют развитию системной инфекции и ингибируют колонизацию хозяина (Anderson et al., 1986; Chu et al., 1991; Pon et al., 1997; Passwell et al., 2001; Passwell et al., 2003). В недавних исследованиях кишечных патогенов были изучены подходы, основанные на конъюгатах LPS, в качестве вакцин-кандидатов человека (Gu et al., 1996; Mieszala et al., 2003; Cox et al., 2005; Yu and Gu, 2007).
Липополисахарид (LPS) является главным компонентом клеточной поверхности H. pylori. Исследования структуры, проведенные на ряде изолятов H. pylori (Monteiro, 2001), привели в результате к созданию структурной модели LPS, состоящей из O-цепи и корового олигосахарида, который прикреплен к молекуле липида A. Структура полисахаридного остова O-цепи большинства штаммов H. pylori является уникальной и отражает детерминанты группы крови по Льюису (Le) типа 2 и/или типа 1, которые имитируют детерминанты, присутствующие на поверхности клеток желудка и опухолевых клеток человека (Wirth et al., 1996); указанные детерминанты могут быть вовлечены в нежелательные аутоиммунные реакции, приводящие к атрофическому гастриту (Appelmelk et al., 1996). Кроме того, внешний участок кора LPS H. pylori содержит два необычных полимерных компонента: DD-гептогликан и α1,6-глюкан (Monteiro, 2001). Полимер α1,6-глюкана внешнего корового участка LPS изолятов H. pylori синтезируется продуктом гена HP0159 с открытой рамкой считывания. Наличие и экспрессия гена HP0159 в H. pylori являются обычными.
Описано несколько биосинтетических генов LPS H. pylori и определена их роль в патогенезе и колонизации (Logan et al., 2000; Logan et al., 2005; Hiratsuka et al., 2005; Chandan et al., 2007; Altman et al., 2008). Были созданы мутанты HP0826 H. Pylori, и было показано, что указанная мутация приводит к образованию усеченных LPS, лишенных антигена Le (Logan et al., 2000). Однако не была проведена полная характеристика структуры LPS.
Несмотря на успехи в данной области, иммуногенные эпитопы, эффективные во многих типах H. Pylori остаются неясными.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому эпитопу внешнего участка кора LPS Helicobacter pylori. Более подробно, настоящее изобретение относится к новому эпитопу внешнего участка кора LPS H. pylori, его синтезу, описанию и конъюгированию.
Настоящее изобретение относится к α1,6-глюкан-содержащему соединению Helicobacter pylori, содержащему структуру формулы I:
R представляет собой трисахарид α-DDHep-3-α-L-Fuc-3-β-GlcNAc, замещенный α1,6-глюканом, связанным с α1,3-DD-гептаном, и последний остаток DD-Hep α1,3-DD-гептана кэпирован остатком β-GlcNAc. В описанном соединении α1,6-глюкан может содержать приблизительно от 3 до 12 α1,6-связанных остатков глюкозы, и α1,3-DD-гептан может содержать приблизительно от 2 до 6 α1,3-связанных остатков гептозы.
Группа R соединения, которое описано выше, может представлять собой
где остаток L β-GlcNAc связан с О-2 Hep G. В соединении, которое описано выше, остатки Q и Z глюкана представляют собой α1,6-связанные остатки глюкозы, и n может иметь любое значение от 1 до 11; остатки T, Y и X представляют собой α1,3-связанные остатки гептозы, и m может иметь любое значение приблизительно от 0 до 4.
Соединение, которое описано выше, может быть выделено или очищено из штамма HP0826::Kan H. pylori.
В соединениях, описанных выше, структура формулы I может, кроме того, содержать молекулу липида A, ковалентно связанную с остатком Kdo С. Молекула липида A может быть O-деацилирована или может быть отщеплена путем гидролиза кетозидной связи от остатка Kdo.
Настоящее изобретение также относится к конъюгату, содержащему по существу линейное α1,6-глюкан-содержащее соединение, конъюгированное с линкерной молекулой, белком-носителем или их комбинацией. По существу линейное α1,6-глюкан-содержащее соединение может представлять собой соединение, описанное в настоящей заявке, отличающееся тем, что структура формулы I конъюгирована с линкерной молекулой, белком-носителем или их комбинацией. По существу линейное α1,6-глюкан-содержащее соединение альтернативно может представлять собой Декстран, такой как Декстран T5. Белок-носитель может представлять собой столбнячный анатоксин или бычий сывороточный альбумин.
Настоящее изобретение также включает композицию, содержащую одно или более чем одно соединения или конъюгаты, которые описаны выше.
Настоящее изобретение дополнительно относится к антителу, направленному против соединения, содержащего α1,6-глюкановый эпитоп, описанный в настоящем описании. Антитело может быть моноклональным антителом 1C4F9. Изобретение, кроме того, относится к гибридомной клеточной линии 1C4F9, которая продуцирует моноклональное антитело 1C4F9.
Моноклональное антитело, описанное выше, может быть использовано для индукции комплемент-опосредованного бактериолиза α1,6-глюкан-экспрессирующих штаммов H. pylori у индивида, при необходимости.
Настоящее изобретение также относится к применению эффективного количества композиции, описанной выше, для индукции иммунного ответа против H. pylori у индивида. Соединение(я) в композиции может быть конъюгировано с подходящим белком-носителем; кроме того, соединение(я) в композиции может быть конъюгировано с подходящим белком-носителем с помощью 2-кето-3-деокси-октулозоновой кислоты (Kdo) липополисахарида.
Настоящее изобретение, кроме того, относится к иммунной антисыворотке, полученной иммунизацией млекопитающего иммуногенной композицией, описанной в настоящей заявке. Иммунная антисыворотка может содержать IgG, распознающий α1,6-связанный глюкановый эпитоп в гомологичных и гетерологичных типируемых и нетипируемых штаммах H. pylori мутантного и дикого типа. IgG может вызывать комплемент-опосредованный бактериолиз штаммов H. pylori мутантного и дикого типа, экспрессирующих α1,6-глюкан.
Дополнительные аспекты и преимущества настоящего изобретения будут понятны с учетом нижеследующего описания. Подробное описание и примеры, в которых приведены предпочтительные варианты осуществления изобретения, показаны только в качестве иллюстрации, поскольку различные изменения и модификации в рамках изобретения будут очевидны специалистам в данной области в свете описания настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Указанные и другие признаки изобретения будут описаны в настоящей заявке в форме примера со ссылкой на прилагаемые чертежи, где:
на ФИГУРЕ 1 показан анализ CE-MS гликоформ LPS фракции 1 делипидизированного LPS штамма 26695 HP0826::Kan H. pylori в режиме определения положительных ионов. На фигуре 1A показан выделенный масс-спектр (m/z 1000-1500), тогда как на фигуре 1 B показан спектр ионов-продуктов ионов при m/z 1266,3.
На ФИГУРЕ 2 показан анализ CE-MS гликоформ LPS O-деацилированного LPS штамма 26695 HP0826::Kan H. pylori в режиме определения отрицательных ионов. На фигуре 2A показан выделенный масс-спектр (m/z 600-2000), тогда как на фигуре 2B показан спектр ионов-продуктов ионов при m/z 1597,7. Заряженные фрагменты, соответствующие группировке липида А, помечены звездочкой.
На ФИГУРЕ 3A показана структура основной гликоформы LPS штамма 26695 HP0826::Kan H. pylori; ацилирование не показано. Продукты KOH-деацилирования LPS фигуры 3A показаны на фигуре 3B (соединения 1-4). Продукты дезаминирования соединения 4 показаны на фигуре 3C (соединения 5 и 6). Продукты окисления периодатом соединения 6 показаны на фигуре 3D (соединения 7 и 8). Структуры, ранее предложенные в данной области для LPS H. pylori штамма 26695 (фигура 3E) и LPS H. pylori мутантного штамма 26695 HP0826::Kan (фигура 3F), также показаны (адаптировано из Logan et al., 2000). PEtn = фосфоэтаноламин; Glc = D-глюкопираноза; Gal = D-галактопираноза; Kdo = 2-кето-3-деокси-октулозоновая кислота; LDHep = L-глицеро-D-манногептоза; DDHep = D-глицеро-D-манногептоза; GlcNAc - 2-ацетамидо-2-деокси-D-глюкоза; GlcN=2-амино-2-деокси-D-глюкоза; Fuc=L-фукоза; P=фосфат; и Gro=глицерин.
На ФИГУРЕ 4 показана схема реакции получения конъюгатов на основе LPS настоящего изобретения.
На ФИГУРЕ 5 показан анализ CE-MS основной фракции делипидизированного LPS H. pylori O:3HP0826::Kan в режиме определения отрицательных ионов. ●: гликоформы LPS, содержащие один остаток Hep в боковой цепи, R=Hex5-13, Hep, HexNAc, Fuc; ■: гликоформы LPS, содержащие два остатка Hep в боковой цепи, R=Hex8-13, Hep, Hep, HexNAc, Fuc.
На ФИГУРЕ 6 представлены графики определения специфичности кроличьих антител, вызываемых конъюгатом dLPS-TT, с помощью ингибирования ELISA с помощью LPS H. pylori 26695 HP0479::Kan (фигура 6A) и 26695 HP0826::Kan (фигура 6B). Нанесение LPS изображено следующим образом: закрашенные квадраты - 26695; закрашенные ромбы - 26695 HP0826::Kan; закрашенный круг - 26695 HP0159::Kan; закрашенные треугольники - 26695 HP0479::Kan; незакрашенные круги - SS1; незакрашенные квадраты - SS1 HP0826::Kan; незакрашенные треугольники - SS1 HP0159::Kan; незакрашенные перевернутые треугольники - SS1 HP0479::Kan.
На ФИГУРЕ 7 представлены графики, иллюстрирующие образование H. pylori-специфичных антител у мышей CD-1. Мышей вакцинировали четыре раза с недельными интервалами 25 мкг/мышь конъюгата dLPS-TT с добавленным в качестве адъюванта 1 мкг/мышь холерного токсина (закрашенные столбики), бесклеточного сониката PJ2 с добавленным в качестве адъюванта 1 мкг/мышь холерного токсина (заштрихованные столбики) или физиологического раствора (незакрашенные столбики). Через четыре недели после первой иммунизации собирали образцы сыворотки, фекалий и вагинальных смывов и тестировали на H. pylori-специфичные IgG и IgA. Показания отдельных мышей нанесены на графики с горизонтальной чертой, указывающей среднее значение в группе (n=5/группа). *p<0,05, **p<0,01 согласно одностороннему критерию Манна-Уитни.
ФИГУРА 8 представляет собой столбчатый график, изображающий нагрузки H. pylori в желудках мышей CD-1. Мышей вакцинировали четыре раза с недельными интервалами 25 мкг/мышь конъюгатом dLPS-TT с добавленным в качестве адъюванта 1 мкг/мышь холерного токсина (заштрихованные столбики), бесклеточного сониката PJ2 с добавленным в качестве адъюванта 1 мкг/мышь холерного токсина (заштрихованные столбики) или физиологического раствора (незакрашенные столбики). Через пять недель после первой иммунизации мышам вводили перорально с помощью зонда три раза через день по -108 КОЕ H. pylori, штамм PJ2. Через четыре недели мышей умерщвляли и подсчитывали живые бактерии в желудках. Столбики представляют собой группы из 4-5 мышей ±SEM. *p<0,05, односторонний критерий Манна-Уитни.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к новому эпитопу внешнего участка кора LPS Helicobacter pylori. Более подробно, настоящее изобретение относится к новому эпитопу внешнего участка кора LPS H. pylori, его синтезу, описанию и конъюгации.
Если не указано иного, то все технические и научные термины, используемые в настоящей заявке, имеют значение, понятное специалисту в данной области, к которой относится изобретение. Хотя любые способы и материалы, сходные или эквивалентные с описанными в настоящей заявке способами и материалами, могут быть использованы на практике или при тестировании настоящего изобретения, ниже описаны предпочтительные способы и материалы. Все упомянутые в настоящей заявке публикации включены в качестве ссылки.
В данном контексте “очищенный” не обязательно означает абсолютную чистоту, но, скорее, предназначен как относительное определение. Аналогичным образом, в данном контексте “выделенный” относится к удалению чего-либо из его естественной среды.
Helicobacter pylori представляет собой бактериальный патоген, обычно связанный у человека с хроническим гастритом, пептической язвой и раком желудка; в результате того, что риск рака желудка повышается при наличии инфекции H. pylori, этот патоген был классифицирован как канцероген класса I. Липополисахарид (LPS) является главным компонентом клеточной поверхности H. pylori. Существующие до настоящего момента публикации, относящиеся к исследованиям структуры LPS H. Pylori, привели к созданию модели, в которой полисахарид O-цепи ковалентно связан с олигосахаридом кора, который, в свою очередь, присоединен к молекуле липида А. Полисахаридный остов О-цепи большинства штаммов H. pylori является уникальным и может проявлять детерминанты группы крови по Льюису (Le) типа 2 и/или типа 1; указанный полисахаридный компонент является антигенным. "Типируемые" штаммы H. pylori имеют эпитопы Льюиса (антигены Le X и/или Le Y), которые могут быть распознаны антителами анти-Льюис (anti-Le); такие антитела коммерчески доступны и помогают при типировании. "Нетипируемые" штаммы не содержат структур Льюиса.
Другие исследования структуры показали, что внешний участок кора LPS H. pylori содержит два необычных полимерных компонента: DD-гептогликан и α1,6-глюкановые боковые цепи (Monteiro, 2001). Logan et al. (2000) также дали представление о структуре LPS. В частности, предложенные структуры (см. фиг. 3E и 3F) предусматривали, что DD-гептоза (DD-Hep) боковой цепи присоединена к DD-Hep основной цепи, тогда как α1,6-глюкан присоединен к указанной DD-Hep боковой цепи и образует другую ветвь. В частности, Logan et al. (2000) определили длину гликановой цепи LPS мутанта 0826, которая составляет от одной до трех молекул глюкозы, на основании спектров FAB-MS (масс-спектрометрия с бомбардировкой ускоренными атомами). Наличие α1,6-связанной глюкозы в LPS штамма 26695 H. pylori также было описано и основано на данных анализа метилирования, но длина глюкана не была установлена. Кроме того, было сделано предположение, что в LPS штамма 26695, 3-замещенная Hep образует связь между элементом GlcNAc O-цепи и кором. Также было установлено наличие 3-связанной гептозы в LPS H. pylori HP0826::Kan, но наличие α1,3-гептана или его длина не были описаны. Другой информации о структуре или длине гептановых или глюкановых боковых цепей не существует. Структура LPS H. pylori в настоящее время устанавливается.
Настоящее изобретение относится к новому α1,6-глюкан-содержащему соединению Helicobacter pylori, содержащему структуру формулы I:
в которой R представляет собой трисахарид α-DDHep-3-α-L-Fuc-3-β-GlcNAc, замещенный α1,6-глюканом за которым следует α1,3-DD-гептан, где последний остаток DD-Hep α1,3-DD-гептана кэпирован остатком β-GlcNAc.
В структуре, которая описана выше, β-GlcNAc трисахарида (α-DDHep-3-α-L-Fuc-3-β-GlcNAc), связан с α-DDHep G. α-DDHep трисахарида связан с α1,6-глюканом, который в свою очередь связан с α1,3-DD-гептаном. Затем α1,3-DD-гептан соединяется с остатком β-GlcNAc; последний может предоставлять точку прикрепления для полисахарида O-цепи. Термин "связанный" или "замещенный" обозначает, что две группировки соединены ковалентной связью.
Термин "α1,6-глюкан", используемый в настоящей заявке, также может взаимозаменяемо употребляться как "глюкан", "α1,6-глюкановая боковая цепь", "глюкановая боковая цепь", "α1,6-глюкановый фрагмент" и/или "глюкановый фрагмент". α1,6-Глюкан представляет собой линейную полисахаридную цепь, состоящую из мономеров глюкозы, связанных α1,6 O-гликозидными связями. В одном неограничивающем примере α1,6-глюкан может представлять собой линейный полисахарид. α1,6-Глюкан может содержать любое подходящее количество α1,6-глюкозных остатков. Например, глюкан может содержать без ограничения приблизительно от 3 до 12 α1,6-связанных остатков глюкозы; в частности, фрагмент глюкана может содержать приблизительно 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 α1,6-связанных остатков глюкозы, или число остатков может находиться в любом диапазоне, задаваемом любыми двумя из перечисленных значений. В неограничивающем примере α1,6-глюкан может содержать 9-12 остатков α1,6-глюкозы; в другом неограничивающем примере α1,6-глюкан может содержать 10 α1,6-глюкозных остатков.
Термин "гликоформа", как используется в настоящем описании, обозначает различные формы или типы соединения с одинаковой структурой LPS, но отличающиеся числом остатков α1,6-глюкозы или α1,3-гептозы. Например, и без связи с какой-либо теорией, каждая гликоформа может содержать глюкановый и/или гептановый фрагмент определенной длины или их комбинацию.
Термин "α1,3-гептан", используемый в настоящей заявке, также может взаимозаменяемо упоминаться как "α1,3-DD-гептан", "гептан", "α1,3-гептановая боковая цепь", "гептановая боковая цепь", "α1,3-гептановый фрагмент", "гептановый фрагмент" и/или "DD-гептогликан". α1,3-Гептан представляет собой полисахаридную цепь, состоящую из мономеров гептозы, связанных α1,3 O-гликозидными связями. В одном из примеров, которые не предназначены для ограничения каким-либо образом, α1,3-гептан может представлять собой линейный полисахарид. α1,3-Гептан может содержать любое подходящее количество остатков α1,3-гептозы. Например, гептан может содержать без ограничения приблизительно 2-6 α1,3-связанных остатков гептозы; в частности, гептановый фрагмент может содержать приблизительно 2, 3, 4, 5 или 6 α1,3-связанных остатков гептозы или количество остатков гептозы может находиться в диапазоне, задаваемом любыми двумя из перечисленных выше значений.
Последний остаток DD-Hep α1,3-DD-гептана, описанного выше, кэпирован остатком β-GlcNAc. Термин "кэпированный" означает, что остаток β-GlcNAc является последним остатком боковой цепи; также может быть использован термин "концевой". β-GlcNAc может быть связан с DD-Hep через положение О-2 гептозы. Вне связи с какой-либо теорией, остаток β-GlcNAc может предоставлять точку прикрепления для полисахарида O-цепи.
В неограничивающем примере R может представлять собой
где остаток L β-GlcNAc связан с O-2 Hep остатка G. В данном примере остаток W β-GlcNAc может предоставлять точку прикрепления для полисахарида O-цепи. В соединении, которое описано, остатки Q и Z глюкана представляют собой α1,6-связанные остатки глюкозы, и n может иметь любое значение от 1 до 11, так что глюкан содержит приблизительно 3-12 остатков глюкозы в α1,6-соединении; в одном конкретном не ограничивающем примере основная гликоформа содержит 10 последовательных α1,6-связанных остатков глюкозы (n=9). В соединении, которое описано, остатки T, Y и X представляют собой α1,3-связанные остатки гептозы, и m может иметь любое значение от 0 до 4, так что гептан содержит приблизительно от 2 до 6 остатков гептозы в α1,3-соединении; в одном конкретном не ограничивающем примере основная гликоформа содержит 4 последовательных α1,3-связанных остатков гептозы (m=2).
Структура может быть выделена и/или очищена из любого подходящего штамма H. pylori; в качестве примера и без намерения ограничить каким-либо образом, усеченная молекула LPS H. pylori может быть выделена из нетипируемого штамма H. pylori (т.е. штамма, лишенного антигенов Льюиса), такого, но без ограничения, как штамм H. Pylori, имеющий мутацию в гене HP0826, приводящую к изогенному мутанту, лишенному полисахарида O-цепи. В неограничивающем примере соединение, описанное в настоящем описании, может быть выделено и/или очищено из штамма 26695 HP0826::Kan или штамма PJ2 H. pylori.
Структура формулы I, также обозначаемая в настоящем описании как "молекула внутреннего участка кора", может, кроме того, включать молекулу липида A, ковалентно присоединенную к остатку Kdo, например, к остатку Kdo С. В других вариантах осуществления молекула липида A может быть O-деацилирована или может быть полностью деацилирована. В других вариантах осуществления молекула липида A отщеплена путем гидролиза кетозидной связи от остатка Kdo. Вне связи с какой-либо теорией, отщепление липида А можно осуществить для устранения токсичности LPS и во избежание возможной агрегации и нерастворимости конъюгата. Специалистам в данной области известны способы O-деацилирования, деацилирования, или гидролиза кетозидной связи молекулы липида A (см., например, Hoist et al., 1991; Altman et al., 2003).
Настоящее изобретение также относится к конъюгату, содержащему по существу линейное α1,6-глюкан-содержащее соединение, конъюгированное с белком-носителем. По существу линейное α1,6-глюкан-содержащее соединение может представлять собой любой подходящий по существу линейный полисахарид, состоящий из α1,6-связанных остатков глюкозы. Термин "по существу линейный" обозначает, что α1,6-глюкан содержит несколько ветвей; например, α1,6-глюкан может без ограничения содержать приблизительно от 0 до 5% разветвления в α1,6-глюкане. В частности, α1,6-глюкан может включать приблизительно 0, 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5 или 5% разветвления, или любое количество между указанными значениями; соединение также может представлять собой смесь, в которой степень разветвления в смеси изменяется от одного соединения к другому. В неограничивающем примере α1,6-глюкан-содержащее соединение может представлять собой структуру, которая описана выше, и в настоящем описании в другом примере α1,6-глюкан-содержащее соединение может представлять собой Декстран. Декстран может быть любым подходящим Декстраном, который соответствует требованиям, описанным выше, и имеет молекулярный вес от 1 до 10 кДа; например, Декстран может иметь без ограничения молекулярный вес 1, 3,5, 5, 6,5, 8 или 10 кДа, или любой молекулярный вес между указанными значениями. В конкретном неограничивающем примере Декстран может представлять собой Декстран T5. В еще одном примере α1,6-глюкан-содержащее соединение может представлять собой линейную цепь из 5-8 α1,6-связанных остатков глюкозы; например, α1,6-глюкан-содержащее соединение может представлять собой без ограничения линейную цепь из 5, 6, 7 или 8 α1,6-связанных остатков глюкозы.
α1,6-Глюкан-содержащее соединение конъюгируют с линкерной молекулой и/или белком-носителем; специалисту в данной области очевидно, что структуру, описанную в настоящем описании, можно конъюгировать непосредственно с белком-носителем или можно конъюгировать с линкерной молекулой (также обозначаемой в настоящей заявке как "линкер"), которая, в свою очередь, конъюгируется с белком-носителем. Термин "конъюгированный" обозначает, что структура ковалентно присоединена или связана с линкерной молекулой и/или белком-носителем. Способы ковалентного присоединения линкера и/или белка-носителя хорошо известны специалистам в данной области; и как будет понятно специалисту в данной области, способ ковалентного присоединения (и независимо от того, представлен ли линкер) может изменяться с учетом применяемого белка-носителя. Без намерения ограничить каким-либо образом, на фигуре 4 представлен один из таких способов, который адаптирован из Fernandez-Santana et al. (1998); в указанном способе деацилированный или делипидизированный LPS активируется ковалентным присоединением карбоксильной группы остатка Kdo к линкерной молекуле с последующим введением малеимидной функциональной группы. Активированный LPS смешивают с тиолированным белком-носителем для получения конъюгированной структуры. Как оценят специалисты в данной области, способ, описанный в настоящей заявке, является общим и соответственно может быть использован любой другой подходящий способ (например, но, не ограничиваясь способами, описанными Chu et al., 1991; Cox et al., 2005; Gu et al., 1996; Mieszala et al., 2003; Yu and Gu, 2007). α1,6-Глюкан-содержащее соединение можно присоединить к линкеру/белку-носителю с помощью карбоксильной группы любого подходящего углеводного остатка структуры. В конкретном неограничивающем примере α1,6-глюкан-содержащее соединение может иметь структуру настоящего изобретения и может быть присоединено с помощью остатка С, Kdo внутреннего участка кора.
Белок-носитель может представлять собой любой подходящий носитель, известный в данной области, включая иммуногенные носители. Например, белок-носитель может представлять собой, но без ограничения, столбнячный анатоксин, бычий сывороточный альбумин (BSA), дифтерийный анатоксин, мутантный дифтерийный анатоксин, CRM, белок CRM197, белок А Pseudomonas, белок холерного токсина (CT), белок холерного токсина мутанта CT-E29H, и другие белки-носители, известные в данной области, например, но без ограничения части жгутиков, пили и другие токсины.
Как указывалось ранее, конъюгаты могут быть получены либо непосредственно соединением белка-носителя и структуры настоящего изобретения через естественные группы, либо соединением с помощью введения спейсера или линкерных молекул, включая, но без ограничения простейшие аминогруппы, гидразиды, тиолы, карбоксильные группы и другие.
Настоящее изобретение, кроме того, относится к композиции, содержащей одно или более соединения, которые описаны выше, один или более конъюгаты, как описано выше, или их комбинацию. В одном из вариантов осуществления композиция может содержать смесь гликоформ соединения, описанного выше; в качестве примера и без намерения ограничить каким-либо образом, композиция может содержать основную гликоформу, включающую 10 последовательных α1,6-связанных остатков глюкозы (n=9) во фрагменте глюкана. Аналогичным образом, композиция может содержать без ограничения конъюгаты, полученные из более чем одной гликоформы, описанной в настоящей заявке. Как показано в примерах, структура LPS, вырабатываемого штаммом H. pylori 26695 HP0826::Kan, который использовали при получении конъюгатов, представляла собой смесь трех гликоформ: олигосахарид основной цепи I, олигосахарид основной цепи I, кэпированный GlcNAc и [GlcNAc, Fuc, Hep], и олигосахарид, содержащий α1,6-связанный глюкан, с наиболее длинной глюкановой цепью, соответствующей приблизительно двенадцати α-1,6-связанным остаткам, как определили с помощью анализа CE-MS (таблица 2, фиг. 2).
Композиция, которая описана выше, может быть иммуногенной. Термин "иммуногенный" обозначает, что композиция может вызывать иммунный ответ против H. pylori диких и/или мутантных штаммов. Иммунный ответ может обеспечить широкую иммуногенную реакцию против типируемых и нетипируемых штаммов H. pylori.
Настоящее изобретение также относится к применению эффективного количества композиции, которая описана в настоящей заявке, для индукции иммунного ответа против H. pylori у индивида. Как описано ранее, композиция может содержать одно или более чем одно соединение по настоящему изобретению. Одно или более чем одно соединение может быть конъюгировано с линкером и/или подходящей молекулой-носителем.
Настоящее изобретение, кроме того, относится к иммунной антисыворотке, полученной иммунизацией млекопитающего иммуногенной композицией, как описано выше. Иммунная антисыворотка может содержать или предоставлять постиммунный сывороточный IgG, распознающий α1,6-связанный глюкановый эпитоп в гомологичных и гетерологичных типируемых и нетипируемых мутантных и диких штаммах H. pylori. IgG может вызывать комплемент-опосредованный бактериолиз мутантных и диких α1,6-глюкан-экспрессирующих штаммов H. pylori.
Настоящее изобретение, кроме того, относится к анти-α1,6-глюкановым антителам. Антитела могут быть индуцированы против соединения изобретения, которое описано в настоящей заявке, или могут быть индуцированы против других α1,6-глюкан-содержащих молекул, таких как Декстран (или конъюгаты Декстрана, например, но без ограничения конъюгаты BSA-Декстран). В одном из неограничивающих примеров антитело может быть моноклональным антителом, полученным способом, известным в данной области (см. Пример 10; Altman et al., 2005). Например, антитело может быть без ограничения моноклональным антителом, индуцированным против α1,6-глюканового эпитопа, представленного во внешнем коровом участке LPS мутанта HP0826 H. pylori; более подробно, антитело может быть индуцировано против соединения, представленного на фигуре 5. В более конкретном примере моноклональное антитело может представлять собой IgM 1C4F9, продуцируемый гибридомной клеточной линией 1C4F9. Указанная клеточная линия зарегистрирована Международным депозитарным органом Канады (National Microbiology Laboratory, Public Health Agency of Canada, 1015 Arlington Street, Winnipeg, Manitoba, CANADA) 30 июля 2009 и с присвоением учетного номера 300709-01. Как показано в примерах, антитело 1C4F9 распознавало α1,6-глюкановый эпитоп в LPS и в целых клетках типируемых и нетипируемых штаммов H. pylori, являлось легко доступным на поверхности живых бактерий и реагировало одинаково хорошо с конъюгатами LPS-OH-TT и dLPS-BSA или dLPS-TT.
Настоящее изобретение относится к применению антитела 1C4F9, для осуществления комплемент-опосредованного бактериолиза мутантных и диких типируемых и нетипируемых α1,6-глюкан-экспрессирующих штаммов H. pylori у индивида, при необходимости. Как описано ранее, типируемые штаммы H. pylori имеют антигены Льюиса, распознаваемые антителами анти-Le, тогда как нетипируемые штаммы их не имеют. Однако, поскольку типируемые и нетипируемые штаммы содержат α1,6-глюкан, оба типа штаммов будут распознаваться антителом 1C4F9.
В настоящее время в данной области, штаммы H. pylori могут быть типированы с помощью коммерчески доступных антител против антигенов Льюиса; однако, поскольку нетипируемые штаммы не содержат структур Льюиса, они не могут быть классифицированы с применением указанного подхода. Поскольку большинство типируемых и нетипируемых штаммов H. pylori имеют α1,6-глюкановые эпитопы, анти-α1,6-глюкановые антитела (такие как mAb 1C4F9) могут предоставить дополнительный способ скрининга и описания изолятов H. pylori.
LPS штамма 26695 HP0826::Kan H. pylori очищали и его химическую структуру определяли с помощью композиции, метилирования, углубленного анализа ядерного магнитного резонанса (ЯМР) и данных анализа CE-MS. Наличие α1,6-связанного глюкана во внешнем коровом участке LPS мутанта HP0826 H. pylori также было показано; указанная структура распознавалась моноклональным антителом 1C4F9, специфичным к α1,6-глюкану. Последнее антитело было получено с использованием фиксированных формалином клеток мутантного штамма О:3 HP0826::Kan H. pylori. Указанные антитела были доступны на клеточной поверхности и являлись бактерицидными. Ранее считалось, что только структуры Льюиса являются антигенными; таким образом, получение антител против α1,6-глюкана стало неожиданным.
Для изучения вакцинного потенциала LPS H. pylori, модифицированный LPS мутанта 26695 HP0826::Kan H. pylori конъюгировали со столбнячным анатоксином (TT) или бычьим сывороточным альбумином (BSA). Применяли два подхода для получения частично делипидизированного или делипидизированного LPS: O-деацилирование LPS с помощью мягкого гидразинолиза (LPS-OH) или делипидизация LPS мягкой обработкой кислотой (dLPS). Дополнительные способы делипидизации и/или частичной делипидизации хорошо известны в данной области, и такие подходящие способы можно использовать в объеме настоящего изобретения. LPS-OH и dLPS ковалентно связывали через остаток 2-кето-3-деокси-октулозоновой кислоты (Kdo) со спейсером, содержащим диаминогруппу, с последующим введением малеимидной функциональной группы и конъюгированием с тиолированным TT или BSA для получения конъюгатов LPS-OH-TT, dLPS-BSA и dLPS-TT, соответственно. В отдельном эксперименте LPS нетипируемого штамма PJ2 делипидизировали и использовали для конъюгации с получением конъюгата dLPS(PJ2)-TT.
Конъюгаты LPS-OH-TT, dLPS-BSA, dLPS-TT и dLPS(PJ2)-TT сохраняли антигенность поверхностной доступной α1,6-глюкановой детерминанты, которую оценивали в непрямом тесте ELISA с IgM 1C4F9. Антитело, как было показано, обладало высокой специфичностью к α1,6-глюкановой детерминанте и характеристики связывания определяли в тесте ингибирования ELISA олигосахаридами из изомальто-серий и очищенным LPS типируемых и нетипируемых штаммов H. pylori. Указанные исследования подтвердили, что антителу 1C4F9 необходимы 5-6 последовательных α1,6-связанных остатков глюкозы, модель согласуется с размером участков связывания анти-α-(1→6)декстрана, постулированным Kabat (1993).
Конъюгаты LPS-OH-TT, dLPS-BSA, dLPS-TT или dLPS(PJ2)-TT являлись иммунногенными у мышей и кроликов и вызывали статистически значимое образование антител IgG в ответ на LPS гомологичных, гетерологичных и диких штаммов H. pylori. У мышей и кроликов, которые получали dLPS-содержащий конъюгат, развивался в десять раз более сильный иммунный ответ IgG на иммунизирующий антиген. Постиммунные сыворотки кроликов, иммунизированных либо LPS-OH-TT, dLPS-BSA, dLPS-TT, либо dLPS(PJ2)-TT демонстрировали бактерицидную активность против мутантного 26695 HP0826::Kan и дикого 26695 штаммов H. pylori.
Таким образом, указанные результаты показывают, что белковые конъюгаты на основе делипидизированного или частично делипидизированного на основе LPS H. pylori, лишенного антигена Le и несущего длинную α1,6-глюкановую цепь являются иммуногенными для мышей и кроликов и индуцируют образование бактерицидных антител. Важно отметить, что указанный эпитоп был идентифицирован как иммуногенный. Данный факт не был установлен ранее, поскольку было известно, что только структуры Льюиса являются антигенными и вызывают образование специфических антител.
Настоящее изобретение далее будет проиллюстрировано в следующих примерах. Однако следует понимать, что указанные примеры являются только иллюстративными и не должны использоваться для ограничения объема настоящего изобретения каким-либо образом.
Пример 1. Выделение и структурный анализ LPS H. pylori 26696 HP0826::Kan
Штамм 26695 Helicobacter pylori был получен от Dr. R. Aim (Astra Zeneca, Boston, MA), изолят H. pylori О:3 был получен от Dr. J. Penner, J99 был получен от Dr. D. Taylor (University of Alberta, Edmonton, Canada), SS1 был получен от Dr. A. Lee (The University of New South Wales, Sydney, Australia), клинические изоляты PJ1 и PJ2 представляли собой свежие клинические изоляты от Dr. W. Conlan (IBS, NRC) и M6 был получен от Dr. K. Eaton (Michigan State University, MI).
Культивирование бактериальных штаммов осуществляли, как описано Hiratsuka et al. (2005). Кратко, клетки выращивали при 37°C на чашках с кровяным агаром Columbia (Difco) и с добавлением антибиотиков, содержащим 7% крови лошади в микроаэрофильных условиях в течение 48 часов (Kan 20 мкг/мл), как описано ранее (Hiratsuka et al., 2005). Для роста в суспензионной культуре с добавлением антибиотиков жидкую среду Brucella, содержащую 10% фетальной бычьей сыворотки, инокулировали клетками H. pylori, собранными через 48 часов со слоя питательной среды кровяной агар Columbia/лошадиная кровь, и инкубировали в течение 48 часов в шейкере в микроаэрофильных условиях (85% N2, 10% CO2, 5% O2), как описано ранее (Hiratsuka et al., 2005).
Штаммы H. pylori культивировали в жидкой культуре, как описано выше, и влажную клеточную массу, полученную при центрифугировании бактериальной культуры, дважды последовательно отмывали этанолом, ацет