Биопринтер
Иллюстрации
Показать всеИзобретение относится к области биоинженерии и может быть использовано при печати живых органов и других биологических систем. Биопринтер содержит блок перепрограммирования клеток и блок вывода клеток на подложку, а также последовательно соединенные блок загрузки и хранения колонии соматических клеток, блок перепрограммирования клеток с установленными на нем устройством введения одного или более факторов перепрограммирования и устройством введения ингибитора метилтрансферазы GSK126, имеющий по меньшей мере один отсек перепрограммирования, блок культивирования плюрипотентных стволовых клеток с установленными на нем устройством введения агента, изменяющего эпигенетический статус клетки, устройством введения белка Вах, устройством введения белка Bak, устройством введения монооксида азота, устройством введения ингибитора пролиферации и устройством введения ингибитора апоптоза, имеющий, по меньшей мере, один отсек культивирования клеток и механизм смены питательной среды для клеток, блок дифференцировки клеток с установленным на нем устройством введения одного или более факторов роста, имеющий по меньшей мере один отсек дифференцировки клеток, блок хранения дифференцированных клеток, имеющий по меньшей мере один отсек хранения дифференцированных клеток, блок вывода клеток на подложку с установленным на нем устройством введения гидрогеля на подложку, выполненный с возможностью работы по принципу трехмерного струйного принтера, и систему управления. Изобретение обеспечивает возможности печати органов и тканей без признаков канцерогенеза при отсутствии необходимости использования дополнительного оборудования. 2 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к области биоинженерии и может быть использовано при печати живых органов и прочих биологических систем.
Известен биопринтер, включающий в себя:
а) одну или несколько головок принтера, каждая из которых включает в себя средство для приема и удержания по меньшей мере одного картриджа, содержащего один или более типов чернил и материал подложки;
б) модуль ультрафиолетового излучения для облучения содержимого по крайней мере одного картриджа ультрафиолетовым излучением; и
с) средство для выдачи содержимого по меньшей мере одного картриджа (US 2014093932 Al, С12М 1/00, 03.04.2014).
Недостатком данного биопринтера является то, что он способен работать лишь с уже подготовленными клетками, то есть в процессе полного цикла преобразования колонии соматических клеток в определенный орган или ткань он выполняет лишь малую функцию.
Наиболее близким аналогом заявленного изобретения является система биологической печати, включающая биореактор, асептическое устройство и принтер. Биореактор состоит из реакционной системы, системы управления, динамической системы, системы аэрации и системы детектирования. Реакционная система включает в себя открытый контейнер для раствора культуры (CN 201395599 Y, A61L 27/38, 03.02.2010).
Недостатком описанной системы биологической печати является длительность подготовки клеток перед их выводом на подложку, а также то, что она не рассчитана печатать органы с большой разновидностью клеток, поскольку она предназначена работать только с одной колонией клеток, обеспечивая для нее только один путь развития.
Общим недостатком всех известных биопринтеров является их неспособность автоматически осуществлять полный цикл преобразования колонии соматических клеток в конечный продукт (орган или ткань), а также большая вероятность развития канцерогенеза в получаемых клетках.
Задачей заявленного изобретения является разработка многофункционального биопринтера, способного печатать различные живые ткани и органы с различными габаритами и содержащие несколько видов клеток.
Техническим результатом заявленного изобретения является обеспечение возможности печати органов и тканей без признаков канцерогенеза при отсутствии необходимости использования дополнительного оборудования.
Технический результат достигается с помощью предложенного биопринтера, содержащего блок перепрограммирования клеток и блок вывода клеток на подложку, причем биопринтер содержит последовательно соединенные блок загрузки и хранения колонии соматических клеток, блок перепрограммирования клеток с установленными на нем устройством введения одного или более факторов перепрограммирования и устройством введения ингибитора метилтрансферазы GSK126, причем упомянутый блок состоит из одного или более отсеков перепрограммирования, блок культивирования плюрипотентных стволовых клеток с установленными на нем устройством введения агента, изменяющего эпигенетический статус клетки, устройством введения белка Вах, устройством введения белка Bak, устройством введения монооксида азота, устройством введения ингибитора пролиферации и устройством введения ингибитора апоптоза, причем упомянутый блок состоит из одного или более отсеков культивирования клеток и снабжен механизмом смены питательной среды для клеток, блок дифференцировки клеток с установленным на нем устройством введения одного или более факторов роста, причем упомянутый блок состоит из одного или более отсеков дифференцировки клеток, блок хранения дифференцированных клеток, причем упомянутый блок состоит из одного или более отсеков хранения дифференцированных клеток, блок вывода клеток на подложку с установленным на нем устройством введения гидрогеля на подложку, причем упомянутый блок работает по принципу трехмерного струйного принтера, и систему управления.
Система управления может быть выполнена с возможностью:
a. автономного или ручного регулирования перемещением колонии клеток между следующими блоками: загрузки и хранения колонии соматических клеток, перепрограммирования клеток, культивирования плюрипотентных стволовых клеток, дифференцировки клеток и хранения дифференцированных клеток, а также выводом колонии клеток на подложку в блоке вывода клеток на подложку;
b) автономного или ручного регулирования температуры внутри блока загрузки и хранения колонии соматических клеток;
c) автономного или ручного регулирования введением одного или более факторов перепрограммирования и ингибитора метилтрансферазы GSK126 в блок перепрограммирования клеток;
d) автономного или ручного регулирования введением агента, изменяющего эпигенетический статус клетки, белка Вах, белка Bak, монооксида азота, ингибитора пролиферации и ингибитора апоптоза в блок культивирования плюрипотентных стволовых клеток;
e) автономного или ручного управления механизмом смены питательной среды для клеток в блоке культивирования плюрипотентных стволовых клеток;
f) автономного или ручного регулирования введением одного или более факторов роста в блок дифференцировки клеток;
g) автономного или ручного регулирования скорости вывода клеток на подложку в блоке вывода клеток на подложку, а также скорости выведения на подложку гидрогеля;
h) автономного или ручного дозирования разных видов клеток, выводимых на подложку.
Блок перепрограммирования клеток может дополнительно содержать иммунофлюоресцентный анализатор, выполненный с возможностью передачи сигнала о наличии маркера репрессии H3K27me3 в генах колонии клеток системе управления, причем система управления в таком случае может быть выполнена с возможностью корректировки введения ингибитора метилтрансферазы GSK126 в блок перепрограммирования клеток.
Необходимость введения в среду дедифференцировки соматических клеток ингибитора метилтрансферазы GSK126 объясняется следующим. Наличие метки H3K9me3 препятствует перепрограммированию клеток в индуцированные стволовые, так как мешает посадке белковых репрограммирующих факторов плюрипотенции на гены мишени. В связи с этим модификацию клеток необходимо проводить при высоком содержании маркера репрессии H3K27me3, который исключает работу препятствующего перепрограммированию маркера репрессии H3K9me3, а также, помимо всего прочего, способствует сохранению эпигенетической памяти в процессе деления клетки, что позволяет избежать в них канцерогенных и деструктивных явлений. Косвенно это можно подтвердить тем, что установка маркера H3K27me3 обычно происходит в промежуток клеточного цикла до репликации ДНК.
Кроме того, следует отметить, что триметилирование лизина 27 в гистоне Н3 (H3K27me3) в принципе является необходимым условием перепрограммирования соматических клеток в индуцированные плюрипотентные стволовые, однако присутствие данного маркера в малом количестве не только тормозит процесс перепрограммирования, но и еще чревато дальнейшим образованием в дифференцированных клетках воспалительных процессов.
В связи с вышеописанным во время дедифференцировки соматических клеток возникает необходимость искусственной установки маркера H3K27me3. Это можно осуществить посредством введения в среду дедифференцировки N-[(1,2-дигидро-4,6-диметил-2-оксо-3-пиридинил)метил]-3-метил-1-[(1S)-1-метилпропил]-6-[6-1-пиперазинил)-3-пиридинил]-1Н-индол-4-карбоксиамида (ингибитора метилтрансферазы GSK126).
Ингибитор метилтрансферазы GSK126 способствует образованию метилтрансферазы гистонов EZH2, входящей в состав комплекса PRC2 белковой группы policomb. Образовавшаяся субъединица EZH2 в свою очередь осуществляет тройное метилирование гистона Н3 с образованием маркера репрессии H3K27me3.
Согласно иммунофлюоресцентному анализу большинство колоний индуцированных плюрипотентных клеток, полученных иными способами, отличными от предложенного, дают средней силы сигнал о наличии H3K27me3 в ядрах 40-100%-ах клеток в колонии. В таком случае при наиболее стабильной плотности монослоя индуцируемых клеток в начале процесса дедифференцировки, составляющей 30-60%, для образования необходимого количества метилтрансферазы гистонов EZH2 предпочтительно, чтобы концентрация ингибитора метилтрансферазы GSK126 в среде составляла 0,8 - 2 мас.%.
Касательно совершенствования последующего культивирования и дифференцировки стволовых клеток следует отметить следующее. Известно, что в организме среднестатистического взрослого человека в результате апоптоза ежедневно погибает порядка 50-70 миллиардов клеток. Для среднестатистического ребенка в возрасте от 8 до 14 лет число клеток, погибших путем апоптоза, составляет порядка 20-30 миллиардов в день. Суммарная масса клеток, которые на протяжении 1 года жизни подвергаются разрушению, эквивалентна массе тела человека. При этом восполнение утраченных клеток обеспечивается за счет пролиферации - увеличения клеточной популяции путем деления.
Наиболее перспективным способом получения плюрипотентных стволовых клеток является модификация соматическых клеток, индуцирующая их превращение в стволовые с помощью факторов перепрограммирования -рекомбинантных белков, микроРНК, синтетической самореплицирующейся полицистронной РНК или низкомолекулярных биологически активных веществ. Одними из известных вышеупомянутых факторов являются факторы Яманаки (Oct4, Klf4, Sox2 и с-Мус).
Также существуют факторы перепрограммирования, представляющие собой низкомолекулярные соединения, позволяющие преобразовать взрослые клетки в индуцированные плюрипотентные стволовые, способные поддерживать свою жизнеспособность на высоком уровне в течение нескольких месяцев. В число указанных соединений входят семь факторов:
- вальпроевая кислота или ингибитор гистондезацетилазы, которая способствует активации генов плюрипотентности и репрессии генов линейной дифференцировки;
- GSK3 - ингибитор гликоген-синтазы-киназы 3. Ингибирование GSK3 имитирует активацию сигнального пути Wnt, в результате чего β-катенин, избежав деградации, входит в ядро, где активирует синтез ферментативной субъединицы теломеразы;
- Е-616452 - ингибитор трансформирующего ростового фактора бета TGF-[бета], который в ходе перепрограммирования заменяет Sox2, активируя Nanog;
- транилципромин - ингибитор моноаминоксидазы или ингибитор деметилазы, которая избирательно удаляет метальные группы с лизина в положении Лиз4 или Лиз9 гистона Н3. Действуя на хроматин, транилципромин вызывает глобальное увеличение Н3К4 метилирования и, как следствие этого, дерепрессию генов. Ингибиторы деметилазы обладают способностью подавлять избыточную пролиферацию клеток и таким образом подавлять развитие раковых опухолей;
- форсколин - препарат, активирующий аденилатциклазу - фермент, катализирующий превращение АТФ в цАМФ;
- 3-деазанепланоцин - ингибитор гидролазы S-аденозилгомоцистеина, который вызывает разрушение репрессорного комплекса PRC2 и ингибирующее метилирование гистонов;
- PD-0325901 - высокоизбирательный и сильнодействующий синтетический ингибитор митоген-активируемой протеинкиназы МЕК, избирательно фосфорилирующей серин/треонин и остатки тирозина в активационной петле ее субстратов.
Общая проблема всех известных способов индуцирования стволовых клеток заключается в том, что получаемые из них дифференцированные клетки оказываются недозрелыми и соответствуют примерно второму месяцу развития плода.
У естественных зрелых клеток и полученных лабораторным путем около сотни генов работают по-разному. Половина из них в норме активна только в стволовых клетках, и со временем эти гены прекращают свою деятельность. У дифференцированных же клеток, полученных искусственно, эти гены продолжают работать. Более того, внезапная активация в зрелых клетках «стволовых» генов, многие из которых управляют клеточным делением, чревата возникновением злокачественной опухоли.
Причиной возникновения злокачественных опухолей является нарушение апоптоза и процесса деления клеток. В качестве основной причины данной патологии были рассмотрены соматические мутации гена, кодирующего белок р53. Порядка 50% искусственно трансформированных клеток экспрессируют мутантную форму р53.
Регуляция деления и апоптоза клеток и доведение их "до кондиции" до пересадки в человеческий организм наравне с увеличением количества маркера репрессии H3K27me3 в период дедифференцировки позволят решить проблему "недозревания" и возникновения раковых клеток.
Культивирование полученных индуцированных плюрипотентных стволовых клеток в присутствии агента, изменяющего эпигенетический статус клетки, (например, деметилирующего агента, ингибитора деацетилазы гистонов или их сочетания) позволит сделать эпигенетический статус клеток «подвижным», то есть с помощью механизмов, не затрагивающих последовательности ДНК, обеспечит изменчивость экспрессии генов (фенотипа клетки).
Для того чтобы скорость разрушения клеток не превышала скорость поглощения частиц отмерших клеток соседними клетками, что приводит к воспалительным процессам, необходимо урегулировать проницаемость наружной мембраны митохондрий клеток, отвечающую за поглощение и переработку отмершего материала. Существенную роль в повышении проницаемости наружной мембраны митохондрий играют белки Вах и Bak. Они встраиваются в наружную мембрану митохондрий и олигомеризуются. При этом нарушается целостность внешней мембраны митохондрий.
Функционирование белков Вах и Вак зависит от их предварительной активации, например, белками Bid и Bim, которые относятся к подсемейству ВН3 белков. С другой стороны, активация и функционирование Вах и Вак может блокироваться антиапоптотическими белками семейства Bcl-2: Bcl-2, Bcl-xL, Mcl-1 и др. В свою очередь, антиапоптотические белки также могут блокироваться белками-депрессорами (например, Bad), относящимися к подсемейству ВН3 белков. В итоге достигается комбинированная регуляция мембранной проницаемости митохондрий и, соответственно, апоптоза за счет взаимодействия апоптотических, антиапоптотических, а также ВН3 белков-активаторов и депрессоров. Регуляция функций ВН3 белков осуществляется на уровне транскрипции, стабильности молекул, при взаимодействии с другими белками и при различных модификациях.
Несмотря на то, что на данном этапе невозможно установить все причины паталогических нарушений процесса апоптоза, добавление белков bax и bak в среду культивации молодых клеток способно выровнять скорость разрушения и поглощения отмерших клеток за счет регуляции проницаемости наружной мембраны митохондрий. Кроме того, в присутствии агента, изменяющего эпигенетический статус клетки, это позволит «вылечить» ген ТР53, нарушенная модификация которого обнаружена в клетках около 50% раковых опухолей.
Это явление можно объяснить следующим. На наличие и частоту мутаций гена ТР53 существенно влияют факторы окружающей среды, в том числе изменение параметров апоптоза, которое по вышеописанной схеме можно спровоцировать белками bax и bak. Повышение активности гена ТР53 в присутствии агента, изменяющего эпигенетический статус клетки, может повышать восприимчивость клеток к сигналам входа в апоптоз через опосредованное влияние белка р53 на экспрессию генов bax и bcl2. Такие р53-опосредованные изменения экспрессии генов bax и bcl2 могут изменять соотношение количества белков Вах и Bcl2, тем самым переводя клетку в состояние повышенной чувствительности к апоптозу. Таким образом, помимо химического выравнивания скорости разрушения и поглощения клеток, белки Bax и bak через непосредственное влияние на апоптоз способны также оказывать обратное воздействие на ген ТР53, которое заключается в предварительном повреждении гена с его последующей нормальной структуризацией.
Если культивирование стволовых клеток проводить в присутствии монооксида азота, это позволит несложным способом создать стрессовый стимул для гена ТР53, таким образом спровоцировав его дополнительную активацию для последующего лечения.
При этом следует отметить, что вследствие строгого "посттрансляционного контроля активации белка р53″, непосредственно сама по себе высокая концентрация белка р53 не ведет к собственной активации и лечению гена ТР53.
Для ускорения "выздоровления" индуцированных плюрипотентных стволовых клеток их культивирование в присутствии агента, изменяющего эпигенетический статус клетки, а также культивирование в отсутствие указанного агента предпочтительно проводить в присутствии ингибитора пролиферации.
В качестве ингибитора пролиферации предпочтительно использовать по меньшей мере одну пептидную цепь глобина. Указанный ингибитор не только позволит быстрее "выздоравливать" стволовым клеткам в отношении канцерогенных полиморфизмов генов, но еще экспериментально было установлено, что он способствует регулированию всего цикла развития индуцированных стволовых клеток.
Культивирование индуцированных плюрипотентных стволовых клеток предпочтительно проводить также в присутствии по меньшей мере одного ингибитора апоптоза.
За счет белков bak и bax клеточная смерть проходит посредством апоптоза. Указанные белки также способствуют регуляции самого процесса апоптоза, в то время как ингибитор апоптоза желателен для контроля его скорости.
После культивации стволовых клеток следует провести дифференцировку указанных клеток в присутствии по меньшей мере одного фактора роста, некоторые из которых, помимо самой дифференцировки клеток, способны стимулировать также их пролиферацию. В зависимости от того, какие дифференцированные клетки следует получить в конечном итоге, в качестве факторов роста можно использовать различные пептидные или стероидные гормоны.
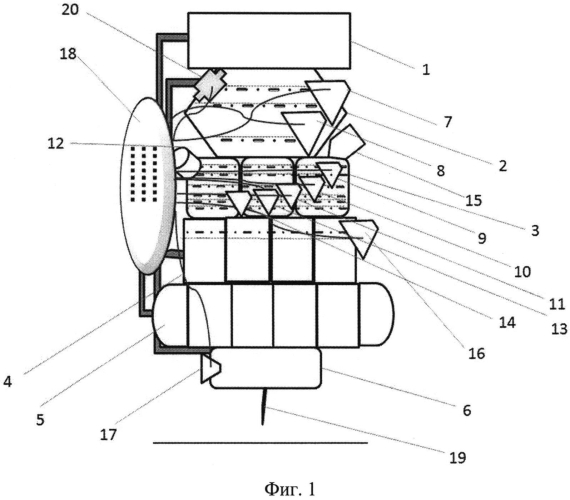
Схема предложенного биопринтера (без корпуса) представлена на фигуре 1.
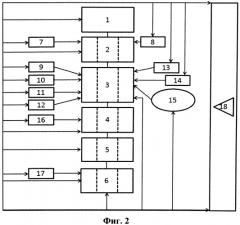
На фигуре 2 представлена блок-схема, поясняющая работу биопринтера. Цифрами на фигурах обозначены следующие элементы:
1- блок загрузки и хранения колонии соматических клеток,
2- блок перепрограммирования клеток,
3 - блок культивирования плюрипотентных стволовых клеток,
4 - блок дифференцировки клеток,
5 - блок хранения дифференцированных клеток,
6 - блок вывода клеток на подложку,
7 - устройство введения одного или более факторов перепрограммирования,
8 - устройство введения ингибитора метилтрансферазы GSK126,
9 - устройство введения агента, изменяющего эпигенетический статус клетки,
10 - устройство введения белка Вах,
11 - устройство введения белка Bak,
12 - устройство введения монооксида азота,
13 - устройство введения ингибитора пролиферации,
14 - устройство введения ингибитора апоптоза,
15 - механизм смены питательной среды для клеток,
16 - устройство введения одного или более факторов роста,
17 - устройство введения гидрогеля,
18 - систему управления,
19 - раздаточная головка,
20 - иммунофлюоресцентный анализатор.
Устройства введения (7-11), (13-14), (16), (17) представляют собой жидкостные дозаторы.
Устройство введения (12) представляет собой газовый дозатор.
Блок загрузки и хранения колонии соматических клеток (1) представляет собой клеточный инкубатор-холодильник.
Блок перепрограммирования клеток (2) представляет собой биохимический реактор, в котором может быть размещена емкость с колонией клеток и к которому подсоединены устройства введения (7) и (8).
Блок культивирования плюрипотентных стволовых клеток (3) представляет собой клеточный инкубатор, который содержит по меньшей мере одну емкость для выращивания клеток и к которому подсоединены устройства введения (9-14).
Если поставлена задача одновременно вырастить несколько колоний стволовых клеток, отличных друг от друга рядом признаков, емкостей для выращивания клеток должно быть несколько. Если же они представляют собой ячеистые силиконовые формы (луночные планшеты), во избежание смешения колоний между ними должны быть размещены перегородки. В каждой емкости находится мембрана для клеточной культуры. Если емкость представляет собой луночный планшет, мембрана должна быть аккуратно размещена в каждой ячейке.
Отсеки культивирования плюрипотентных стволовых клеток представляют собой разделенные между собой, например, перегородками участки инкубатора.
Механизм смены питательной среды (15) может быть исполнен в двух вариантах.
Первый вариант представляет собой жидкостный дозатор и задвижку. Для использования этого варианта на дне емкости для выращивания клеток или же на дне каждой ячейки луночного планшета (частный случай вышеуказанной емкости) должно быть расположено отверстие с клапаном. Края мембраны должны быть непрерывно приклеены к краям ячейки. Для смены питательной среды задвижка открывает клапан(-ы), старая питательная среда вытекает, после чего упомянутый дозатор может залить в емкость новую питательную среду двумя способами:
- первый способ заключается в том, что после вытекания старой среды клапан(-ы) закрываются, а дозатор заливает питательную среду сверху в емкость;
- второй способ может применяться в случае использования луночного планшета и заключается в том, что в отверстие на дне каждой ячейки вставляется трубочка, отходящая от жидкостного дозатора, через которую идет добавление необходимого количества питательной среды, после чего указанная трубочка отсоединяется от ячейки, и вместе с тем отверстия на дне ячеек закрываются клапаном. При использовании этого способа жидкостный дозатор должен содержать несколько трубочек. Этот способ является более сложным, однако в случае использования в качестве емкости для культивирования клеток луночного планшета он обеспечивает более равномерное распределение питательной среды по ячейкам.
Второй вариант механизма смены питательной среды представляет собой лабораторный манипулятор. Для использования этого варианта края мембраны должны быть приклеены к зафиксированной относительно корпуса блока культивирования пластине с отверстиями, а именно - края мембраны должны быть прикреплены к краям отверстия в пластине. Лабораторный манипулятор захватывает емкость и вынимает ее из отсека культивирования плюрипотентных стволовых клеток, после чего помещает в указанный отсек емкость с другой питательной средой.
Блок дифференцировки клеток (4) представляет собой клеточный инкубатор, который содержит по меньшей мере одну емкость для дифференцировки клеток и к которому подсоединено устройство введения одного или более факторов роста (16).
Если поставлена задача одновременно вырастить несколько различных колоний дифференцированных клеток, емкостей для их выращивания должно быть несколько. Если же емкости представляют собой ячеистые силиконовые формы (луночные планшеты), во избежание смешения колоний между ними должны быть размещены перегородки.
Блок хранения дифференцированных клеток (5) представляет собой клеточный инкубатор-холодильник.
Блок вывода клеток на подложку (6) представляет собой струйный 3D-принтер, к которому подсоединено устройство введения гидрогеля (17) и под которым размещена подложка для печати, на которую через раздаточную головку (19) выводятся капли, содержащие живые клетки.
В качестве картриджа струйный 3D-принтер использует один или более отсеков блока хранения дифференцированных клеток (5).
Емкости с клетками перемещаются между блоками (1-5) посредством механизма спуска-подъема (на фиг. не показан), который может работать по принципу мини-лифта, либо же представлять собой один или более лабораторных манипуляторов.
Емкости с клетками перемещаются через отверстия, расположенные в верхней и нижней частях блоков (2-4), нижней части блока (1) и верхней части блока (5).
Из блока хранения дифференцированных клеток (5) в блок их вывода на подложку (6) клетки перемещаются без емкости по стандартному механизму струйного принтера (например, посредством "подачи по требованию" или "непрерывной подачи").
Блоки (1-6) могут иметь корпуса (например, металлические или пластиковые), которые могут быть скреплены между собой с помощью различных крепежных элементов (винты, болты, шурупы, зажимы и т.д.). Устройства введения (7-14), (16-17) могут быть непосредственно прикреплены к блокам таким же образом.
Предложенный биопринтер удобен тем, что для печати достаточно лишь поместить колонию клеток в блок загрузки и в системе управления задать конфигурацию биосистемы, необходимую к воспроизведению. Далее биопринтер способен автоматически напечатать указанную биосистему. При необходимости можно воспользоваться ручным управлением.
Работа биопринтера осуществляется следующим образом.
В блок загрузки и хранения колонии соматических клеток (1) помещается одна или более емкостей, например луночных планшетов с соматическими клетками. В данном блоке эти клетки хранятся при пониженной температуре до востребования. После запуска процесса подготовки клеток с помощью системы управления (18) емкость с клетками размораживается и с помощью механизма спуска-подъема (на фиг. не показан) перемещается в блок перепрограммирования (2). Установленное на нем устройство введения факторов перепрограммирования (7) добавляет нужную комбинацию факторов в клеточную среду для индуцирования плюрипотентных стволовых клеток. Установленное на блоке устройство введения ингибитора метилтрансферазы GSK126 (8) добавляет нужное количество данного соединения, необходимого для образования в генах индуцируемых клеток маркера репрессии H3K27me3, наличие которого, в свою очередь, необходимо для дальнейшего получения дифференцированных клеток с отсутствием признаков канцерогенеза и деструктивных явлений.
Блок перепрограммирования клеток может быть дополнительно оснащен иммунофлюоресцентным анализатором (20), выполненным с возможностью передачи сигнала о наличии маркера репрессии H3K27me3 в генах колонии клеток системе управления, которая, в свою очередь, обеспечивает корректировку введения ингибитора метилтрансферазы GSK126 в блок перепрограммирования клеток.
После получения индуцированных стволовых клеток емкость с ними с помощью механизма спуска-подъема перемещается в блок культивирования (3). Установленное на нем устройство введения агента, изменяющего эпигенетический статус клетки (9), добавляет указанный агент в клеточную среду. Другие устройства введения (10), (11), (13), (14) вводят в клеточную среду, соответственно, необходимые для быстрого выращивания и размножения здоровых клеток белок Вах, белок Bak, ингибитор пролиферации и ингибитор апоптоза. Устройство введения монооксида азота (12) впрыскивает указанный газ в камеру блока культивирования, что также способствует получению здоровых клеток.
Механизм смены питательной среды для клеток (15) может перемещать клетки из одной среды в другую. Это может происходить либо при необходимости обновления питательной среды, либо при необходимости замены состава среды культивирования. Так например, культивирование индуцированных плюрипотентных стволовых клеток целесообразно проводить в начале в присутствии агента, изменяющего эпигенетический статус клетки, а затем в отсутствие указанного агента.
Блок культивирования плюрипотентных стволовых клеток может обрабатывать сразу несколько колоний клеток, находящихся на разной стадии развития, при этом в зависимости от того, какие впоследствии следует получить дифференцированные клетки, для разных колоний клеток могут быть различные условия обработки.
После культивирования емкость с клетками перемещается в блок дифференцировки (4). Установленное на нем устройство введения одного или более факторов роста (16) вводит в среду дифференцировки те или иные факторы роста - в зависимости от того, какие клетки следует получить. Вышеупомянутый блок состоит из одного или более отсеков дифференцировки. Во всех отсеках могут формироваться колонии разных видов клеток.
Далее емкость с клетками перемещается в блок хранения дифференцированных клеток (5).
В системе управления задается команда для печати живого органа или ткани того или иного вида, плотности и состава, после чего система управления подает соответствующий сигнал в блок вывода клеток на подложку (6), который по механизму струйного принтера забирает клетки (без емкости, в которой они хранятся) из блока хранения дифференцированных клеток (5) (картриджа) и с помощью раздаточной головки (19) выводит на подложку клетки заданного вида и в заданном количестве. С помощью раздаточной головки на подложку также выводится гидрогель, который дозируется устройством введения (17) и является необходимым для поддержания формы живой ткани или органа.
Блок вывода клеток на подложку работает по принципу трехмерного струйного принтера.
Для подтверждения достижения технического результата способом, который может быть осуществлен с помощью предложенного биопринтера, был проведен опыт.
Из фибробластов кончика хвоста мыши получали химически индуцированные плюрипотентные стволовые клетки (ХИПСК). Для этого указанные фибробласты были разморожены и посеяны в луночный планшет в питательную среду RPMI-1640 с глутамином. Изначальная плотность монослоя фибробластов составляла 20%. Через 18,5 часов после рассева плотность монослоя достигла 40%.
По достижении заданной плотности в питательную среду были введены три фактора химического перепрограммирования, представляющие собой низкомолекулярные соединения: вальпроевую кислоту, хлорид лития, 4-[4-(1,3-бензодиоксол-5-ил)-5-(2-пиридинил)-1Н-имидазол-2-ил]бензамид (ингибитор SB-431542, чистота 99%). Также в среду был введен концентрированный диметилсульфоксидный раствор N-[(1,2-дигидро-4,6-диметил-2-оксо-3-пиридинил)метил]-3-метил-1-[(1S)-1-метилпропил]-6-[6-1-пиперазинил)-3-пиридинил]-1Н-индол-4-карбоксиамид (ингибитор метилтрансферазы GSK126, чистота 98%).
Через 35 часов клетки были пересеяны в питательную среду RPMI-1640 с глутамином, в которую заранее были введены агент, изменяющий эпигенетический статус клетки, в качестве которого был взят 5-аза-2′-дезоксицитидин, протеин Вах марки 6А7 и протеин Bak марки (G-23)-G. В указанную среду был также добавлен ингибитор пролиферации, представлявший собой композицию из дельта-глобиновой цепи гемоглобина и фармацевтически приемлемого носителя.
В описанных условиях клетки культивировали в течение 7 часов. После этого среда была заменена на питательную среду RPMI-1640 с глутамином. Последующее культивирование проводили в течение 9 часов в атмосфере, содержащей монооксид азота.
Для выращенных индуцированных плюрипотентных клеток среду заменили на питательную среду Игла MEM с солями Эрла, без глутамина, в которую был добавлен фактор роста нервов - Mouse Nerve Growth Factor (mNGF). Дифференцировку клеток проводили в течение 32 часов.
Среднее ядерно-цитоплазматическое отношение в клетках составляло 0,04. Ядрышко имело плохую выраженность. Наличие диспергированного хроматина в ядре обнаружено не было. Данные показатели свидетельствуют о высокой степени созревания клеток и неактивном состоянии «стволовых» генов, работа которых в зрелых клетках чревата возникновением злокачественной опухоли.
Длительное наблюдение за колонией полученных клеток не выявило признаков канцерогенеза.
Таким образом, эксперимент, который может быть осуществлен с помощью предложенного биопринтера, позволил за относительно короткий промежуток времени получить зрелые дифференцированные клетки, не склонные к образованию злокачественной опухоли. В свою очередь, предложенный биопринтер способен осуществлять полный цикл преобразования колонии соматических клеток в необходимую биологическую систему, состоящую из здоровых клеток, без необходимости использования другого оборудования.
1. Биопринтер, содержащий блок перепрограммирования клеток и блок вывода клеток на подложку, отличающийся тем, что он содержит последовательно соединенные блок загрузки и хранения колонии соматических клеток, блок перепрограммирования клеток с установленными на нем устройством введения одного или более факторов перепрограммирования и устройством введения ингибитора метилтрансферазы GSK126, причем упомянутый блок состоит из одного или более отсеков перепрограммирования, блок культивирования плюрипотентных стволовых клеток с установленными на нем устройством введения агента, изменяющего эпигенетический статус клетки, устройством введения белка Вах, устройством введения белка Bak, устройством введения монооксида азота, устройством введения ингибитора пролиферации и устройством введения ингибитора апоптоза, причем упомянутый блок состоит из одного или более отсеков культивирования клеток и снабжен механизмом смены питательной среды для клеток, блок дифференцировки клеток с установленным на нем устройством введения одного или более факторов роста, причем упомянутый блок состоит из одного или более отсеков дифференцировки клеток, блок хранения дифференцированных клеток, причем упомянутый блок состоит из одного или более отсеков хранения дифференцированных клеток, блок вывода клеток на подложку с установленным на нем устройством введения гидрогеля на подложку, причем упомянутый блок работает по принципу трехмерного струйного принтера, и систему управления.
2. Биопринтер по п. 1, отличающийся тем, что система управления выполнена с возможностью:a) автономного или ручного регулирования перемещением колонии клеток между следующими блоками: загрузки и хранения колонии соматических клеток, перепрограммирования клеток, культивирования плюрипотентных стволовых клеток, дифференцировки клеток и хранения дифференцированных клеток, а также выводом колонии клеток на подложку в блоке вывода клеток на подложку;b) автономного или ручного регулирования температуры внутри блока загрузки и хранения колонии соматических клеток;c) автономного или ручного регулирования введением одного или более факторов перепрограммирования и ингибитора метилтрансферазы GSK126 в блок перепрограммирования клеток;d) автономного или ручного регулирования введением агента, изменяющего эпигенетический статус клетки, белка Вах, белка Bak, монооксида азота, ингибитора пролиферации и ингибитора апоптоза в блок культивирования плюрипотентных стволовых клеток;e) автономного или ручного управления механизмом смены питательной среды для клеток в блоке культивирования плюрипотентных стволовых клеток;f) автономного или ручного регулирования введением одного или более факторов роста в блок дифференцировки клеток;g) автономного или ручного регулирования скорости вывода клеток на подложку в блоке вывода клеток на подложку, а также скорости выведения на подложку гидрогеля;h) автономного или ручного дозирования разных видов клеток, выводимых на подложку.
3. Биопринтер по п. 1 или 2, отличающийся тем, что блок перепрограммирования клеток дополнительно содержит иммунофлюоресцентный анализатор, выполненный с возможностью передачи сигнала о наличии маркера репрессии H3K27me3 в генах колонии клеток системе управления, причем система управления выполнена с возможностью корректировки введения ингибитора метилтрансферазы GSK126 в блок перепрограммирования клеток.