Полипептиды для связывания с "рецептором конечных продуктов гликирования", а также их композиции и способы, в которых они принимают участие
Иллюстрации
Показать всеИзобретение относится к биохимии. Описано антитело, специфически связывающееся с «рецептором конечных продуктов гликирования» (RAGE). Представлены нуклеиновая кислота, кодирующая описанное антитело, композиция для применения в качестве лекарственного средства для лечения связанного с RAGE заболевания или нарушения. Также представлен способ диагностики связанного с RAGE заболевания или нарушения. Изобретение расширяет арсенал средств для лечения и диагностики заболеваний, связанных с RAGE. 4 н. и 8 з.п. ф-лы, 5 ил., 2 табл., 5 пр.
Реферат
Настоящее изобретение относится к полипептиду или полипептидному комплексу, содержащему по меньшей мере две аминокислотных последовательности, скомпонованных так, чтобы обеспечивать специфическое связывание с "рецептором конечных продуктов гликирования" (RAGE), к одной или нескольким нуклеиновой кислоте(ам), кодирующей полипептид или полипептидный комплекс, к клетке, продуцирующей антитело против RAGE, к фармацевтической композиции, содержащей по меньшей мере один полипептид или нуклеиновую кислоту, как определено выше, необязательно, для лечения связанного с RAGE заболевания или нарушения, и к способу диагностики связанного с RAGE заболевания или нарушения.
Рецептор конечных продуктов гликирования (RAGE) представляет собой трансмембранный рецептор массой 35 кДа из суперсемейства иммуноглобулинов, который впервые был охарактеризован в 1992 году Neeper et al. (Neeper et al., 1992, J.Biol.Chem. 267: 14998-15004). Он является представителем суперсемейства иммуноглобулинов, находящимся на клеточной поверхности, с множеством лигандов. RAGE состоит из внеклеточного домена, одного проходящего через мембрану домена и цитозольной хвостовой части. Внеклеточный домен рецептора состоит из домена иммуноглобулинов V-типа, за которым следуют два домена иммуноглобулинов C-типа. Цитозольный домен отвечает за передачу сигнала, а трансмембранный домен заякоривает рецептор на клеточной мембране. Вариабельный домен связывает лиганды RAGE. RAGE также существует в растворимой форме (sRAGE).
Название RAGE вытекает из его способности связывать конечные продукты гликирования (AGE), гетерогенную группу неферментативно измененных белков, которые образуются при длительных гипергликемических состояниях. Однако AGE могут быть только случайными патогенным лигандами. Помимо AGE, RAGE также способен связывать другие лиганды и, таким образом, его часто называют образ-распознающим рецептором. Однако RAGE представляет собой необычный образ-распознающий рецептор, который связывает несколько различных классов эндогенных молекул, ведущих к различным клеточным ответам, включая секрецию цитокинов, увеличение клеточного окислительно-восстановительного стресса, рост нейритов и миграцию клеток. Известные лиганды RAGE включают белки, имеющие нити из β-слоев, которые являются характерными для отложений амилоида и провоспалительных медиаторов, включая S100/кальгранулины, сывороточный амилоид (SAA) (фибриллярная форма), β-амилоидный белок (Aβ), и высокоподвижный хромосомный белок 1 группы бокс-1 (HMGB1, также известный как амфотерин). На двух моделях сепсиса у мышей было показано, что HMGB-1 является поздним медиатором летальности, и полагают, что взаимодействие между RAGE и лигандами, такими как HMGB1, играет важную роль в патогенезе сепсиса и других воспалительных заболеваний.
RAGE экспрессируется во многих типах клеток, например, в эндотелиальных и гладкомышечных клетках, макрофагах и лимфоцитах, во многих различных тканях, включая легкие, сердце, почку, скелетную мышцу и головной мозг. Экспрессия возрастает при хронических воспалительных состояниях, таких как ревматоидный артрит и диабетическая нефропатия.
Ряд важных нарушений у человека связан с увеличенной продукцией лигандов для RAGE или с увеличенной продукцией самого RAGE. Вследствие увеличенного уровня лигандов RAGE при диабете или других хронических нарушениях этот рецептор предположительно имеет этиологический эффект при ряде воспалительных заболеваний, таких как осложнения диабета, болезнь Альцгеймера и даже некоторые опухоли.
Кроме того, RAGE связывали с некоторыми хроническими заболеваниями, которые, как полагают, являются результатом повреждения сосудов. Полагают, что патогенез включает связывание лиганда, при котором RAGE передает сигнал на активацию ядерного фактора каппа-B (NF-κB). NF-κB контролирует несколько генов, которые вовлечены в воспаление. Интересно, что RAGE также активируется NF-κB. В случае состояний, где имеется большое количество лигандов RAGE (например, AGE при диабете или белок амилоида β при болезни Альцгеймера), это формирует цикл с положительной обратной связью, который приводит к хроническому воспалению. Полагают, что затем это хроническое состояние фатальным образом изменяет микрососуды и макрососуды, что приводит к повреждению органа или даже недостаточности органа. Заболеваниями, которые связывают с RAGE, являются многие хронические воспалительные заболевания, включая ревматоидный и псориатический артрит и заболевание кишечника, злокачественные опухоли, диабет и диабетическую нефропатию, амилоидозы, сердечно-сосудистые заболевания, сепсис, атеросклероз, болезнь периферических сосудов, инфаркт миокарда, застойную сердечную недостаточность, диабетическую ретинопатию, диабетическую невропатию, диабетическую нефропатию и болезнь Альцгеймера.
Соответственно, от многих из этих заболеваний эффективные лекарственные средства не доступны. Было бы полезным наличие безопасных и эффективных способов лечения таких связанных с RAGE нарушений. Один из подходов включает использование полипептидов, например, антител, связывающихся с RAGE.
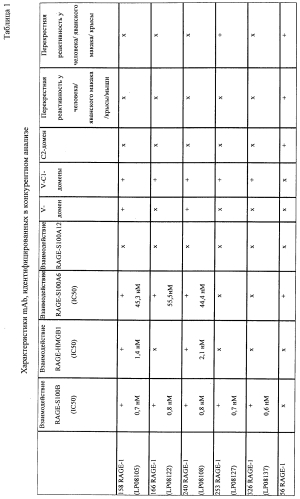
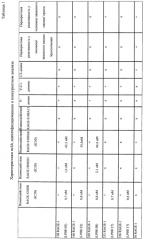
Неожиданно, теперь идентифицирован ряд моноклональных антител (mAB), которые обеспечивают преимущественные характеристики. В частности, моноклональные антитела против RAGE были идентифицированы на основе набора экспериментальных данных, включающих константы связывания, перекрестную реактивность, картирование доменов и данные о функциональности in vitro (конкурентный ELISA). Исходя из указанных выше данных было отобрано 23 mAb, удовлетворяющих следующим критериям:
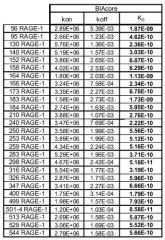
Константы связывания KD ≤ 1,0×10-9 M и koff ≤ 2,0×10-3 c-1.
Как известно квалифицированному специалисту, характеристики связывания антител опосредуются вариабельными доменами. Для связывания с антигеном необходимо, чтобы присутствовали подходящий вариабельный домен из тяжелой цепи и совместно действующий вариабельный домен из легкой цепи и они были расположены в порядке, позволяющем совместное действие. Вариабельный домен также называют FV-областью, и он является наиболее важной областью для связывания с антигенами. Более конкретно, за связывание с антигеном ответственны вариабельные петли, по три на легкой (VL) и тяжелой (VH) цепях. Эти петли называют определяющими комплементарность областями (CDR). Эти три петли называют L1, L2 и L3 для VL, и H1, H2 и H3 для VH. Однако в данной области известно многообразие различных компоновок вариабельного домена из тяжелой цепи и действующего совместно с ним вариабельного домена из легкой цепи. Таким образом, идентификация подходящего домена из тяжелой цепи и действующего совместно с ним вариабельного домена из легкой цепи является необходимой для настоящего изобретения. Таким образом, их последовательности были идентифицированы для 23 антител, указанных выше.
Таким образом, в первом аспекте настоящее изобретение относится к полипептиду или полипептидному комплексу, содержащему по меньшей мере две аминокислотных последовательности или их функционально активных варианта, где по меньшей мере две аминокислотных последовательности представляют собой:
- SEQ ID NO:1 и SEQ ID NO:24,
- SEQ ID NO:2 и SEQ ID NO:25,
- SEQ ID NO:3 и SEQ ID NO:26,
- SEQ ID NO:4 и SEQ ID NO:27,
- SEQ ID NO:5 и SEQ ID NO:28,
- SEQ ID NO:6 и SEQ ID NO:29,
- SEQ ID NO:7 и SEQ ID NO:30,
- SEQ ID NO:8 и SEQ ID NO:31,
- SEQ ID NO:9 и SEQ ID NO:32,
- SEQ ID NO:10 и SEQ ID NO:33,
- SEQ ID NO:11 и SEQ ID NO:34,
- SEQ ID NO:12 и SEQ ID NO:35,
- SEQ ID NO:13 и SEQ ID NO:36,
- SEQ ID NO:14 и SEQ ID NO:37,
- SEQ ID NO:15 и SEQ ID NO:38,
- SEQ ID NO:16 и SEQ ID NO:39,
- SEQ ID NO:17 и SEQ ID NO:40,
- SEQ ID NO:18 и SEQ ID NO:41,
- SEQ ID NO:19 и SEQ ID NO:42,
- SEQ ID NO:20 и SEQ ID NO:43,
- SEQ ID NO:21 и SEQ ID NO:44,
- SEQ ID NO:22 и SEQ ID NO:45, и/или
- SEQ ID NO:23 и SEQ ID NO:46,
где эти последовательности расположены так, чтобы обеспечить специфическое связывание с "рецептором конечных продуктов гликирования" (RAGE).
В соответствии с настоящим изобретением полипептид или полипептидный комплекс содержит по меньшей мере две аминокислотные последовательности или их функционально активных варианта, как определено выше. Последовательности SEQ ID NO:1-23 представляют собой вариабельные домены легких цепей, и последовательности SEQ ID NO:24-46 представляют собой вариабельные домены тяжелых цепей идентифицированных антител (как определено с помощью анализа последовательности). SEQ ID NO вариабельного домена тяжелой цепи, соответствующего преобладающему вариабельному домену легкой цепи, можно определять добавлением 23 к SEQ ID NO указанного вариабельного домена легкой цепи. Например, SEQ ID NO вариабельного домена тяжелой цепи, соответствующего вариабельному домену легкой цепи SEQ ID NO:5, представляет собой SEQ ID NO:28 (5+23).
Для настоящего изобретения необходимо, чтобы полипептид или полипептидный комплекс содержал две совместно действующих аминокислотных последовательности или их функционально активных варианта, как определено выше. Если они скомпонованы подходящим образом, компоновка позволяет специфическое связывание с RAGE. К настоящему времени разработано и идентифицировано множество различных форматов антител. Для полипептида или полипептидного комплекса по настоящему изобретению можно использовать любую из этих или других пригодных компоновок, при условии что формат или компоновка позволяют специфическое связывание с RAGE.
Две последовательности, как определено в указанных выше SEQ ID NO или их вариантах, могут быть скомпонованы в один полипептид или в пептидный комплекс. Если они скомпонованы в один полипептид, две последовательности могут быть соединены линкерной последовательностью, предпочтительно, пептидным линкером, например, таким как слитый белок. Если они скомпонованы в полипептидный комплекс, два или более полипептида связаны друг с другом нековалентной связью, включая водородные связи, ионные связи, ван-дер-ваальсовы силы и гидрофобные взаимодействия. Описанные выше последовательности или их функционально активные варианты могут формировать полипептид или полипептидный комплекс или могут быть их частью.
Полипептид (также известный как белки) представляет собой органическое соединение, образованное из α-аминокислот, расположенных в виде линейной цепи. Аминокислоты в полимерной цепи связаны друг с другом пептидными связями между карбоксильной и аминогруппами соседних аминокислотных остатков. Как правило, генетический код определяет 20 стандартных аминокислот. После синтеза или даже в процессе синтеза остатки в белке могут подвергаться химической модификации путем посттрансляционной модификации, которая изменяет физические и химические свойства, укладку, стабильность активность, и, в конечном итоге, функцию белков.
Полипептиды или их комплексы, как определено в настоящем документе, селективно распознают и специфично связываются с RAGE. Использование в настоящем документе терминов "селективный" или "специфичный" относится к тому факту, что описанные полипептиды или их комплексы не демонстрируют существенного связывания со структурами, отличными от RAGE, за исключением тех конкретных случаев, когда полипептид/комплекс дополнены так, чтобы они обеспечивали дополнительную отличающуюся специфичность специфичному к RAGE связывающему белку (как например, в биспецифических или бифункциональных молекулах, где молекула сконструирована так, чтобы связывать две структуры или выполнять две функции, по меньшей мере одной из которых является специфичное связывание RAGE). В конкретных вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 1,2×10-6 или менее. В конкретных вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 5×10-7 или менее, 2×10-7 или менее, или 1×10-7 или менее. В дополнительных вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 1×10-8 или менее. В других вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 5×10-9 или менее, или 1×10-9 или менее. В следующих вариантах осуществления специфичные к RAGE полипептиды или их комплексы связываются с RAGE человека с KD 1×10-10 или менее, KD 1×10-11 или мене, или KD 1×10-12 или менее. В конкретных вариантах осуществления специфичные к RAGE полипептиды или их комплексы не связываются с другими белками с более высокими KD.
KD относится к константе диссоциации, получаемой из отношения kd (скорость диссоциации для конкретного взаимодействия связывающая молекула - белок-мишень; также называемая koff) к ka (скорость ассоциации для конкретного взаимодействия связывающая молекула - белок-мишень; также называемая kon), или kd/ka, которую выражают в молярной концентрации (M). Величины KD можно определять с использованием способов, общепринятых в данной области. Предпочтительный способ определения KD связывающей молекулы представляет собой способ с использованием поверхностного плазмонного резонанса, например, биосенсорной системы, такой как система Biacore(TM) (GE Healthcare Life Sciences) (см. пример 5 и таблицу 2). Другой способ представлен на фиг. 2 и в примере 2.
Было показано, что специфичные к RAGE полипептиды или их комплексы зависимым от дозы образом ингибируют взаимодействие RAGE/лиганд (см. фиг. 4, пример 3 и 4 и таблицу 1). Таким образом, специфичные к RAGE полипептиды или их комплексы могут быть охарактеризованы их способностью противодействовать связыванию лиганда с RAGE. Степень ингибирования любым специфичным к RAGE полипептидом или его комплексом можно количественно определять путем статистического сравнения с контролем, или любым альтернативным способом, доступным в данной области. В конкретных вариантах осуществления ингибирование представляет собой по меньшей мере приблизительно 10% ингибирование. В других вариантах осуществления ингибирование составляет по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95%.
Полипептид или его комплекс также может содержать функционально активный вариант указанных выше последовательностей. Функционально активный вариант по изобретению характеризуется наличием биологической активности, сходной с активностью, которую проявляет полный белок, включая способность связываться с RAGE и необязательно ингибировать RAGE. Вариант является функционально активным в контексте настоящего изобретения, если активность (например, активность связывания, необязательно выраженная в качестве KD) варианта составляет по меньшей мере 10%, предпочтительно, по меньшей мере 25%, более предпочтительно, по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, особенно по меньшей мере 90%, в частности по меньшей мере 95%, наиболее предпочтительно, по меньшей мере 99% от активности пептида/комплекса без изменения последовательности. Подходящие способы определения активности связывания с RAGE приведены в “Примерах”. Функционально активный вариант можно получать с путем ограниченного количества аминокислотных замен, делеций и/или вставок.
В предпочтительном варианте осуществления настоящего изобретения функционально активный вариант любой последовательности из SEQ ID NO:1-23 содержит определяющую комплементарность область L3 (CDR L3), предпочтительно, CDR L1, CDR L2 и CDR L3, соответствующей последовательности SEQ ID NO:1-23; и/или функционально активный вариант любой из последовательностей SEQ ID NO:24-46 содержит определяющую комплементарность область H3 (CDR H3), предпочтительно, CDR H1, CDR H2 и CDR H3, соответствующей последовательности SEQ ID NO:24-46. В наиболее предпочтительном варианте осуществления функционально активный вариант любой из последовательностей SEQ ID NO:1-23 содержит CDR L1, CDR L2 и CDR L3 соответствующей последовательности SEQ ID NO:1-23; и функционально активный вариант любой из последовательностей SEQ ID NO:24-46 содержит CDR H1, CDR H2 и CDR H3 соответствующей последовательности SEQ ID NO:24-46. Альтернативно одна из последовательностей может представлять собой SEQ ID NO:1-46 без каких-либо изменений последовательности, а другой вариант может быть таким, как определено в настоящем документе.
Описаны различные способы идентификации CDR в последовательности вариабельной области. Кроме того, известен ряд программ, которые можно использовать для этой цели. Однако следующий набор правил применим к последовательностям SEQ ID NO:1-46 для идентификации CDR в этих последовательностях (также см. www.bioinf.org.uk; MacCallum et al., 1996, J. Mol. Biol. 262 (5): 732-745; Antibody Engineering Lab Manual, Chapter "Protein Sequence and Structure Analysis of Antibody Variable Domains", Ed.: Duebel, S. and Kontermann, R., Springer-Verlag, Heidelberg). Последовательности с указанными CDR представлены на фигуре 1.
| CDR-L1 | |
| Начало | Приблизительно остаток 24 |
| Остаток перед | всегда Cys |
| Остаток после | всегда Trp. Как правило, Trp-Tyr-Gln, но также Trp-Leu-Gln, Trp-Phe-Gln, Trp-Tyr-Leu |
| Длина | 10-17 остатков |
| CDR-L2 | |
| Начало | всегда 16 остатков после окончания L1 |
| Остатки перед | как правило, Ile-Tyr, но также Val-Tyr, Ile- |
| Lys, Ile-Phe | ||
| Длина | всегда 7 остатков | |
| CDR-L3 | ||
| Начало | всегда 33 остатка после окончания L2 | |
| Остаток перед | всегда Cys | |
| Остатки после | всегда Phe-Gly-XXX-Gly | (SEQ ID NO:47) |
| Длина | 7-11 остатков | |
| CDR-H1 | ||
| Начало | Приблизительно остаток 26 (всегда 4 после Cys) | |
| Остатки перед | всегда Cys-XXX-XXX-XXX | (SEQ ID NO:48) |
| Остатки после | всегда Trp. Как правило, Trp-Val, но также Trp-Ile, Trp-Ala | |
| Длина | 10-12 остатков | |
| CDR-H2 | ||
| Начало | всегда 15 остатков после окончания CDR-H1 | |
| Остатки перед | как правило, Leu-Glu-Trp-Ile-Gly, | (SEQ ID NO:49) |
| но существует ряд вариантов | ||
| Остатки после | Lys/Arg-Leu/Ile/Val/Phe/Thr/Ala-Thr/Ser/Ile/Ala | |
| Длина | 9-12 остатков | |
| CDR-H3 | ||
| Начало | всегда 33 остатка после окончания CDR-H2 (всегда 2 после Cys) |
| Остатки перед | всегда Cys-XXX-XXX (как правило, Cys-Ala-Arg) |
| Остатки после | всегда Trp-Gly-XXX-Gly (SEQ ID NO:50) |
| Длина | 3-25 остатков |
Как подробно описано выше, в VH и VL имеются гипервариабельные области, которые демонстрируют наибольшую вариабельность последовательностей от одного антитела к другому, и каркасные области, которые являются менее вариабельными. Укладка обеспечивает сближение гипервариабельных областей с образованием антигенсвязывающих карманов. Эти участки наиболее тесного контакта между антителом и антигеном представляют собой CDR антитела, которая опосредует специфичность антитела. Таким образом, они имеют особое значение для связывания антигена. Хотя предпочтительно, чтобы функционально активный вариант содержал три CDR, было выявлено, что для некоторых антител для обеспечения специфичности являются достаточными CDR-L3 и CDR-H3. Таким образом, в одном из вариантов осуществления обязательным является только присутствие CDR-L3 и CDR-H3. В любом случае CDR должны быть расположены так, чтобы обеспечивать специфическое связывание антигена, в данном случае RAGE.
В предпочтительном варианте осуществления настоящего изобретения CDR (CDR-L3 и -H3; или CDR-L1, -L2, -L3, -H1, -H2 и -H3) расположены в каркасной области преобладающего вариабельного домена, т.е. L1, L2 и L3 в каркасной области VL, и H1, H2 и H3 в каркасной области VH. Это означает, что CDR, идентифицированные любым подходящим способом или представленные на фиг. 1, можно удалять из представленных соседних областей и переносить в другой (второй) вариабельный домен, тем самым заменяя CDR второго вариабельного домена. Для иллюстрации CDR SEQ ID NO:1 и 24 можно использовать для замены CDR SEQ ID NO:2 и 27. Кроме того, можно использовать каркасную область вариабельного домена, которая не представлена на фиг. 1. Множество вариабельных доменов или последовательностей антител известны в данной области и их можно использовать для этой цели. Например, вариабельные домены, в которые встроены представляющие интерес CDR, можно получать из любого вариабельного домена эмбрионального типа или подвергнутого реаранжировке вариабельного домена человека. Вариабельные домены также можно получать синтетически. Области CDR можно встраивать в соответствующие вариабельные домены с использованием технологии рекомбинантных ДНК. Один из способов достижения этого описан в Marks et al., 1992, Bio/Technology 10:779-783. Вариабельный домен тяжелой цепи может образовывать пару с вариабельным доменом легкой цепи с образованием антигенсвязывающего центра. Кроме того, для связывания антигена можно использовать независимые области (например, вариабельный домен тяжелой цепи отдельно).
Наконец, в другом варианте осуществления CDR можно переносить в соседнюю область не вариабельного домена, при условии, что CDR в соседней области располагается так, чтобы обеспечивалось специфическое связывание с RAGE.
В предпочтительном варианте осуществления полипептида или полипептидного комплекса по настоящему изобретению аминокислотная последовательность SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 и/или SEQ ID NO:23 или ее функционально активный вариант представляет собой вариабельный домен легкой цепи (VL).
Альтернативно или дополнительно, аминокислотная последовательность SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45 и/или SEQ ID NO:46 или ее функционально активный вариант представляет собой вариабельный домен тяжелой цепи (VH).
В предпочтительном варианте осуществления настоящего изобретения полипептид или полипептидный комплекс представляет собой антитело.
Природные антитела представляют собой глобулярные белки плазмы (~150 кДа), которые также известны как иммуноглобулины, которые обладают общей основной структурой. Поскольку они имеют цепи сахаров, присоединенные к аминокислотным остаткам, они представляют собой гликопротеины. Основным функциональным элементом каждого антитела является мономер иммуноглобулина (Ig) (содержащий только один элемент Ig); секретируемые антитела также могут быть димерными с двумя элементами Ig, как в случае IgA, тетрамерными с четырьмя элементами Ig, такими как IgM костистых рыб, или пентамерными с пятью элементами Ig, такими как IgM млекопитающих. В настоящем изобретении примеры подходящих форматов включают формат природных антител, включая изотипы антител, известные как IgA, IgD, IgE, IgG и IgM.
Мономер Ig представляет собой молекулу в форме "Y", которая состоит из четырех полипептидных цепей; две идентичных тяжелых цепи и две идентичных легких цепи связаны дисульфидными связями между остатками цистеина. Каждая тяжелая цепь имеет длину приблизительно 440 аминокислот; каждая легкая цепь имеет длину приблизительно 220 аминокислот. Каждая из тяжелой и легкой цепей содержит дисульфидные связи внутри цепей, которые стабилизируют их укладку. Каждая цепь состоит из структурных доменов, называемых Ig-доменами. Эти домены содержат приблизительно 70-110 аминокислот и их подразделяют на различные категории (например, вариабельные или V, и константные или C) согласно их размеру и функции. Они имеют характерную укладку иммуноглобулинов, в которой два бета-слоя образуют форму "сэндвича", удерживаются вместе взаимодействиями между консервативными остатками цистеина и другими заряженными аминокислотами.
Существует пять типов тяжелых цепей Ig млекопитающих, обозначаемых как α, δ, ε, γ и μ. Тип присутствующей тяжелой цепи определяет изотип антитела; эти цепи встречаются в антителах IgA, IgD, IgE, IgG и IgM, соответственно.
Различные тяжелые цепи отличаются по размеру и составу; α и γ содержат приблизительно 450 аминокислот и δ содержит приблизительно 500 аминокислот, в то время как μ и ε имеют приблизительно 550 аминокислот. Каждая тяжелая цепь имеет две области, константную область (CH) и вариабельную область (VH). У одного вида константные области идентичны во всех антителах одного и того же изотипа, но отличаются в антителах отличающихся изотипов. Тяжелые цепи γ, α и δ имеют константную область, состоящую из трех тандемных Ig-доменов и шарнирной области для дополнительной гибкости; тяжелые цепи μ и ε имеют константную область, состоящую из четырех доменов иммуноглобулинов. Вариабельные области тяжелой цепи отличаются в антителах, продуцируемых различными B-клетками, но являются одинаковыми для всех антител, продуцируемых единичной B-клеткой или клоном B-клеток. Вариабельная область каждой тяжелой цепи имеет длину приблизительно 110 аминокислот и состоит из одного Ig-домена.
У млекопитающих существует два типа легких цепей иммуноглобулинов, обозначаемых как λ и κ. Легкая цепь имеет два последовательно расположенных домена: один константный домен (CL) и один вариабельный домен (VL). Приблизительная длина легкой цепи составляет 211-217 аминокислот. Каждое антитело содержит две легкие цепи, которые всегда идентичны; у млекопитающих на антитело присутствует только один тип легкой цепи, κ или λ. У низших позвоночных, таких как Chondrichthyes и Teleostei встречаются другие типы легких цепей, такие как ι.
В дополнение к природным антителам, были разработаны искусственные форматы антител, включая фрагменты антител. Некоторые из них описаны далее. Однако также настоящее изобретение охватывает любой другой формат антител, содержащий или состоящий из описанного выше полипептида(ов) и позволяющий специфическое связывание с RAGE.
Хотя основанная структура всех антител является высоко сходной, уникальное свойство данного антитела определяется вариабельными (V) областями, как подробно описано выше. Более конкретно, вариабельные петли, по три на каждую легкую цепь (VL) и три на каждую тяжелую цепь (VH), отвечают за связывание с антигеном, т.е. за его антигенную специфичность. Эти петли называют определяющими комплементарность областями (CDR). Поскольку CDR из обоих доменов VH и VL вносят вклад в антигенсвязывающей центр, конечная антигенная специфичность определяется комбинацией тяжелой и легкой цепей, но не какой-либо из них отдельно.
Таким образом, термин "антитело", как используют в настоящем документе, означает любой полипептид, который обладает структурным сходством с природным антителом и способен специфично связываться с RAGE, где специфичность связывания определяется CDR в SEQ ID NO:1-46, например, как представлено на фиг. 1. Таким образом, "антитело" относится к происходящей из иммуноглобулина структуре со специфическим связыванием с RAGE, включая, но не ограничиваясь ими, полноразмерное или целое антитело, антигенсвязывающий фрагмент (фрагмент, происходящий, физически или по существу, из структуры антитела), производное любого из вышесказанных, химерную молекулу, слитую молекулу любого из вышесказанных с другим полипептидом, или любую альтернативную структуру/композицию, которая селективно связывается с RAGE и необязательно ингибирует функцию RAGE. Антитело может представлять собой любой полипептид, который содержит по меньшей мере один антигенсвязывающий фрагмент. Антигенсвязывающие фрагменты состоят по меньшей мере из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи, расположенных так, чтобы оба домена вместе были способны связываться со специфическим антигеном.
"Полноразмерные" или "полные" антитела относятся к белкам, которые содержат две тяжелых (H) и две легких (L) цепи, связанных друг с другом дисульфидными связями, которые содержат: (1) в контексте тяжелых цепей: вариабельную область и константную область тяжелой цепи, которая содержит три домена: CH1, CH2 и CH3; и (2) в контексте легких цепей: вариабельную область легкой цепи и константную область легкой цепи, которая содержит один домен CL. Что касается термина "полное антитело", подразумевают, что любое антитело имеет типичную общую доменную структуру природного антитела (т.е. содержащую тяжелую цепь с тремя или четырьмя константными доменами и легкую цепь с одним константным доменом, а также с соответствующими вариабельными доменами), даже несмотря на то, что каждый домен может содержать другие модификации, такие как мутации, делеции или вставки, которые не изменяют общую доменную структуру.
"Фрагмент антитела" также содержит по меньшей мере один антигенсвязывающий фрагмент, как определено выше, и проявляет по существу ту же функцию и специфичность, что и полное антитело, из которого фрагмент происходит. Ограниченное протеолитическое расщепление папаином приводит к расщеплению прототипа Ig на три фрагмента. Два идентичных N-концевых фрагмента, каждый из которых содержит одну целую L-цепь и приблизительно половину H-цепи, представляют собой антигенсвязывающие фрагменты (Fab). Третий фрагмент, сходный по размеру, но содержащий C-концевую половину обеих тяжелых цепей с их дисульфидной связью между цепями, представляет собой кристаллизующийся фрагмент (Fc). Fc содержит углеводы, участки связывания комплемента и участки связывания FcR. Ограниченное расщепление пепсином приводит к одному F(ab')2-фрагменту, содержащему как оба Fab-фрагмента, так и шарнирную область, включая дисульфидную связь между цепями H-H. F(ab')2 является двухвалентным в отношении связывания антигена. Дисульфидную связь F(ab')2 можно расщеплять с получением Fab'. Более того, вариабельные области тяжелой и легкой цепей можно подвергать слиянию с образованием одноцепочечного вариабельного фрагмента (scFv).
Поскольку первое поколение полноразмерных антител имеет некоторые проблемы, многие из антител второго поколения содержат только фрагменты антител. Вариабельные домены (Fv) представляют собой наименьшие фрагменты с интактным антигенсвязывающим доменом, состоящие из одного VL и одного VH. Такие фрагменты только со связывающими доменами, можно получать с помощью ферментативных подходов или экспрессии соответствующих фрагментов генов, например, в бактериальных и эукариотических клетках. Можно использовать различные подходы, например, либо Fv-фрагмент отдельно, либо или "Fab"-фрагменты, содержащие одно из верхних плеч "Y", которое включает Fv вместе с первыми константными доменами. Эти фрагменты обычно стабилизируют внесением полипептидной связи между двумя цепями, что приводит к образованию одноцепочечного Fv (scFv). Альтернативно можно использовать связанные дисульфидной связью Fv-фрагменты (dsFv). Связывающие домены фрагментов можно комбинировать с любым константным доменом с получением полноразмерных антител или их можно подвергать слиянию с другими белками и полипептидами.
Рекомбинантный фрагмент антитела представляет собой одноцепочечный Fv-фрагмент (scFv). Как правило, он обладает высокой аффинностью к его антигену и может экспрессироваться в различных хозяевах. Эти и другие свойства делают scFv-фрагменты не только используемыми в медицине, но также имеющими потенциал для биотехнологических применений. Как подробно описано выше, в scFv-фрагменте VH- и VL-домены связаны гидрофильным и гибким пептидным линкером, который повышает эффективность экспрессии и укладки. Обычно используют линкеры приблизительно из 15 аминокислот, среди которых наиболее часто используют линкер (Gly4Ser)3. Молекулы scFv можно легко протеолитически деградировать, в зависимости от используемого линкера. С развитием способов генетической инженерии эти ограничения смогли быть практически преодолены с помощью исследований, сфокусированных на повышении функции и стабильности. Примером является получение стабилизированных дисульфидами (или связанных дисульфидами) Fv-фрагментов, где димер VH-VL стабилизирован дисульфидной связью между цепями. На поверхности контакта доменов VL и VH встраивают остатки цистеина, формируя дисульфидные связи, которые удерживают два домена вместе.
Диссоциация scFv приводит к мономерным scFv, которые могут образовывать комплексы с формированием димеров (диател), тримеров (триател) или более крупных агрегатов, таких как TandAb и Flexibody.
Антитела с двумя связывающими доменами можно получать либо путем связывания двух scFv с простой полипептидной связью (scFv)2, либо путем димеризации двух мономеров (диател). Наиболее простыми конструкциями являются диатела, которые имеют два функциональных антигенсвязывающих домена, которые могут быть одинаковыми, сходными (двухвалентные диатела) или обладают специфичностью к различным антигенам (биспецифические диатела). Эти биспецифические антитела позволяют, например, дополнение новыми эффекторными функциями (таких как функции цитотоксических T-клеток) в отношении клеток-мишеней, что делает их высоко пригодными для применения в медицине.
Недавно были разработаны форматы антител, содержащие четыре вариабельных домена тяжелых цепей и четыре вариабельных домена легких цепей. Их примеры включают четырехвалентные биспецифические антитела (TandAb и Flexibody, Affimed Therapeutics AG, Heidelberg. Германия). В противоположность биспецифическому диателу, биспецифическое TandAb представляет собой гомодимер, состоящий только из одного полипептида. Вследствие двух различных цепей диатело может быть сформировано тремя различными димерами, только один из которых является функциональным. Таким образом, проще и дешевле получать и очищать этот гомогенный продукт. Более того, TandAb обычно демонстрирует лучшие связывающие свойства (наличие удвоенного количества участков связывания) и увеличенную стабильность in vivo. Flexibody представляют собой комбинацию scFv с мультимерным мотивом диатела с образованием поливалентной молекулы с высокой степенью гибкости для связывания двух молекул, которые достаточно удалены друг от друга на клеточной поверхности. Если присутствует более двух функциональных антигенсвязывающих домена и если они обладают специфичностью к различным антигенам, антитело является полиспецифическим.
В общих словах, специфические иммуноглобулины, в которые можно встраивать конкретные описанные последовательности или, альтернативно, формируют их неотъемлемую часть, включают но не ограничиваются ими, следующие молекулы антител, которые формируют конкретные варианты осуществления настоящего изобретения: Fab (одновалентный фрагмент с вариабельным доменом легкой цепи (VL), вариабельным доменом тяжелой цепи (VH), константным доменом легкой цепи (CL) и константным доменом тяжелой цепи 1 (CH1)), F(ab')2 (двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидной связью или альтернативно в шарнирной области), Fv (домены VL и VH), scFv (одноцепочечный Fv, где VL и VH связаны линкером, например, пептидным линкером), молекула биспецифического антитела (молекула антитела, содержащая полипептид, как описано в настоящем документе, связанный со второй функциональной частью, имеющей отличающуюся специфичность связывания, чем антитело, включая, но не ограничиваясь ими, другой пептид или белок, такой как антитело или лиганд рецептора), биспецифический одноцепочечный димер Fv, диатело, триатело, тетратело, минитело (scFv, связанный с CH3).
Определенные молекулы антител, включая, но не ограничиваясь ими, Fv, scFv, молекулы диател или доменные антитела (Domantis) могут быть стабилизированы внесением дисульфидных мостиков для связывания VH- и VL-доменов. Биспецифические антитела можно получать с использованием общепринятых технологий, конкретные способы которых включают получение химически, или с помощью гибридных (гибридомы) и других технологий, включая, но не ограничиваясь ими, технологию BiTETM (молекулы, обладающие антигенсвязывающими областями с различной специфичностью с пептидным линкером) и конструирование "выступов в полостях".
Таким образом, антитело может представлять собой Fab, Fab', F(ab')2, Fv, связанный дисульфидной связью Fv, scFv, (scFv)2, двухвалентное антитело, биспецифическое антитело, полиспецифическое антитело, диатело, триатело, тетратело или минитело.
В другом предпочтительном варианте осуществления антитело представляет собой моноклональное антитело, химерное антитело или гуманизированное антитело. Моноклональные антитела представляют собой моноспецифические антитела, которые идентичны, поскольку они продуцируются одним типом иммунной клетки, все из которых являются клонами одной родительской клетки. Химерное антитело представляет собой антитело, в котором по меньшей мере одна область иммуноглобулина одного вида слита с другой областью иммуноглобулина другого вида способами генетической инженерии для снижения его иммуногенности. Например, VL- и VH-области можно подвергать слиянию с остальной частью иммуногл