Производное 23-ин-витамина d3
Иллюстрации
Показать всеИзобретение относится к новому производному витамина D3, применимому в качестве терапевтического средства против остеопороза, которое представлено формулой (1), где R1 представляет собой атом водорода, алкильную группу с 1-6 атомами углерода, алкилкарбонилоксиалкильную группу, причем каждый алкил имеет 1-6 атомов углерода, или арилкарбонилоксиалкильную группу, причем арил имеет 6-10 атомов углерода и алкил имеет 1-6 атомов углерода; R2 представляет собой атом водорода или алкильную группу с 1-6 атомами углерода или вместе с другим R2 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; R3 представляет собой алкильную группу с 1-6 атомами углерода или вместе с другим R3 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; X представляет собой атом кислорода или метиленовую группу; и n равен целому числу 1 или 2. Изобретение также относится к фармацевтической композиции, обладающей аффинностью к рецептору витамина D (VDR), содержащей соединение формулы (1); а также относится к промежуточному соединению, представленному формулой (2), в которой R2, X и n являются такими же, как указано выше, R4 представляет собой R1 в формуле (1), метоксиметильную группу, метоксиэтоксиметильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу или бензилоксиметильную группу; и R5 представляет собой защитную группу для гидроксильной группы, выбранную из группы, включающей метоксиметильную группу, ацильную группу с 1-3 атомами углерода (указанное число атомов углерода включает углерод карбонила), триметилсилильную группу, триэтилсилильную группу, трет-бутилдиметилсилильную группу и трет-бутилдифенилсилильную группу. 5 н. и 7 з.п. ф-лы, 4 табл., 14 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к производному витамина D3 или его медицински приемлемому сольвату, которые применимы в качестве лекарственного средства, к терапевтическому средству с использованием их, к фармацевтической композиции, включающей их, и к промежуточному соединению для их получения. Конкретнее, настоящее изобретение относится к производному 23-ин-витамина D3 или его медицински приемлемому сольвату, к фармацевтической композиции, включающей их, к включающему их в качестве активного ингредиента терапевтическому средству против остеопороза, злокачественной опухоли, псориаза, гиперпаратиреоза, воспалительного заболевания дыхательных путей, ревматоидного артрита, сахарного диабета, гипертензии, алопеции, акне или дерматита, и к промежуточному соединению для их получения.
Уровень техники
Активированные производные витамина D3 регулируют ремоделирование костной ткани, состоящее из образования костной ткани и резорбции костной ткани, и показывают эффект повышения плотности костной ткани. Таким образом, они используются как ценные терапевтические средства в случае остеопороза. Однако такие активные производные витамина D3, например, 1α,25-дигидроксивитамин D3, не всегда показывают удовлетворительное повышение плотности минерального костного вещества. Когда дозу повышают для того, чтобы повысить плотность минерального костного вещества, происходит повышение уровня кальция в сыворотке, а не дополнительное повышение плотности минерального костного вещества, что вызывает повышение сывороточного показателя кальция в на 1 мг/л или более - величину, рассматриваемую как один из критериев, клинически нежелательных. Так, иногда имеют место случаи, когда достаточного эффекта повышения плотности минерального костного вещества не получают (международная публикация №WO 01/62723). Поэтому весьма желательно производное витамина D3, которое проявляет сильное действие повышения плотности минерального костного вещества без возрастания показателя кальция в сыворотке. До сих пор синтезировано множество производных витамина D3 в попытке получить такое производное, но пока еще не найдено какое-либо производное, которое имеет удовлетворительный профиль.
Раскрытие изобретения
Целью настоящего изобретения является новое производное витамина D3 или его медицински приемлемый сольват, проявляющие желательное фармакологическое действие, отделенное от эффекта возрастания содержания кальция в крови.
Кроме того, целью настоящего изобретения является терапевтическое средство против остеопороза, злокачественной опухоли, псориаза, гиперпаратиреоза, воспалительного заболевания дыхательных путей, ревматоидного артрита, сахарного диабета, гипертензии, алопеции, акне или дерматита, включающее в качестве активного ингредиента производное витамина D3 или его медицински приемлемый сольват.
Кроме того, целью настоящего изобретения является фармацевтическая композиция, включающая производное витамина D3 или его медицински приемлемый сольват.
И также целью настоящего изобретения является промежуточное соединение производного витамина D3, подходящее для получения производного витамина D3 или его медицински приемлемого сольвата.
Авторы настоящего изобретения провели кропотливое исследование для того, чтобы решить вышеуказанные проблемы, и в результате осуществили описанное далее изобретение.
Иными словами, настоящее изобретение относится к производному витамина D3, представленному приведенной далее формулой (1), или его медицински приемлемому сольвату.
где
R1 представляет собой атом водорода, алкильную группу с 1-6 атомами углерода, алкилкарбонилоксиалкильную группу, причем каждый алкил имеет 1-6 атомов углерода, или арилкарбонилоксиалкильную группу, причем арил имеет 6-10 атомов углерода и алкил имеет 1-6 атомов углерода; R2 представляет собой атом водорода или алкильную группу с 1-6 атомами углерода или вместе с другим R2 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; R3 представляет собой алкильную группу с 1-6 атомами углерода или вместе с другим R3 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; Х представляет собой атом кислорода или метиленовую группу; и n равен целому числу 1 или 2.
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей производное витамина D3, представленное приведенной выше формулой (1), или его медицински приемлемый сольват и фармацевтически приемлемый носитель.
Кроме того, настоящее изобретение относится к терапевтическому средству против одного или нескольких заболеваний, выбранных из группы, включающей остеопороз, злокачественную опухоль, псориаз, гиперпаратиреоз, воспалительное заболевание дыхательных путей, ревматоидный артрит, сахарный диабет, гипертензию, алопецию, акне или дерматит, включающему в качестве активного ингредиента производное витамина D3, представленное приведенной выше формулой (1), или его медицински приемлемый сольват.
И, кроме того, настоящее изобретение относится к промежуточному соединению для производного витамина D3, представленному формулой (2)
,
где
R2, X и n являются такими же, как в приведенной выше формуле (1); R4 представляет собой R1 в приведенной выше формуле (1), метоксим стильную группу, метоксиэтоксиметильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу или бензилоксиметильную группу; и R5 представляет собой защитную группу для гидроксильной группы.
Согласно настоящему изобретению, предлагается новое производное витамина D3 или его медицински приемлемый сольват, которые эффективны для лечения различных заболеваний, представленных остеопорозом, злокачественной опухолью, псориазом, гиперпаратиреозом, воспалительным заболеванием дыхательных путей, ревматоидным артритом, сахарным диабетом, гипертензией, алопецией, акне, дерматитом и т.п. Кроме того, получаемое промежуточное соединение, представленное приведенной выше формулой (2), применимо для получения производного витамина D3 и т.п. по настоящему изобретению.
Осуществление изобретения
Термины, используемые в настоящем изобретении, определяются так, как описано далее.
«Алкильная группа» обозначает линейную, разветвленную или циклическую алифатическую углеводородную группу. Алкильная группа с 1-6 атомами углерода конкретно включает, например, метильную группу, этильную группу, изобутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу, гексильную группу, циклопропильную группу, циклопропилметильную группу и циклогексильную группу.
«Алкилкарбонилоксиалкильная группа» конкретно включает трет-бутилкарбонилоксиметильную группу.
«Арилкарбонилоксиалкильная группа» конкретно включает фенилкарбонилоксиметильную группу.
В приведенной выше формуле (1) R1 представляет собой атом водорода, алкильную группу с 1-6 атомами углерода, алкилкарбонилоксиалкильную группу, причем каждый алкил имеет 1-6 атомов углерода, или арилкарбонилоксиалкильную группу, причем арил имеет 6-10 атомов углерода и алкил имеет 1-6 атомов углерода. Из них предпочтительными являются атом водорода, метильная группа, этильная группа, пропильная группа, изопропильная группа или трет-бутильная группа; и особенно предпочтительны атом водорода или изопропильная группа. Как алкилкарбонилоксиалкильная группа предпочтительной является трет-бутилкарбонилоксиметильная группа. Кроме того, предпочтительной в качестве арилкарбонилоксиалкильной группы является фенилкарбонилоксиалкильная группа.
В приведенной выше формуле (1) R2 представляет собой атом водорода или алкильную группу с 1-6 атомами углерода или вместе с другим R2 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода. Из них R2 предпочтительно представляет собой атом водорода или метильную группу; или, когда R2 вместе с другим R; и атомом углерода, с которым они связаны, образует циклоалкильную группу, предпочтительной является циклопропильная группа.
В приведенной выше формуле (1) R3 представляет собой алкильную группу с 1-6 атомами углерода или вместе с другим R3 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу. В качестве алкильной группы с 1-6 атомами углерода предпочтительными являются метальная группа и этильная группа. Кроме того, когда R3 вместе с другим R3 и атомом углерода, с которым они связаны, образует циклоалкильную группу, предпочтительной является циклопентильная группа.
Кроме того, в приведенной выше формуле (1) Х представляет собой атом кислорода или метиленовую группу.
Кроме того, в приведенной выше формуле (1) n равен целому числу 1 или 2, где особенно предпочтительно, n равен 1.
В качестве предпочтительного конкретного примера производного витамина D3 по настоящему изобретению, представленного формулой (1), можно упомянуть соединения, указанные в следующей далее таблице.
| Таблица 1 | |||||
| Соединение № | R1 | R2 | R3 | Х | n |
| C-1 | Атом водорода | Атом водорода | Метальная группа | Атом кислорода | 1 |
| С-2 | Метальная группа | Атом водорода | Метальная группа | Атом кислорода | 1 |
| С-3 | Этильная группа | Атом водорода | Метальная группа | Атом кислорода | 1 |
| С-4 | Пропильная группа | Атом водорода | Метальная группа | Атом кислорода | 1 |
| С-5 | Изопропильная группа | Атом водорода | Метальная группа | Атом кислорода | 1 |
| С-6 | трет-Бутильная | Атом водорода | Метальная | Атом кислорода | 1 |
| группа | группа | ||||
| C-7 | трет-Бутилкарбонил-оксим стильная группа | Атом водорода | Метильная группа | Атом кислорода | 1 |
| С-8 | Фенилкарбонил-оксиметильная группа | Атом водорода | Метильная группа | Атом кислорода | 1 |
| D-1 | Атом водорода | Атом водорода | Метильная группа | Метиленовая группа | 1 |
| D-2 | Метильная группа | Атом водорода | Метильная группа | Метиленовая группа | 1 |
| D-3 | Этильная группа | Атом водорода | Метильная группа | Метиленовая группа | 1 |
| D-4 | Пропильная группа | Атом водорода | Метильная группа | Метиленовая группа | 1 |
| D-5 | Изопропильная группа | Атом водорода | Метильная группа | Метиленовая группа | 1 |
| D-6 | трет-Бутильная группа | Атом водорода | Метильная группа | Метиленовая группа | 1 |
| Е-1 | Атом водорода | Циклопропил | Метильная группа | Атом кислорода | 1 |
| Е-2 | Метильная группа | Метильная группа | Метильная группа | Атом кислорода | 1 |
| F-1 | Атом водорода | Атом водорода | Этильная группа | Атом кислорода | 1 |
| F-2 | Атом водорода | Атом водорода | Циклопентил | Атом кислорода | 1 |
При необходимости производное витамина Ds по настоящему изобретению можно превратить в медицински приемлемый сольват. Такой растворитель включает воду, метанол, этанол, 1-пропанол, 2-пропанол, бутанол, трет-бутанол, ацетонитрил, ацетон, метилэтилкетон, хлороформ, этилацетат, диэтиловый эфир, трет-бутилметиловый эфир, бензол, толуол, ДМФА, ДМСО и подобные растворители. В особенности как предпочтительные растворители можно упомянуть воду, метанол, этанол, 1-пропанол, 2-пропанол, ацетонитрил, ацетон, метилэтилкетон и этилацетат.
Кроме того, R5 в приведенной выше формуле (2) представляет собой защитную группу для гидроксильной группы. Защитная группа для гидроксильной группы включает метоксиметильную группу, ацильную группу с 1-3 атомами углерода (указанное число атомов углерода включает углерод карбонила), триметилсилильную группу, триэтилсилильную группу, трет-бутилдиметилсилильную группу, трет-бутилдифенилсилильную группу- и подобные группы. Из них как предпочтительные примеры можно назвать триэтилсилильную группу и трет-бутилдиметилсилильную группу.
Кроме того, R4 в приведенной выше формуле (2) представляет собой R1 в приведенной выше формуле (1) или представляет собой метоксиметильную группу, метоксиэтоксиметильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу или бензилоксиметильную группу. Из них предпочтительными являются метильная группа, этильная группа, пропильная группа, изопропильная группа; или трет-бутильная группа, трет-бутилкарбонилоксиметильная группа, фенилкарбонилоксиалкильная группа или бензилоксиметильная группа.
Кроме того, в приведенной выше формуле (2) n равен целому числу 1 или 2, при этом особенно предпочтительный n равен 1.
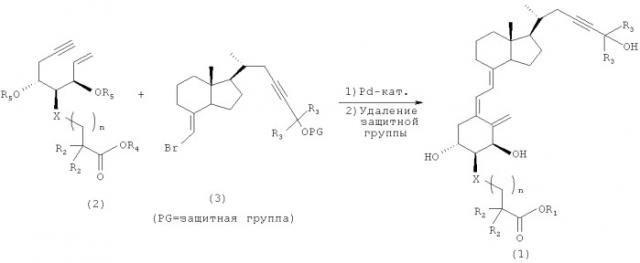
Синтез производного витамина D3, представленного приведенной выше формулой (1), можно выполнить любым способом, но можно осуществить, например, так, как описано на следующей далее схеме 1. Иными словами, после того, как соединение (2) и соединение (3) подвергают реакции сочетания, группу, защищающую гидроксильную группу, удаляют, и при необходимости сложноэфирную группу гидролизуют, и получают целевой материал (1).
Схема 1
В формулах на приведенной выше схеме реакции R1-R5 в соединении (1) и соединении (2) являются такими же, как в приведенных выше формулах (1) и (2). Кроме того, в формулах на приведенной выше схеме реакции R3 в соединении (3) являются такими же, как в приведенной выше формуле (1). Кроме того, OPG в соединении (3) представляет собой защищенную гидроксильную группу. Конкретно защитная группа включает триметилсилильную группу, триэтилсилильную группу и метоксиметильную группу.
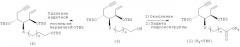
Когда на приведенной выше схеме 1 R2 представляет собой атом водорода, соединение (2) можно синтезировать из ен-инового соединения (4) согласно следующей далее схеме 2, причем ен-иновое соединение (4) описано, например, в литературе (Takayama et al., «Vitamin D Analog in Cancer Prevention and Therapy», Recent Results in Cancer Research, Vol.164, Springer, pp.289-317, 2003; и т.п.). Иными словами, путем селективного удаления защитной группы (трет-бутилдиметилсилильной группы - группы TBS) из первичной гидроксильной группы (4) получают соединение (5). Затем гидроксильную группу (5) окисляют до карбоксильной группы, которую впоследствии этерифицируют, и получают нужное соединение (2) (R2=TBS).
Схема 2
Между тем, когда на приведенной выше схеме 1 R3 представляет собой метальную группу, соединение (3) можно синтезировать так, как описано на следующей далее схеме 3.
Иными словами, соединение (3) можно получить бромметилированием соединения (6), причем последнее соединение описано в литературе (например, в патенте США №4804502).
Схема 3
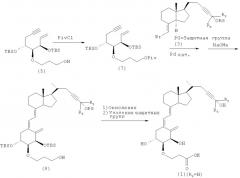
Кроме того, из производных витамина D3, представленных приведенной выше формулой (1), соединение, в котором R2 представляет собой атом водорода, кроме как по описанной выше схеме 1, также можно синтезировать согласно способу, показанному на приведенной далее схеме 4. Иными словами, в соединение (5) на схеме 2 вводят защитную пивалоильную группу, и получают соединение (7), которое подвергают сочетанию с соединением (3) на схеме 1, и удаляют группу, защищающую гидроксильную группу на конце заместителя, присоединенного в положении 2 цикла А, и получают соединение (8).
Гидроксильную группу полученного соединения окисляют до карбоновой кислоты, и наконец, все группы, защищающие гидроксильные группы, удаляют и получают соединение (1) (R2=Н).
Схема 4
Кроме того, когда на приведенной выше схеме 1 R2 является замещенным, например, когда R2 в соединении (2) образует циклоалкильную группу вместе с другим R2 и атомом углерода, с которым они связаны, соединение (10) получают эпоксидированием коммерческого 4,6-O-бензилиден-α-O-метилглюкопиранозида (9), который используют в качестве исходного материала, и затем осуществляют раскрытие цикла эпоксида в щелочной среде таким же способом, как ен-инового соединения (4), описанного в литературе (Takayama et al., «Vitamin D Analog in Cancer Prevention and Therapy», Recent Results in Cancer Research, Vol. 164, Springer, pp.289-317, 2003; и т.п.). После получения соединения (11) путем защиты гидроксильных групп соединения (10), осуществляют раскрытие бензилиденового цикла и далее восстановление 1-положения глюкозы, и получают соединение (12). Затем получают эпоксид из диольной части, и получают соединение (13), после чего следует взаимодействие эпоксида с ацетиленом с образованием соединения (14), имеющего введенную тройную связь. Защищая подходящим образом гидроксильные группы, можно получить соединение (15). Путем сочетания соединения (15) и цикла CD промежуточного соединения (3), описанного на схеме 1, и селективного удаления защитной группы получают соединение (16). Далее, путем окисления первичной гидроксильной группы до карбоксильной и последующего удаления защитных групп из гидроксильных групп можно получить нужное соединение (1).
Схема 5
Терапевтическое средство против остеопороза и т.п., включающее в качестве активного ингредиента производное витамина D3 или его медицински приемлемый сольват по настоящему изобретению, получают с использованием носителя, наполнителя и других добавок, обычно используемых в композициях лекарственных средств. Носитель и наполнитель для лекарственного препарата могут быть твердыми или жидкими и включают, например, лактозу, стеарат магния, крахмал, тальк, желатин, агар, аравийскую камедь, оливковое масло, сезамовое масло, масло какао, этиленгликоль и т.п.; и другие обычно используемые материалы. Тип введения может быть или пероральным введением посредством таблеток, пилюль, капсул, гранул, порошка, жидкостей и т.п.; или парентеральным введением посредством инъекций, таких как внутривенная инъекция, внутримышечная инъекция и т.п., суппозиториев, трансдермальных лекарственных средств и т.п.
В терапевтическом средстве по настоящему изобретению терапевтически эффективное количество активного ингредиента изменяется в зависимости от способа введения, возраста и пола пациента и степени заболевания. Однако оно, как правило, составляет примерно 0,01-10 мкг/сутки, и число введений, как правило, составляет 1-3 раз/сутки или 1-3 раз/неделя. Таким образом, предпочтительно получают композицию, удовлетворяющую таким условиям.
Примеры
Далее настоящее изобретение будет описываться подробнее с обращением к примерам. Однако следует иметь в виду, что не предполагается ограничение ими настоящего изобретения. Кроме того, в настоящем изобретении используются следующие аббревиатуры:
TBS = трет-бутилдиметилсилильная группа;
TES = триэтилсилильная группа;
TESCl = хлортриэтилсилан;
TMS = триметилсилильная группа;
TMSCl = хлортриметилсилан;
Piv = пивалоильная группа;
PivCl = пивалоилхлорид;
TBAF = фторид тетрабутиламмония;
CSA = (+/-)-камфор-10-сульфоновая кислота;
PDC = дихромат пиридиния;
TBSOTf = трет-бутилдиметилсилилтрифторметансульфонат;
DIBAL = гидрид дибутилалюминия;
ДМФА = N,N-диметилформамид;
ТГФ = тетрагидрофуран;
TsCl = п-толуолсульфонилхлорид; и
Ts = п-толуолсульфонил.
Пример 1
Получение (5Z,7Е)-(1R,2S,3R,20R)-2-(2-карбоксиэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение С-1)
(1) Соединение А-1 (2,29 г, 4,11 ммоль), известное из литературы (например, из Kittaka et al., J. Org. Chem., 69, 7463-7471 (2004)), растворяют в этаноле (20 мл), к раствору при охлаждении льдом добавляют (+/-)-камфор-10-сульфоновую кислоту (954 мг, 4,11 ммоль), и смесь перемешивают при 0°C в течение 1 часа. Реакцию обрывают путем добавления насыщенного водного раствора гидрокарбоната натрия, и смесь разбавляют этилацетатом. Смесь промывают водой и насыщенным водным раствором хлорида натрия, и органический слой сушат над сульфатом натрия. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 9/1), и получают соединение А-2 (1,64 г, выход 90%).
1Н-ЯМР (CDCl3) δ: 5,96-5,88 (1Н, м), 5,27-5,21 (2Н, м), 4,29 (1Н, дд, J=6,8, 3,9 Гц), 3,88-3,72 (5Н, м), 3,45 (1Н, дд, J=5,4, 4,1 Гц), 3,00 (1Н, т, J=6,0 Гц), 2,50-2,46 (1Н, м), 2,38-2,33 (1Н, м), 2,01 (1Н, т, J=2,6 Гц), 1,85-1,68 (2Н, м), 0,91 (9Н, с), 0,91 (9Н, с), 0,10 (9Н, с),0,07(3Н, с).
(2) Соединение А-2 (1,0 г, 2,26 ммоль), полученное в (1), растворяют в пиридине (10 мл), и после добавления пивалоилхлорида (0,69 мл, 5,65 ммоль) при 0°C, реакционную смесь перемешивают при комнатной температуре. К смеси добавляют безводный метанол (3 мл), и смесь перемешивают при комнатной температуре еще в течение 30 минут.
Добавляют толуол, и смесь концентрируют при пониженном давлении. К полученному остатку добавляют этилацетат, смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 9/1), и получают соединение А-3 (1,072 г, выход 90%).
1Н-ЯМР (CDCl) δ: 5,95 (1Н, ддд, J=17,0, 11,0, 6,0 Гц), 5,21 (1Н, ддд, J=17, 2,0,1,0 Гц), 5,14 (1Н, ддд, J=11,0, 2,0, 1,0 Гц), 4,32-4,28 (1Н, м), 4,18-4,10 (2Н, м), 3,86 (1Н, к, J=5,6 Гц), 3,81-3,74 (1Н, м), 3,68-3,60 (1Н, м), 3,39 (1Н, дд, J=5,4, 3,4 Гц), 2,49 (1Н, дк, J=17,0, 2,7 Гц), 2,35 (1Н, дк, J=16,9, 2,8 Гц), 1,96 (1Н, т, J=2,7 Гц), 1,87 (2Н, дт, J=14,0, 7,0 Гц), 1,19 (9Н, с), 0,90 (9Н, с), 0,89 (9Н, с), 0,10 (3Н, с), 0,08 (3Н, с), 0,07 (5Н, с), 0,03 (3Н, с).
(3) Бромид (брометил)трифенилфосфония (1,25 г, 2,87 ммоль) растворяют в тетрагидрофуране (7 мл), и раствор охлаждают до 0°C в атмосфере азота. К раствору добавляют бис(триметилсилил)амид натрия (1,0 М раствор в тетрагидрофуране, 2,90 мл, 2,87 ммоль), и смесь перемешивают при охлаждении льдом в течение 30 минут. Реакционную смесь охлаждают до -78°C, и к ней добавляют раствор соединения В-1 (200 мг, 0,574 ммоль), растворенное в тетрагидрофуране (1,5 мл), причем указанное соединение известно из литературы (например, из Uskokovic et al., патент США №4804502). После перемешивания при -78°C в течение 1 часа смесь еще в течение 1 часа перемешивают при 0°C. К реакционной смеси добавляют силикагель (2,5 г), и после энергичного перемешивания при комнатной температуре в течение 10 минут смесь фильтруют через целит. Полученный фильтрат концентрируют при пониженном давлении, остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 9/1), и получают соединение В-2 (161 мг, выход 67%).
1Н-ЯМР (CDCl3) δ: 5,65 (1Н, с), 2,90-2,86 (1Н, м), 2,28-1,24 (20Н, м), 1,08 (3Н, д, J=6,3 Гц), 0,58 (3Н, с), 0,18 (9Н, с).
(4) Соединение В-2 (1,2 г, 2,82 ммоль), полученное в (3), растворяют в тетрагидрофуране (10 мл), к раствору добавляют фторид тетрабутиламмония (1 М раствор в тетрагидрофуране, 4,23 мл, 4,23 ммоль), и смесь перемешивают при 50°c в течение 30 минут. Добавляют этилацетат, смесь промывают водой, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, и полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 19/1). Очищенный материал растворяют в безводном пиридине (10 мл), и раствор охлаждают до 0°C в атмосфере азота. К раствору добавляют хлортриэтилсилан (0,944 мл, 5,70 ммоль), и смесь нагревают до комнатной температуры и перемешивают в течение 2,5 часов. Реакционную смесь охлаждают до 0°C, и после добавления насыщенного водного раствора хлорида аммония и воды выполняют экстракцию толуолом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 99/1), и получают соединение В-3 (783 мг, выход 88%).
1Н-ЯМР (CDCl3) δ: 5,65 (1Н, с), 2,92-2,85 (1Н, м), 2,23 (1Н, дд, J=16,5, 3,4 Гц), 2,07-1,24 (19Н, м), 1,08 (3Н, д, J=6,6 Гц), 0,96 (9Н, т, J=7,9 Гц), 0,66 (6Н, к, J=7,9 Гц), 0,57 (3Н, с).
(5) Соединение В-3 (783 мг, 1,67 ммоль), полученное в (4), и соединение А-3 (733 мг, 1,39 ммоль), полученное в (2). растворяют в смеси безводный толуол/триэтиламин (1/1, 11,1 мл), к полученной смеси добавляют тетракис(трифенилфосфин)палладий (289 мг, 0,25 ммоль), и смесь перемешивают в атмосфере азота при 105°C в течение 2 часов. После охлаждения до комнатной температуры к смеси добавляют диамин-силикагель (производство Fuji Silysia Chemical Ltd., 6 г) и н-гексан (20 мл), и смесь перемешивают при комнатной температуре в течение 1 часа. Затем смесь фильтруют с использованием этилацетата, полученный фильтрат концентрируют при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 100/0 → 95/5). Полученный очищенный материал безводном тетрагидрофуране (5,5 мл) и безводном метаноле (4,6 мл), к раствору добавляют раствор метоксида натрия в метаноле (0,91 мл, 5,46 ммоль), и смесь кипятят с обратным холодильником в течение 1 часа. Добавляют насыщенный водный раствор хлорида аммония, и смесь концентрируют при пониженном давлении. К полученному остатку добавляют этилацетат, смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 100/0 → 50/50), и получают соединение АВ-1 (609 мг, выход 67%).
1Н-ЯМР (CDCl3) δ: 6,18 (1Н, д, J=11,2 Гц), 6,02 (1Н, д, J=11,2 Гц), 5,30 (1Н, ушс), 5,00 (1Н, ушс), 4,46 (1Н, ушс), 4,05 (1Н, м), 3,88-3,69 (4Н, м), 3,36 (1Н, ушс), 2,94 (1Н, ушс), 2,83-2,77 (1Н, м), 2,62-2,56 (1Н, м), 2,24 (1Н, дд, J=16,5, 3,4 Гц), 2,10 (1Н, дд, J=13,9, 4,4 Гц), 2,06-1,21 (21Н, м), 1,07 (3Н, д, J=6,6 Гц), 0,96 (9Н, т, J=7,9 Гц), 0,93 (9Н, с), 0,87 (9Н, с), 0,67 (6Н, к, J=7,9 Гц), 0,55 (3Н, с), 0,10 (3Н, с), 0,10 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с).
(6) Соединение АВ-1 (427 мг, 0,514 ммоль), полученное в (5), растворяют в безводном дихлорметане (5,2 мл), и раствор охлаждают до 0°C. Затем добавляют реагент Десса-Мартина (523 мг, 1,23 ммоль), и после перемешивания при охлаждении льдом в течение 2 часов смесь нагревают до комнатной температуры и перемешивают в течение 1 часа. К смеси добавляют насыщенный водный раствор тиосульфата натрия и насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют дихлорметаном. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток растворяют в трет-бутаноле (21 мл), к раствору добавляют тетрагидрофуран (37 мл) и 2-метил-2-бутен (6,47 мл), и смесь охлаждают на льду. Добавляют водный раствор (7,3 мл) гипохлорита натрия (чистота 80%, 580 мг, 5,14 ммоль) и дигидрат дигидрофосфата натрия (400 мг, 2,57 ммоль), и смесь перемешивают при охлаждении льдом в течение 45 минут. К смеси добавляют насыщенный водный раствор тиосульфата натрия и насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Органический слой концентрируют при пониженном давлении, полученный остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 100/0 → 80/20), и получают соединение АВ-2 (341 мг, выход 78%).
1Н-ЯМР (CDCl3) δ: 6,22 (1Н, д, J=11,2 Гц), 6,00 (1Н, д, J=11,2 Гц), 5,27 (1Н, ушс), 4,99 (1Н, ушс), 4,45 (1Н, ушс), 4,07 (1Н, м), 3,91 (2Н, т, J=6,1 Гц), 3,36 (1Н, ушс), 2,84-2,77 (1Н, м), 2,64 (2Н, д, J=6,1, 1,5 Гц), 2,60-2,53 (1Н, м), 2,24 (1Н, дд, J=16,5, 3,4 Гц), 2,13 (1Н, дд, J=13,9, 5,4 Гц), 2,07-1,21 (19Н, м), 1,07 (3Н, д, J=6,3 Гц), 0,96 (9Н, т, J=7,9 Гц), 0,90 (9Н, с), 0,87 (9Н, с), 0,67 (6Н, к, J=7,9 Гц), 0,55 (3Н, с), 0,09 (3Н, с), 0,09 (6Н, с), 0,07 (3Н, с).
(7) Соединение АВ-2 (140 мг, 0,165 ммоль), полученное в (6), растворяют в ацетоне (1,65 мл), и раствор охлаждают до 0°C. Затем добавляют разбавленный раствор (1,65 мл) хлороводородной кислоты (6 N, 0,332 мл) в ацетоне, и смесь перемешивают при комнатной температуре в течение 4 часов. К смеси добавляют н-гексан (3,3 мл), и смесь предварительно очищают хроматографией на силикагеле (н-гексан/ацетон = 1/1) и тонкослойной хроматографией на силикагеле (н-гексан/ацетон = 4/5) и дополнительно очищают ВЭЖХ с обращенной фазой (А = 0,1% муравьиной кислоты/1% метанола/4% ацетонитрила/вода; В = 0,1% муравьиной кислоты/5% воды/19% метанола/ацетонитрил; 0-2 мин: В=20%, 2-20 мин: В=20% → 98%, 20-25 мин: В=98%, 25-30 мин: В=20%), и получают соединение С-1 (34,9 мг, выход 42%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11,2 Гц), 6,00 (1Н, д, J=11,2 Гц), 5,39 (1Н, д, J=1,9 Гц), 5,09 (1Н, д, J=1,9 Гц), 4,50 (1Н, д, J=2,9 Гц), 4,36-3,58 (6Н, м), 3,35 (1Н, дд, J=8,1, 3,2 Гц), 2,86-2,79 (1Н, м), 2,72-2,57 (3Н, м), 2,29-2,19 (2Н, м), 2,04-1,20 (19Н, м), 1,06 (3Н, д, J=6,6 Гц),0,54(3Н, с).
Пример 2
Получение (5Z,7E)-(1R,2S,3R,20R)-2-(2-метоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение С-2)
(1) Соединение А-2 (1,45 г, 3,27 ммоль), полученное в примере 1 (1), растворяют в безводном диметилформамиде (15 мл), к раствору добавляют дихромат пиридиния (6,17 г, 16,4 ммоль), и смесь перемешивают в течение 12 часов. Добавляют воду, смесь экстрагируют этилацетатом, и полученный органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (20% этилацетата/н-гексан), и получают соединение А-4 (0,82 г, выход 55%).
1Н-ЯМР (CDCl3) δ: 5,90 (1Н, ддд, J=17,0, 6,0, 11,0 Гц), 5,30-5,20 (2Н, м), 4,33 (1Н, ддт, J=7,0, 3,0, 1,0 Гц). 3,96 (2Н, тд, J=6,0, 1,2 Гц), 3,85-3,75 (1Н, м), 3,55 (1Н, дд, J=6,3, 3,7 Гц), 2,63 (2Н, тд, J=5,9, 1,9 Гц), 2,50-2,32 (2Н, м), 2,02 (1Н, т, J=2,7 Гц), 0,91 (9Н, с), 0,90 (9Н, с), 0,11 (3Н, с), 0,10 (3Н, с), 0,09 (3Н, с), 0,08 (3Н, с).
(2) Соединение А-4 (0,82 г, 1,79 ммоль), полученное в (1), растворяют в безводном метаноле (8 мл), к раствору добавляют концентрированную серную кислоту (74 мкл, 1,5 ммоль), и смесь перемешивают в течение 2,5 часов. После охлаждения до комнатной температуры к смеси добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Полученный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток растворяют в безводном дихлорметане, к раствору при охлаждении льдом добавляют 2,6-лутидин (1,01 мл, 9 ммоль) и трет-бутилдиметилсилилтрифторметансульфонат (1,65 мл, 7,2 ммоль), и затем смесь перемешивают при комнатной температуре в течение 1 часа. Добавляют безводный метанол (1,5 мл), и смесь перемешивают при комнатной температуре еще в течение 10 минут. К смеси добавляют смесь н-гексан/этилацетат (9/1), смесь промывают водой, и полученный органический слой сушат над безводным сульфатом натрия. Органический слой концентрируют при пониженном давлении, остаток очищают колоночной хроматографией на силикагеле (3% этилацетата/н-гексан), и получают соединение А-5 (683,4 мг, выход 81%).
1Н-ЯМР (CDCl3) δ: 5,94 (1Н, ддд, J=10,0, 17,2, 6,5 Гц), 5,21 (1Н, дт, J=17,3, 1,3 Гц), 5,14 (1Н, дт, J=10,0, 1,3 Гц), 4,30 (1Н, дд, J=6,8, 3,4 Гц), 4,00-3,97 (1Н, м), 3,88-3,82 (2Н, м), 3,68 (3Н, с), 3,40 (1Н, дд, J=5,5, 3,5 Гц), 2,57 (2Н, т, J=6,6 Гц), 2,48 (1Н, дк, J=16,8, 2,7 Гц), 2,35 (1Н, дк, J=17,0, 2,8 Гц), 1,96 (1Н, т, J=2,6 Гц), 0,90 (9Н, с), 0,89 (9Н, с), 0,09 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с), 0,03 (3Н, с).
(3) Соединение А-5 (47.0 мг, 0,1 ммоль), полученное в (2), и соединение В-2 (46,2 мг, 0,11 ммоль), полученное в примере 1 (3), растворяют в смеси толуол/триэтиламин (1/1, 2 мл), добавляют тетракис(трифенилфосфин)палладий (12,5 мг, 0,0108 ммоль), и смесь перемешивают в атмосфере азота при 110°C в течение 3 часов. Смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток предварительно очищают тонкослойной хроматографией на силикагеле (н-гексан/этилацетат = 19/1). Полученный предварительно очищенный материал растворяют в смеси безводный дихлорметан/ацетонитрил (1/1, 1 мл), к смеси при 0°C в атмосфере азота добавляют тетрафторборат лития (78 мг, 0,8 ммоль) и серную кислоту (1 М раствор в ацетонитриле, 0,08 мл, 0,08 ммоль), и смесь перемешивают в течение 30 минут. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Полученный органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Органический слой концентрируют при пониженном давлении, полученный остаток предварительно очищают тонкослойной хроматографией на силикагеле (н-гексан/этилацетат = 1/2) и дополнительно очищают ВЭЖХ с обращенной фазой (А = 95% воды/ацетонитрил; В = 0,5% воды/40% метанола/ацетонитрил; В = 75%),и получают соединение С-2 (6,8 мг, 13%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11,2 Гц), 6,03 (1Н, д, J=11,2 Гц), 5,40 (1Н, д, J=1,2 Гц), 5,09 (1Н, д, J=2,2 Гц), 4,45 (1Н, т, J=3,3 Гц), 4,06-3,79 (3Н, м), 3,73 (3Н, с), 3,36 (1Н, дд, J=7,7, 3,3 Гц), 2,85-2,60 (7Н, м), 2,24 (2Н, дт, J=18,8, 5,9 Гц), 2,02-1,96 (3Н, м), 1,89-1,82 (2Н, м), 1,72-1,54 (6Н, м), 1,51 (6Н, s), 1,47-1,24 (4H, м), 1,06 (3Н, д, J=6,3 Гц), 0,54 (3Н, с).
МС m/z 537,2 (М+23)+523.3 (М+18)+.
Пример 3 Получение (5Z,7Е)-(1R,2S,3R,20R)-2-(2-пропоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение С-4)
(1) С использованием в качестве исходного материала соединения А-4 (240 мг, 0,525 ммоль), полученного в примере 2 (1), и заменяя метанол пропанолом, осуществляют синтез так же, как в примере 2 (2), и получают соединение А-6 (18,5 мг, выход 27%).
(2) С использованием в качестве исходных материалов соединения А-6 (40,5 мг, 0,081 ммоль), полученного в (1), и соединения В-2 (47 мг, 0,11 ммоль), полученного в примере 1 (3), осуществляют синтез так же, как в примере 2 (3), и получают соединение С-4 (6,8 мг, выход 15%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11,2 Гц), 6,03 (1Н, д, J=11,2 Гц), 5,39 (1Н, д, J=1,2 Гц), 5,09 (1Н, д, J=2,2 Гц), 4,45 (1Н, т, J=3,5 Гц), 4,08 (2Н, т, J=6,7 Гц), 4,06-3,95 (2Н, м), 3,85-3,77 (1Н, м), 3,36 (1Н, дд, J=7,8, 3,2 Гц), 2,85-2,82 (1Н, м), 2,79 (1Н, д, J=4,1 Гц), 2,70-2,62 (4Н, м), 2,26-2,22 (2Н, м), 2,03-1,98 (3Н, м), 1,90-1,80 (3Н, м), 1,70-1,64 (7Н, м), 1,58-1,53 (4Н, м), 1,51 (6Н, с),1,48-1,45 (2Н, м), 1,40-1,20 (4Н, м), 1,06 (3Н, д, J=6,6 Гц), 0,94 (4Н, т, J=7,4 Hz), 0,54 (3Н, с).
(1) С использованием в качестве исходного материала соединения А-4 (240 мг, 0,525 ммоль), полученного в примере 2 (1), и заменяя метанол изопропанолом, осуществляют синтез так же, как в примере 2 (2), и получают соединение А-7 (157,4 мг, выход 60%).
(2) С использованием в качестве исходных материалов соединения А-7 (35 мг, 0,07 ммоль), полученного в (1), и соединения В-2 (44 мг, 0,11 ммоль), полученного в примере 1 (3), осуществляют синтез так же, как в примере 2 (3), и получают соединение С-5 (6,8 мг, выход 17%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11,0 Гц), 6,03 (1Н, д, J=11,5 Гц), 5,39 (1Н, д, J=1,5 Гц), 5,09-5,02 (2Н, м), 4,45 (1Н, т, J=3,5 Гц), 4,05-3,78 (3Н, м), 3,35 (1Н, дд, J=7,7, 3,3 Гц), 2,85-2,58 (6Н, м), 2,28-1,53 (18Н, м), 1,51 (6Н, с), 1,46-1,30 (5Н, м), 1,26 (3Н, д, J=1,7 Гц), 1,24 (3Н, д, J=1,5 Гц), 1,06 (3Н, д, J=6,3 Гц), 0,54 (3Н, с).
Пример 5
Получение (5Z,7Е)-(1R,2S,3R,20R)-2-(2-карбоксипропил)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение D-1)
(1) Соединение А-8 (0,72 г, 1,69 ммоль), полученное таким же способом, как в примере 1 (1) из (3R,4R,5S)-3,5-бис[(трет-бутилдиметилсилил)окси]-4-[3-{(трет-бутилдиметилсилил)окси}пропил]окт-1-ен-7-ина - соединения, известного из литературы (например, из Saito, et al., Tetrahedron, 60, 7951-7961 (2004)), растворяют в дихлорметане (6,8 мл). К раствору при 0°C добавляют триэтиламин (0,47 мл, 3,37 ммоль), гидрохлорид триметиламина (16 мг, 0,169 ммоль) и п-толуолсульфонилхлорид (0,48 г, 2,53 ммоль), и смесь перемешивают при комнатной температуре в течение 1 часа. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия, смесь экстрагируют этилацетатом, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, и полученный остаток растворяют в диметилформамиде (3 мл). К раствору добавляют цианид натрия (199 мг, 4,06 ммоль) и иодид натрия (380 мг, 2,53 ммоль), и смесь перемешивают при 50°C в течение 2 часов. Добавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, концентрируют при пониженном давлении, и получают сырое соединение А-9. Его растворяют в тетрагидрофуране (5 мл), к раствору добавляют фторид тетрабутиламмония (1 М раствор в тетрагидрофуране, 5,07 мл, 5,07 ммоль), и смесь перемешивают при 60°C в течение 1 часа. Добавляют этилацетат, смесь промывают водой, и органический слой сушат над безводным сульфатом м